Nano-sized PtRu-Ni/VC and PtRu-Sn/VC electrocatalysts were synthesized by a one-step radiation-induced reduction (RIR) (30 kGy) process using distilled water as the solvent and Vulcan XC-72 as the supporting material. The obtained electrocatalysts were characterized by transmission electron microscopy (TEM), scanning electron microscope energy dispersive spectroscopic (SEM-EDS), X-ray diffraction (XRD) and X-ray photoelectron spectroscopy (XPS), respectively. The catalytic efficiency of electrocatalysts was examined for oxygen reduction, MeOH oxidation and CO stripping decreased in the following order, Hydrogen stripping : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK). MeOH oxidation : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/ VC® (E-TEK). Unit cell performance : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK) catalysts.
방사선환원법을 통해 탄소지지체(Vulcan XC-72®)를 기반으로 한 나노사이즈의 PtRu-Ni/VC와 PtRu-Sn/VC를 합성하였다. 합성된 촉매는 투과전자현미경(transmission electron microscopy, TEM), 주사전자현미경-에너지 분산형 분석기(scanning electron microscopy-energy dispersive spectroscopy, SEM-EDS), X선 광전자 분광기(X-ray photoelectron spectroscopy, XPS), X선 회절(X-ray diffraction, XRD)을 통해 촉매의 표면과 구조 및 성분에 대해 특성평가 되어졌으며, 촉매 전기화학적 효율 및 안정성 대한 평가를 위하여 산소 환원 반응, 메탄올 산화반응과 CO 흡착 효율을 E-TEK사에서 상용촉매로 판매되는 PtRu/VC® (60 wt% PtRu)와 비교하였으며, 이에 대한 요약은 다음과 같다. 수소 흡?탈착 반응 : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK). 메탄올산화반응 : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK). 단위셀 효율 : PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK).
연료전지는 산화?환원반응을 통하여 연료의 화학에너지를 전기에너지로 변환시켜 직류 전류를 생산하는 전지이며, 연료를 전기로 직접 변환시키기 때문에 에너지 변환 효율이 높다. 또한, 내부에 저장되어 있는 물질이 반응하여 에너지를 공급하는 종래의 전지와는 다르게 외부에서 연료가 공급되는 한 반영구적으로 전기를 생산할 수 있는 에너지변환 시스템이다. 이러한 연료전지는 SOx, NOx, CO2 등과 같은 대기 오염 물질을 거의 발생시키지 않아 친환경적이며 소음이 적고 이동성이 뛰어나 휴대폰, 노트북과 같은 소형발전부터 차량 가정용 등과 같은 대형발전까지 응용할 수 있는 장점이 있다. 그러나 대부분의 연료전지의 연료로 사용되는 수소는 높은 가격과 수소의 저장 및 운송이 어려워 아직까지는 널리 활용되지 못하고 있다. 따라서 보다 저가이고 저장, 운송이 용이한 탄화수소들(메탄, 프로판, 가솔린, 에탄올 또는 메탄올 등)을 연료로 이용하고자 하는 연구가 활발히 진행 중에 있다[1-4].
직접 메탄올 연료전지(direct methanol fuel cell, DMFC)는 수소를 연료로 사용하는 고분자 전해질형 연료전지(polymer electrolyte membrane fuel cell, PEMFC)와 비슷한 형태를 갖고 있으며, 유사한 구조와 작동원리를 갖고 있다. 그러나 DMFC는 연료로 수소 대신 액체인 메탄올을 직접 산화전극(anode)에 공급하여 사용한다. 위와 같이 DMFC는 PEMFC와는 달리 가습장치와 연료개질장치를 사용하지 않고 액체인 메탄올을 연료로 직접 이용하기 때문에 연료의 취급이 PEMFC에 비해 용이하고, 장치를 단순화 할 수 있다. 이러한 DMFC의 특성은 전지를 소형화 시켜 휴대전화, PMP, 카메라, 군용장비 등과 같은 휴대용 전자기기의 동력원 등에 가장 적합한 연료전지이다[5-7].
그러나 DMFC는 아직까지는 낮은 기술력과 극복해야 될 문제점들이 있기 때문에 상용화를 위해서는 많은 연구가 진행되어야 한다. DMFC의 상용화를 위해 해결해야 될 문제점은 낮은 촉매 활성, 낮은 전극 성능, 높은 메탄올 투과(methanol crossover) 등이 있다. 특히 낮은 연료 극 성능은 메탄올 산화반응의 복잡한 경로와 CO와 같은 반응 중간 생성물이 연료극에 사용되는 백금 표면에 흡착하여 촉매활성을 감소시키고 전자의 이동을 방해함으로 기인된다. DMFC의 촉매로 사용되는 Pt는 낮은 온도에서 알코올의 산화반응에 있어 매우 적합한 물질로 알려져 있으나, 순수한 Pt는 일산화탄소로 인한 피독(CO poisoning)현상으로 인하여 활성이 점차 감소되어 촉매의 수명을 단축시키는 문제점을 가지고 있다. 또한 희귀금속으로 분류되어 있는 Pt는 가격이 비싸다는 문제점을 갖고 있어 이러한 문제점을 극복하기위해 다양한 해결방안이 제시되었다. 그중에 하나는 Pt만을 단일촉매물질로 사용하지 않고 Ru, Sn, Mo, Ni, Pd, Co 등과 같은 조촉매를 사용해 2합금촉매 3합금촉매의 형태로 제조하여 CO에 대한 내구성 향상과 더불어 값비싼 Pt 촉매의 다량 사용으로 인한 고비용 문제를 극복하는 방법이다[8-10].
본 연구에서는 DMFC의 CO에 의한 피독현상과 Pt촉매의 고비용 문제를 극복하기 위하여 Pt와 함께 조촉매로 Ru, Ni, Sn을 사용하여 3합금촉매를(PtRu-Ni, PtRu-Sn) 방사선환원법을 통하여 합성하였고, 합성된 촉매는 투과전자현미경(transmission electron microscopy, TEM), 주사전자현미경-에너지 분산형 분석기(scanning electron microscopy-energy dispersive spectroscopy, SEM-EDS), X선 회절(X-ray diffraction, XRD)을 통해 촉매의 특성 및 성분에 대한 분석을 하였고, 전기화학적 특성을 평가하기 위해 수소 흡?탈착 반응, 메탄올 산화반응, 단위셀 효율 분석 등을 조사하였다[11-13].
실험에 사용된 시약은 Sigma-Aldrich, USA에서 구입한 H2PtCl6xH2O (37.5%Pt), RuCl3xH2O (41.0%Ru), CoCl2xH2O (47.4%Co), SnCl2xH2O (52.0%Sn)와 NiCl2 x6H2O (41.5%Ni)을 사용하였으며 촉매합성 시 추가적인 정제 없이 사용되었다. 탄소지지체로 사용된 Vulcan XC-72®는 CABOT Co., Ltd (USA)에서 구매하여 사용하였다. 합성을 위해 사용된 용매는 aqua-MAXTM-Basic 360 series plus water purification system (YL Instruments Co. Ltd. Korea)로 정제한 증류수를 사용하였으며, 증류수의 최종 저항 값은 18.2 MΩcm-1이다. 합성된 촉매의 전기화학적 특성평가를 위하여 상용촉매인 E-TEK사의 PtRu/VC® (PtRu: 50 wt%), Johnson Matthey사의 HiSPEC 1000 (Pt/VC), Dupont사의 Nafion 117를 구입하여 비교분석을 하였다.
2.2. 방사선환원법을 이용한 PtRu/M-VC 촉매의 합성
먼저, VC (Vulcan XC-72®)를 황산/물(2 : 8 vol %)로 이루어진 혼합 용매를 사용해 결정체를 이루지 못한 탄소 불순물들을 제거하여 준다. 정제된 VC는 촉매를 담지시키기 위한 지지체로 사용하였다. PtRu-Co/VC촉매를 합성하는 방법은 다음과 같다: 증류수(188 mL)와 이소프로필알콜(12 mL)로 이루어진 혼합용매에 지지체로 사용될 VC 1.0 g을 초음파분산기를 통해 15분동안 분산시켜준다. 지지체가 분산된 용매에 H2PtCl6xH2O (0.43 g), RuCl3xH2O (0.41 g), NiCl2x6H2O (0.37 g)을 첨가해 준 후 15분 동안 초음파분산기를 통하여 분산시켜 준다. 지지체와 촉매로 사용될 금속들이 분산되어 있는 용매는 질소 버블링에 의해 탈산소화시키고 1.0 M 수산화나트륨 용액을 이용해 pH 9.0으로 조절해 주었다. 모든 전처리가 완료된 용매는 감마선(gamma-irradiation)을 투과시켜 준다. 감마선의 총 선량은 30 kGy (6.48 × 105/h)이다. 마지막으로, 방사선조사
후 회수된 혼합용매는 감압필터를 사용하여 용매로 사용된 물, 이소프로필알콜 및 불순물을 제거시켜준다. PtRu-Sn/VC 촉매도 위와 같은 방법을 통해 합성하였다.
합성된 촉매의 결정성은 X선 회절(Japanese Rigaku D/maxγA XRD)분석을 통해 확인하였고, 합성된 촉매의 조성과 구조를 분석하기 위해 주사전자현미경-에너지 분산형 분석기(Hitachi S-4800 microscope SEM-EDS) 투과전자현미경(JEOLJEM-2100 microscope TEM)을 통해 수행하였다.
합성된 촉매의 전기화학적 활성인 수소 흡?탈착 반응, 메탄올 산화 반응을 진행하였다. 먼저 합성된 촉매(5.0 mg)과 5% 나피온 용액(0.05 mL)을 24시간 동안 교반시켜준다. 위의 실험을 통해 얻어진 촉매잉크는 유리탄소전극(Glass carbon electrode, GCE)위에 0.02 cm2 두께로 코팅시켜주었다. 코팅된 전극은 질소분위기상태의 진공오븐에서 50 ℃ 온도로 24시간동안 건조시켜 주었다. 수소 흡?탈착 반응과 메탄올 산화반응 평가는 0.5 M의 황산에서 cyclic voltammetry (EG&GInstruments, Potentiostat/Galvanostat model 283, USA)에 의해 평가되었으며, 모든 전기화학적 분석에 이용한 전기화학 셀은 Ag/AgCl을 기준전극 (reference electrode)으로 Pt전극과 촉매를 이용하여 제조한 전극을 각각 상대전극(counter electrode)과 작업전극(working Electrode)을 통한 3원 전극시스템을 사용하였다. 직접메탄올연료전지의 효율측정을 위해서 전해질 전극 접합체(membrane electrode assemblies, MEA)를 제작하여 실험하였다. 전해질 막은 Dupont사의 Nafion 117막을 전처리하여 사용하였다. 음극촉매는 본 연구를 통해 제작된 PtRu-Ni/VC (2.5 mg/cm2), PtRu-Ni/VC (2.5 mg/cm2)를 사용하였고 양극촉매는 Johnson Matthey사의 HiSPEC 1000 Pt/VC (2.5 mg/cm2)을 사용하였다. 양극촉매는 MEA 제작은 전처리된 Nafion 117을 전해질 막으로 사용하였으며, 음극촉매는 방사선환 원법을 통해 제조된 PtRu-M/VC (Ni, Sn), PtRu/VC® (E-TEK)양극촉매는 Johnson Matthey사의 HiSPEC 1000 (Pt/VC)를 사용하였다.
PtRu-M/VC 촉매는 원스텝 방사선환원법에 의해 성공적으로
합성하였다. 방사선환원법에 대한 메카니즘은 많은 논문들에 의해 발표되어졌으며 그 메카니즘은 다음과 같은 식을 통해 정의할 수 있다.
방사선으로 인해 H2O에서 분해된 자유라디칼과 용매화전자는 금속이온을 0가 상태로 만들기 위한 강한 환원제로 사용 되어진다. 이에 대한 식은 식 (2)와 (3)에서 확인할 수 있다.
위의 반응과 유사하게, 다가 이온인 Pt4+, Co2+과 Sn2+은 멀티스텝 반응에 의해 환원된다. 반면에 히드록실 라디칼(OH?)은 높은 산화 능력을 가지고 있기 때문에 금속 원자와 이온은 히드록실 라디칼에 의해 산화 될 수도 있다. 금속이온이 산화되는 현상을 방지하기 위하여 합성용매에 첨가제로써 이소프로필알콜을 첨가해준다. 이에 대한 자세한 반응식은 Eq. (4)와 Eq. (5)를 통해 확인할 수 있다.
Choi et al.[14-17]연구팀들은 다양한 금속과 비닐 단량체들을 방사선환원법을 통하여 탄소지지체 표면에 고정시키는 연구 결과를 발표해왔다. 이러한 결과는 방사선환원법이 본 연구에서 제조된 PtRu-M/VC를 만드는데 있어 적합한 합성법이라는 것을 확인할 수 있었다.
3.2. PtRu-M/VC (M = Ni, Sn) 촉매의 특성 평가
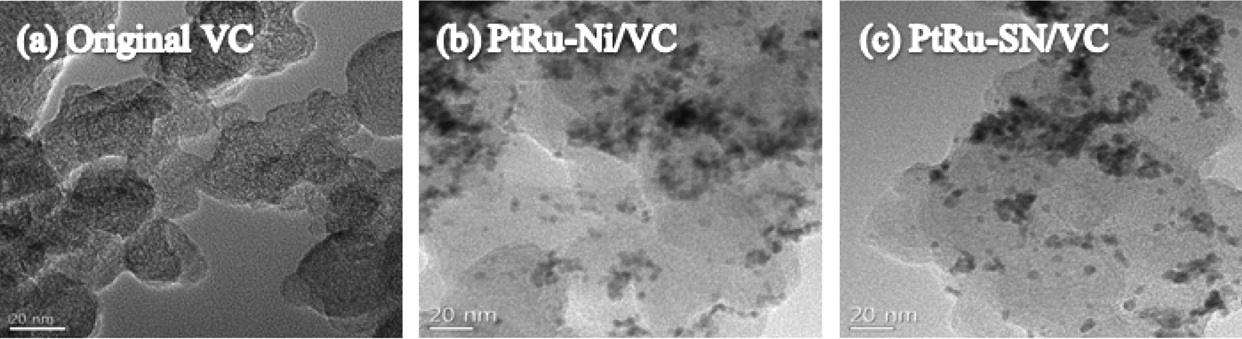
방사선환원법을 통해 3합금형태의 PtRu-M/VC (M = Ni, Sn) 촉매는 다양한 장비를 사용하여 특성평가 되어졌다. Figure 2는 방사선환원법을 통해 제조된 촉매(PtRu-M/VC)의 표면은 HR-TEM을 통해 측정한 결과이다. Figure 2(a)는 정제된 카본지지체의 HR-TEM 이미지이다. 정제된 지지체는 불순물이나 다른 금속이 존재하지 않는 다는 것을 확인하였으며 지지체의 평균크기는 약 45 nm이다. Figure 2(b), (c)는 HR-TEM 이미지로
방사선환원법을 통해 제조된 PtRu-M 삼성분계 금속이 탄소지지체 표면에 7 nm 크기 이하의 나노 입자가 고르게 분산되어 고정되어 있음을 확인할 수 있었으며, 이러한 입자사이즈와 분산도는 직접메탄올연료전지에 사용될 촉매의 역할을 수행하는데 적합하다는 것을 문헌을 통해 확인할 수 있다[18,19].
Figure 3은 방사선환원법을 통해 제조된 촉매(PtRu-M/VC)의 SEM-EDS 측정 결과이다. Figure 3(a), (c)는 제조된 촉매의 SEM이미지로 탄소지지체 표면에 PrRu-M (M = Ni, SN) 나노입자가 고르게 분산되어 있음을 확인할 수 있었으며 입자크기는 약 2.2 nm~7.0 nm의 크기를 갖는다는 것을 확인하였다. 또한, 첨가 비율에 따른 각 촉매의 조성 확인을 위하여 EDS를 측정하였으며, 측정결과는 Figure 3(b), (d)를 통해 확인할 수 있다[20,21].
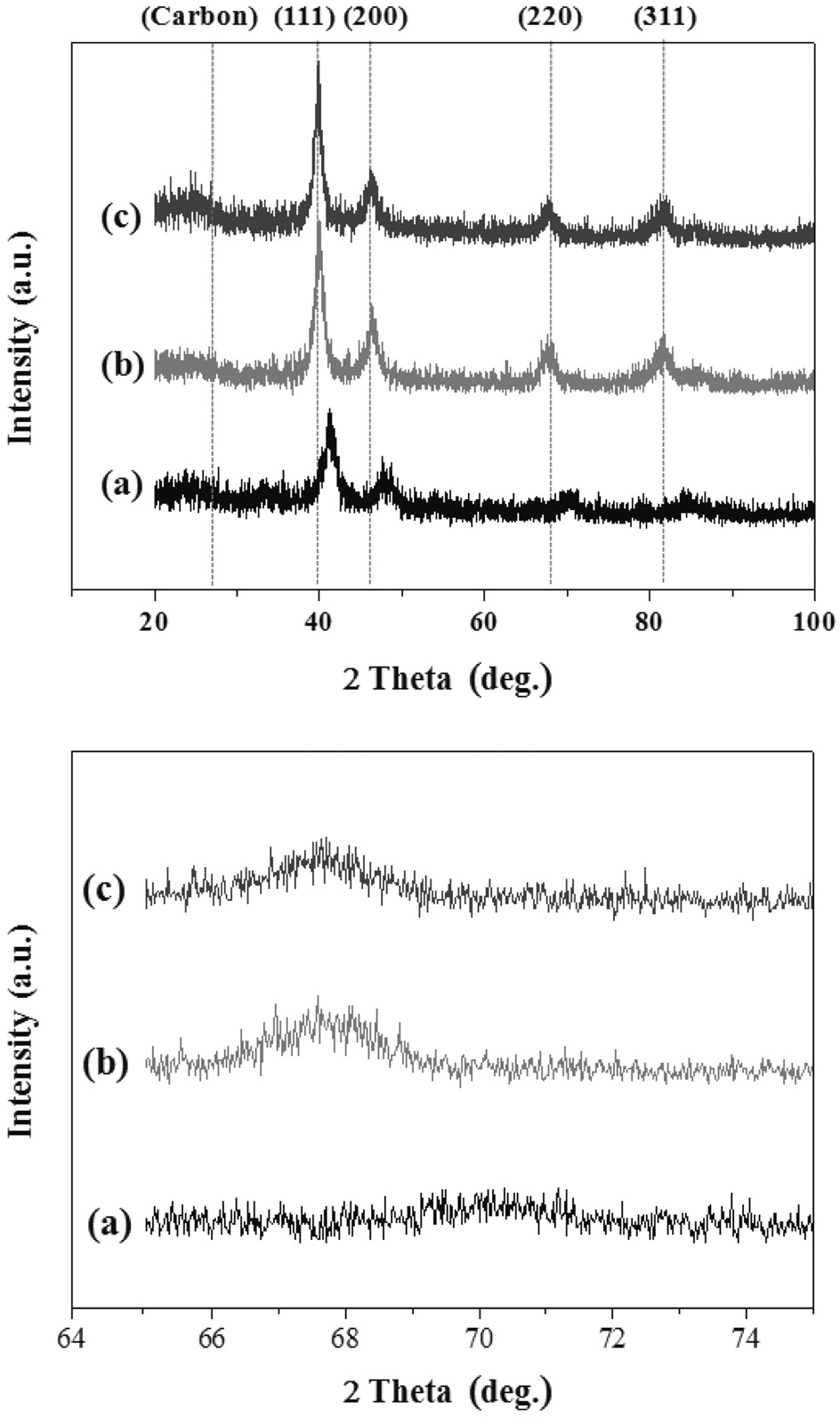
합성된 촉매의 X선 회절(X-ray diffraction, XRD)분석 결과는 Figure 4에 나타내었다. Figure 4(a)~(c)를 보면 260 부근에서 모든 샘플에 동일하게 나타난 피크는 육방정계의 구조를 갖는 Vulcan XC-72® carbon black에 의한 것이며, FCC Pt 금속의 (111), (200), (220)의 특성피크인 400, 460, 680 부근의 피크가 PtRu-M/VC 촉매에서 관찰되었다. 알려진 순수한 Ni 및 Sn의 피크가 나타나지는 않았지만 PtRu와 Ni, Sn의 합금형성으로 인하여 X-ray amorphous 형태가 생성됨에 따라 피크의 위치가 2θ의 낮은 각 쪽으로 조금씩 일정하게 이동되었음을 관찰할 수 있었다.
이는 Figure 4의 Pt (220) 부근의 피크를 확대한 것을 통해 좀 더 정확하게 확인할 수 있는데, 이러한 이동은 fcc 구조의 Pt에 다른 금속 원자들이 포함되는 것이 원인으로 Pt와 Ru, Ni, Sn의 합금 형성이 성공적으로 합성되었음을 확인할 수 있었다[22-24].
3.3. PtRu-M/VC (M = Ni, Sn) 촉매의 전기화학적 특성 평가
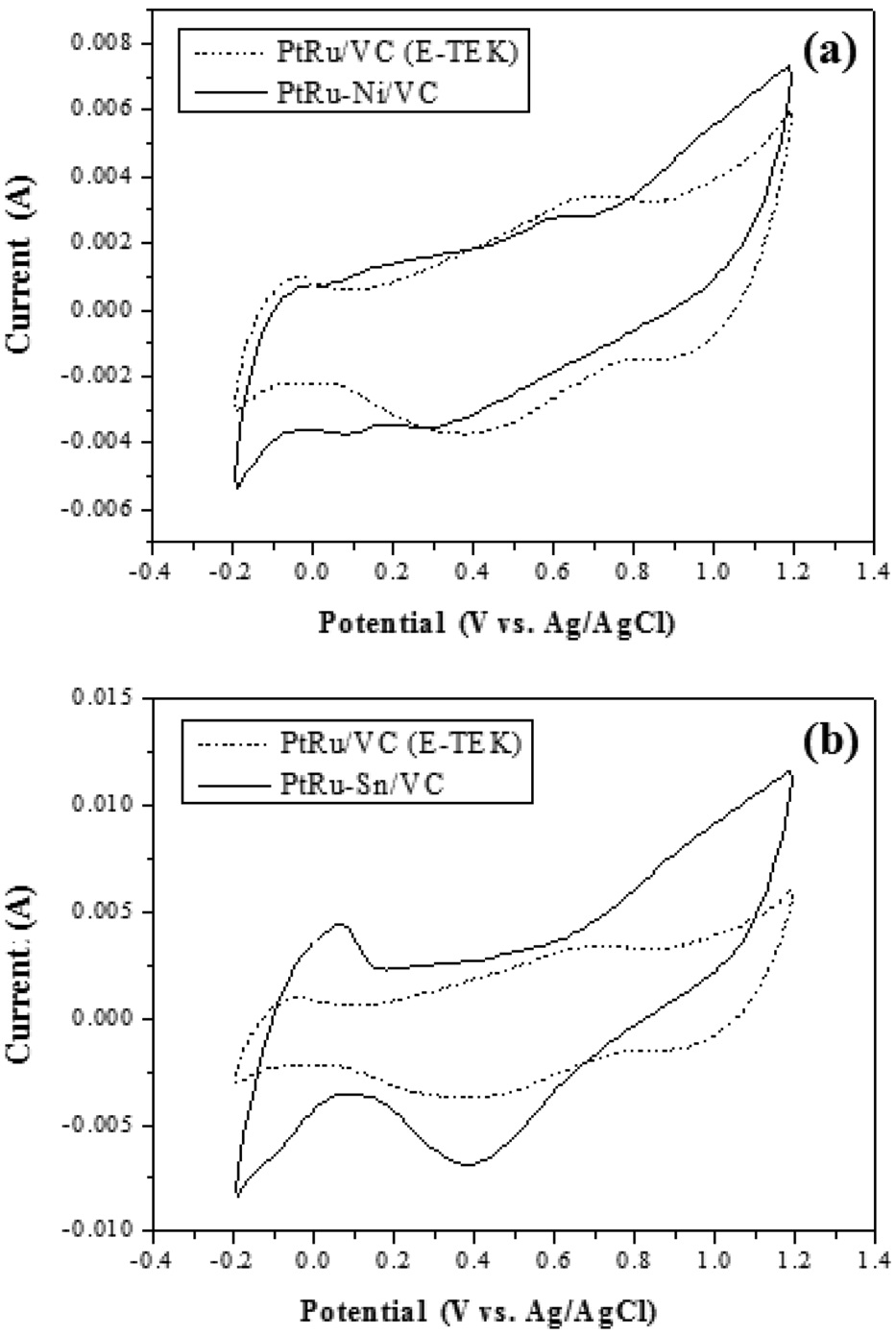
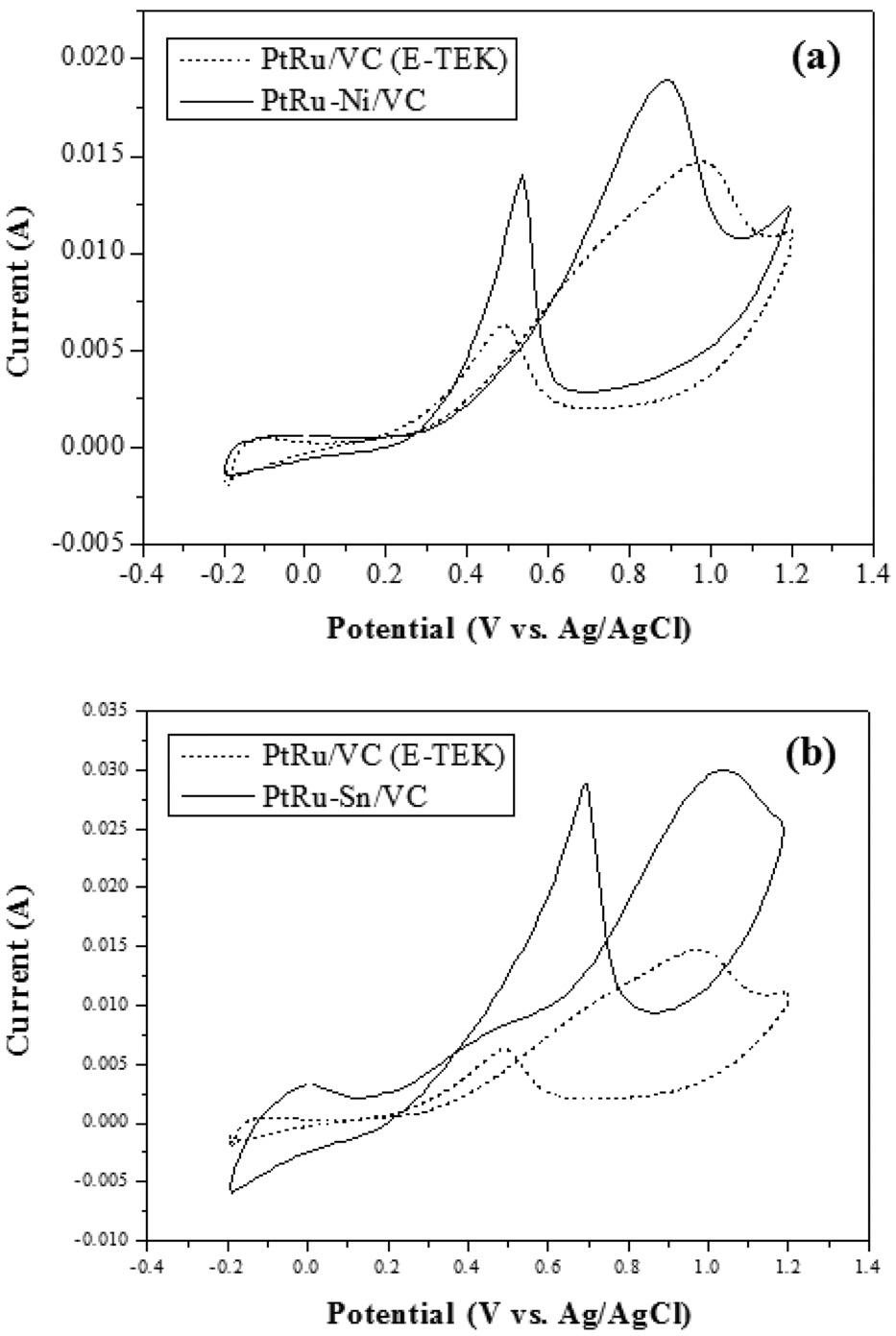
순환전압법(cyclic voltammetry, CV)은 금속과 산소간의 상호작용에 대한 분석뿐만 아니라 전기화학적 안정성을 분석하는데 사용되는 방법이다. 0.5 M H2SO4 용액 내에서 합성된 촉매의 산화환원 반응 특성을 0.1 V/s의 속도로 -0.2~1.2 V (vs. Ag/AgCl)의 범위에서 CV를 이용하여 분석하였다.
Figure 5는 -0.2~1.2 V 범위에서 수소(H+)의 흡착과 탈착에 대한 반응피크를 분석한 결과이다. Figure 5(a)는 상용촉매인 PtRu/VC® (E-TEK)와 방사선환원법을 통해 얻어진 PtRu-Ni/VC를 비교 분석한 것으로 PtRu/VC® (E-TEK)보다 PtRu-Ni/VC가 수소(H+) 흡?탈착 반응성이 더 높다는 것을 확인할 수 있었다. Figure 5(b)는 상용촉매인 PtRu/VC® (E-TEK)와 방사선환원법을 통해 얻어진 PtRu-Sn/VC를 비교 분석한 것으로 Figure 5(a)의 결과와 비슷하게 PtRu/VC® (E-TEK)보다 PtRu-Sn/VC가 수소(H+) 흡?탈착 반응성이 더 높다는 것을 확인할 수 있었다[25-28].
Figure 6은 메탄올 산화환원반응 특성을 조사하기 위해 1.0 M CH3OH + 0.5 M H2SO4의
혼합용액에서 20 mV/s의 속력으로 상용촉매로 사용되는 PtRu/VC® (E-TEK)와 방사선환원법을 통해 합성된 PtRu-Ni/VC, PtRu-Sn/VC를 순환전압전류법(cyclic voltammograms)으로 비교 측정한 결과이다. Figure 6(a)는 상용촉매인 PtRu/VC® (E-TEK)와 PtRu-Ni/VC의 메탄올 산화환원반응 특성을 나타내는 것으로 PtRu/VC® (E-TEK)보다 PtRu-Ni/VC가 높은 반응 특성 결과를 보여주는 것을 확인하였다. Figure 6(b)는 상용촉매인 PtRu/VC® (E-TEK)와 PtRu-Sn/VC의 메탄올 산화환원반응 특성을 나타내는 것으로 PtRu/VC®(E-TEK)보다 PtRu-Sn/VC가 높은 반응 특성 결과를 보여주는 것을 확인하였다. 이러한 결과는 조촉매로 사용된 Ni과 Sn이 적절한 성분비로 첨가시켜줄 경우 메탄올 산화반응의 활성을 증가시키는 역할을 한다는 것으로 해석할 수 있다[12,22,23,26-28].
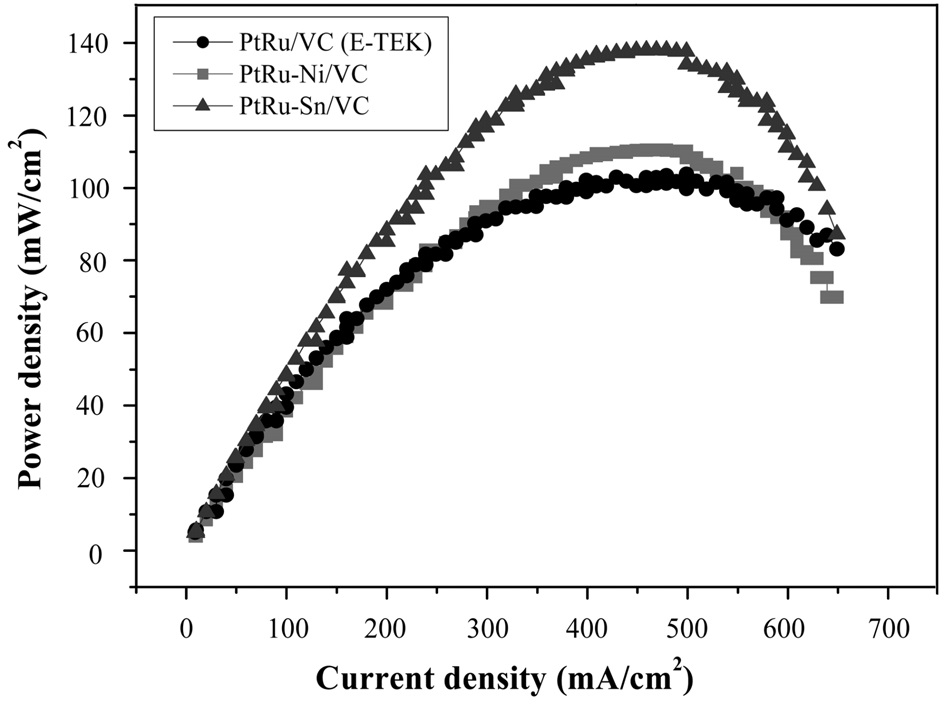
Figure 7은 방사선환원법으로 제조된 촉매를 사용해 전해질 전극 접합체(membrane electrode assemblies, MEA)를 제작하여 단위셀 효율을 분석한 결과이다. 본 연구를 통해 합성된 촉매(PtRu-Ni/VC, PtRu-Sn/VC)를 사용해 제작한 MEA가 각각 138 mW/cm2, 104 mW/cm2로 상용촉매(PtRu/VC® E-TEK)를 사용하여 제작한 MEA (104 mW/cm2)보다 더 높은 단위셀 효율을 나타나는 것을 확인할 수 있었다[29-33].
본 연구에서는 방사선환원법을 이용하여 전처리 탄소지지체에 3합금형태의 PtRu-M/VC (M = Ni, Sn)을 합성하였다. 합성된 촉매는 TEM과 SEM 분석을 통해 금속 나노 입자들이 카본지지체에 고르게 분산되어 고정되었음을 확인하였으며, XPS와 XRD를 통해 촉매의 성분과 구조를 분석하였다.
합성된 촉매는 수소 흡?탈착반응, 메탄올 산화반응, 단위셀효율분석을 통하여 촉매의 전기화학적 활성 특성을 분석하였으며, 모든 특성평가는 상용촉매인 PtRu/VC® (E-TEK)를 사용해 비교분석하였다. 촉매의 전기화학적 활성에 대한 비교분석 결과는 다음과 같이 요약할 수 있다.
PtRu-Sn/VC > PtRu-Ni/VC > PtRu/VC® (E-TEK)
방사선환원법을 통해 제조된 PtRu-Sn/VC촉매가 상용촉매인 PtRu/VC® (E-TEK)보다 약 1.6배 정도의 전기화학적 촉매활성능력을 보여주었으며 이는 조촉매인 Sn을 첨가할 경우, Pt의 구조와 전기적 성질을 변화시키면서 촉매 활성을 증가시키는 결과를 보여주는 것을 확인할 수 있었다.