PVC는 가격이 저렴하면서도 물성과 가공성이 우수하여 건축자재, 생활용품, 산업용품을 포함하는 다양한 분야에서 사용되고 있으며 국내 6대 범용 폐플라스틱 발생량의 약 15% 정도를 차지한다[1]. PVC 포함 가연성 폐기물의 에너지화를 위하여 열분해 하면 다량의 염소(Cl) 화합물이 액상 및 기상 생성물에 섞여 배출된다. 이 생성물들을 염소(Cl) 화합물의 정제없이 액상 또는 기상 연료로 사용하는 경우 설비의 심각한 부식을 일으킨다.
염소(Cl) 성분이 HCl과 같이 무기 염소(Cl)로 존재하는 경우 알칼리 용액 등을 사용하여 제거하는 것이 용이하나 생성물의 탄소결합에 포함된 소위 유기 염소(Cl)인 경우 통상적인 알칼리 용액을 사용한 방법은 효과적이지 못하다.
본 연구에서는 PVC를 포함하는 혼합 폐플라스틱을 열분해 시 Fe 계열 및 Ca 계열 건식 탈염 흡수제를 사용하여 생성물에 포함된 염소(Cl) 화합물을 제거할 때 탈염 흡수제가 생성물의 분포, 액상 생성물의 비점분포, 생성물의 염소농도에 미치는 영향을 조사하였다.
HCl 흡수능력이 뛰어난 Ca 계열 흡수제와 촉매적 특성을 가져 유기염소 화합물의 분해에도 우수한 성능을 가질 것으로 예상되는 Fe 계열 흡수제를 탈염반응 실험에 사용하였다[2,3]. 사용된 흡수제 중 CaO, Ca(OH)2, Fe2O3, Fe3O4는 분말상태로 국내에서 구입하였고 분말상태의 α-FeO(OH), Fe-C와 CaH-C 복합 성형체(
본 연구에서 사용된 탈염 흡수제는 아래와 같은 방법으로 특성이 조사되었다.
2.1.1. X-선 회절분석
사용된 열분해 촉매의 결정구조를 X선 회절기(X-ray diffractometer) (Model X'Pert-MPD, Phillips MPD)를 사용하여 2
2.1.2. SEM 분석
주사전자현미경(scanning electron microscope, Model S-4700, Hitachi)을 사용하여 열분해 촉매의 형상(morphology)을 조사하였다.
2.1.3. 비표면적 측정
상용촉매가 아닌 실험실에서 합성된 흡수제를 사용하는 경우, 사용된 촉매의 표면적과 전체 기공의 부피 및 직경을 측정하기 위하여 BET 시스템(ASAP 2405, Micrometritics)을 사용하였다.
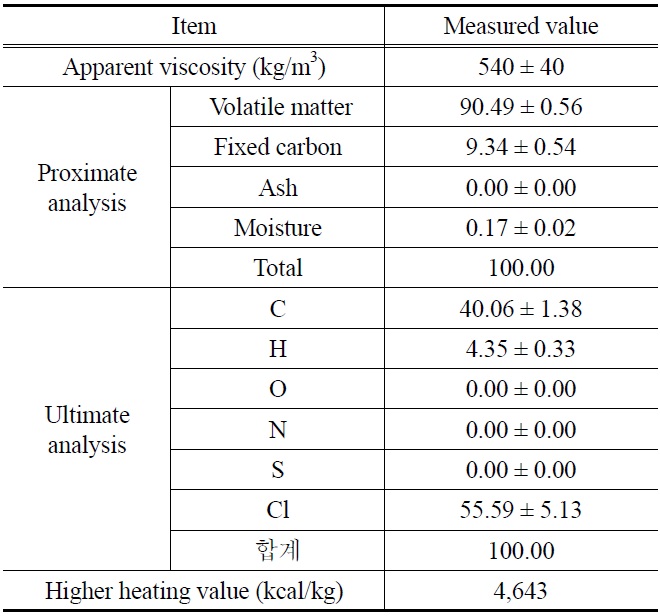
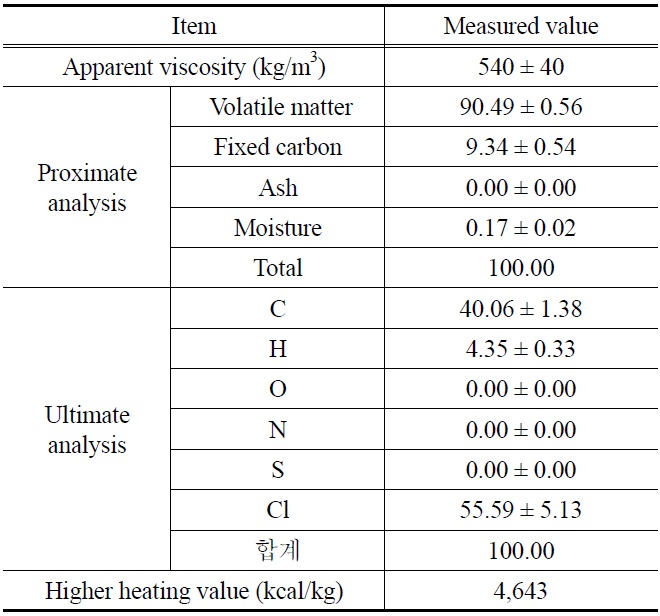
사용된 PVC 수지의 공업분석 및 원소분석 결과가 Table 1에 나타나 있다. PVC 수지의 염소(Cl) 함량은 55.6%이며 발열량은 다른 플라스틱과 비교하여 절반 수준에 지나지 않는데, 그 이유는 PVC의 염소(Cl) 함량이 50% 이상으로 높기 때문이다.
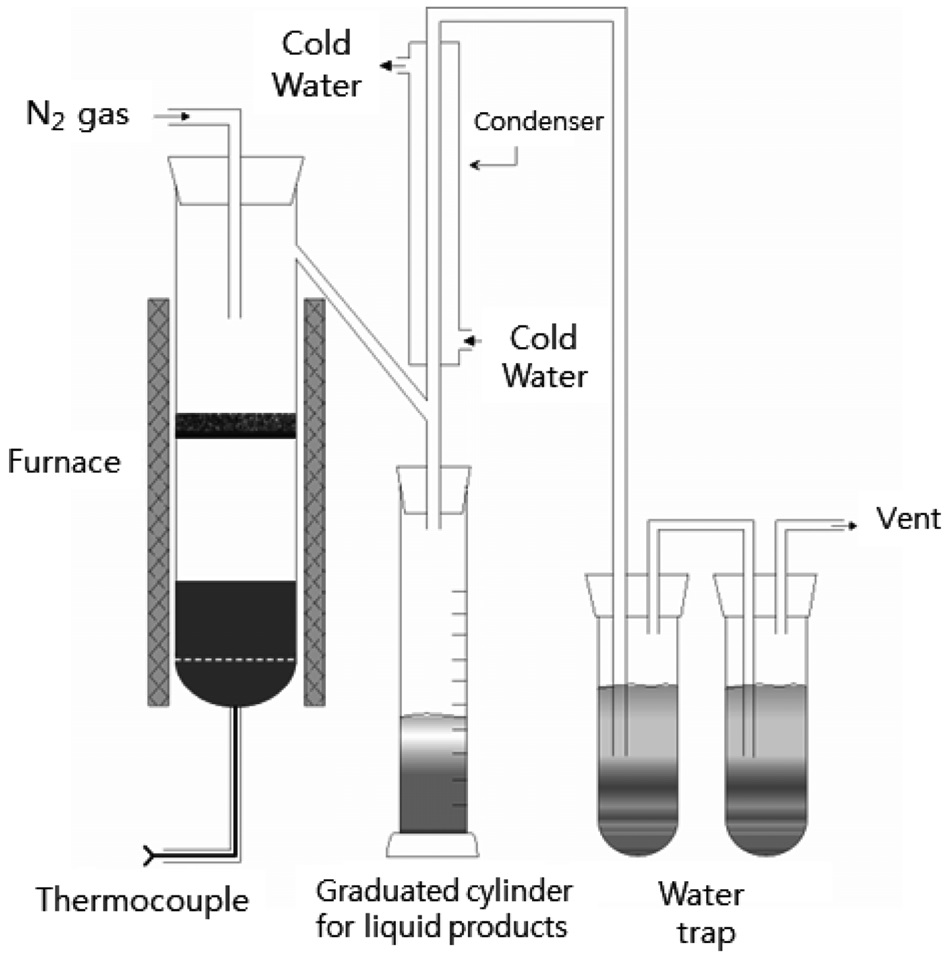
Figure 1은 PVC 열분해 실험을 수행하기 위하여 사용된 반응기를 보여준다. 열분해 반응용기는 파이렉스로 제작되었고 크기는 내경 30 mm × 높이 150 mm이었다. 20 g의 PP/PVC 4:1 혼합물과 2 g의 흡수제를 기상 (G)또는 액상(L)으로 사용하여 열분해 실험을 수행하였다. 흡수제가 액상 흡수제(L)로 사용되는 경우 원료와 같이 혼합되어 반응기에 투입되었고 기상 흡수제(G)로 사용되는 경우 반응기 중간부분에 고정층으로 설치되어 열분해 생성물과 기상에서 접촉하였다. 반응기 내부의 온도는 전기히터와 PID 제어장치(controller)를 사용하여 조절하였다.
열분해 실험시 반응온도 변화의 경로는 A와 B의 2가지를 사용하였다. 온도 변화경로 A에서는 온도가 5 ℃/분으로 상승되어 수분을 제거하기 위하여 120 ℃에서 30분간 유지된 후 다시 온도가 5 ℃/분으로 상승되어 300 ℃에서 60분의 탈염과정을 거친
[Table 1.] Characteristics of PVC resin used
Characteristics of PVC resin used
후 다시 온도가 5 ℃/분으로 상승되어 430 ℃에 도달하여 오일이 더 이상 포집되지 않을 때까지 온도가 일정하게 유지되었다. 온도 변화경로 B에서는 300 ℃에서 60분간의 탈염과정을 거치지 않는 것만 제외하고 온도 변화경로 A와 동일하였다.
열분해 반응이 일어나는 동안 질소가스를 40 cc/분으로 공급하여 발생된 기상 및 액상 생성물이 원활히 이동할 수 있도록 하였다. 비응축성 가스는 대기 중으로 방출시키고 응축되는 오일은 응축기에서 집유하여 일정한 시간 간격으로 무게를 측정하였다. 열분해 실험 종료후 흡수제가 액상(L)으로 사용된 경우 잔류물과 흡수제의 분리가 어려우므로 무게를 같이 측정하였고, 기상(G)으로 사용된 경우는 잔류물과 흡수제의 무게를 별도로
[Table 2.] Condition for SIMDIS Analysis
Condition for SIMDIS Analysis
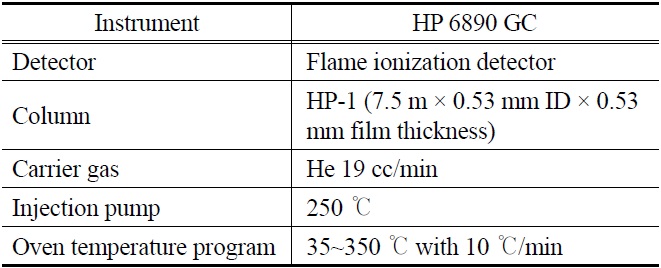
측정하였다. 비응축성 가스의 발생량은 (열분해 원료+흡수제)무게의 합 22.0 g과 (열분해 오일+잔류물+흡수제) 무게의 합의 차이로 계산하였으며 오일의 수율은 최초 원료 열분해 투입량 20 g을 기준으로 계산하였다. 응축된 오일의 비점분포를 SIMDIS (Simulated Distillation: ASTM D2887) 방법으로 분석을 하였으며 SIMDIS 분석조건은 Table 2에 주어져 있다.
생성된 오일, 열분해 잔류물, 흡수제의 염소(Cl) 함량은 Eschka 방법 (ASTM Method D 2361-66)에 의하여 측정하였다. Eschka 방법에서는 1 g의 시료와 3 g의 Eschka 혼합물(MgO : NaCl2 = 2 : 1)을 잘 혼합하여 50 mL의 도가니에 담고 2 g의 Eschka 혼합물로 덮는다. 시료를 담은 도가니는 로에 넣고 1시간 내에 675 ± 25 ℃까지 승온시켜 675 ± 25 ℃에서 2시간 30분 정도 태운다. 이때 시료가 타면서 발생되는 염소(Cl) 성분가스가 Eschka 혼합물에 흡착된다. 흡착실험이 끝난 시료를 100 mL 비이커에 담고 소량의 더운물(10 mL)과 40 mL의 HNO3를 첨가하여 용해시킨다. 용해된 시료는 전위차 적정기(Model 960 pH/Ion Selective Electrode meter, Orion)를 이용하여 AgNO3 용액으로 적정함으로써 시료의 염소(Cl) 함량을 측정하였다.
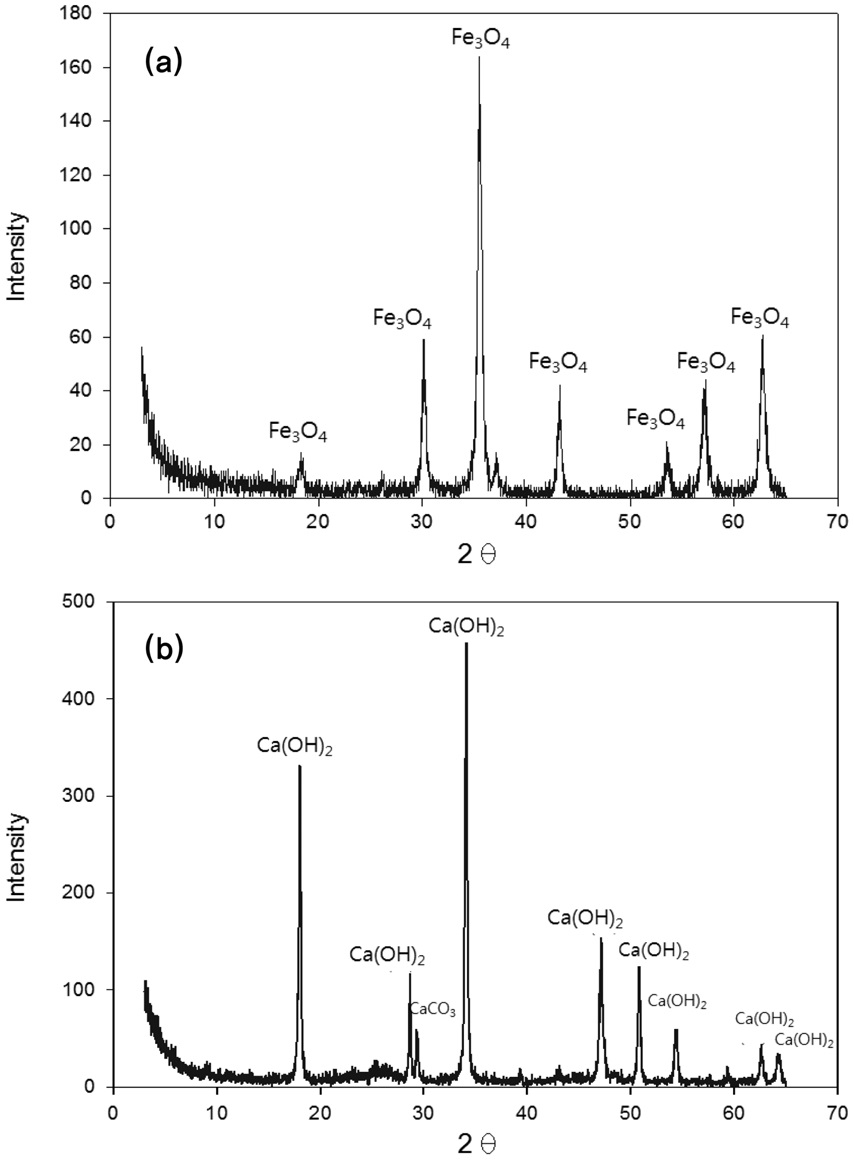
Figure 2는 여러 흡수제의 주사전자현미경(SEM) 사진을 보여준다. Figure 2(a)에서 볼 수 있듯이, α-FeO(OH) 분말은 굵기가 30~60 nm, 길이가 250~320 nm 크기의 긴 누에 모양이었다. 이 α-FeO(OH) 분말과 페놀수지를 사용하여 제조된 Fe-C 복합 성형체는 Figure 3(a)의 X선 회절분석(XRD) 결과에 따르면 α-FeO(OH)가 소성과정에 의하여 Fe3O4로 변화되었음을 나타내지만 Figure 2(d)에서 볼 수 있듯이 α-FeO(OH)의 형상은 그대로 유지하였다. Figure 3(b)에서 볼 수 있듯이 CaH-C 복합 성형체의 Ca 성분은 주로 Ca(OH)2이다.
PVC의 열분해는 2단계의 분해과정을 거치는데 1차로 250 ℃에서 HCl 가스가 배출되고 2차로 400 ℃에서 환화 축중합이 일어나면서 방향족 화합물이 생성된다. PVC를 열분해하면 HCl이 발생되며 극성 분자인 HCl은 다른 플라스틱 열분해시 발생되는 이중결합 화합물을 공격하여 유기염화물을 생성한다[4]. 저온에서는 HCl이 지퍼반응(zipper elimination)에 의한 PVC 탈염반응의 주요 생성물이며, 고온에서의 PVC 탈염반응은
주로 라디칼 반응에 의하여 일어나는 것으로 알려져 있다[5]. 유기염화물의 생성은 HCl과 PE, PP, PS와 같은 다른 플라스틱의 열분해시 얻어진 탄화수소와의 반응에 의하여 생성되는 것이 잘 알려져 있다[5].
3.2.1. 오일 수율
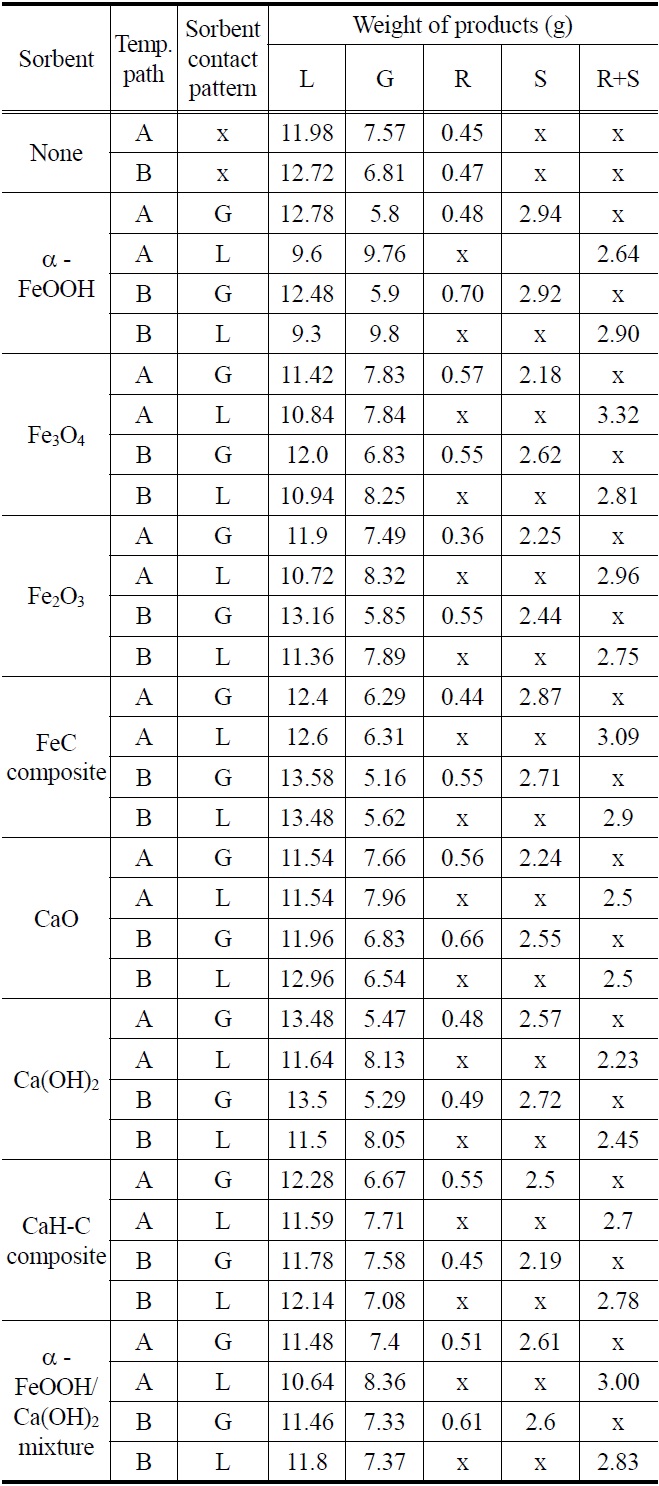
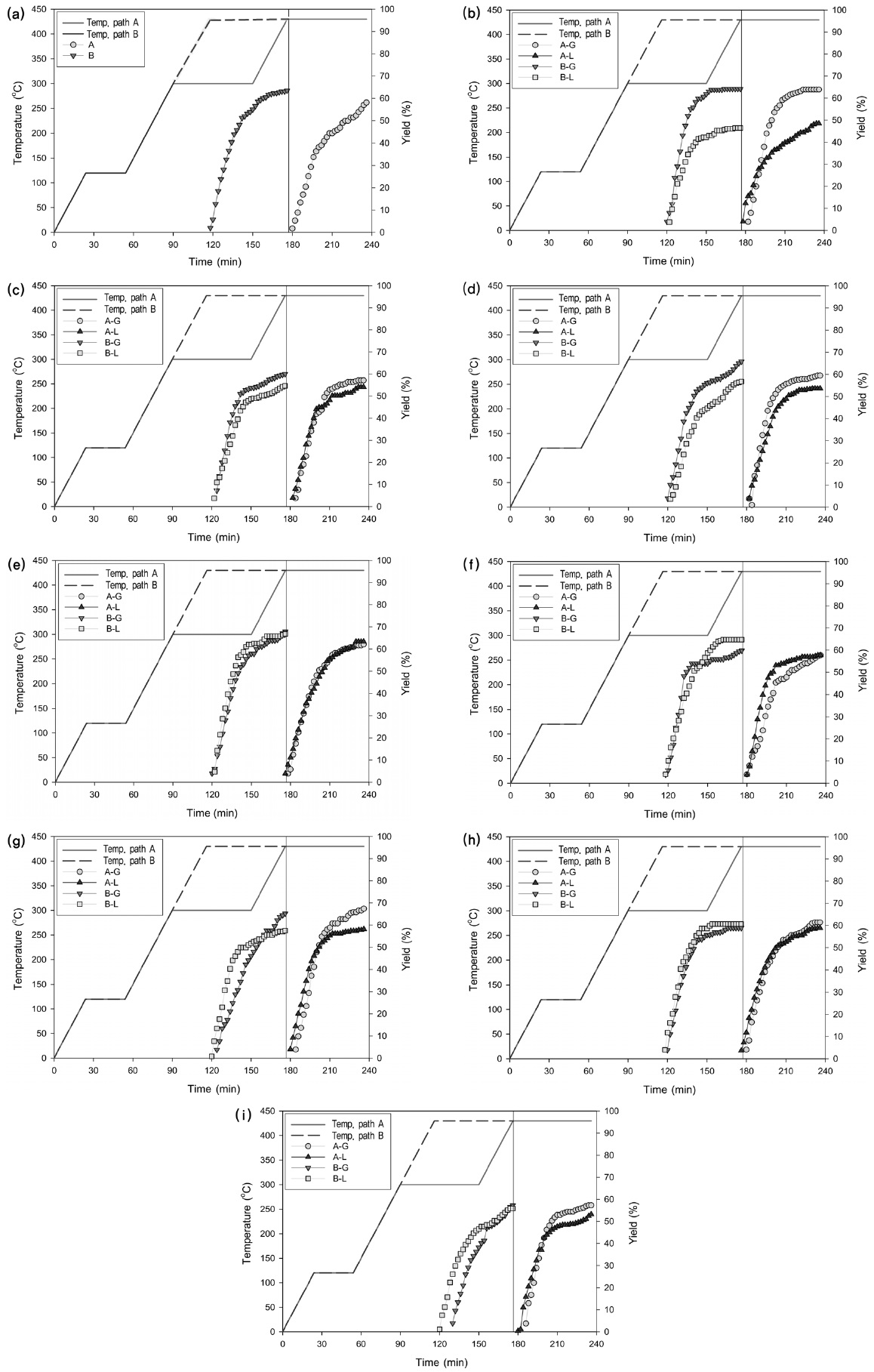
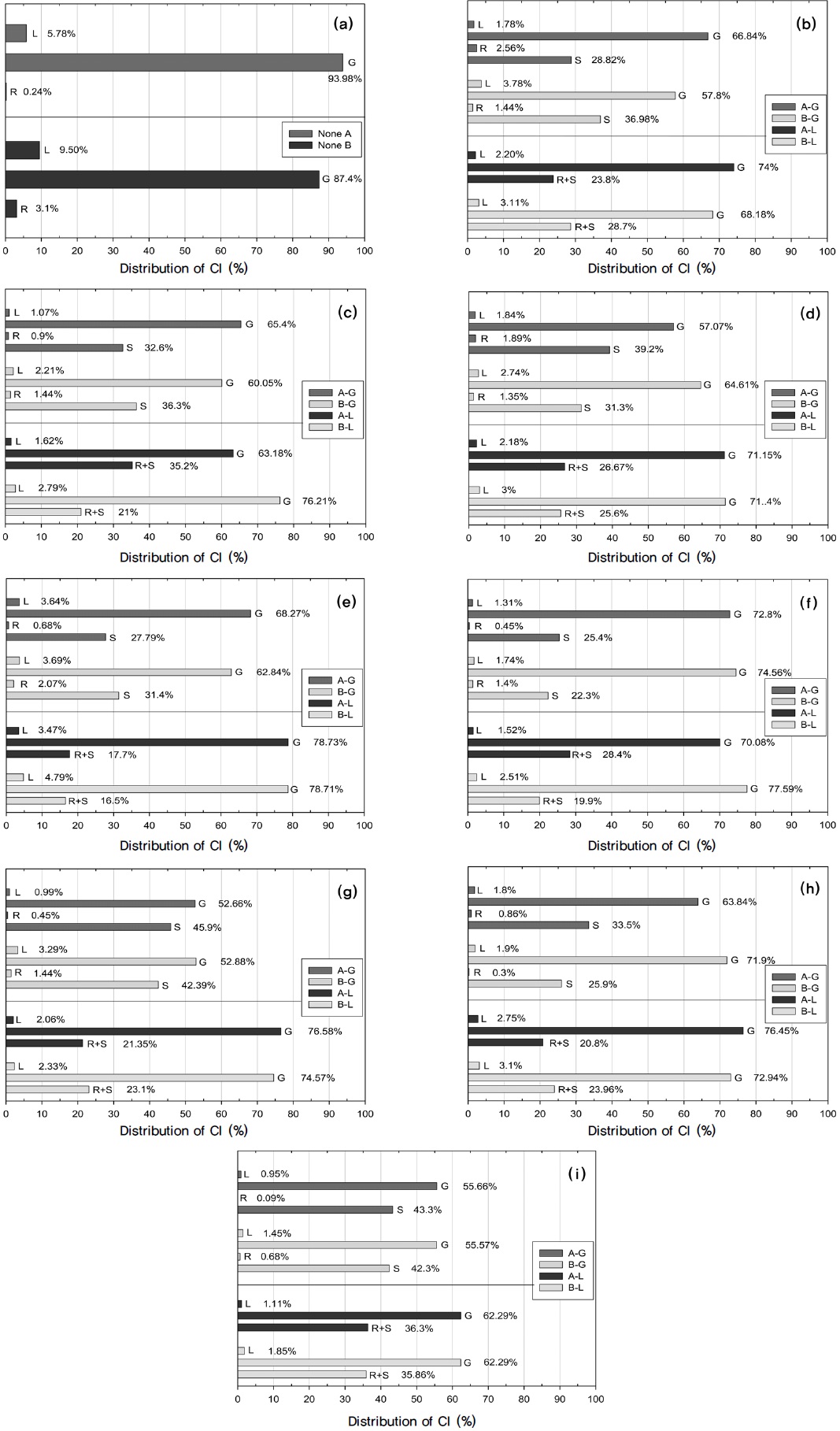
Table 3은 생성물과 잔류물의 무게분포를 보여주며 Figure 4(a)~(i)은 사용된 흡수제의 종류별로 반응시간의 경과에 따른 오일수율의 변화를 보여준다.
Table 3과 Figure 4(a)에서 볼 수 있듯이, 흡수제가 사용되지 않은 경우의 오일수율은 반응온도 변화경로가 A인 경우 59.9%였으며, 반응온도 변화경로가 B인 경우 63.5%로 열분해 반응중 300 ℃에서의 탈염단계를 별도로 거치지 않은 경우의 오일수율이 약간 더 높았다. 이러한 현상은 전반적으로 반응온도 변화경로 A가 반응온도 변화경로 B보다 온도가 300 ℃에 도달하여 60분 동안 일정온도를 유지 후 온도가 다시 증가하여 43 0 ℃에 도달하는데 소요되는 시간만큼 가열시간이 더 길어져 염소(Cl) 성분이 더 많이 분해되는 것은 물론이고 생성물의 일부가 더 많이 분해되어 비응축성 가스의 상태로 배출되었기 때문이다.
Table 3과 Figure 4(b)에서 볼 수 있듯이, α-FeO(OH) 분말을 흡수제로 사용한 경우, 오일수율은 흡수제가 기상(G)에서 사용되었을 때 온도변화 경로에 관계없이 흡수제를 사용하지 않은 경우와 비슷하였으나 흡수제가 액상(L)으로 사용되었을 때 크게 감소하여 온도변화경로가 A인 경우 48.0%, 온도변화 경로가 B인 경우 46.5%에 불과하였다. α-FeO(OH) 분말을 액상에서 흡수제로 사용한 경우 오일수율이 이와 같이 크게 감소한 현상은 α-FeO(OH)가 열분해 반응을 촉진하는 촉매의 역할을 하였음을 의미한다.
Table 3과 Figure 4(c), (d)에서 볼 수 있듯이, Fe3O4와 Fe2O3 분말을 흡수제로 사용한 경우, 오일수율은 흡수제가 기상에서 사용되었을 때 온도변화 경로에 관계없이 흡수제를 사용하지 않은 경우와 비슷하였으나, 흡수제가 액상에서 사용되었을 때 α - FeO(OH) 분말을 사용한 경우에 비하여 그 정도는 덜하였지만 오일수율이 반응경로 A는 5.7~6.3% 감소하고 반응경로 B는 6.7~8.8% 감소하여 Fe3O4와 Fe2O3 분말도 역시 열분해 반응중분해촉매의 역할을 하였음을 나타낸다. Masuda et al.[6]도 Fe2O3와 같은 금속산화물을 PVC 열분해에 사용한 결과 오일생성물의 수율이 감소함을 보고하였다. 그들은 Fe2O3를 사용시 오일의 생성이 감소하는 현상은 Fe2O3 또는 반응중 생성된 FeCl3가 Lewis 산의 역할을 하였을 가능성을 제시하였고, 이외 FeCl3는 양이온 중합(cationic polymerization)에 의한 폴리엔(polyene)사슬의 가교(bridging)현상을 향상시켜 촤(char)의 생성을 증가시키는 것으로 보고하였다[6].
Table 3과 Figure 4(e)에서 볼 수 있듯이, Fe가 Fe3O4의 형태로 존재하는 Fe-C 복합체가 흡수제로 사용되었을 때는 분말상태의 Fe3O4와는 달리 오일수율이 온도변화 경로 및 흡수제 사용방식과 관계없이 증가하였다. Kim et al.[7]과 Jakab and Blazs?[8]의 연구결과에 따르면 이러한 Fe3O4와 Fe-C의 오일수율에 미치는 영향의 차이는 Fe-C에 포함된 C의 촉매적 기능에 의한 것이다.
Distribution of pyrolysis products with sorbent(L: liquidphase, G: gaseous phase, R: residue, S: sorbent)
Kim et al.[7]은 LDPE를 400 ℃에서 열분해할 때 카본블랙을 촉매로 사용시 왁스 수율이 무촉매시의 20%에서 무시할 정도의 적은 양으로 감소한 반면에 오일 수율은 45%에서 74%로 크게 증가하였음을 발견하였다. Jakab과 Blazs?[8]도 카본블랙을 촉매로 사용하여 PP 열분해 실험을 수행한 결과, 카본블랙이 사슬반응의 종료를 촉진하여 단량체(monomer), 이량체(dimer), 삼량체(trimer)의 수율은 감소하였으나 분자 사이의 수소이동반응에
의하여 toluene, ethyl benzene, diphenyl propane, diphenyl propene의 생성은 증가한 현상을 보고하였다.
Table 3과 Figure 4(f)에서 볼 수 있듯이, CaO를 사용하는 경우 온도변화 경로 및 흡수제 사용방식에 관계없이 오일수율의 큰 변화가 발견되지 않았다. 반면에 Table 4와 Figure 4(g)에서 볼 수 있듯이, Ca(OH)2를 기상 흡수제(G)으로 사용시 온도변화 경로에 관계없이 오일수율이 증가하였다. 이러한 현상은 Ca(OH)2가 액상에서의 분해촉매 역할 보다는 열분해에 의하여 생성된 저분자를 기상에서 결합하여 분자량이 큰 다른 생성물로 전환시키는 촉매의 역할을 하였을 가능성을 나타낸다. Yoshioka et al.[9]의 보고에 따르면, PET 열분해 실험시 Ca(OH)2를 촉매로 사용하였을 때 오일수율과 오일의 벤젠(benzene) 함량이 크게 증가하였다.
Table 3과 Figure 4(h)에서 볼 수 있듯이, CaH-C 흡수제는 오일 수율에 미치는 영향이 Fe-C 만큼 크지 않았다. 그 이유는 CaH-C에 포함된 C의 함량은 35%로 Fe-C의 5%에 비하여 지나치게 커서 C 입자가 응집된 상태로 존재하여 열분해 생성물과 C의 접촉이 Fe-C 만큼 효과적이지 못하였기 때문일 수 있다.
Table 3과 Figure 4(i)에서 볼 수 있듯이, α-FeO(OH)/Ca(OH)2 혼합물을 흡수제로 사용한 경우 반응온도 변화경로가 A이고 흡수제가 액상으로 사용되는 경우의 오일수율이 각각 6.7%와 6.2% 감소하였으며 이러한 현상은 혼합물에 포함된 α-FeO(OH)의 분해촉매로서의 역할에 기인한 것으로 보인다.
3.2.2. 생성물 비점분포
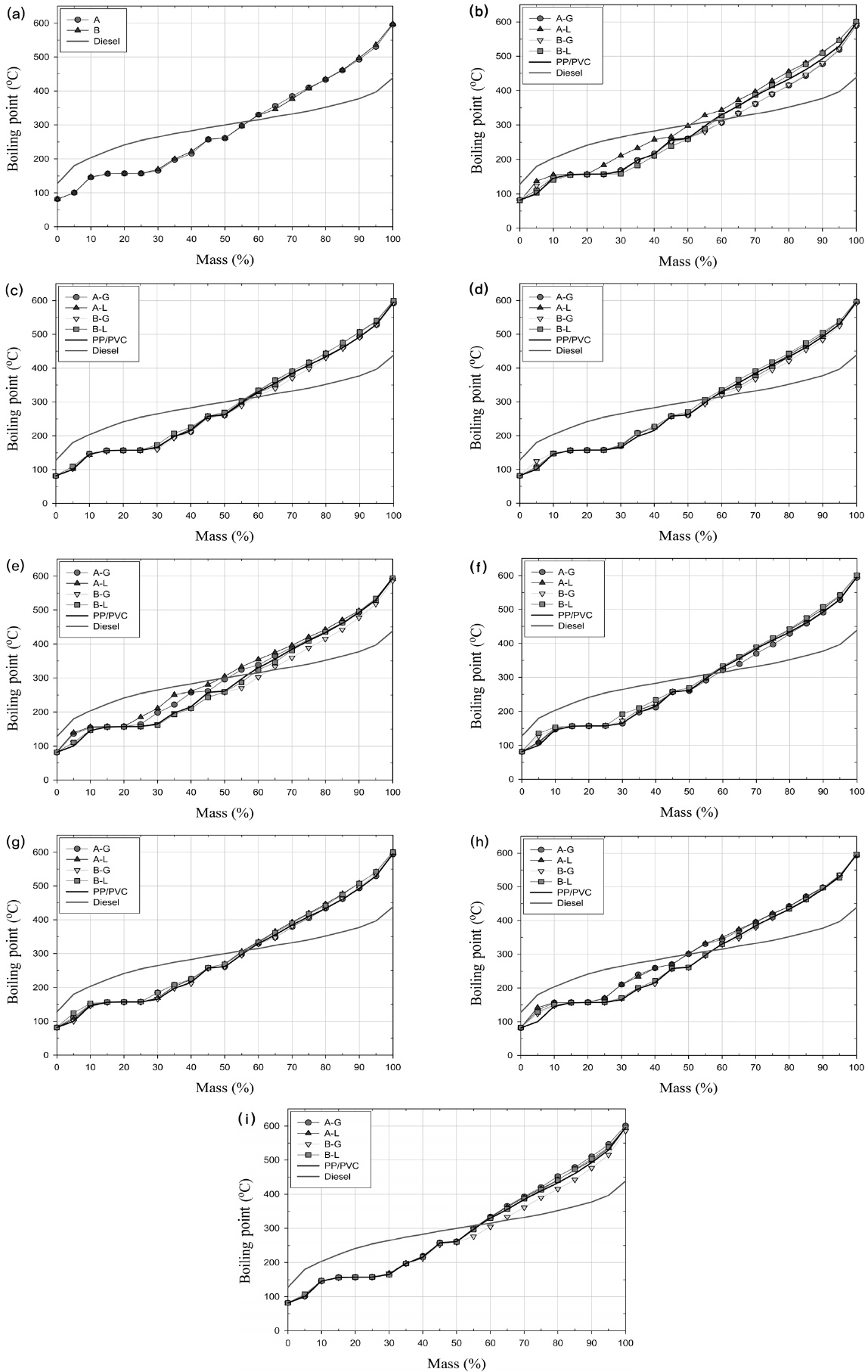
Figure 5(a)~(i)는 수율이 Figure 4(a)~(i)에 해당하는 오일의 비점분포를 보여준다.
Figure 5(a)는 흡수제를 사용하지 않았을 때 생성된 오일의 비점분포를 보여준다. 이 그림에서 볼 수 있듯이, 흡수제를 사용하지 않은 경우 온도의 변화경로에 따라 오일의 수율이 차이가 있어 비점분포에도 차이가 있을 것으로 예상되었으나 온도 변화경로는 비점분포에 거의 영향을 주지 않았다.
Figure 5(b)~(d)는 각각 α-FeO(OH), Fe3O4, Fe2O3를 흡수제로 사용하였을 때 생성된 오일의 비점분포를 보여준다. Figure 4(b)~(d)에서 볼 수 있듯이 α-FeO(OH), Fe3O4, Fe2O3를 액상흡수제로 사용하는 경우 오일수율이 상당히 감소하여 생성된 오일의 비점분포도 감소할 것으로 예상되었으나, 비점분포는 오히려 증가하는 현상이 발견되었다. 이러한 현상은 이들 Fe계열 흡수제의 촉매 반응성이 약하여 저비점 화합물만 분해되어 기상 생성물을 증가시켜 오일수율은 약간 감소하였으나 고비점 화합물은 충분히 분해가 되지 않았기 때문이다.
Figure 4(e)에서 Fe-C 흡수제가 사용된 경우 온도변화 경로 및 흡수제 사용방식에 관계없이 오일수율이 증가하였으며 Figure 5(e)에서 볼 수 있듯이 이 흡수제는 비점분포에도 상당한 영향을 주었다. 반응온도 경로가 A인 경우 흡수제 사용방식에 관계없이 비점이 150~450 ℃ 범위에서 오일의 비점이 증가하였다. Figure 4(e)에서 언급되었듯이, Kim et al.[7]과 Jakab and Blazs?[8]의 연구결과를 참조하면 이러한 현상은 300 ℃에서 이루어지는 탈염과정에서 동시에 발생된 저분자 탄화수소가 Fe-C에 포함된 C의 촉매적 기능에 의하여 고비점 화합물로 재결합하였기 때문이다.
Figure 5(f)와 (g)는 CaO와 Ca(OH)2가 흡수제로 사용된 경우 생성된 오일의 비점분포를 보여준다. 이 두 그림에서 볼 수 있듯이, CaO와 Ca(OH)2가가 흡수제로 사용된 경우는 흡수제가 사용되지 않은 경우에 비하여 비점분포에 큰 변화가 없었다.
Figure 5(h)는 CaH-C 흡수제가 사용된 경우 생성된 오일의 비점분포를 보여주고 있다. Figure 5(g)에서 보았듯이 Ca(OH)2가 흡수제로 사용된 경우에는 오일의 비점분포가 크게 변화하지 않았으나 Ca(OH)2가 주성분인 CaH-C 흡수제의 경우에는 비점분포에 중요한 변화가 있음을 알 수 있다. Fe-C 흡수제가 사용되었던 경우와 같이 온도 변화경로가 A인 경우 150~450 ℃ 범위에서 오일의 비점이 증가한 것을 알 수 있다.
Figure 4(i)는 α-FeO(OH)/Ca(OH)2 혼합물을 흡수제로 사용한 경우 생성된 오일의 비점분포를 보여준다. 전반적으로 비점분포가 크게 변화하지 않은 것을 알 수 있다.
3.2.3. 생성물 염소농도
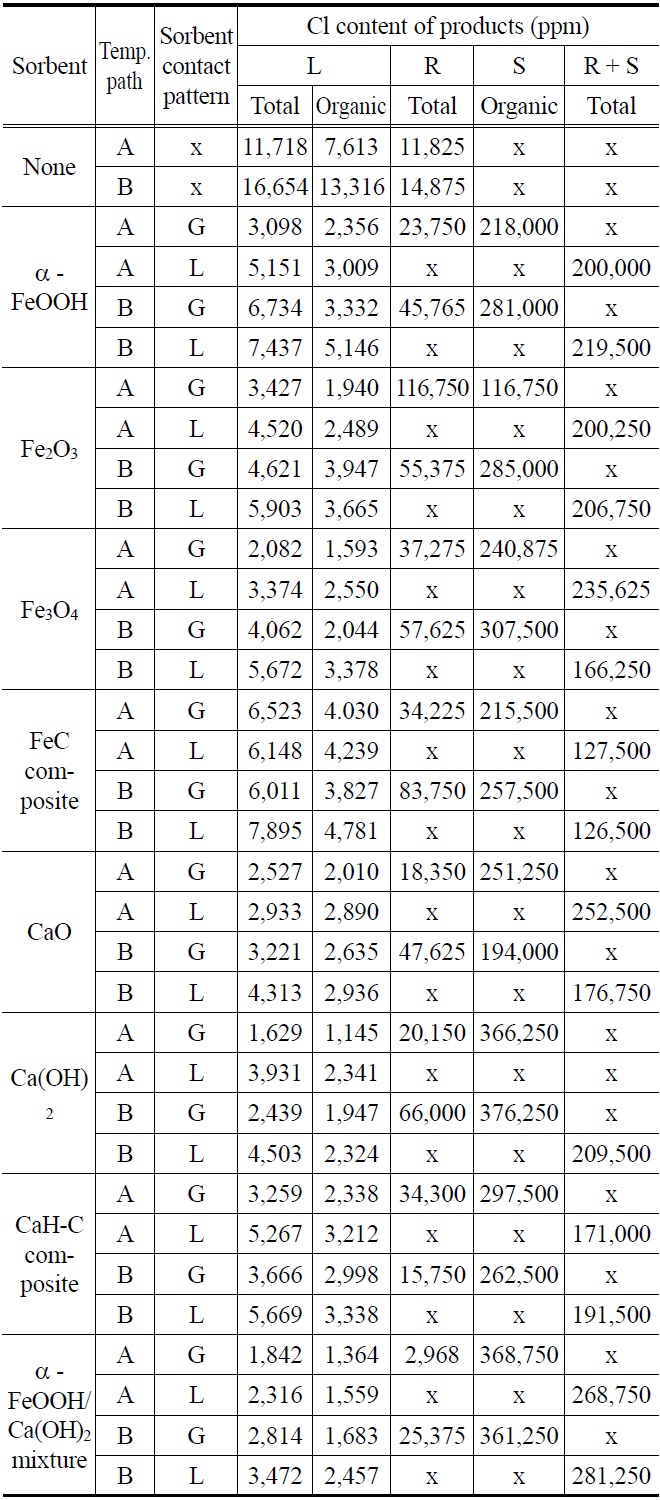
Table 4는 각 흡수제 사용시 열분해 생성물의 염소(Cl) 함량을 나타내며 Figure 6(a)~(i)는 각 흡수제가 사용되었을 때 생성물중의 염소(Cl) 분포비율을 나타낸다. Table 4에서 볼 수 있듯이, 흡수제가 사용되지 않았을 때는 온도변화 경로가 A일 때 오일의 총염소(Cl) 함량이 11,718 ppm이었고 온도변화 경로가 B일 때 오일의 총염소(Cl) 함량은 16,654 ppm이었다. 온도변화 경로가 A일 때 오일의 총염소(Cl) 함량이 온도변화 경로가 B일 때보다 더 낮은 이유는 300 ℃에서 60분간 진행되는 탈염과정에서 C-C 결합 보다는 C-Cl 결합이 끊어져 염소(Cl)이 HCl로 배출되었기 때문이다. Table 4에서 볼 수 있듯이, 유기 염소(Cl)의 비율도 온도변화 경로가 A인 경우에 더 낮았는데 그 이유는 온도변화 경로가 A인 경우 300 ℃에서의 탈염과정에서 염소(Cl)이 HCl로 배출되는 반면에 PP의 분해로 인한 탄화수소가 발생되지 않아 유기 염소(Cl) 화합물이 발생되지 않았고 반면에 온도변화 경로가 B인 경우는 300 ℃에서의 탈염과정을 거치지 않고 온도가 상승하여 HCl과 PP의 분해로 발생된 탄화수소가 결합하여 다량의 유기 염소(Cl)화합물을 생성하였기 때문이다. Uddin et al.[5]의 연구결과에 다르면 유기 염소(Cl) 화합물의 생성은 HCl과 PE, PP, PS와 같은 다른 플라스틱의 열분해시 얻어진 탄화수소와의 반응에 의하여 생성된 것이다. PP 열분해 생성물의 3차 탄소(tertiary carbon) 원자는 PE 열분해시 주요 불포화 생성물인 n-alkene이나 n-alkadiene 등의 2차 탄소(secondary carbon) 원자보다 염소(Cl)의 첨가에 더 취약하며 PP 열분해시 발생되는 탄화수소와 PVC 열분해시 발생되는 HCl의 반응으로 인하여 생성되는 주요 염화물은 2-chloro-2-methylpropane, 2-chloro-2-methylpentane, 2-chloro-2,4-dimethylheptane을 포함하는 monochlorinated branched alkane 등 인 것으로 알려져 있다[10].
Table 4에서 볼 수 있듯이, 전반적으로 흡수제가 액상보다는 기상으로 사용되었을 때 오일의 염소(Cl) 함량이 더 낮았고, 온도변화 경로가 B일 때보다 A일 때 오일의 염소(Cl) 함량이
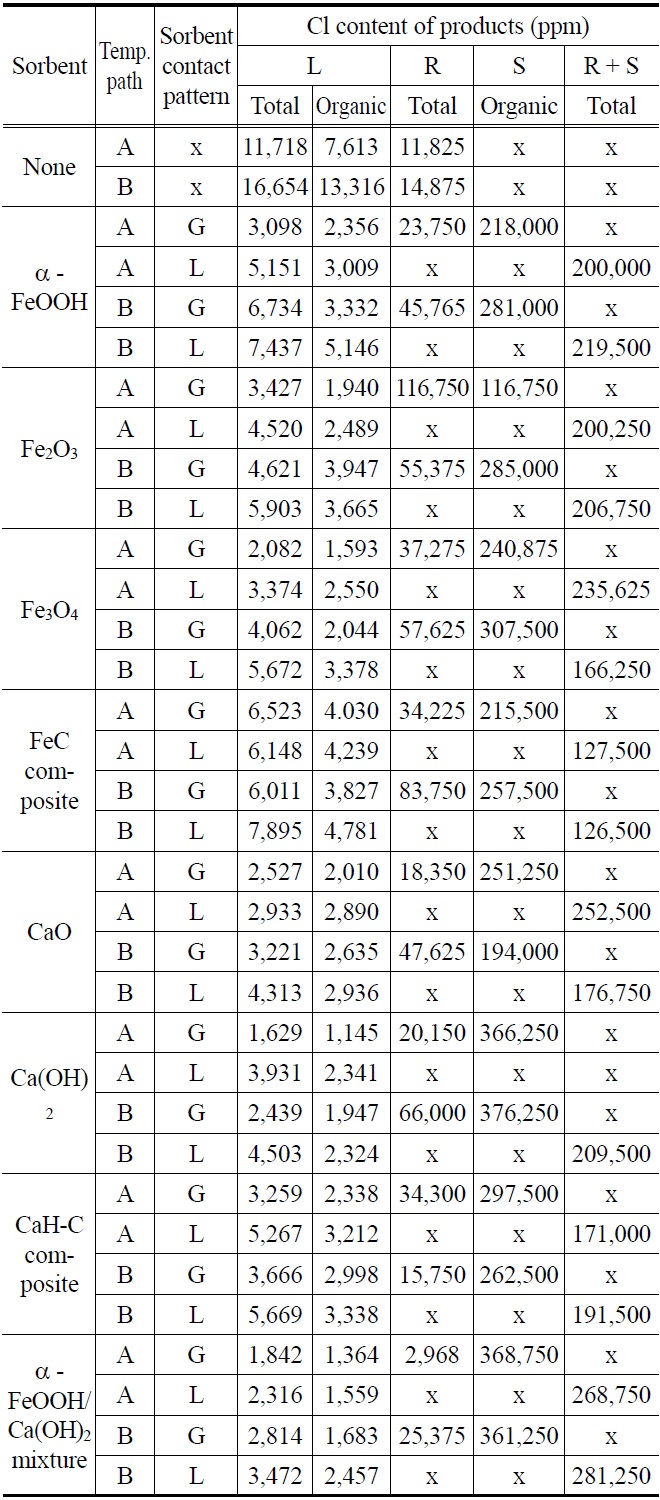
Cl content of pyrolysis products with sorbent (L: liquid phase, G: gaseous phase, R: residue, S: sorbent)
더 낮았다. 흡수제가 액상보다 기상으로 사용될 때 오일의 염소(Cl) 함량이 더 낮은 이유는 액상에서 사용될 때는 흡수제 입자 주변을 큰 분자가 감싸고 있어 C-Cl 결합과 흡수제 입자 사이의 접촉이 원활하지 못한 반면에 기상에서 사용될 때는 흡수제 입자 주변에 큰 분자가 없어 C-Cl 결합과 흡수제 입자 사이의 접촉이 원활하기 때문으로 추정된다.
Blazs? et al.[11]은 산화철과 같이 금속이온의 크기가 충분히 큰 금속 산화물은 염소(Cl)를 끌어당겨 C-Cl 결합을 약하게 함으로써 PVC를 탈염한다고 보고하였다. 산화철은 탈염반응 초기에는 촉매로서의 역할을 하지만 생성된 HCl과 반응하여 염화철로 전환되고 염화철도 역시 유기염화물의 탈염에 효과가 있는 것으로 보고되어 있다[12]. Uddin et al.[5]은 PP/PVC 열분해시 α-FeOOH, Fe2O3, Fe3O4 등의 산화철을 기상에서 흡수제로 사용하여 그 영향을 조사하였는데 α-FeOOH와 Fe3O4는 우수한 염소(Cl) 제거능력을 보여주었으나 Fe2O3는 상대적으로 염소(Cl) 제거능력이 떨어지는 것으로 보고하였다. 반면에 Brebu et al. [13]은 α-FeOOH를 흡수제로 사용한 경우 단지 30%를 약간 상회하는 유기 염소(Cl) 제거가 가능하였음을 보고하였고, 이러한 현상을 열분해 반응중 α-FeOOH가 산화철로 변화되기 때문으로 설명하였다. Uddin et al.[5]의 보고와는 달리 본 연구에서 사용된 산화철 입자들의 탈염 성능은 전반적으로 Fe3O4 > Fe2O3 > α-FeO(OH)인 것으로 보이며, 특히 Figure 6(b)~(d)에서 볼 수 있듯이, 흡수제의 염소(Cl) 흡수 능력의 척도로 볼 수 있는 흡수제의 염소(Cl) 분포비율은 Fe3O4, Fe2O3, α-FeO(OH) 사이에 큰 차이가 없었다. Figure 6(e)에서 볼 수 있듯이, Fe3O4가 주성분인 Fe-C 복합체의 경우 Fe3O4, Fe2O3, α-FeO(OH) 분말보다도 탈염성능이 떨어졌는데 그 이유는 α-FeO(OH), Fe3O4, Fe2O3 흡수제는 미세한 분말상태로 사용된 반면에 Fe-C 흡수제는 0.5~1.0 mm 사이의 크기로 사용되어 열분해 생성물과 흡수제 사이의 접촉이 원활하지 못했던 것으로 추정된다. 산화철 분말이 흡수제로 사용된 경우 오일에 포함된 염소(Cl) 농도는 온도변화 경로가 A일 때 47.5~82.2%, 온도변화 경로가 B일 때 52.6~75.6% 제거되었다. Fe-C 복합체가 흡수제로 사용된 경우는 온도변화 경로가 A일 때 44.3~47.5%, 온도변화 경로가 B일 때 52.5~63.9% 제거되었을 뿐이다.
Table 4와 Figure 6(f), (g)에서 볼 수 있듯이, CaO와 Ca(OH)2의 탈염성능은 산화철 보다 약간 더 우수하였다. 오일에 포함된 염소(Cl) 농도는 온도변화 경로가 A일 때 66.4~86.1%, 온도변화 경로가 B일 때 73.0~85.4% 제거되었다. CaH-C 복합체가 흡수제로 사용된 경우는 Fe-C 복합체의 경우와 같이 탈염성능이 저하되어 온도변화 경로가 A일 때 55.1~72.2%, 온도변화 경로가 B일 때 66.0~78.0% 제거되었으며 이러한 현상역시 CaH-C 흡수제 입자 크기가 0.5~1.0 mm로 분말상태의 흡수제보다 크기 때문이다. 일반적으로 Ca계열 흡수제는 Fe 계열 흡수제보다 염소(Cl) 흡수능이 우수한 것이 보고되어 있다[13].
최적의 탈염 흡수제/촉매를 선정하기 위하여 Ca 계열 및 Fe 계열 산화물을 사용하여 PVC 열분해 실험을 수행하였으며 주요 결과는 아래와 같다.
1) 산화철 분말을 액상에서 흡수제로 사용시 오일의 수율이 뚜렷하게 감소하였다. 이러한 현상은 산화철이 열분해시 일부 분해촉매의 역할을 하였을 가능성을 시사하나 오일의 비점이
낮아지는 현상은 발견되지 않았다.
2) Ca 계열 산화물 분말을 흡수제로 사용한 경우 오일의 수율이 감소하는 현상은 발견되지 않았으며 비점분포는 큰 변화가 없었다.
3) Ca 계열 산화물의 분말 흡수제는 Cl 흡수능력이 우수하여 그 탈염성능이 산화철 분말 흡수제 보다 우수하였다.
4) 흡수제의 강도를 높이기 위하여 Ca 계열의 분말 및 산화철 계열 분말을 성형한 CaH-C와 Fe-C 복합체를 흡수제로 사용한 결과 분말 상태의 흡수제에 비하여 탈염성능이 떨어졌으며, 그 이유는 분말 흡수제에 비하여 Fe-C 및 CaH-C 흡수제의 크기가 커서 열분해 생성물과 흡수제 사이의 접촉이 상대적으로 원활하지 못했던 것으로 추정된다.