Researches on developing photocatalyst materials for hydrogen production from solar water splitting attract great attentions due to the unlimited and clean characteristics of the solar energy. In this review, photocatalysts used for hydrogen production from the solar water splitting are discussed in terms of material characteristics. In addition, various modification techniques applied to the photocatalysts for improving hydrogen production efficiency are summarized. Finally, light characteristics such as intensity, illumination density and wavelength cutoff are also discussed for the importance of hydrogen production rate.
미래의 무한?청정 에너지원으로 고려되고 있는 태양에너지를 활용하여 수소를 생산할 수 있는 광촉매재료에 대한 연구가 활발히 진행되고 있다. 본 총설에서는 태양광을 이용한 물분해 수소생산용 광촉매재료들에 대하여 알아보고, 현재까지 보고된 다양한 광촉매재료의 특성들을 검토하고자 한다. 또한, 다양한 광촉매재료를 활용하여 수소생산 효율을 높이기 위해서 시행되었던 촉매재료 개질 방법들을 통하여 향후 지속적으로 진행될 연구방향을 모색해 보고자 한다. 각각의 광촉매재료들이 활성을 가질 수 있는 빛의 영역을 알아보고, 광촉매 작용에 필수적인 광원, 광밀도, 파장영역 등의 중요성에 대해서도 토론한다.
화석연료의 꾸준한 사용증가로 고갈되어가는 에너지자원을 대체하기 위한 새로운 에너지원의 개발이 중요하게 인식되고 있다. 특히 무한한 에너지원으로 평가되고 있는 태양에너지를 상업적인 공정을 통하여 일상생활에 활용하고자 하는 연구가 최근들에 매우 활발하게 진행되고 있다[1]. 태양에너지는 화석연료의 사용으로부터 발생되는 환경오염을 방지할 수 있는 큰 장점이 있지만, 화석연료에 비하여 현저하게 떨어지는 에너지 전환효율과 낮은 경제성으로 인하여 상업적 적용이 매우 미미한 상태에 있다고 할 수 있다. 태양에너지의 활용은 크게 전기에너지로 변환하는 태양전지재료와 화학에너지로 변환하는 광촉매재료의 개발을 통하여 가능하다. 본 연구는 태양에너지를 화학에너지로 변환할 수 있는 광촉매재료에 대한 총설이며 현재까지 보고된 다양한 연구결과들을 통하여 광촉매재료에 따른 광반응메커니즘과 수소생산 효율 등의 광촉매 활용 추진방향 등에 대하여 논하고자 한다.
광촉매 반응은 크게 두 가지로 구분이 될 수 있는데, 산소의 존재 하에서 비가역적으로 이루어지는 유기물 분해반응과 물을 분해하여 수소와 산소로 전환하여 화학에너지를 생산하는 물분해반응으로 볼 수 있다. 광촉매를 활용한 물분해 반응의 연구는 1972년 Fujishima와 Honda[2]에 의하여 이산화티타늄(TiO2)기반 물질이 처음 보고된 이후, 다양한 물질들이 개발되어 수소생산 연구에 사용되고 있다. TiO2는 3.2 eV의 띠간격(band gap) 에너지를 가지고 있어, 전자를 원자가띠(valence band)에서 전도띠(conduction band)로 여기시키기 위해서는 자외선에 해당하는 빛이 필요하다. 하지만 태양광 자체에 포함된 자외선은 약 4% 수준으로 태양에너지를 활용하는 효율성 측면에서 바람직하지 않다고 할 수 있다. 따라서 TiO2를 개선하기 위하여 다양한 물질의 도핑(doping)으로 띠간격을 줄이고, 원자가띠와 전도띠의 위치를 바꾸는 시도가 수행되어 오고 있다[3].
특히, 이러한 개선 시도를 크게 나누어보면 두 가지로 구분할 수 있다. 첫째는 금속이온 도핑, 둘째는 비금속 물질 도핑이라고 할 수 있다. 금속물질로는 대부분 전이금속(루테늄(ruthenium, Ru), 은(silver, Ag), 백금(platinum, Pt), 구리(copper, Cu), 몰리브데늄(molybdenum, Mo), 니오비움(niobium, Nb), 바나디움(vanadium, V), 철(iron, Fe), 코발트(cobalt, Co), 니켈(nickel, Ni), 크롬(chrome, Cr), 망간(manganese, Mn))들이 사용되고 있으며[4,5], 비금속 물질로는 탄소(carbon, C), 황(sulfur, S)[6], 질소(nitrogen, N)[7], 인(phosphate, P)[8], 붕소(boron, B), 요드(iodine, I), 불소(fluorine, F) 등이 첨가되어 띠간격 에너지를 낮추는 역할을 하고 있다. 또한, 복합재료를 형성하여 띠간격을 낮추려는 시도로, 황화카드뮴(CdS) 입자활용[9], 염료감응화[10], 업컨버젼(upconversion)용 형광물질[11], 나노구조체도입[12,13], 띠간격이 좁은 일산화구리(Cu2O)와 같은 p형 반도체 도입[14,15], 그래핀이나 C60와 같은 전자를 받아들이는 물질과 복합화[16-19] 등의 연구가 보고되었다.
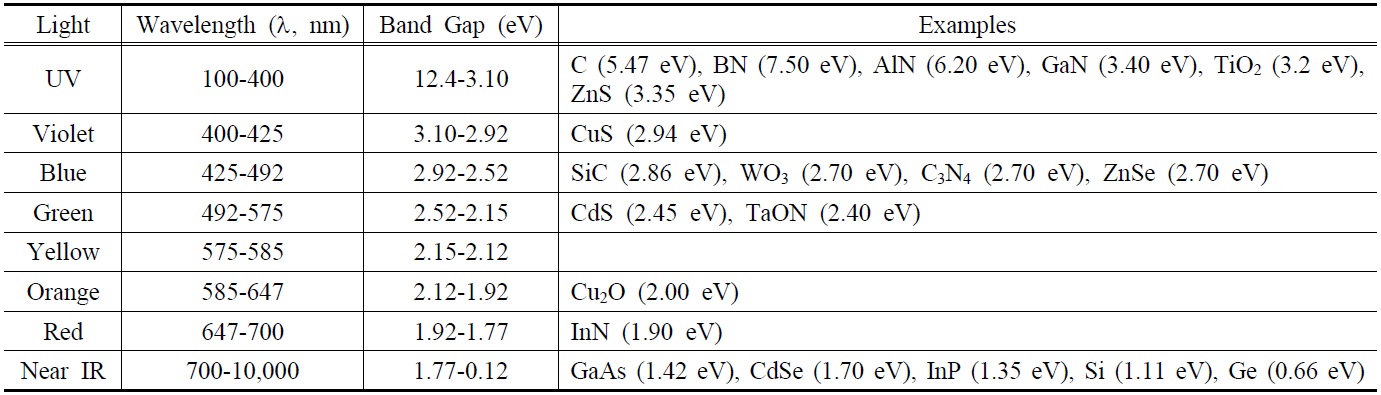
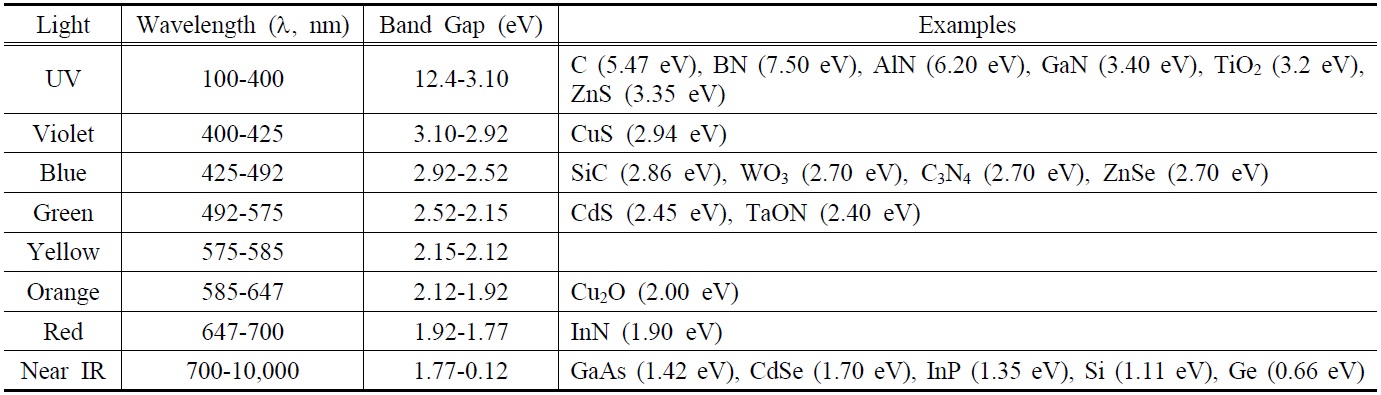
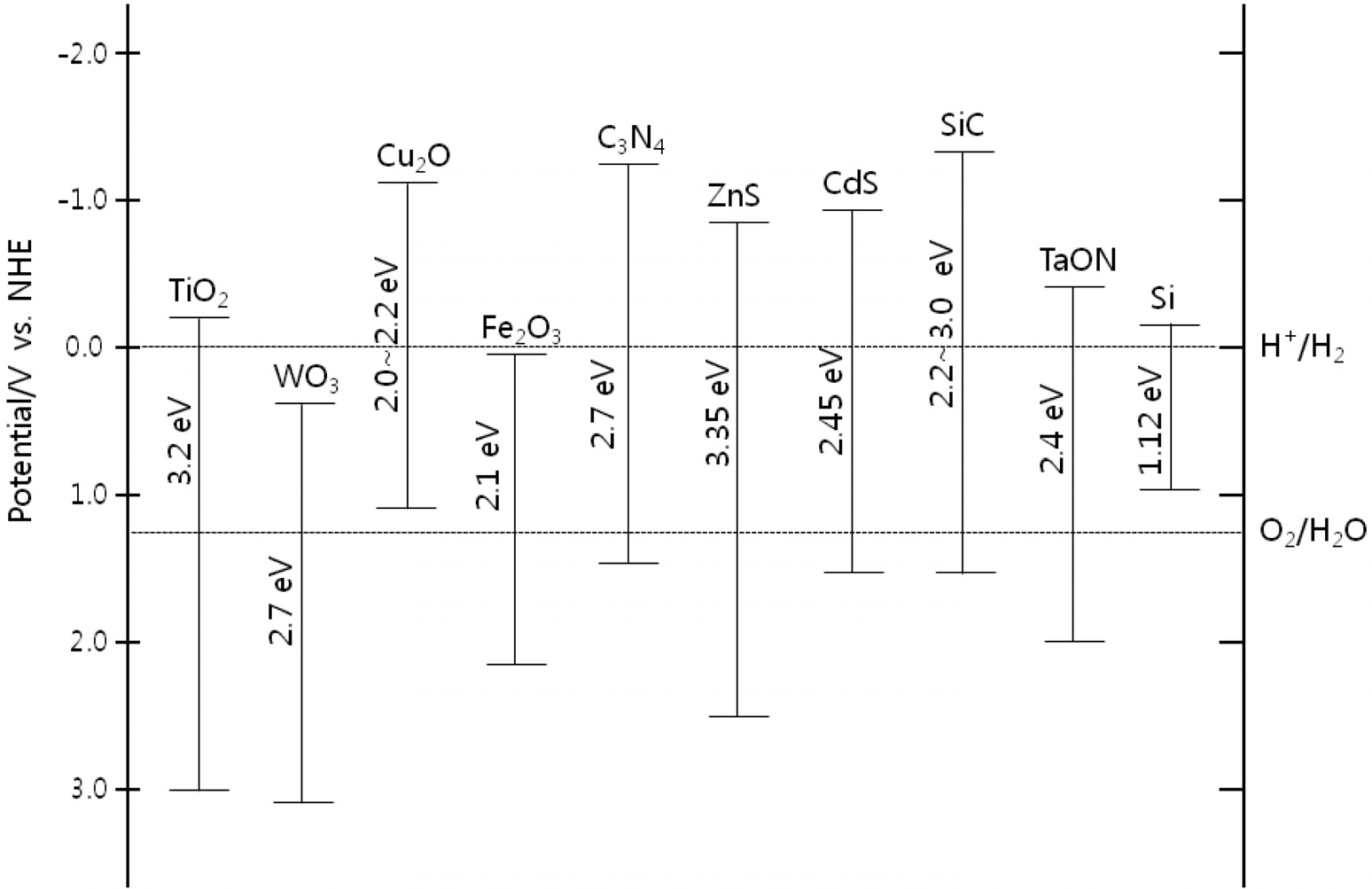
또한, 텅스텐산화물(WO3)에 다양한 금속성 물질들을 복합화하여 띠간격을 조절하는 연구도 광범위하게 수행되었다[20]. 이 외에도 구리산화물(Cu2O), 카본나이트라이드(C3N4), 금속황화물(ZnS, CdS), 및 철산화물(Fe2O3), 다양한 금속산화물(ZnO, Ta2O5, TaON) 등의 반도체 물질들이 있다. Figure 1은
물분해 수소생산 연구에 활발히 사용되고 있는 다양한 광촉매재료들의 띠간격, 원자가띠, 전도띠의 에너지를 물분해 반응의 수소 및 산소 생산 전위와 연관하여 나타내고 있다. 이러한 다양한 반도체물질을 활용한 물분해 수소생산 연구 결과들을 광촉매 재료별로 구별하여 수소생산 연구의 효율성 개선에 대하여 고찰하고자 한다.
이 물질은 물 분해와 공기 정화를 위한 효율적인 광촉매재료로 고려되고 있으며 재료의 표면을 스스로 정화하는 것으로 알려져 있다. 또한, 강한 산화활성(oxidation activity)과 수친화력(hydrophilicity)으로 인하여 살세균제(antibacterial agent)로의 사용도 활발히 고려되고 있다. 하지만 이 물질은 상대적으로 큰 띠간격 에너지로 인하여 자외선 이상의 가시광선(태양광의 약 45%)을 활용함에 어려움이 있으며, 가시광선을 효율적으로 이용하고자 하는 측면에서 다양한 개선 시도가 행하여지고 있다. 이러한 기본적인 소재의 가시광선 흡수 향상을 위한 개선연구는 서론에서 소개한 것과 같이 금속성 물질들과 비금속성 물질들의 도핑을 통하여 다양하게 시도되고 있다.
Figure 2는 TiO2가 빛을 흡수(hν1)하여 전자가 여기되어 전자-정공 쌍을 형성하는 것을 개략적으로 나타내고 있으며, 전자는 전도띠에 정공은 원자가띠에 존재하는 것을 보여주고 있다. 이렇게 형성된 전자와 정공이 수소 생산반응에 효율적으로 사용되기 위해서는 서로 재결합하여 열을 발생할 수 있는 가능성을 줄여야 한다. 그림에 보여주고 있는 것처럼 전자와 정공은 반응의 조건에 따라 OH 라디칼, O2-, H2O2 등의
중간물질을 거쳐 수소와 산소 기체를 생성하게 된다. TiO2 물질이 가지고 있는 큰 띠간격을 줄이고 가시광선의 흡수를 높이기 위해 금속물질이나 비금속물질의 도핑이 수행되는데, Figure 2에서 보여주는 것처럼 금속물질을 도핑할 경우 전도띠 에너지(hν2)를 낮추게 되며, 비금속물질을 도핑할 경우 원자가띠 에너지(hν3)를 높이게 된다. 따라서, 두 가지 경우 모두에서 띠간격을 줄여주며 TiO2 물질 자체에 비하여 도핑을 시도할 경우 가시광선의 흡수를 향상시킬 수 있는 것을 보여주고 있다. 또한, 금속성 물질을 도핑할 경우 전자의 이송을 용이하게 하여 전자가 이동시 물질 내부에 갇혀 있거나 재결합하는 현상을 줄일 수 있는 것으로 알려져 있으며, 결과적으로 광흡수 활성을 향상시키는 것을 보고하고 있다. 다양한 도핑물질을 도입하여 TiO2 광촉매를 제조하는 방법들의 예를 Table 1에 보여주고 있다. Table 1의 예들에서 볼 수 있듯이, 도핑을 수행하기 위해서는 고온에서의 반응과 소결과정이 요구되는 것을 알 수 있다.
금속도핑된 TiO2를 제조하는 공정은 주재료인 TiO2 입자를 만들고 여기에 도핑하고자 하는 금속물질을 수용액상에 첨가하여
[Table 1.] Examples of the various doping materials used for manufacturing doped-TiO2 photocatalysts

Examples of the various doping materials used for manufacturing doped-TiO2 photocatalysts
주재료인 TiO2와 혼합하여 이를 고온공정에서 소결하는 전형적인 과정을 거치게 된다. 공정상으로 살펴보면, 금속물질을 도핑하기 위한 방법으로 이온주입법(ion-implantation)[32], 스퍼터링(sputtering)[24], 수열법(hydrothermal)[25], 졸겔(solgel)[26] 등이 사용되고 있다. 각각의 공정으로 도핑된 TiO2를 제조하고 이의 광활성을 증진시키기 위하여 공정조건에 따른 고온의 소결을 진행한다. 또한, 비금속도핑공정으로 제조하는 TiO2는 가시광 활성을 향상시키기 위해 다양한 도핑물질을 함유한 타이타늄 원료물질(precursor)의 수분해(hydrolysis)[29,33,34], 기상 박막 증착법[35], 산화분위기에서 소결법(TiN[36], TiS2[36], TiC[37]), 대기압 하에서 플라즈마법을 통한 나노입자제조[38] 등의 방법을 통하여 제조되고 있다.
이렇게 다양한 도핑방법으로 개질된 TiO2 광촉매의 가시광 반응 효율은 제조방법에 크게 의존하며, 장시간 사용과 반복적인 사용에 의한 광활성 손실을 어떻게 극복할 것인가가 중요한 문제점으로 알려져 있다. 또한, 도핑이 되지 않은 TiO2와 비교하여 금속이 도핑 된 TiO2가 가시광하에서 활성이 없거나 자외선 하에서 낮은 활성을 보이는 경우도 나타나는데, 이는 금속이온이 전하의 재결합을 촉진하는 역할을 하는 것으로 알려져 있기 때문이다. 따라서, 상업적 활용을 목적으로 한 광범위한 광촉매시스템 확대를 위해서는 가시광 하에서 화학적, 물리적 안정성과 향상된 표면특성을 소유하는 새로운 소재의 개발이나 기존에 개발된 다양한 소재의 최적화가 매우 중요할 것으로 판단된다. 추가적으로, TiO2를 기반으로 하는 가시광 반응 촉매의 활성을 향상시키기 위한 새로운 도핑물질이나 도핑물질을 도입하기 위한 새로운 방법을 개발하는 것과 광반응의 새로운 응용분야를 확보하는 것이 중요하게 인식되고 있다.
도핑을 통한 TiO2 기반 광촉매재료의 개발은 상대적으로 큰 띠간격을 줄여줌으로써 가시광선의 활용 효율을 향상시키는 것에 주요점이 있다. 이처럼 띠간격이 작은 반도체 성질의 새로운 물질을 발견하고 광촉매의 효율을 높이고자 하는 노력이 계속되고 있다. Figure 1에서 보여준 띠간격 에너지 준위를 참고해 보면, 효율적인 수소생산을 위한 재료의 조건으로는 전도띠의 에너지준위가 프로톤이 전자를 받아서 수소가 형성되는 것보다 음준위가 되어야 하며, 또한 이에 비례하여 물로부터 산소가 생산되는 준위는 더 양준위로 분포해야 한다. 하지만 이런 조건을 모두 만족할 경우 띠간격 에너지가 너무 크게 되어 태양광에 의한 전자-정공의 발생이 어렵게 된다. 따라서 한종류의 금속산화물 반도체 광촉매를 바탕으로 이러한 모든 성질을 만족시키는 것보다는 두 종류의 재료를 결합하여 각각으로부터 수소와 산소를 생산하는 역할을 담당하게 하는 촉매, 즉 Z-scheme 촉매의 개념이 등장하게 되었다[39]. 이러한 개념은 수소를 생산하는 촉매와 산소를 생산하는 촉매를 따로 구성하는 이며 좁은 띠간격 에너지를 가지는 다양한 광촉매를 혼합할 수 있다는 큰 장점이 있다. 이러한 개념은 수소와 산소를 생산하는데 관여하는 포톤(photon)의 개수로 크게 구별할 수 있는데, 단일 광촉매의 경우는 하나의 포톤을 흡수하여 하나의 전자-정공 쌍을 만들지만 Z-scheme의 경우는 두 개의 포톤을 흡수하여 두 개의 광반응에 관여하는 것이며 이를 Figure 3에 나타내고 있다.
이러한 개념을 바탕으로 텅스텐산화물(WO3)은 물을 산화시켜 산소를 생산하는데 매우 유리한 전위구조를 가지고 있으며, 다양한 화학반응 용액조건에서 광 및 화학적 안정성을 보여주고 있다. 또한, 이미 지적한 것처럼 낮은 띠간격(2.7 eV vs. 3.2 eV for TiO2)으로
인하여 태양광의 잠재적 활용가능성이 크다고 할 수 있다. 따라서 텅스텐 산화물의 우수한 산소발생 능력을 유지하면서 수소생산성을 높일 수 있도록 텅스텐 산화물의 전자수조를 조절하기 위한 다양한 연구가 수행되어 오고 있다. TiO2의 경우와 같이 금속이나 비금속물질을 도핑하여 수소생산 효율을 높이고자 하는 연구들이 수행되었으나 큰 효율의 향상이 이루어지지 않았으며 텅스텐산화물을 활용하는 수소생산의 연구는 이성분이나 삼성분물질을 함유하여 광촉매의 효율을 향상시키고자 하는 다양한 연구가 보고되고 있다. Figure 4는 다양한 종류의 이성분계 텅스텐 산화물 반도체 광촉매의 띠간격과 전위수준을 보여주고 있다. 기본물질인 WO3와 비교하여 첨가물의 종류에 따라 원자가띠의 에너지 준위와 띠간격이 다양하게 변화되는 것을 잘 보여주고 있다. 예를 들어, Kudo와 공동연구자들[40-42]이 보고하였던 비스뮤스텅스텐산화물(Bi2WO6)의 밴드에너지를 보면, WO3와 비교하여 띠간격에서는 큰 변화가 없지만 전도띠의 에너지 준위가 음준위 방향으로 개선됨에 따라 수소생산이 용이할 수 있음을 나타낸다. 이러한 이성분계 텅스텐산화물을 제조하는 방법은 고온공정이 필수적으로 동반되어 에너지관점에서 큰 단점으로 작용하기도 한다. 따라서, 전기증착법, 화학적용액성장법(chemical bath deposition, CBD), 졸겔법 등의 에너지와 시간의 관점에서 재료합성의 효율성을 향상시키고자 하는 다양한 시도가 이루어지고 있다. 또한 삼성분을 혼합하여 밴드에너지준위를 개선하기 위한 시도들도 다양하기 이루어졌으나 이성분 시스템들과 유사한 영역에서의 밴드에너지 준위들을 확보하는 것으로 판단된다.
또한, WO3를 활용한 수소생산 효율을 높이기 위하여 Z-scheme 광촉매를 구성하는 다양한 연구가 보고되었다. WO3를 활용한 수소생산용 혼합 광촉매로 보고된 물질로는 스트론튬타이타늄산화물 : 로듐(SrTiO3 : Rh)[43-46], 탄탈륨옥시나이트라이드(TaON)[47,48], 구리인듐셀레늄(CuIn3Se5)[49] 등의 다양한 물질들이 있다. 이상에서 살펴본 바와 같이 텅스텐 산화물의 전자구조를 바꾸기 위한 노력, 수소생산을 용이하게 하기 위한 전도띠를 음전위로 이동하기 위한 노력, 띠간격을 줄이기 위한 노력 등의 다양한 시도 등이 텅스텐계열 광촉매 재료의 주요 연구 방향이었다. 혼합형 광촉매를 위한 Z-scheme 재료는 텅스텐화합물을 산소생산반응에 활용함을 기본으로 하여 이성분이나 삼성분계의 소재를 결합함으로서 수소생산효율을 높이고자하는 시도들이 계속되어 왔다. 계속되는 나노수준의 다성분계 혼합에 따른 표면공학의 진보는 Z-scheme 공정을 통한 광촉매 수소생산 연구의 효율을 지속적으로 높여줄 것으로 기대된다.
구리 화합물인 황동(chalcopyrite) 계열(CuInSe2, CuInS2, Cu-InGaSe2)은 좁은 띠간격과 화합물에 따라 비교적 정교한 에너지준위를 가진 물질로 태양광의 특정 파장영역을 흡수하기에 매우 적합한 물질이다. 이들은 화합물의 조성을 비교적 쉽게 변화시켜 밴드구조를 1.1~2.5 eV 범위에서 조절이 가능하며 우수한 전자이송 특성을 가지고 있다. 또한 전도띠의 전위가 수소를 생산하기에 용이한 음전위에 위치하고 있으며, 개미산으로부터 수소를 생산하기에도 충분한 광촉매임을 보이고 있다. 하지만, 원자가띠의 위치에 있어서 물분해로부터 산소를 생산하기에는 적합하지 않은 것으로 나타나며, 따라서 황동광계열 촉매로부터 물분해수소생산은 혼합구조 광촉매의 사용이 필요한 실정이다. 황동광 계열 물질은 박막[50], 나노결정[51], 나노선[52], 나노튜브[53] 등의 다양한 형태로 보고되었으며 나노구조형 반도체들이 광전환효율의 샹항 측면에서 태양전지나 태양연료로의 응용이 확대되고 있는 실정이다.
구리산화물(Cu2O) 또한 좁은 띠간격(2.0~2.2 eV)을 소유하고 있으며 전도띠의 전위가 -1.15 V 수준으로 수소생산 반응에 적합한 것을 나타낸다. 이 물질은 매우 광범위하게 존재하는 풍부한 재료로서 경제적인 관점에서 큰 장점이 있으며, 환경적인 유해성도 적은 것으로 알려져 있다. 하지만, 구리 산화물은 빛으로부터 생성된 전자가 효율적으로 짧은 시간 내에 활용되지 못할 경우 구리로 환원되는 현상이 나타날 수 있다. 따라서, 이러한 전자의 광환원작용을 줄여줄 수 있도록 양전위 전도띠를 가지는 TiO2나 ZnO와 같은 물질(전자를 효율적으로 이송시키는 역할을 담당)과 결합하여 전자의 광안정성을 높여줄 수 있다. 최근에 Gratzel 그룹에서는 산화구리 박막에 다층 박막을
만들고 Pt 나노입자를 공용촉매로 활용하여 수소를 생산하는 연구를 보고하였다[54]. Figure 5는 다층박막이 결합된 구리 산화물 접합구조를 보여주고 있으며, 구리 산화물이 전해질 용액으로부터 분리되어 스스로 광환원작용을 줄여주는 구조를 나타낸다. 이러한 구조적 특징으로 인하여 뛰어난 광전류 안정성을 나타내며 약 40%의 광전환효율을 보였다고 보고하였다. 또한 Chen et al.[55]은 구리 산화물의 광안정성과 광촉매효율을 높이기 위하여 나노선에 대한 연구를 제시하였으며, 구리 산화물 나노선이 격자형으로 구성된 나노입자형 구리산화물에 비하여 매우 우수한 광안정성과 높은 광전류를 보였다고 보고하였다.
흑연탄소질화물(g-C3N4)은 그래파이트와 유사한 고분자형 반도체 소재로서 우수한 화학적, 광화학적 안정성을 가지고 있는 것으로 알려져 있다. 띠간격은 약 2.7 eV이며 이는 가시광선 파장영역인 400~450 nm의 파장을 흡수할 수 있음을 나타낸다. 위에서 설명한 광촉매재료들과 같이 흑연산소질화물의 경우도 띠간격을 조절하기 위한 다양한 시도들이 있었으며, 여러 가지 원소를 이용한 도핑, 소재의 열처리 등의 방법들이 보고되었다. 예를 들어, 본 재료는 광반응에 의하여 생성되는 전류의 강도는 다소 약하지만, 그래파이트와 유사한 g-C3N4의 구조를 활용하여 다른 소재를 기능화하여 광흡수 영역을 확장하기에 화학적으로 매우 큰 가능성을 가지고 있다. Domen과 동료들은 마그네슘 프탈로시아닌(magnesium phythalocyanine, MgPc) 염료를 C3N4의 본체에 π-π 적층작용을 통하여 도입하여 더 효율적인 가시광선의 흡수를 이루었다고 보고하였다[56]. 또한 π-π 작용으로 C3N4와 그래핀 복합체가 합성되기도 하였으며[57,58], 이때 그래핀은 전자 흡수체 역할을 함으로서 C3N4 영역 내에서 전하를 효율적으로 분리시키고 광전류를 향상시키는 작용을 하는 것으로 보고되었다. 최근에 보고된 연구로는 다공성 C3N4 (mpg-C3N4)가 비표면적을 높이고 다분산 효과에 의하여 흑연산소질화물의 광효율과 촉매활성을 크게 향상키기는 가장 촉망되는 가능성을 제시하기도 하였다[59].
물분해 수소생산을 위한 광촉매로의 적용에서 mpg-C3N4는 triethanolamine (TEOA)/물의 혼합 용액에서 매우 활성이 높은 것으로 나타났으며, 촉매의 효율은 공극과 비표면적에 따라 크게 의존하는 것으로 알려졌다. 그래핀 복합체를 사용할 경우는 전자흡수체 역할을 하여 mpg-C3N4 보다 3배 이상의 활성을 보였다. 또한 저가 광촉매를 개발하기 위한 노력으로 mpg-C3N4/Co3O4[60]를 이용한 물분해를 통한 산소반응 촉매와 같이 흑연산소질화물을 이용하며 귀금속을 사용하지 않는 촉매를 개발하기 위한 시도들이 보고되고 있다. 또한, 흑연산소질화물에 수소생산이나 산소생산을 일으키는 전자촉매를 접합하여 무선융합 광촉매의 개발도 새로운 관심을 이끌고 있으며, 태양광의 효율적인 활용과 관련한 다양한 요구사항들을 만족시키기 위한 노력이 지속될 것으로 판단된다.
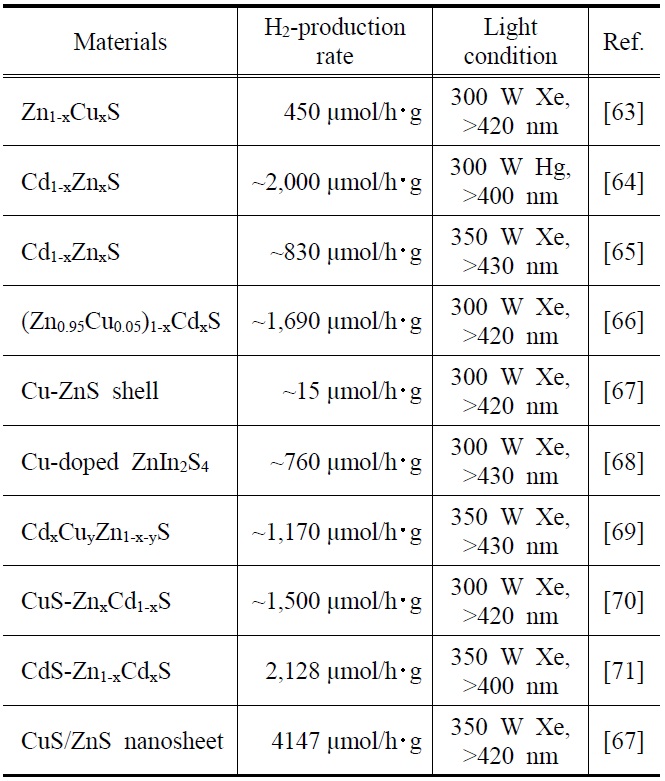
Examples of H2-production from metal sulfide photocatalysts under visible light irradiation
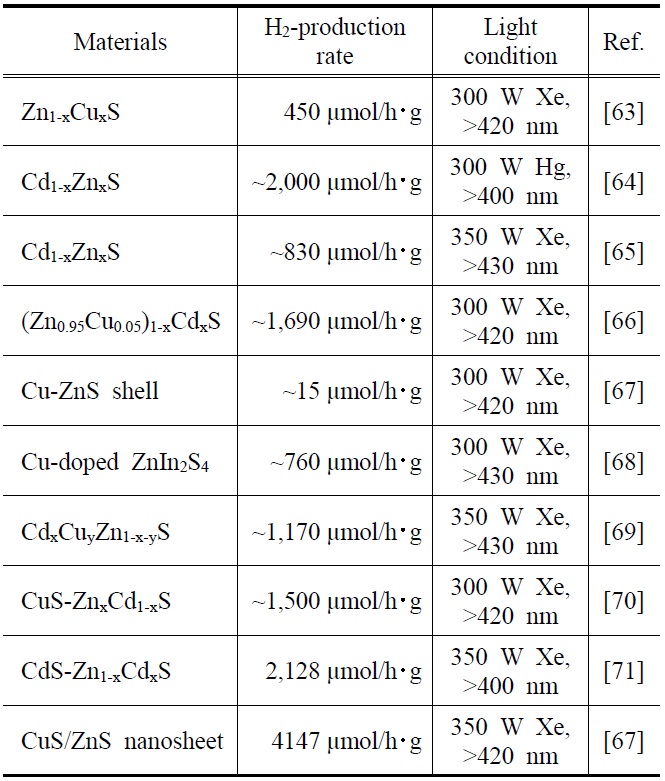
금속황화물 광촉매는 촉매기능이나 띠간격 측면을 고려하여 최근에 연구가 활발히 진행되고 있다. 특히, 아연황화물(ZnS)은 광여기에 의하여 전자-정공 쌍을 빨리 형성하고 여기된 전자가 높은 음전위를 가지고 있어 물분해 수소생산 반응에서 매우 높은 활성을 보이는 특징이 있는 것으로 잘 알려진 광촉매 물질 중 하나이다[61,62]. 또한, 금속황화물 광촉매재료는 수소생산 효율 향상을 위하여 다양한 연구가 꾸준히 지속되고 있다. Table 2는 현재까지 보고된 다양한 금속황화물 광촉매를 활용한 물분해 수소생산의 대표적인 예를 정리하여 보여주고 있다. ZnS의 띠간격은 3.66 eV로 비교적 큰 편이며 가시광에 의한 광여기를 용이하게 하기 위하여, 구리(Cu)와 카드뮴(Cd) 등의 금속성 물질을 동시에 도입하는 다양한 결과들을 보여주고 있다. 보고된 대부분의 금속황화물 광촉매의 제조는 사용되는 재료의 기재(precursor)를 동시에 혼합하여 한 번의 공정으로 만드는 고체용액(solid solution)법을 사용하였으며, 고온의 열처리를 통하여 각각의 금속성물질의 결정특성을 개선하여 광촉매 특성을 향상시킨 것을 나타내었다. 수소생산 속도는 10~4,000 μmol/h?g 범위에서 다양하게 보고되었으며, 이는 광반응에 사용된 촉매의 양과 반응시간을 단위시간과 단위무게로 환산한 경우를 나타내고 있다.
최근에 보고된 Zhang et al.[72]의 결과에서는 ZnS와 구리황화물(CuS)을 접합하는 나노쉬트(nanosheet) 형태를 두 단계 공정으로 제조하여 여기된 전자를 계면전하이동(interfacial charge transfer, IFCT) 개념으로 해석하였으며 매우 높은 수준(4,147 μmol/h?g)의
수소생산속도를 보고하였다. 이들은 CuS가 ZnS에 비하여 상대적으로 낮은 2.94 eV의 띠간격을 가지고 있어, 가시광선을 활용하는 효율을 높였으며, 또한 ZnS의 표면에 응집체(cluster) 형태로 존재하는 CuS의 전도띠 에너지준위로 전자가 운반되어 수소생산에 효과적으로 활용된 것을 설명하고 있다. Figure 6은 이를 개략적으로 보여주고 있는 것이며, CuS를 표면에 도입할 경우 함량에 따라 수소생산 효율이 달라지기 때문에 적절한 함량이 존재함을 제시하였다.
이상에서 정리한 광촉매재료와 더불어 적철광(hematite, α-Fe2O3)는 2.1 eV의 띠간격을 가지고 있어 가시광을 흡수하기에 매우 적합한 소재로 알려져 있으며, 금(Au) 나노입자를 도입하여 광흡수와 전하분리를 용이하게 하기 위한 시도가 보고되었다[73]. 또한, CdSe, CdTe, GaP, GaAs, ZnO, InP, Ndoped Ta2O5 등의 다양한 반도체 특성을 가지는 광촉매재료들이 보고되었으며, 이러한 다양한 물질들을 효율적으로 물분해 수소생산에 활용할 수 있기 위해서는 광흡수특성, 광전류 변환효율, 광부식 등의 관점에서 지속적인 연구가 필요할 것으로 판단된다.
광촉매재료의 활용에 있어서 가장 중요하게 고려되는 것은 광원이 가지고 있는 에너지와 재료의 고유한 띠간격 에너지와의 관계이다. 즉, 광촉매재료의 띠간격 에너지보다 큰 광원의 에너지가 재료에 조사될 경우 재료의 전도띠에 있는 전자는 여기상태가 되어 원자가띠로 이동하게 된다. 이때 여기된 전자가 물분해 수소생산에서 프로톤(H+)을 수소(H2)로 전환하는 역할을 하게 된다. 전자의 여기에 필요한 에너지는 식 (1)과 같이 표현된다.
여기서 h는 플랑크상수(6.62606957 × 10-34 m2kg/s), c는 빛의
[Table 3.] Summary of possible semiconductor photocatalyst materials
Summary of possible semiconductor photocatalyst materials
속도(299,792,458 m/s) λ는 빛의 파장(m)이다. 식 (1)을 이용하여 빛의 에너지를 계산할 경우 m2kg/s2의 단위가 나오는데 이는 Joule의 에너지 단위이며 띠간격 에너지를 나타낼 때 주로 사용하는 eV로 환산하기 위해서는 1 eV를 1.6 × 10-19 J의 관계를 이용할 수 있다. 이를 바탕으로 하여 다양한 광원에 따른 파장, 띠간격 에너지, 이에 해당되는 반도체 광촉매재료의 예들을 Table 3에 정리하여 보여주고 있다.
광원으로부터 충분한 에너지를 받아서 여기된 전자가 원자가띠로부터 분리되어 전도띠로 이동한 후, 전자와 정공이 다시 재결합하는 현상이 없이 효율적으로 사용될 경우 수소생산효율은 높아지게 된다. 이렇게 되기 위해서는 분리된 전자와 정공이 재결합을 하지 않는 것이 매우 중요한데, 이는 분리된 전자가 효율적으로 이송되어야 한다. 띠간격이 매우 좁은 물질의 경우는 전자의 여기를 위한 에너지는 적게 필요하지만 반면에 분리된 전자와 정공이 재결합을 이룰 가능성 또한 매우 높아서 효율적인 전자 이송과정을 반드시 고려해서 광촉매를 설계해야 한다.
비록 다양하게 매력적인 반도체형 광촉매 소재 군이 개발되었지만, 물분해 반응으로부터 충분한 생산속도로 수소와 산소의 자발적인 반응을 일으키는 광촉매의 제조는 여전히 필요한 실정이다. 더군다나 좁은 띠간격을 소유한 황동, 산화구리, 산화철 등은 가시광을 흡수하는 우수한 특성을 가진 반면, 원자가띠의 전위가 물분해 반응을 통하여 산소를 발생하기에는 부적절한 것으로 알려져 있다. 또한, 이들은 통상적으로 장기간 사용 시에 광부식을 일으키는 것으로도 알려져 있다. 물분해 수소생산에 적합한 밴드구조를 소유하였으며 상대적으로 안정한 TiO2와 카본나이트라이드 물질 등의 반도체 물질은 태양광 중에서 매우 적은양인 자외선 영역을 주로 흡수하여 광전환효율이 상대적으로 매우 낮은 것으로 알려져 있다. 따라서 광안정성과 좁은 띠간격을 소유한 반도체형 소재의 지속적인 개발이 꾸준히 요구되고 있으며, 광촉매를 이용한 물분해 수소생산으로의 응용을 위해서는 탠덤구조, 외부전극의 응용, 소재의 복합화, 산화환원 매개물질의 응용 등 다양한 공학적인 접근이 필요할 것으로 판단된다.
또한, 광촉매 연구에서 매우 중요한 변수는 광원이라고 할 수 있다. 광원을 구성하는 중요한 인자로는 빛의 세기(W), 단위면적당 광조사 에너지(W/m2), 파장(λ)을 선택하는 차단(cutoff)범위(nm) 등에 따라 광촉매를 통한 수소생산 반응은 매우 다른 결과를 가져올 수 있다. 예를 들어, Table 2에서 보여주고 있는 금속황화물 광촉매를 통한 수소생산속도는 사용된 빛의 조건이 서로 다르기 때문에 직접적인 비교가 어려운 실정이다. 같은 빛의 세기를 가지고 있다고 하더라도 단위면적당 광조사 에너지밀도를 알 수 없으며, 같은 빛의 세기를 가지고 있지만 서로 다른 차단 파장범위를 가지고 있다면 수소생산 결과도 당연히 달라질 수 있기 때문이다.
일반적으로 태양광을 활용한 연구의 경우 상호 신뢰비교를 위해서는 기준조건이 필요하다고 판단된다. 예를 들면, 태양광을 활용하는 태양전지 연구에 있어서 태양광을 모사할 수 있는 장치(solar simulator)를 이용하여 지구표면에 도달하는 태양광 파장을 가장 유사하게 구현할 수 있는 차단 파장범위를 선택하여 태양광밀도(1,000 W/m2)를 표준조건으로 설정하여 태양전지 효율을 보고하고 있다. 하지만, 미래 무한 에어지원인 태양광을 활용하고자 하는 일환으로 다양하게 진행되고 있는 태양광활용 광촉매 수소생산연구는, 가장 중요한 실험변수인 광원의 표준화가 없음으로 인하여 서로 다른 연구결과들을 상호 비교하기가 매우 어려운 실정이다. 따라서 가능하다면 표준광원과 광밀도를 사용할 수 있도록 하여 다양한 연구결과들을 비교 판단하는 것이 용이하게 하고 각기 보고된 결과의 상호 신빙성을 높여 연구결과를 모든 연구자들이 쉽게 파악할 수 있도록 하는 것이 중요할 것으로 판단된다. 또한, 광촉매를 활용한 수소생산속도 표현 방법에 있어서도 특정한 기준조건을 사용하여 앞으로 보고되는 다양한 연구결과를 서로 상대비교할 수 있게 함으로써 광촉매 수소생산 연구 개선방향을 공통적으로 찾아갈 수 있도록 하는 것이 중요할 것으로 판단된다.
물분해 수소생산용 광촉매재료로 연구되어오고 있는 TiO2 계열, 텅스텐 계열, 구리 계열, 흑연질소산화물 계열, 금속황화물 등의 다양한 반도체물질들에 대하여 알아보았다. 광촉매 재료와 태양광을 이용하여 물분해 수소생산에 효율적으로 활용되기 위해서는 띠간격 에너지가 전자를 여기시키기에 충분한 범위를 가져야 한다. 띠간격이 클 경우 가시광의 흡수를 통하여 전자의 발생이 어렵게 되며 따라서 금속물이나 비금속물을 도입하는 방법 등을 통하여 띠간격을 낮추는 연구가 광범위하게 수행되었다. 대부분의 촉매들이 자외선에 의한 활성이 크게 나타났지만, 태양광의 큰 영역을 차지하고 있는 가시광선(λ: 400~700 nm)을 효과적으로 활용하지 못한다면 효율을 높이는 면에서 한계가 있다고 할 수 있다. 따라서 이러한 관점에서 가시광을 활용하기 위한 다양한 연구들이 수행되었으며, 수소생산 효율의 향상을 위하여 다양한 공용촉매들을 도입하는 방법이나, 태양광을 흡수하여 여기된 전자와 정공을 효율적으로 분리하여 재결합을 방지함으로써 프로톤을 수소로 전환하는 성능을 높이는 방법들이 연구되었다. 다양한 연구자들이 광촉매 연구에서 활용하는 광원에 통일성이 없는 것으로 타나났으며, 상호 비교를 통해 보다 신뢰성 있는 연구 결과를 공유하기 위해서는 사용되는 광원의 통일이 필요할 것으로 판단된다.
![Electron excitation mechanism of TiO2 photocatalysis: hν1: pure TiO2; hν2: metal-doped TiO2 and hν3: nonmetaldoped TiO2. It is adaped from the reference[3]. The CB and VB represent conduction band and valence band, respectively.](http://oak.go.kr/repository/journal/12616/CJGSB2_2013_v19n3_191_f002.jpg)

![Illustration of the one photon (a), and the two photon (Z-scheme) water splitting (b), on a single and a dual semiconductor photocatalyst[4].](http://oak.go.kr/repository/journal/12616/CJGSB2_2013_v19n3_191_f003.jpg)
![Band positions of various tungsten based binary oxide semiconductors[4].](http://oak.go.kr/repository/journal/12616/CJGSB2_2013_v19n3_191_f004.jpg)
![Cu2O photocathode with multiple layers designed by Gratzel[54].](http://oak.go.kr/repository/journal/12616/CJGSB2_2013_v19n3_191_f005.jpg)
![Schematic illustration for visible light induced IFCT from the valence band of ZnS to the CuS clusters in CuS/ZnS system[72].](http://oak.go.kr/repository/journal/12616/CJGSB2_2013_v19n3_191_f006.jpg)