치매는 뇌의 신경세포가 대부분 손상되어 기억, 판단 및 사회생활 전반에 걸쳐 장애가 생기는 대표적인 신경 정신계 질환이다1). 치매를 일으키는 원인질환으로 약 80가지 이상의 질환이 보고되고 있는데1), 가장 많은 부분을 차지하는 것이 알츠하이머병(Alzheimer's disease; AD)으로 전체 치매의 50∼60%를 차지한다2).
한의학에서는 치매를 ?病, 健忘, 癲狂 등의 범주로 이해하고 있으며, 精氣不足, 脾腎虧虛, 痰濁阻竅, 氣滯血瘀, 氣血虛弱 등으로 辨證하여 치료한다2).
聰明湯은 『東醫寶鑑·神門』6)에서 “治多忘, 久服能日千語”하는 효능이 있다고 기재되어 있고, 임상현장에서 건망 및 치매 등을 치료하는데 널리 활용되는 대표적인 처방으로7), 최근 한의학계에서 총명탕 및 聰名湯에 단미제를 추가한 여러 聰明湯加味方이 치매의 치료와 예방에 활용될 수 있다는 다양한 실험 연구8-13)가 진행되었다.
단미제 중 巴戟天이 항콜린 작용과 아밀로이드 전구단백질(amyloid precursor protein; APP), PS-1, PS-2의 발현억제 효과가 있어 치매에 활용할 수 있다는 연구결과14)가 있고, 山査肉이 CT105를 처리한 PC-12 cell의 IL-1
더불어 聰明湯에 巴戟天 또는 山査肉을 가한 巴戟天聰明湯, 山査聰明湯16,17)이 항염증효과, 행동개선효과, 기억력감퇴 억제효과, 뇌세포 보호효과가 있다는 실험보고가 있으며, 聰明湯에 巴戟天과 山査肉을 첨가한 聰明湯加味方이
이에 본 연구팀은 위의 연구결과를 바탕으로, 聰明湯에 巴戟天, 山査肉을 가한 처방을 ACM이라고 명명하고, 치매 치료를 위한 한방신약개발의 일환으로 GLP기관에서 SD Rat을 이용하여 ACM의 안정성에 대한 평가한 바 있다. SD Rat을 이용한 단회 경구투여 독성시험19)과 13주간 반복 경구투여 독성시험20)에서 암수 모두에서 ACM의 투여에 의한 독성변화가 관찰되지 않았으며, ACM의 무독성량(NOAEL)이 5,000 mg/kg을 상회함을 확인하였다.
본 연구에서는 비 설치류를 이용한 일반 독성 시험의 실험동물로 널리 사용되고 있는 비글견을 대상으로 단회 용량증가 경구투여 독성시험 및 4주 반복 경구투여 용량 결정 시험을 실시하여 ACM의 독성반응과 안정성을 평가하고, 13주 반복투여 독성시험의 용량설정의 근거자료로 활용하고자 하였다.
1) 단회 경구투여 용량증가 독성시험과 4주 반복 경구투여 용량결정시험
GLP기관인 (주)바이오톡스텍에서 두 시험의 전 과정을 시행하였다.
두 시험 모두 동물보호법에 근거한 (주)바이오스텍의 동물실험윤리위원회에 의해 승인되었다(승인번호 : 단회 경구투여 용량증가 독성시험 100254, 4주 반복 경구투여 용량결정시험 100617).
1) 시험동물
(1) 단회 경구투여 용량증가 독성시험
본 시험에서는 비글견(Dog, Beagle, Beijing Marshall Biotechnology Co., Ltd., China)을 사용하였다. 비글견은 의약품 등의 안정성 시험에 널리 사용되고 있으며, 비교할 기초자료가 풍부하여 선택하였다. 5∼6개월령의 수컷(입수 시 체중 7.04∼7.51 kg), 암컷(입수 시 체중 4.72∼5.42 kg) 각각 3마리를 입수하여, 20일간의 검역·순화기간을 거쳐(투여 개시 시 체중 수컷 7.80∼8.18kg, 암컷 4.73∼6.41kg) 시험에 사용하였다. 반입 시 모든 동물은 문신번호를 확인하였으며, 일반상태를 관찰하고 체중(HW-100KGV, A&D Co., Ltd., Korea) 및 체온을 측정하였다. 입수 후 20일간의 검역·순화기간 중 매일 1회 일반증상을 관찰하고, 주 1회 체중을 측정하였다. 순화기간 종료 시에 동물의 건강상태를 확인하여 모든 동물에 이상이 없음을 확인하였다.
(2) 4주 반복 경구투여 용량결정시험
본 시험에서는 비글견(Dog, Beagle)을 사용하였다. 5∼6개월령의 수컷(입수 시 체중 5.87∼6.83 kg), 암컷(입수 시 체중 5.62∼6.71 kg) 각각 8마리를 입수하여, 13일간의 검역·순화기간을 거쳐(투여 개시 시 체중 수컷 6.18∼7.57 kg, 암컷 5.65∼6.99 kg)시험에 사용하였다. 반입 시 모든 동물은 문신번호를 확인하였으며, 일반상태를 관찰하고 체중(HW-100KGV, A&D Co., Ltd., Korea) 및 체온을 측정하였다. 20일간의 검역·순화기간 중 매일 1회 일반증상을 관찰하고, 주 1회 체중을 측정하였다. 순화기간 종료 시에 동물의 건강상태를 확인하여 모든 동물에 이상이 없음을 확인하였다.
2) 사육환경
(1) 단회 경구투여 용량증가 독성시험
순화과정 및 시험 전 기간 동안 스테인레스 개사육상자(800W×900L×830H)에 1마리씩 수용하여 사육하였다. 온도는 19.6∼23.8℃, 상대습도 26.7∼68.6%, 환기회수 10∼15회/시간, 조명시간 12시간/일(오전 7시부터 오후 7시), 조도 150∼300 Lux로 사육환경조건을 유지하였다. 사료는 실험동물용 고형사료(Agribrands Purina Korea Inc., Korea)를 사용하였고, 마리당 약 250 g씩 1일 1회(11:00∼13:00) 공급하였다. 혈액생화학적 검사 및 부검 시에는 그 전날의 16:00∼17:00 사이에 절식시켰다. 사료의 분석은 Agribrands Purina Korea Inc.에서 제공한 분석 성적서를 확인하여 본사에서 정한 허용범위 내에 속하는지 확인하였다. 음수는 청주시 수돗물을 필터유수살균기로 여과 후 자외선을 조사한 정제수를 자동급수장치를 이용하여 자유섭취 시켰다. 음수의 분석은 충청북도 보건환경연구원에 의뢰하여 ‘먹는 물 수질기준 및 검사 등에 관한 규칙’의 전 항목에 대하여 허용범위 내에 속하는지 확인하였다. 사육상자 및 사료통은 1∼2회/2주의 빈도로 세척하였으며, 이 기간에 사료통이 분변 및 분뇨 등으로 오염되었을 경우 그때마다 세척 또는 교환하였다.
(2) 4주 반복 경구투여 용량결정시험
순화과정 및 시험 전 기간 동안 스테인레스 개사육상자(800W×900L×830H)에 1마리씩 수용하여 사육하였다. 온도는 19.9∼22.7℃, 상대습도 41.1∼70.0%, 환기회수 10∼15회/시간, 조명시간 12시간/일(오전 7시부터 오후 7시), 조도 150∼300 Lux로 사육환경조건을 유지하였다. 사료는 실험동물용 고형사료(Agribrands Purina Korea Inc., Korea)를 사용하였고, 마리당 약 250 g씩 1일 1회(11:00∼13:00) 공급하였다. 혈액생화학적 검사 및 부검 시에는 그 전날의 16:00∼17:00 사이에 절식시켰다. 사료의 분석은 Agribrands Purina Korea Inc.에서 제공한 분석 성적서를 확인하여 본사에서 정한 허용범위 내에 속하는지 확인하였다. 음수는 청주시 수돗물을 필터유수살균기로 여과 후 자외선을 조사한 정제수를 자동 급수장치를 이용하여 자유섭취 시켰다. 음수의 분석은 충청북도 보건환경연구원에 의뢰하여 ‘먹는 물 수질기준 및 검사 등에 관한 규칙’의 전 항목에 대하여 허용범위 내에 속하는지 확인하였다. 사육상자 및 사료통은 1∼2회/2주의 빈도로 세척하였으며, 이 기간에 사료통이 분변 및 분뇨 등으로 오염되었을 경우 그때마다 세척 또는 교환하였다.
1) 시험물질
(1) 단회 경구투여 용량증가 독성시험 및 4주 반복 경구투여 용량 결정 시험
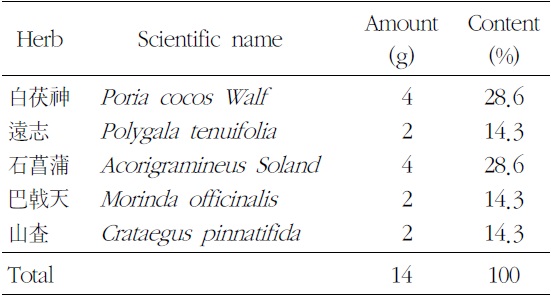
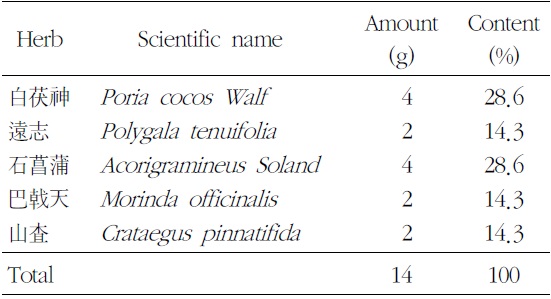
본 실험에 사용한 ACM은 (주)경방신약에서 표준화하여 분말형태로 공급받았으며, 전자저울(CP323S, Sartorius, Germany)로 칭량하여 용기에 넣고 일부의 부형제를 가한 다음 균질화기(ARE-250, THINKY, JAPAN)를 사용하여 현탁시켰다. 조제병에 조제물을 옮긴 후 부형제를 가하여 규정농도(단회 경구투여 용량증가 독성시험 20 → 400 → 500 mg/ml, 4주 반복 경구투여 용량 결정 시험 100, 200, 400 mg/ml)로 조제하였으며, 매번 투여 당일 실시하였다. 한 첩당 약재 구성은 다음과 같다(Table 1).
2) 투여절차
(1) 단회 경구투여 용량증가 독성시험
시험물질의 임상적용예정경로가 경구이므로 경구경로를 선택하였다. 투여액량은 5 및 10 ml/kg으로 하였고, 개체별 투여액량은 투여 당일의 체중으로 산출하였다.
[Table 1.] Prescription of ACM (Added Chongmyung-Tang)
Prescription of ACM (Added Chongmyung-Tang)
[Table 2.] Composition of Group of Single Oral Dose-increasing Toxicity Test in Beagle Dogs

Composition of Group of Single Oral Dose-increasing Toxicity Test in Beagle Dogs
투여일 오전에 경구투여용 카테터를 부착한 일회용 주사기(50 ml)를 이용하여 위내에 강제투여 하였다. 투여 후 약 2시간 후에 사료를 공급하였으며, 3일 간격으로 용량을 증가하여 총 3회 투여하였다.
(2) 4주 반복 경구투여 용량 결정 시험
시험물질의 임상적용예정경로가 경구이므로 경구 경로를 선택하였다. 투여액량은 5 ml/kg으로 하였고, 개체별 투여액량은 매주 1회 측정한 체중을 기준으로 산출하였다. 경구투여용 카테터를 부착한 일회용 주사기(50 ml)를 이용하여 위내에 강제투여 하였다. 투여 후 약 2시간 후에 사료를 공급하였으며, 1일 1회, 4 주간 반복 투여하였다.
3) 군 분리 및 투여용량 설정
(1) 단회 경구투여 용량증가 독성시험
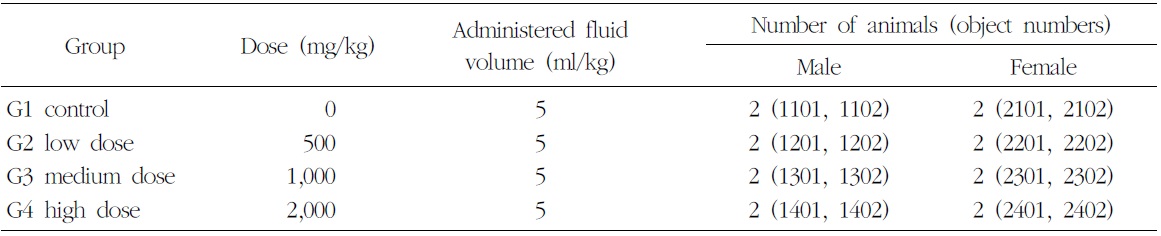
군 분리는 순화기간 종료 후에 실시하였고, 각 군의 평균체중이 균등하도록 하여 암수 각 2군, 대조군은 1마리, 시험물질 투여군은 2마리로 군 분리 하였다(Table 2).
SD Rat을 이용한 13주 반복투여 독성시험20)의 결과 본 시험물질의 무독성량은 암수 모두 5,000 mg/kg을 상회하는 것으로 나타났다. 따라서 본 시험에서는 5,000 mg/kg를 최종(3차)투여용량으로 정하고, 최종투여용량의 1/5과 2/5에 해당하는 1,000 mg/kg과 2,000 mg/kg을 각각 1, 2차 투여용량으로 설정하였다. 대조군에는 동일한 액량의 부형제를 투여하였다.
(2) 4주 반복 경구투여 용량 결정 시험
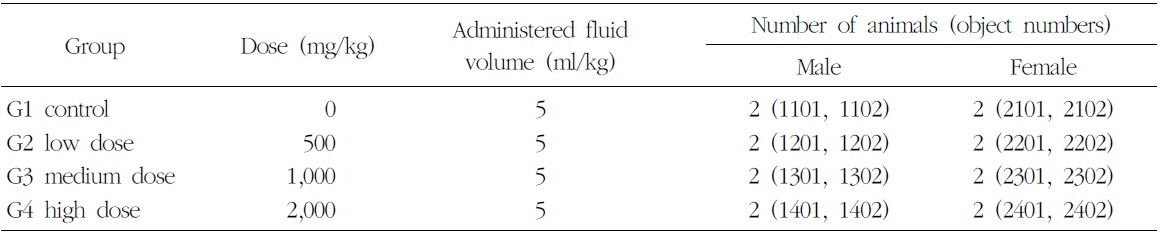
군 분리는 순화기간 종료 후에 실시하였고, 각 군의 평균체중이 균등하도록 하여 암수 각 4군, 군당
[Table 3.] Composition of Group of 4-weeks Repeated Oral Dose Determinating Test in Beagle Dogs
Composition of Group of 4-weeks Repeated Oral Dose Determinating Test in Beagle Dogs
2마리로 군 분리 하였다(Table 3).
본 시험물질에 대한 비글견 단회투여 용량증가 독성시험(B09631)의 결과, 2,000 mg/kg의 용량에서는 단 1례에서 경미한 구토증상을 보였고, 5,000 mg/kg의 용량을 투여했을 때 3/4례에서 구토증상이 관찰되었다. 따라서 본 시험에서는 반복투여인 것을 감안하여 2,000 mg/kg을 고용량으로 설정하고 공비 2를 적용하여 500 및 1,000 mg/kg을 각각 저용량 및 중용량의 투여용량으로 설정하였다. 대조군에는 동일한 액량의 부형제를 투여하였다.
1) 단회 경구투여 용량증가 독성시험
이하의 관찰 및 검사일은 투여 개시일을 투여 0일로 하여, 투여 개시일로부터 7일간을 1주로 계산하였다.
(1) 일반증상 및 사망유무 관찰
매번 투여 당일은 투여 후 30분 및 1, 2, 4, 6시간째에 일반증상(독성징후의 종류) 및 사망유무를 관찰하였다. 투여 후 1일 후부터는 1일 2회 관찰하였고, 최종 투여 후 2주간 관찰하였다.
(2) 체중 측정
모든 동물에 대하여, 매번 투여일(투여 전)과 투여 후 1일, 최종투여 후 1, 3, 7, 및 13일에 동일한 시간대에 측정하였다.
(3) 부검
관찰기간 종료 후, 모든 동물을 펜토탈소디움(thiopental sodium, (주)중외제약)으로 마취하에, 액와동맥을 절단 방혈하여 안락사 시키고 부검하였다.
(4) 조직병리학적 검사
부검 시 육안소견이 관찰되지 않았고 병리변화가 의심되는 장기·조직이 없었으므로 조직병리학적 검사를 실시하지 않았다.
(5) 자료의 통계처리
체중에 대한 통계처리는 실시하지 않았다.
2) 4주 반복 경구투여 용량 결정 시험
이하의 관찰 및 검사일은 투여 개시일을 투여 0일로 하여, 투여 개시일로부터 7일간을 1주로 계산하였다.
(1) 일반 증상 및 사망유무 관찰
관찰 기간 중, 모든 동물에 대하여 1일 2회 이상 일반증상을 관찰하고, 1일 2회 빈사나 사망동물의 유무를 확인하였다.
(2) 체중 측정
모든 종물에 대하여, 투여 개시일(투여 전), 투여개시 후 주 1회, 부검일에 체중을 측정하였다. 부검일의 체중은 상대 장기 중량을 구하기 위해 절식체중을 측정하였다.
(3) 사료섭취량
사료섭취량은 투여개시 전, 투여개시 후 주 1회 측정하였으며, 측정일의 전날에 마리당 250 g씩 공급하고, 공급과 동일한 시간대에 잔량을 측정하여 섭취량을 산출하였다.
(4) 뇨검사
투여개시 전 및 투여 4주에 자연배뇨방법으로 약 3 ml의 신선뇨(배설 후 약 3시간 이내의 뇨)를 채취하여 검사를 실시하였다. 검사 항목은 색상, 뇨비중, pH, protein, glucose, ketone body, bilirubin, occult blood, 침사 등이다.
(5) 혈액학적 검사
모든 동물에 대하여 투여개시 전과 투여 4주에 채혈 전 약 16시간 이상 절식시킨 후, 요측피정맥로부터 혈액을 채취하였다. 채취한 혈액 약 1 ml를 EDTA가 함유된 CBC bottle에 주입한 후, 혈구 분석기(ADVIA 120, SIEMENS, Germany)로 측정하였다. 검사항목은 RBC, HGB, HCT, MCV, MCH, MCHC, PLT, WBC, WBC differential counting, reticulocytes 등이다.
(6) 혈액생화학적 검사
요측피경구로부터 채취한 혈액 약 3 ml를 3,000 rpm으로 10분간 4℃에서 원심 분리 후, 혈청을 채취하여 이용하였다. 혈액생화학분석기(7080, HITACHI, Japan) 및 전기영동분석기(Epalyzer2, HELENA, Japan)로 측정하였다. 검사 항목은 ALT, AST, ALP, Crea, T-Bili, TP, Alb, Globulin (
(7) 부검
관찰기간 종료 후 모든 동물은 펜토탈소디움(thiopental sodium, (주)중외제약)으로 마취하에 액와동맥을 절단 방혈하여 안락사 시킨 후, 체표 및 전신의 장기, 조직에 대한 상세한 육안검사를 실시하였다.
(8) 장기중량 측정
모든 동물에 대해 뇌, 심장, 간, 비장, 신장, 부신, 고환, 난소에 대한 습중량을 측정하고 절식체중에 대한 상대적인 장기중량을 산출하였다 신장, 부신, 고환, 난소는 좌우를 합하여 무게를 측정하였다.
(9) 조직병리학적 검사
부검을 실시한 모든 동물에 대하여 뇌, 갑상선 및 부갑상선, 흉선, 심장, 뇌하수체, 폐 및 기관지, 간 및 담낭, 비장, 부신, 십이지장, 결장, 췌장, 전립선, 자궁, 골수(대퇴골), 신장, 위, 공장, 맹장, 고환, 부고환, 난소 육안소견이 관찰된 장기, 조직을 적출하여 10% 중성완충 포르말린 용액(neutral buffered formalin)에 고정하고, 그 중 고환은 Davidson 고정액에 고정 후, 10% 중성완충 포르말린 용액에 보관하였다. 고정한 장기와 조직은 삭정, 탈수 및 파라핀 포매 등의 일반적인 조직처리과정을 거쳐 조직절편을 제작하여 박절한 후, Hematoxylin & Eosin (H&E) 염색한 후 검경하였다. 골조직은 Calci-Clear-Rapid™ 액(National diagnostics, USA.)을 사용하여 탈회하였다. 잔여장기, 조직은 10% 중성완충 포르말린 용액에 보존하였다.
(10) 통계처리
자료들에 대한 통계처리는 실시하지 않았으나, 평균 및 표준편차를 구한 후, 그 변화의 경향에 대하여 평가하였다.
1) 사망유무 및 일반증상
시험기간 중 사망동물을 발생하지 않았다.
1,000 mg/kg 투여 후, 이상 증상은 관찰되지 않았다. 2,000 mg/kg 투여 후, 30분 이내에 수컷 1례(1201)에서 약간의 구토(vomiting) 증상이 관찰되었다. 5,000 mg/kg 투여 후, 수컷 2예(1201, 1202), 암컷 1례(1201)에서 30분 이내에 구토 증상이 관찰되었으며, 암컷의 1례(2201)에서는 약 1시간 후에도 구토증상이 관찰되었다. 비글견은 구토가 쉽게 발생할 뿐만 아니라 구토의 증상이 경미하고 지속적이지 않아 시험물질에 의한 독성반응은 아닌 것으로 사료된다. 시험물질 투여 후 1∼2일째 약물혼입변(compoundcolored stool)이 발견되고 그 뒤 관찰되지 않은 것으로 미루어, 시험물질 배설에 따른 착색변으로 판단되며 시험물질의 독성변화는 아닌 것으로 사료된다(Table 4).
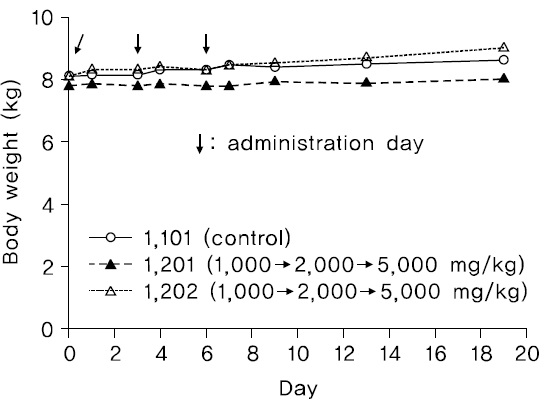
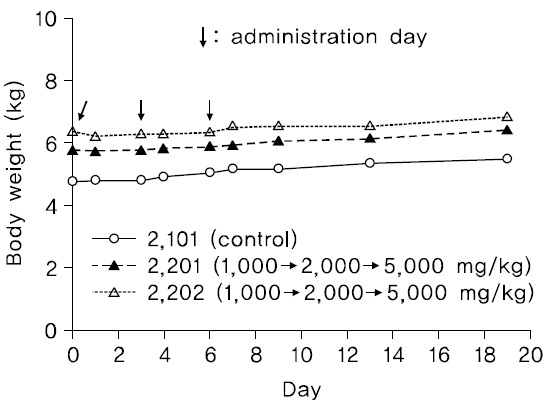
2) 체중 변화
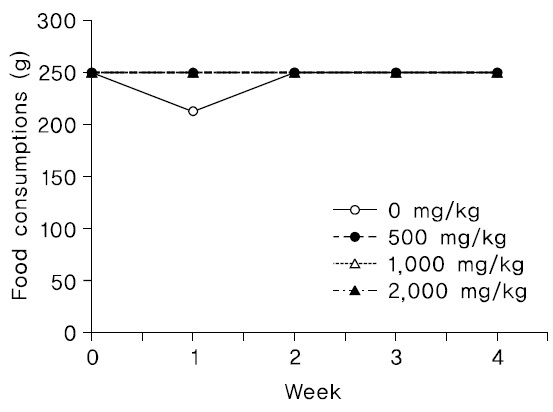
관찰기간동안, 암수 시험물질 투여군에서 시험물질의 투여에 의한 것으로 판단되는 체중변화가 관찰되지 않았다(Fig. 1,2).
[Table 4.] Clinical Signs of Single Oral Dose-increasing Toxicity Test in Beagle Dogs

Clinical Signs of Single Oral Dose-increasing Toxicity Test in Beagle Dogs
[Table 5.] Necropsy Findings of Single Oral Dose-increasing Toxicity test in Beagle Dogs
Necropsy Findings of Single Oral Dose-increasing Toxicity test in Beagle Dogs
3) 육안적 부검소견
부검 시, 암수 대조군과 시험물질 투여군에서 육안적 이상 소견은 관찰되지 않았다(Table 5).
1) 사망유무 및 일반증상
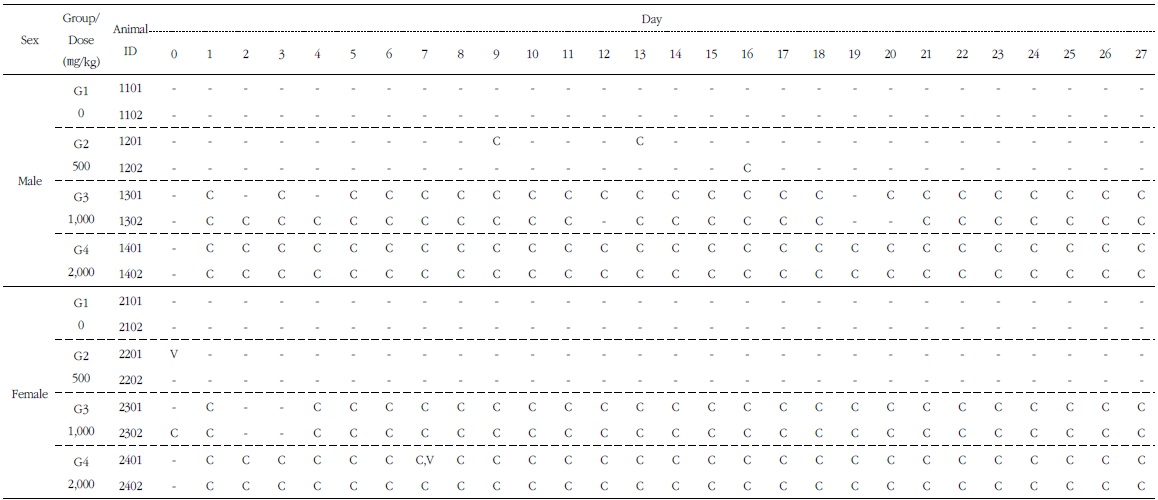
관찰기간동안, 암수 대조군 및 시험물질 투여군에서 사망한 동물은 발생하지 않았다. 암컷 500 mg/kg 투여군 1례(2201)에서 투여일에, 암컷 2,000 mg/kg 투여군 1례(2401)에서 투여 후 7일 째 각각 1회씩 경도의 구토증상이 관찰되었다. 상기 구토증상은 경미하고 일시적인 것으로 시험물질에 의한 독성반응은 아니라고 판단된다. 수컷 500 mg/kg 투여군에서 간혹, 암수 1,000 mg/kg 및 2,000 mg/kg 투여군에서 투여기간동안 지속적으로 약물혼입변(compoundcolored stool)이 관찰되었다. 그 이외의 독성반응으로 판단되는 증상은 관찰되지 않았다. 약물혼입변이 중용량, 고용량 투여군에서 지속적으로 관찰되었고,
[Table 6.] Clinical Signs of 4-weeks Repeated Oral Dose Determinating Test in Beagle Dogs
Clinical Signs of 4-weeks Repeated Oral Dose Determinating Test in Beagle Dogs
단회 경구투여 용량증가 독성시험에서 약물 투여 후 2∼3일 후에는 관찰되지 않은 것으로 미루어, 시험물질 배설에 따른 착색변으로 판단되며, 시험물질의 독성반응은 아닌 것으로 사료된다(Table 6).
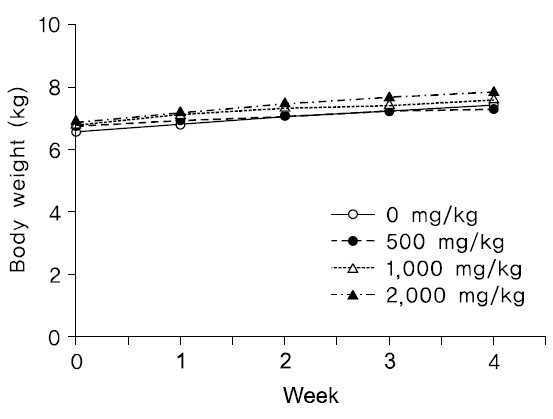
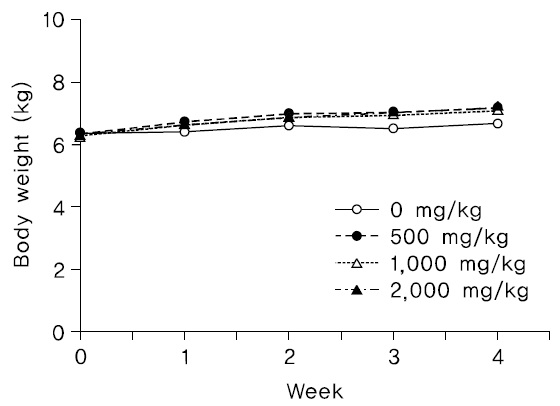
2) 체중변화
투여기간 동안 암수 시험물질 투여군 모두에서 시험물질 투여로 인한 것으로 판단되는 체중변화는 관찰되지 않았다(Fig. 3,4).
3) 사료섭취량
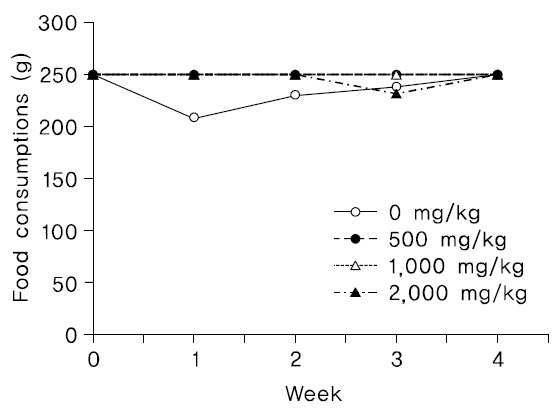
암컷 2,000 mg/kg 투여군 1례(2401)에서 투여 3주에 사료 섭취량이 약간 감소하였으나 일시적인 현상으로 판단되며, 다른 모든 암수 시험물질 투여군에서 시험물질 투여에 인한 것으로 판단되는 사료섭취량의 변화는 관찰되지 않았다(Fig. 5,6).
4) 요검사
모든 검사 항목 대해 암수 시험물질 투여군에서 시험물질에 의한 영향으로 판단되는 변화는 없었다. 시험물질 투여군에서 뇨의 색, 비중, pH의 변화, 뇨단백(protein)이 간혹 관찰되었으나, 모두 산발적으로 일어나는 현상이었고, 미량의 검출로서 용량의존성이 없어, 독성학적인 의미는 없다고 사료된다.
5) 혈액학적 검사
모든 검사 항목 대해 암수 시험물질 투여군에서 시험물질에 의한 영향으로 판단되는 투여 전후의 변화는 관찰되지 않았다. 검사 항목에 대해 투여 전후 경미한 변동이 관찰되었으나 용량의존성이 없었고 비장, 간 등의 조혈과 관련된 형태학적 변화가 관찰되지 않았으므로 독성학적 의미는 없다고 사료된다.
6) 혈액생화학적 검사
모든 검사 항목 대해 암수 시험물질 투여군에서 시험물질에 의한 영향으로 판단되는 투여 전후의 변화는 관찰되지 않았다. 검사 항목에 대해 투여 전후 경미한 변화만 관찰되었고, 용량의존성을 보이지 않아 독성학적 의미는 없다고 판단된다.
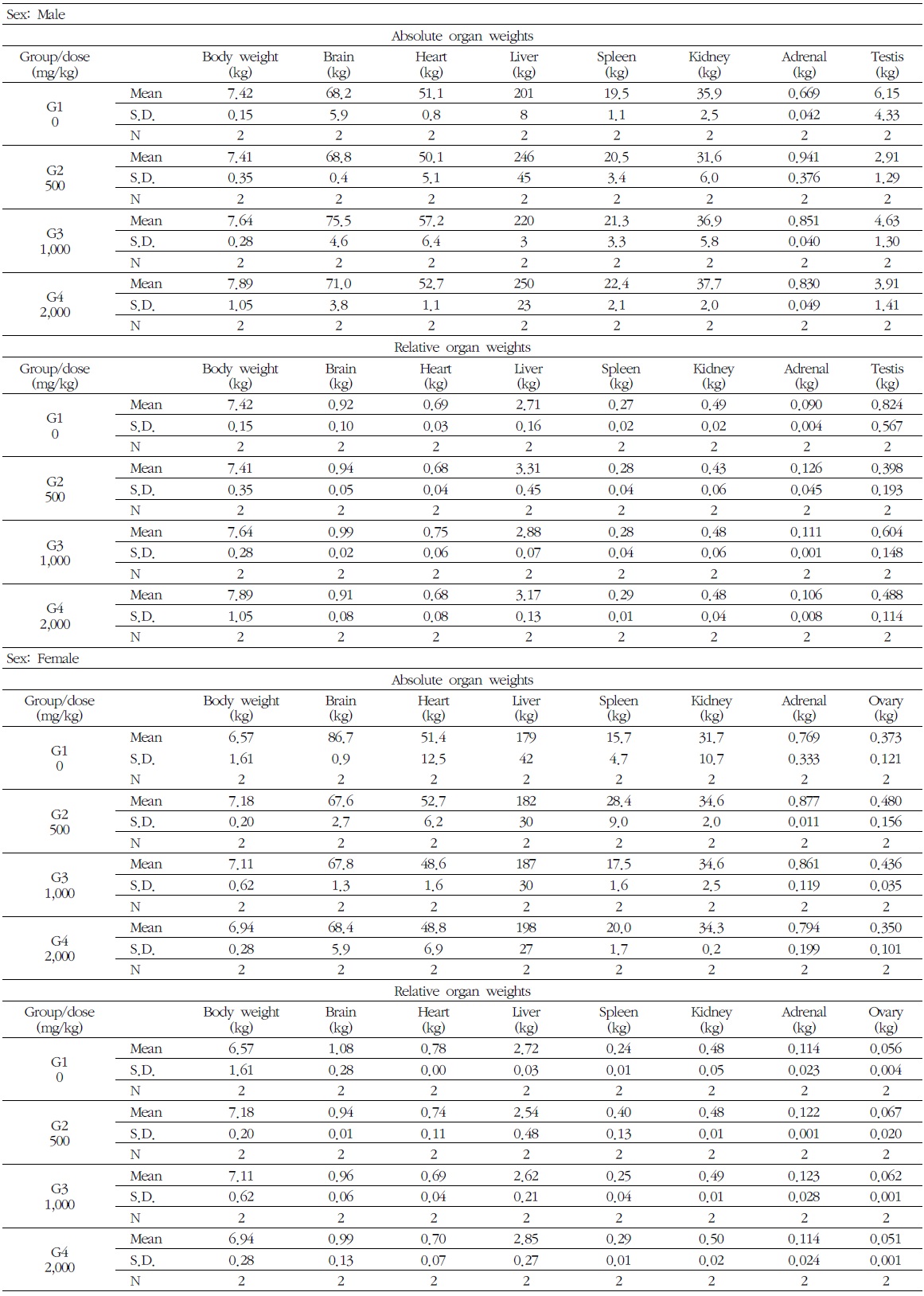
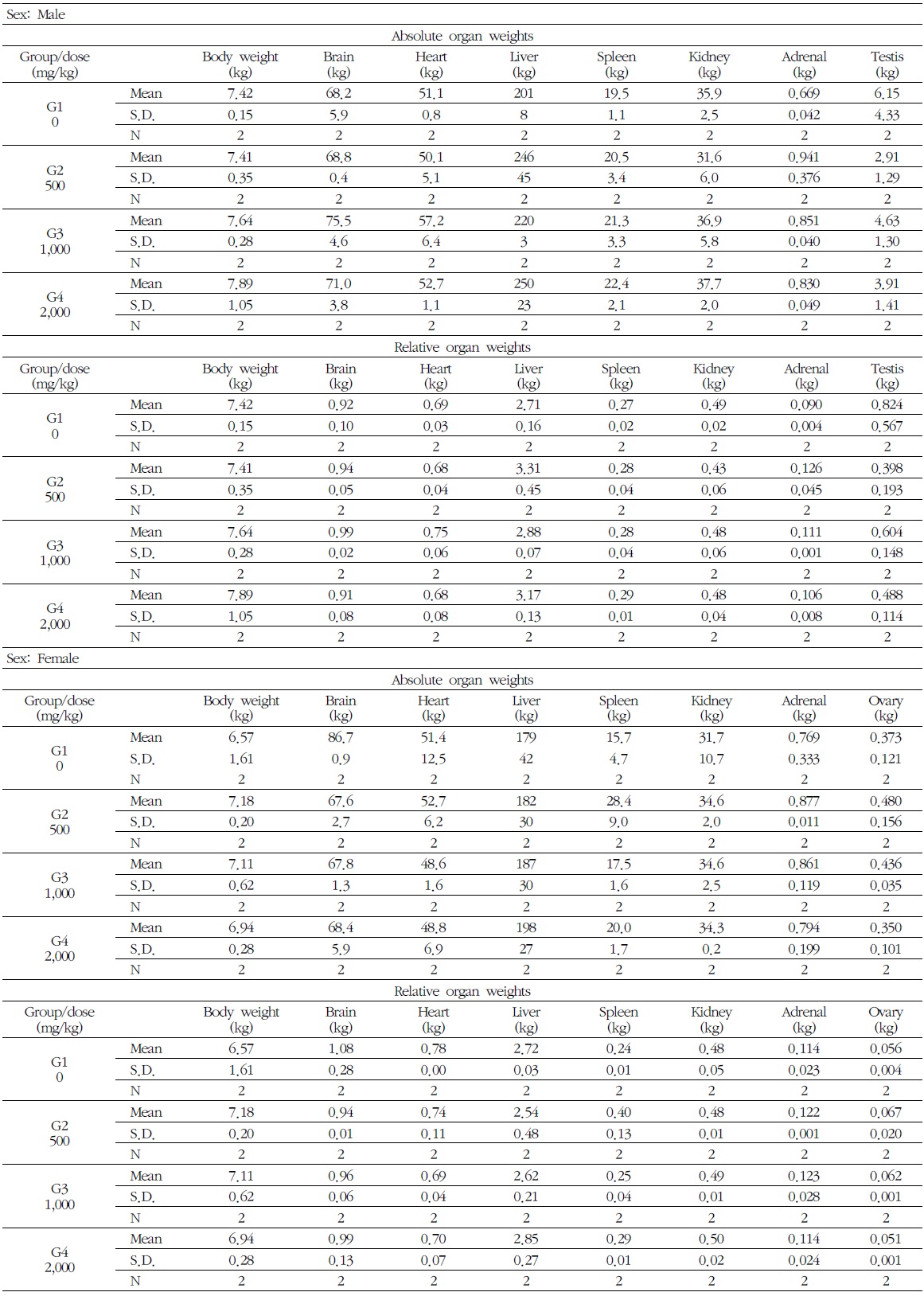
7) 장기중량
암수 시험물질 투여군에서 모두에서 시험물질에 의한 영향으로 판단되는 결과는 없었다. 시험물질 투여군에서 장기의 습중량과 상대중량의 경미한 변화가 관찰되었으나 용량증가에 따른 일정한 증가 경향은 관찰되지 않았으므로, 독성학적 의미는 없다고 사료된다(Table 7).
8) 육안적 부검소견
부검 시, 암수 시험물질 투여군에서 시험물질에 의한 영향으로 판단되는 소견은 보이지 않았다(Table 8).
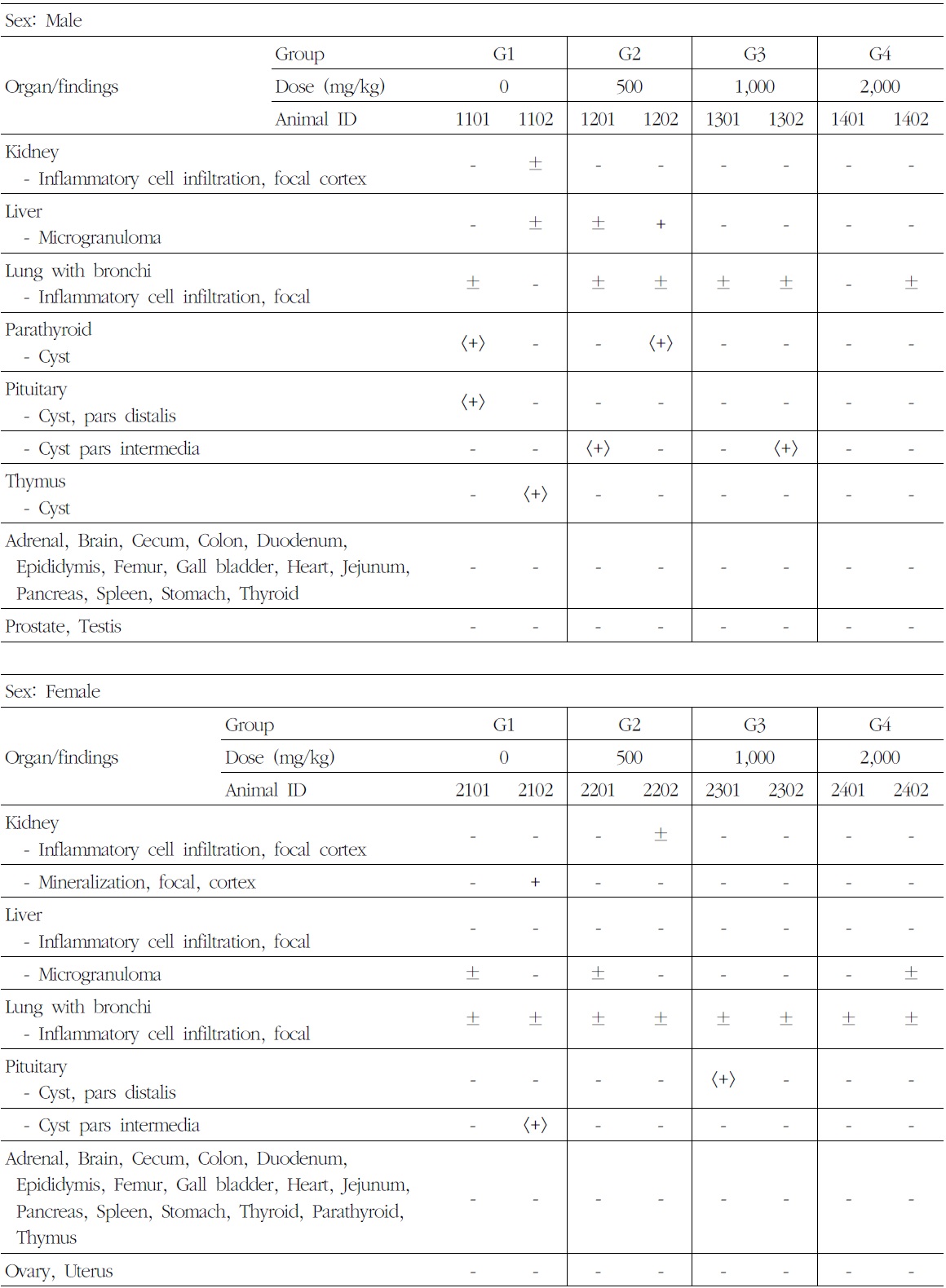
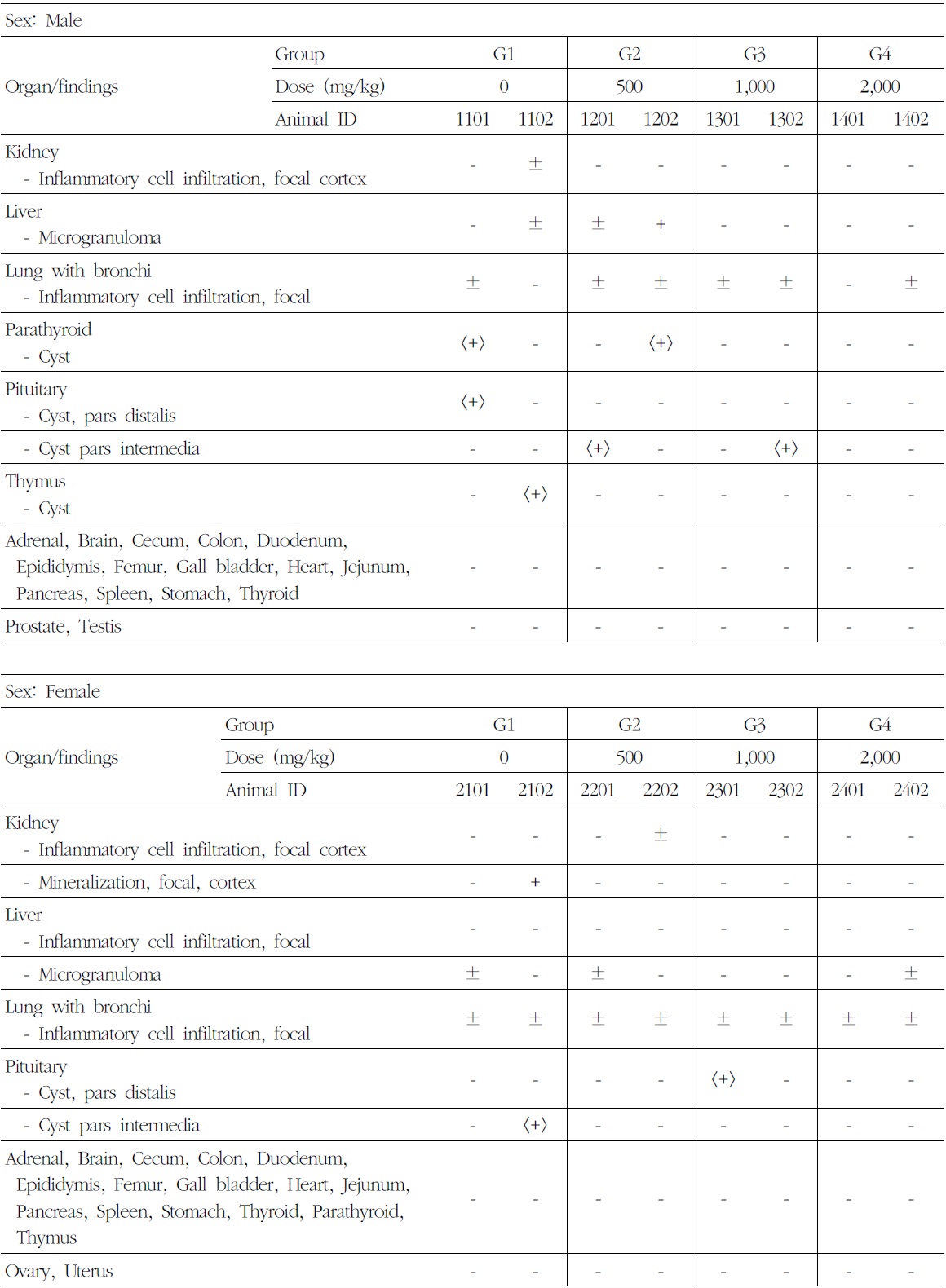
9) 조직병리학적 검사
암수 시험물질 투여군에서 시험물질 투여에 의한 영향으로 판단되는 병리 변화는 관찰되지 않았다. 암수 시험물질 투여군에서 신장피질의 국소성 염증세포침윤(inflammatory cell infiltration),
[Table 7.] Absolute & Relative Organ Weights in Male and Female Beagle Dogs
Absolute & Relative Organ Weights in Male and Female Beagle Dogs
[Table 8.] Necropsy Findings of 4-Weeks Repeated Oral Dose Determinating Test in Beagle Dogs
Necropsy Findings of 4-Weeks Repeated Oral Dose Determinating Test in Beagle Dogs
간의 국소성 염증세포침윤 및 미세육아종(microgranuloma), 폐 및 기관지의 국소성 염증세포침윤, 부갑상선의 낭(cyst), 뇌하수체 원위부 및 중간부의 낭(cyst) 등 소견이 산발적으로 관찰되었다. 이러한 관찰 소견은 모두 자연발생성으로 비글견에서 흔히 관찰되는 병변으로 우발적 또는 산발적으로 분포하므로 독성학적인 의미는 없다고 사료된다(Table 9).
치매의 원인 질환으로 가장 많은 비율을 차지하는 AD는 퇴행성 신경질환으로 현재까지 AD의 명확한 원인과 치료약물은 없는 실정이다21). 이에 본 연구팀은 보건복지부 한의약선도기술개발사업의 지원을 받아 치매치료 한방신약 ACM 개발 연구를 진행하였다.
본 연구에 사용된 ACM은 聰明湯에 巴戟天과 山査肉을 가한 처방으로, BACE 효소활성과
본 연구에서는 일반 독성 시험에 널리 이용되는 비설치류 동물인 비글견을 대상으로 단회 용량증가 경구투여 독성시험과 4주 반복 경구투여 용량결정시험을 진행하여 ACM의 안전성을 평가하고, 13주 반복투여 독성시험에서 용량설정의 근거자료를 마련하고자 하였다.
단회 용량증가 경구투여 독성시험에서 군 구성은 대조군과 시험물질 투여군 2군으로 하였고 암수 각각 대조군에 1마리, 시험물질 투여군에 2마리씩 배정하였다. 시험물질은 3일 간격으로 1,000, 2,000, 5000 mg/kg의 순서로 용량을 증가시켜 투여하였다. 최종투여 후 14일간 임상증상 및 체중변화를 관찰하였으며, 14일 후 최종 부검을 통하여 주요 장기에 대한 육안 소견을 관찰을 실시하였다. 시험기간 중 시험물질 투여로 인한 사망이 발생하지 않았으며, 시험물질 투여와 관련있다고 판단되는 체중변화 및 부검 시 이상소견이 관찰되지 않았다. 임상 증상으로 2,000 mg/kg 투여 후에는 수컷 1례에서 30분 이내에 약간의 구토(vomiting) 증상이 관찰되고, 5,000 mg/kg 투여 후에는 암컷 2례와 수컷 1례에서 30분 이내에 구토 증상이 관찰되었으며 암컷의 1례에서는 약 1시간 후에도 구토 증상이 관찰되었으나, 상기 증상은 일시적인 반응으로 독성반응이 아닌 것으로 사료된다. OECD 시험물질의 급성독성시험에 대한 guideline24)에서는 시험 시 2,000 mg/kg을 한계용량으로 추천한다. 본 시험 결과, 비글견의 ACM에 대한 암수 비글견의 최대내성용량(MTD)는 이보다 높은 5,000 mg/kg을 상회하는 것으로 판단되므로, ACM은 비교적 안전할 것으로 사료된다.
4주 반복 경구투여 용량결정 시험에서는 ACM을
[Table 9.] Summary of Histopathological Findings
Summary of Histopathological Findings
4주간 반복 경구 투여하여 얻어진 결과를 바탕으로 13주 반복 투여 독성시험에서 용량설정의 근거자료를 마련하고자 하였다. 단회 투여 용량증가 독성시험에서 2,000 mg/kg의 용량에서 경미한 구토증상이 관찰되었고, 본 시험은 반복투여인 것을 고려하여, 시험물질 2,000 mg/kg을 고용량으로 설정하고 공비 2를 적용하여 500, 1,000 mg/kg를 각각 저용량, 중용량으로 설정하였다. 암수 각각 군당 2마리씩 배정하였고 4주간 시험물질을 경구 투여하였다. 관찰기간동안 일반증상관찰, 체중측정, 사료섭취량 측정을 실시하였고, 투여 전과 투여 4 후에 혈액학 및 혈액생화학적 검사, 뇨검사를 실시하였다. 관찰기간 종료 후 장기 중량을 측정, 부검 시 육안적 검사 및 조직병리학적 검사를 시행하였다. 시험기간 동안 모든 시험물질 투여군에서 사망한 동물은 발생하지 않았다. 시험물질 투여 때문인 것으로 판단되는 체중변화, 사료섭취량 변화도 관찰되지 않았다. 투여기간 동안 암수 시험물질 투여군에서 특히 1,000 mg/kg 및 2,000 mg/kg 투여군에서는 지속적으로 약물혼입변(compoundcolored stool)이 관찰되었지만, 시험물질로 인한 착색변이며 독성반응은 아닌 것으로 사료된다. 그 외 모든 시험 동물에서 시험물질 투여에 의한 영향으로 판단되는 이상증상은 관찰되지 않았다. 뇨검사, 혈액학적 및 혈액생화학적 검사에서도 시험물질의 투여에 의한 변화가 관찰되지 않았으며, 부검육안소견 및 조직병리학적 검사에서도 시험물질의 투여에 의한 영향으로 판단되는 독성변화는 관찰되지 않았다. 이상의 결과로 2,000 mg/kg 용량에서 시험물질 투여에 기인한 독성변화가 관찰되지 않았으므로, 13주 반복투여 독성시험에서도 고용량은 2,000 mg/kg로 저용량은 500 mg/kg로 설정하는 것이 바람직하다고 판단된다.
비글견을 이용한 ACM의 단회 용량증가 경구투여 독성시험의 결과, 모든 시험물질 투여군에서 사망례는 관찰되지 않았고, 2,000, 5,000 mg/kg 투여군에서 경미한 구토증상이 관찰되었다. 체중 및 부검 결과에서 시험물질의 투여에 의한 영향이 관찰되지 않았다. 따라서 비글견에 대한 ACM의 최대내성용량(MTD)은 5,000 mg/kg을 상회하는 것으로 사료된다.
4주 반복 경구 투여 용량 결정 시험에서 시험기간 중 사망동물은 발생하지 않았으며, 수컷 500 mg/kg 투여군에서는 간혹, 1,000, 2,000 mg/kg 투여군에서는 지속적으로 약물혼입변이 관찰되었으나, 시험물질 투여에 의한 영향으로 판단되는 이상증상은 관찰되지 않았다. 체중, 사료섭취량, 뇨검사, 혈액학적, 혈액생화학적 검사, 부검 및 조직병리학적 검사에서도 시험물질에 의한 영향으로 판단되는 병리변화는 관찰되지 않았다. 따라서 13주 반복투여 독성시험에서도 고용량은 2,000 mg/kg 저용량은 500 mg/kg으로 설정하는 것이 바람직하다고 사료된다.