본 총설에서는 이원계 티타늄 합금 스크랩을 재활용하기 위해 수소 플라즈마 아크 용해를 이용하여 잉곳을 제조하고, 수소화-탈수소화법과 고상탈산 공정을 통해 저산소 합금 분말을 제조하는 기술에 대하여 소개하고자 한다. 이에 더해, 이원계 티타늄 합금 스크랩을 이용하여 고용상 서메트용 탄화물 분말을 제조하는 응용 분야에 대해서도 소개하고자 한다. 이원계 티타늄 합금 스크랩은 수소 플라즈마 아크 용해를 통해 건전한 잉곳의 제조가 가능함을 확인하였고, 최종적으로 제조된 티타늄 합금 분말의 산소함량은 1,000 ppm 이하였으며, 이를 고용상 서메트용 탄화물 분말의 제조에 응용이 가능함을 확인하였다.
국내의 티타늄 산업에서 티타늄 원재료는 90% 이상 수입에 의존하고 있으며 최근 4년 동안 정광을 포함한 티타늄의 수입량은 크게 증가하고 있다. 한국무역통계에 따르면 정광을 포함한 티타늄 수입량은 2009년 약 243,000 ton에서 2012년 약 274,000 ton으로 증가하였다. 다만 2012년부터 국내의 티타늄 생산이 본격화되면서 2011년에 비해 그 수입량은 감소하였다. 이에 반해, 티타늄의 수입단가($/kg)는 2010년 $2.3/kg에서 2011년 $3.4/kg, 2012년 $4.0/kg로 3년 동안 약 74%로 가파르게 증가하고 있다[1]. 이는 전 세계적으로 우주?항공분야 및 의료용 티타늄의 수요가 크게 늘어나면서 티타늄 원재료의 가격 또한 상승하였기 때문으로 판단된다.
티타늄은 경량금속으로 고비강도와 내식성이 매우 뛰어난 신소재로 알려져 있다[2,3]. 그러나 티타늄이 갖는 우수한 성질에도 불구하고 티타늄의 제조공정이 복잡하고 장시간이 소요되어 제조원가가 타 구조용 재료에 비해 매우 고가이다. Norgate et al.[4]의 연구에 따르면 티타늄 1 kg을 생산하는데 소요되는 에너지는 361 MJ로 보고하였다. 이는 1 kg의 알루미늄(211 MJ), 철강(23 MJ)보다 더 많은 에너지가 소요되는 것을 알 수 있다. 또한, 고융점?고반응성?난가공성 등의 단점이 있어서 외국의 경우 티타늄 및 티타늄 합금 스크랩의 재활용 기술 개발에 많은 노력을 기울이고 있다[5,6]. Zheng et al.[7]의 연구에서는 티타늄 화합물 스크랩을 이용한 염화티타늄의 회수 공정을 개발하였다. 이와 더불어 티타늄 스크랩의 재용해 기술에 대한 연구가 많이 진행되었고, 특히 티타늄의 용해 중 고반응성으로 인해 전자빔 용해법, 진공 유도 용해법, 플라즈마 아크 용해법 등과 같이 진공 및 불활성 가스 분위기에서의 용해 연구가 활발히 진행되고 있다[8,9]. 국내의 경우 한국지질자원연구원에서 순 티타늄 스크랩의 정련 및 봉상형 치과용 티타늄 스크랩을 이용해 Ti-6Al-4V 합금 제조 연구를 진행한 바 있다[10,11]. 한국생산기술연구원에서는 순 티타늄 스크랩을 이용하여 분말을 제조하였지만 분말에 함유된 산소함량이 높아 고부가가치 원재료로써 활용은 미비한 실정이다[12]. 이와 같이, 순 티타늄 스크랩의 재활용에 관한 연구는 많이 진행되었지만, 티타늄 합금 스크랩의 재활용에 있어서는 Ti-6Al-4V를 제외한 다른 티타늄 합금의 경우 재활용 연구가 보고된 바 없다. 국내의 경우 산업에서의 순 티타늄 및 티타늄 합금 스크랩의 재활용 기술은 거의 전무한 실정으로, 한국무역협회의 자료에 따르면 2011년 국내의 티타늄 산업에서 발생된 티타늄 스크랩의 90% 이상인 2,336 ton이 해외로 그대로 수출되고 있다. 또한 2011년 국내 티타늄 스크랩의 주요 수출국은 일본과 미국으로 약 80% 이상이 수출되어 낮은 가격으로 수출된 후, 고부가가치의 고순도 금속이나 가공부품으로 재수입되는 악순환이 발생하고 있다.
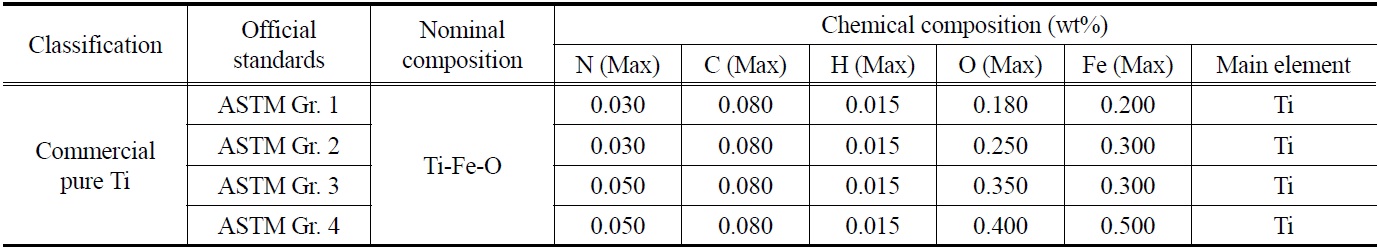
한편 티타늄 스크랩의 재활용에 있어서 가장 큰 문제점은 가공 중 발생하는 가스 및 금속 불순물의 오염으로 이러한 불순물은 티타늄의 물성에 큰 영향을 끼치게 된다. 특히 티타늄의 기계적 가공 중 발생하는 열화현상으로 인해 스크랩 내 산소함량이 크게 증가하게 되는데, 이러한 산소는 티타늄의 물성에 가장 큰 영향을 끼치게 된다[2,3]. 산소는 티타늄 기지내에 최대 약 33 at%까지 침입형으로 고용되며, 공업용 티타늄(commercial purity, CP)의 분류에 기준이 되는 합금원소이다. 티타늄 내 고용된 산소는 부식저항에는 영향을 미치지 않으면서 격자를 강화시키는 고용강화 합금 원소이지만, 산소의 농도가 과다하면 저온에서의 쌍정변형을 억제시킴으로써 충격저항을 급격히 감소시켜 취성?연성 천이온도를 증가시킨다고 알려져 있다. Table 1에 순 티타늄의 미국재료시험학회 규격표를 나타내었다. 표에서도 알 수 있듯이 티타늄 내 타 원소보다도 산소와 금속 불순물 중에서는 철의 함량을 규제하는 것을 알 수 있다.
현재 국내 산업에서 티타늄 스크랩의 재활용은 그 사용처에 있어서 극히 제한적이다. 티타늄 스크랩은 주로 철강 제조시
[Table 1.] Chemical composition of commercial pure Ti in ASTM specifications
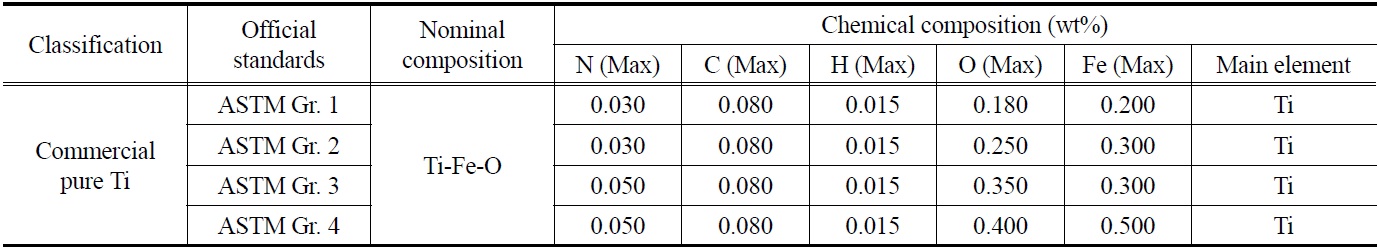
Chemical composition of commercial pure Ti in ASTM specifications
용해로 내 탈산제로써 이용되고 있다. 또한 순 티타늄 스크랩을 이용한 저품위 분말을 제조하여 사용되고 있다. 이러한 이유는 재활용된 티타늄의 소재 내 정확한 순도 및 물성을 보장할 수 없기 때문이다. 티타늄의 재활용에 있어서 원재료로써 그 순도와 물성을 정확히 분석하여 최종 제품에 적용할 수 있어야 한다. 이러한 이유로 Lu et al.[13]의 연구에서 재용해된 티타늄 스크랩의 용도로는 최종 제품의 제조보다는 진공 아크 재용해(vacuum arc remelting, VAR)용 소모성 전극으로의 제조가 유리한 것으로 보고하였다. 하지만 이러한 경우 중간 제품으로 제조되기 때문에 소재의 고부가가치를 창출할 수 없어 최종 제품으로 제조되기 위해서는 스크랩의 고순도화 및 고기능화가 선행되어야 할 것이다.
본 총설에서는 티타늄 합금 스크랩의 재활용을 위해 먼저 고온 용해법을 통해 스크랩 내 금속불순물을 제거한 후 글로 방전 질량 분석기(glow discharge mass spectrometry, GDMS)를 이용하여 극미량 불순물을 분석하여 순도를 평가하고, 이러한 스크랩을 이용해 저산소 고품위 분말을 제조한 후 응용 기술로써 복합 탄질화물에 적용하는 일련의 연구에 대해 살펴보고자 한다.
티타늄 스크랩의 재활용을 위해서는 스크랩 내 가스 및 금속 불순물을 제어하여 고순도 잉곳을 제조하는 것이 필수적이다. 이렇게 제조된 티타늄 잉곳은 대부분이 VAR용 전극으로 이용되고 있다. 티타늄의 대표적인 가스 불순물에는 산소를 들 수 있다. 이러한 티타늄 스크랩의 재활용에 있어서 산소를 비롯한 가스 불순물의 제거 방법이 많이 연구되었다[5,8]. 하지만 이에 반해 티타늄 스크랩의 금속 불순물의 제거 방법은 순 티타늄 스크랩에만 적용되었을 뿐 티타늄 합금에서는 보고된 바 없다. 티타늄 내 금속 불순물 제거의 대표적인 방법은 고온 용해법을 들 수 있다. 하지만 대표적인 고온 용해 정련법인 전자빔 용해는 고진공 분위기가 필수이며 이에 따른 정련효과는 탁월하지만 합금에 있어서 합금 조성이 깨지는 문제가 야기될 수 있다. 실제로 Ti-6Al-4V 합금과 Ti-4Al과 같은 합금의 전자빔 용해 시 합금 성분인 알루미늄의 조성손실이 수% 발생한다고 보고되었다[14]. 이에 최근에는 고진공이 필요하지 않은 플라즈마 아크 용해법이 많이 쓰이고 있으며 많은 연구진에 의해 저급의 금속을 스퍼터링 타겟용 순도로 정련하는데 성공하였다[15-17]. 또한 플라즈마 아크 용해 시 수소를 첨가하여 더 높은 정련효과를 얻는 것으로 알려져 있다. Elanski et al.[18]의 실험에서 수소를 30% 첨가한 수소+아르곤 분위기에서 철, 크롬, 티타늄, 바나듐, 탄탈륨 등의 금속을 용해하였을 때 일반 아르곤 플라즈마 용해에 비해 훨씬 높은 정련효과를 나타낸다고 보고하였다. 수소 첨가 플라즈마 아크 용해는 고진공 분위기에서 행해지는 전자빔 용해에 비해 정련 효과가 저감되는 것을 수소 첨가로 보완할 수 있으며, 또한 용해 중 챔버 내 압력을 조절할 수 있으므로 합금 성분의 손실을 억제할 수 있는 장점이 있다. 티타늄 이원계 합금 중 Ti-Ni, Ti-Mo, Ti-Al 합금 스크랩의 재활용을 위하여 합금 성분의 손실을 최대한 억제하면서 정련이 가능한 수소첨가 플라즈마 아크 용해를 이용하여 잉곳을 제조하였다. 이후 수소 플라즈마 용해 전후의 티타늄 합금 내 금속 불순물의 거동을 확인하기 위하여 GDMS (Autoconcept GD90, MSI Ltd.)를 이용하여 순도를 평가하였다.
티타늄 합금 스크랩의 재활용에 있어서 재용해 기술뿐만 아니라 최근 분말화에 의한 분말야금법에 대한 활발한 연구가 진행되고 있으며, 그 중 수소화-탈수소화법(hydrogenationdehydrogenation, HDH)이 가장 경제적인 티타늄 분말의 제조 방법으로 알려져 있다[19,20]. 티타늄은 수소의 고용한도가 크고 동시에 수소화합물을 형성하기 때문에 수소화-탈수소화 과정을 거쳐 쉽게 분말화가 가능하다[21]. 하지만 티타늄의 분말화 과정에서 티타늄 내 주요 불순물인 산소와의 고반응성으로 인한 산소함량 증가가 불가피한 실정이다. 이러한 이유로 티타늄의 분말화와 더불어 탈산에 관한 연구가 활발히 진행되고 있는데, 이것은 티타늄 분말의 소결체 제조 특성을 향상시키기 위하여 저산소 티타늄 분말이 요구되기 때문이다. 이러한 연구는 순 티타늄 및 Ti-6Al-4V 합금에만 진행되었을 뿐, 다른 티타늄 합금 스크랩을 재활용하여 저산소 티타늄 합금의 분말 제조에 관한 연구는 보고된 바가 없었다.
따라서 본 논문에서는 이원계 β-티타늄 합금인 Ti-Mo 및 Ti-V 합금 스크랩으로부터 HDH법을 이용하여 합금 분말을 제조하고 또한 산소 저감을 위해 고상탈산법(deoxidation in solid state, DOSS)을 적용하여 저산소 티타늄 합금 분말을 제조하는 분야에 대하여 보고하고자 한다. 또한 분말화 및 산소 저감에 있어서 순 티타늄과의 차이점을 확인하기 위하여 순 티타늄 스크랩으로부터 같은 공정에 의해 제조된 저산소 분말의 특성 비교도 살펴보고자 한다.
현재 절삭공구 시장은 WC-Co 초경재료가 뛰어난 공구 특성을 바탕으로 세계 공구시장의 80% 이상을 점유하고 있다. 하지만, WC-Co 초경재료는 재료를 구성하고 있는 텅스텐과 코발트 자원의 산출이 일부 국가에 한정되어 있어 장기적으로 소재의 전략화 및 독점화의 위험성이 크다는 점에서 대체재 개발의 필요성이 대두되었다[22-26]. 이런 이유로 개발되어온 여러 재료 중 가격 및 자원 분포 면에서 텅스텐, 코발트 대비 티타늄, 니켈의 유리함과 더불어 TiC의 고경도 특성으로 TiC-Ni 서메트는 WC-Co 초경재료의 대체재로써 가장 큰 가능성을 인정받고 있다. 한편, TiC-Ni 서메트는 고경도 특성을 갖는다는 장점 이외에 WC-Co 초경재료에 비해 인성이 낮아 절삭공구로 사용 시 수명이 낮다는 단점이 있다. 이러한 단점을 보완하기 위해 개발되어온 재료가 고용상 서메트이며 이 고용상 서메트는 기계적합금화 방법을 통해 제조하는 것이 일반적이다[27-30]. 본 논문에서는 티타늄 합금 스크랩의 응용기술로써 저렴한 티타늄 합금 스크랩을 원재료로 고용상 서메트용 탄화물 분말을 제조하는 기술에 대하여 살펴보고자 한다.
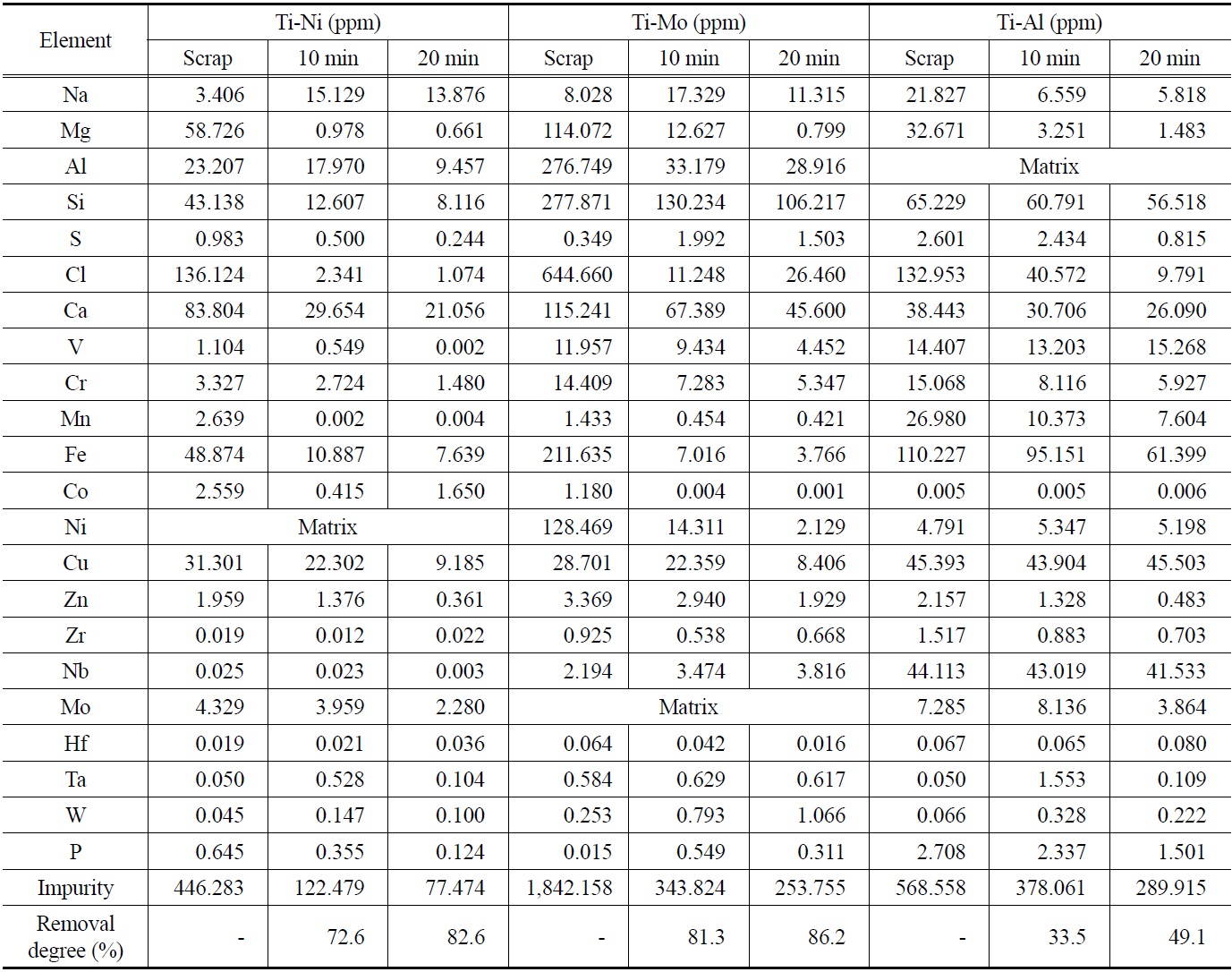
티타늄 합금 스크랩의 용해 시간에 따른 합금 내 금속 불순물의 농도 변화를 GDMS에 의해 분석하였고 그 결과를 Table 2에 나타내었다. GDMS를 이용한 극미량 불순물 분석에 있어서 지금까지 순금속을 대상으로는 많이 보고되었지만, 합금 내 극미량 불순물 분석에 대해서는 아직 보고된 바 없다. 그 이유로는 GDMS 분석 시 합금 원소의 증가에 따라서 다량의 간섭 피크가 발생하므로 합금 내 극미량 불순물의 정확한 해석이 쉽지 않기 때문이다. 이에 본 GDMS 분석에서는 티타늄과 합금 원소들을 매트릭스로 선정하여 합금 원소로 인해 발생한 간섭 피크들을 배제함으로써 극미량 불순물을 평가하였다.
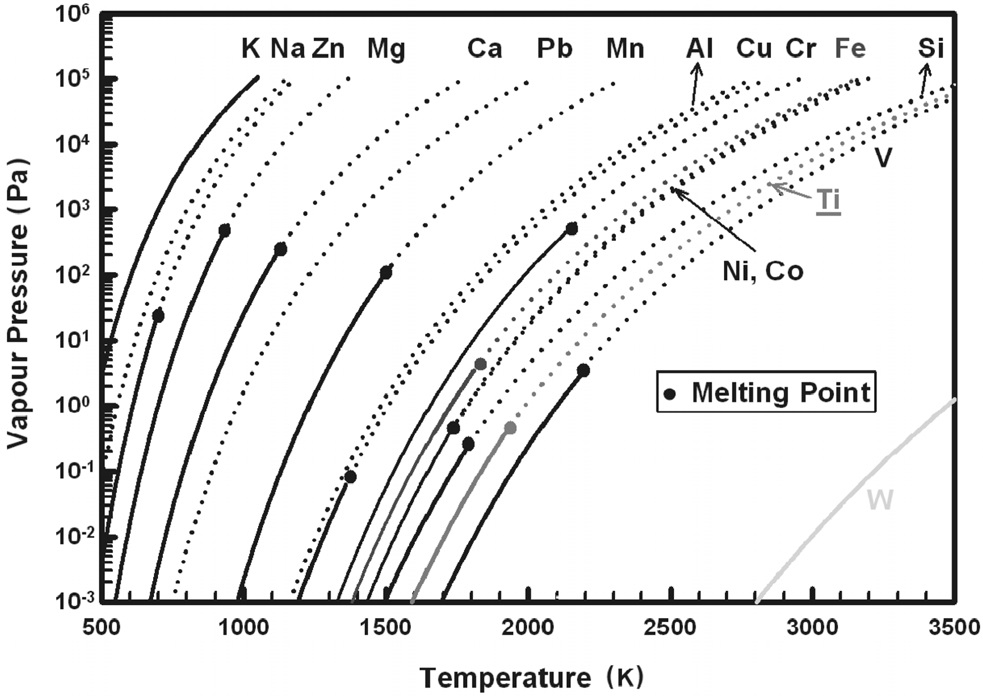
원재료인 티타늄 합금 스크랩 내 불순물의 농도는 Ti-Ni 합금이 446 ppm, Ti-Mo 합금이 1,842 ppm, 그리고 Ti-Al 합금의 경우 568 ppm으로 확인되었다. 합금 스크랩 내 주요 불순물은 염소, 철, 알루미늄, 마그네슘, 실리콘 등이었다. 수소가 20% 첨가된 플라즈마 아크 용해에 의해 10분간 정련한 잉곳 내 불순물들은 상당히 제거되었고, Ti-Ni 합금의 경우 122 ppm, Ti-Mo 합금은 344 ppm, 그리고 Ti-Al 합금은 378 ppm으로 감소됨을 확인하였다. 임의의 금속이 다른 금속과 분리될 수 있는 가장 중요한 성질 중 하나는 휘발성이다[31]. 정련하고자 하는 금속의 증기압에 비해 불순물의 증기압이 높을 때, 용융부로부터 이러한 불순물들을 선택적으로 증발 제거할 수 있다. 따라서 일반적인 진공 용해의 경우, 금속의 증발속도 및 증발량은 임의의 온도에서 그 금속의 증기압에 비례하게 된다. Figure 1에 티타늄과 기타 금속의 증기압 차이를 나타내었다. 하지만 플라즈마 아크 용해의 경우 주로 대기압 부근에서 용해가 이루어지기 때문에 고진공 용해에 비해 정련효과가 떨어지는데 이를 수소의 첨가로 보완할 수 있다. 이러한 수소 플라즈마 아크 용해의 정련 효과는 다음과 같이 설명되어진다. 수소의 첨가로 인하여 아르곤 가스 단독의 경우보다 높아진 플라즈마 프레임의 열전도도와 열용량에 기인되는 것으로 알려져 있다. 즉 아르곤 플라즈마에 수소를 첨가함으로서 용융 금속 표면에서의 수소 분자가 해리되어 용융 금속 내에서 활성화되고 이러한 수소 원자들의 열전도도 증가에
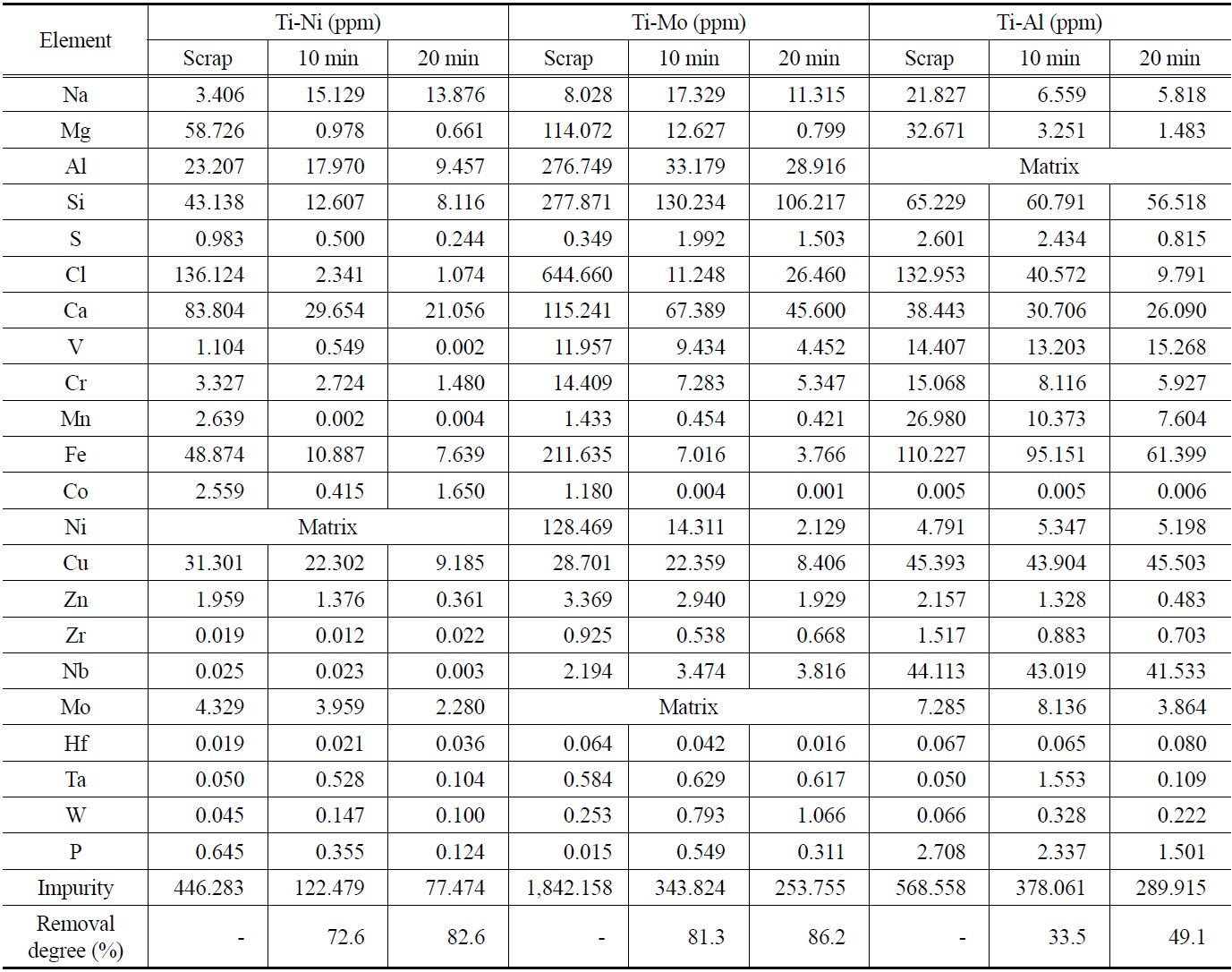
Concentration changes of metallic impurities in the Ti binary alloys before and after hydrogen plasma arc melting and the average removal degrees of the impurities
의해 용융금속의 표면 및 내부 온도 증가로 이어져 정련효과를 높이는 것으로 판단된다. 실제로, 이전의 연구에서 아르곤
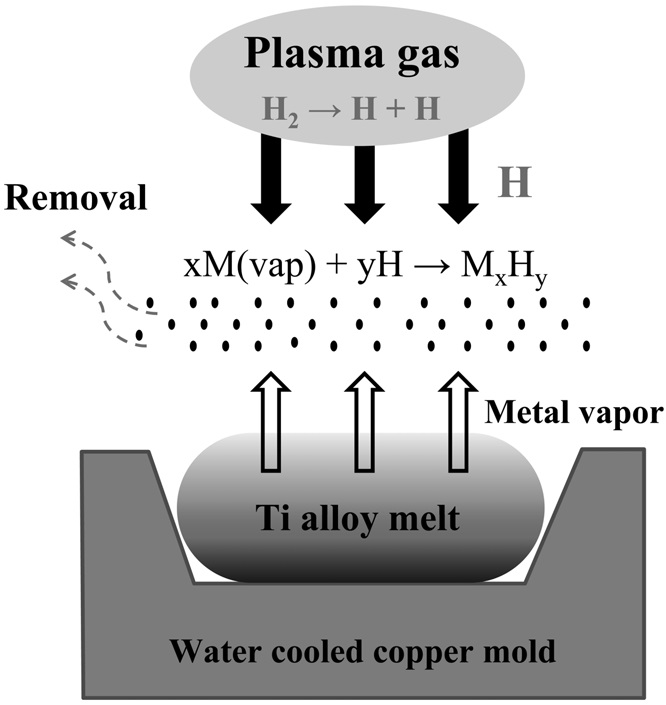
플라즈마와 10%의 수소가 첨가된 플라즈마를 동일한 전력을 투입하여 금속을 용해하였을 때 수소 플라즈마에서 약 370 K의 온도 상승이 있는 것을 확인하였다[32]. 또한, 첨가된 수소 원자가 증발된 금속(Mvap)의 캐리어(Mx-Hy)로 작용하여 비금속 및 금속 불순물 제거의 매개체로써 증발을 촉진하게 된다. Figure 2에 아르곤 플라즈마 용해 시 수소 첨가에 의한 정련 효과 상승에 관한 모식도를 나타내었다. 이후 Ar-20%H2 플라즈마 분위기에서 20분간 용해된 각각의 합금 내 불순물 제거율은 82.6, 86.2, 49.1%로 확인되었다. 또한 무게손실이 1% 미만으로 합금의 조성 성분의 손실은 거의 없는 것으로 확인되었다. 이러한 결과로부터 각각의 합금 모두 수소 플라즈마 아크 용해를 통해 스크랩의 재활용이 가능함을 보고하였다. 다만 Ti-Al 합금의 경우 합금 성분인 알루미늄의 특성으로 인해 정련효과가 다른 합금에 비해 떨어지는 것으로 보고되었다.
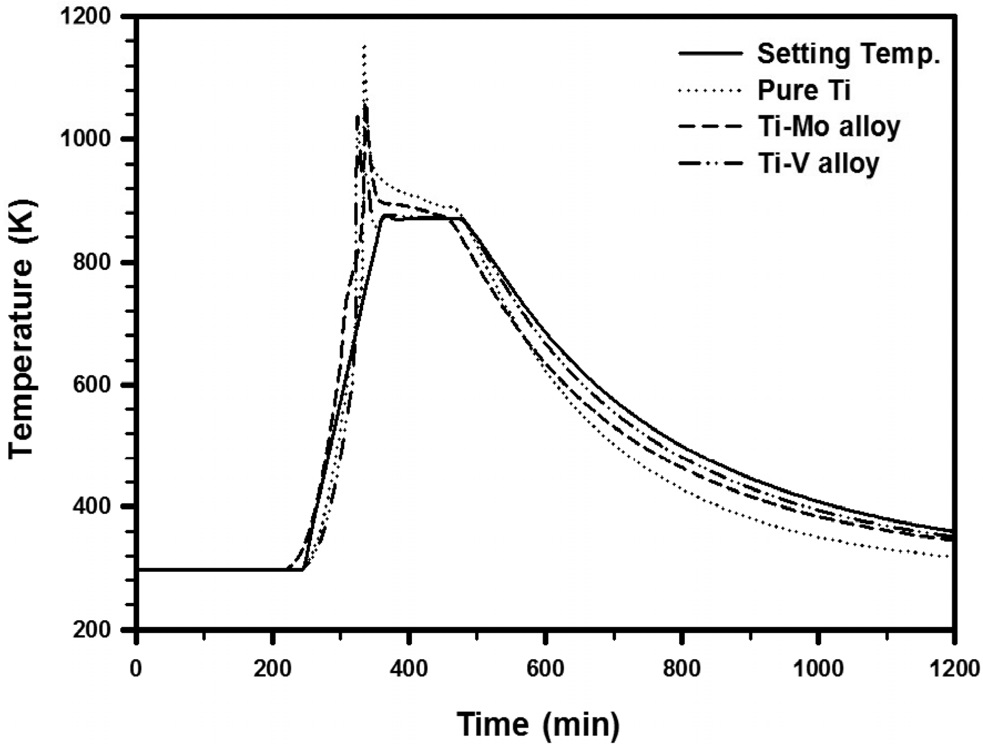
일반적으로 순 티타늄의 수소화 반응은 약 450~600 ℃에서 일어나는 것으로 알려져 있다[3]. 하지만 이러한 반응온도는 시편의 부피 및 표면 상태에 따라 달라질 수 있다. 본 실험에서 사용되는 시편들은 예비실험을 통해 550 ℃ 미만에서 수소화 반응이 완벽하지 않아서 분말의 제조가 어려운 것을 확인하였다. 이에 반해 650 ℃ 이상의 온도에서는 수소가 티타늄 내부에 흡착하지 않고 바로 탈수소가 일어나는 것을 알 수 있었다. 따라서 본 실험에서는 티타늄 합금과 순 티타늄 스크랩의 수소화 반응 설정온도를 600 ℃로 정하였다. Figure 3에 티타늄 합금 및 순 티타늄 스크랩의 수소화 반응 설정온도와 실제 수소화 반응 시 발열온도를 나타내었다. Figure 3의 그래프에서 순 티타늄 스크랩의 경우 수소화 반응 시 발열온도는 880 ℃까지 상승한 것을 확인하였다. 일반적으로 수소가 티타늄에 흡착되어 수소화물을 형성하면 격자팽창을 일으킨다[3,33]. 이때 티타늄에 수소가 흡착되는 반응은 발열반응이며, 역으로 수소를 방출할 때는 흡열반응을 일으킨다. 티타늄과
수소의 반응은 식 (1)과 같은 열화학방정식으로 표시할 수 있다.
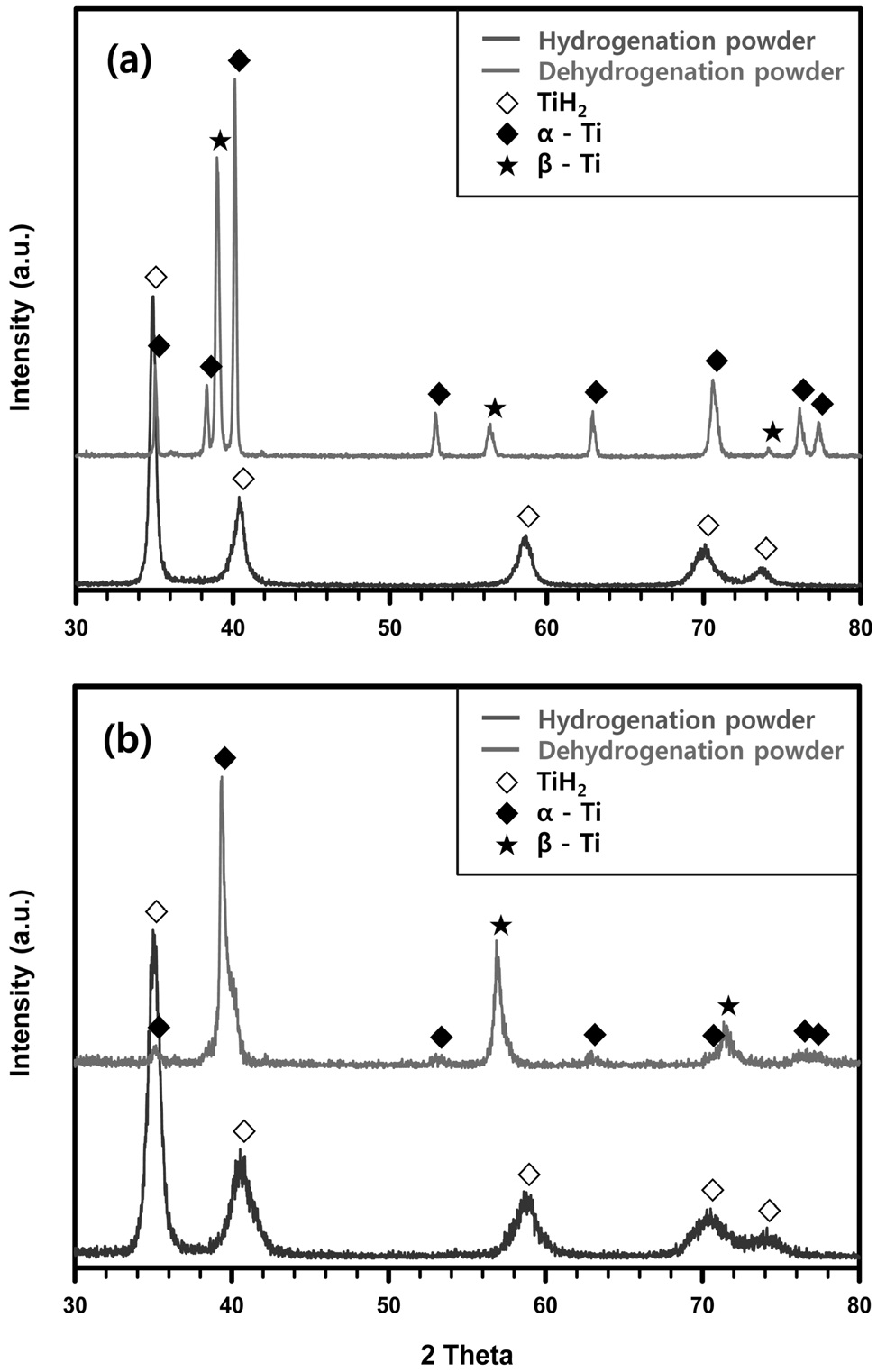
여기서 Q는 반응열을 나타낸다. 반면에 티타늄 합금 스크랩의 수소화 반응 시 발열온도는 순 티타늄보다 낮은 것으로 확인되었다. Ti-Mo 및 Ti-V 합금의 경우 각각 800 ℃ 및 750℃까지 상승하였다. 티타늄 합금이 순 티타늄보다 발열온도가 낮은 것은, Ti-Mo 및 Ti-V 합금의 경우 티타늄 격자 내에 합금 원소가 무게비로 10% 및 20%가 치환되어 있어서 티타늄 수소화물의 형성이 저하되기 때문인 것으로 사료된다. 게다가 β 안정화 원소인 몰리브덴, 바나듐의 첨가에 의해 티타늄의 조밀육방정(hexagonal close packed, HCP) 결정구조가 일부 체심입방정(body centered cubic, BCC) 구조로 상변화 되는데, 이때 BCC 구조의 낮은 원자충진율로 인하여 티타늄 수소화물이 형성되더라도 격자팽창이 적어서 발열온도가 낮아진 것으로 판단된다. Figure 4(a)와 (b)에 Ti-Mo 및 Ti-V 합금 스크랩의 수소화 및 탈수소화 공정에 의한 상변화를 나타내었다. 또한 순 티타늄 스크랩의 수소화 및 탈수소화 공정에 의한 상변화를
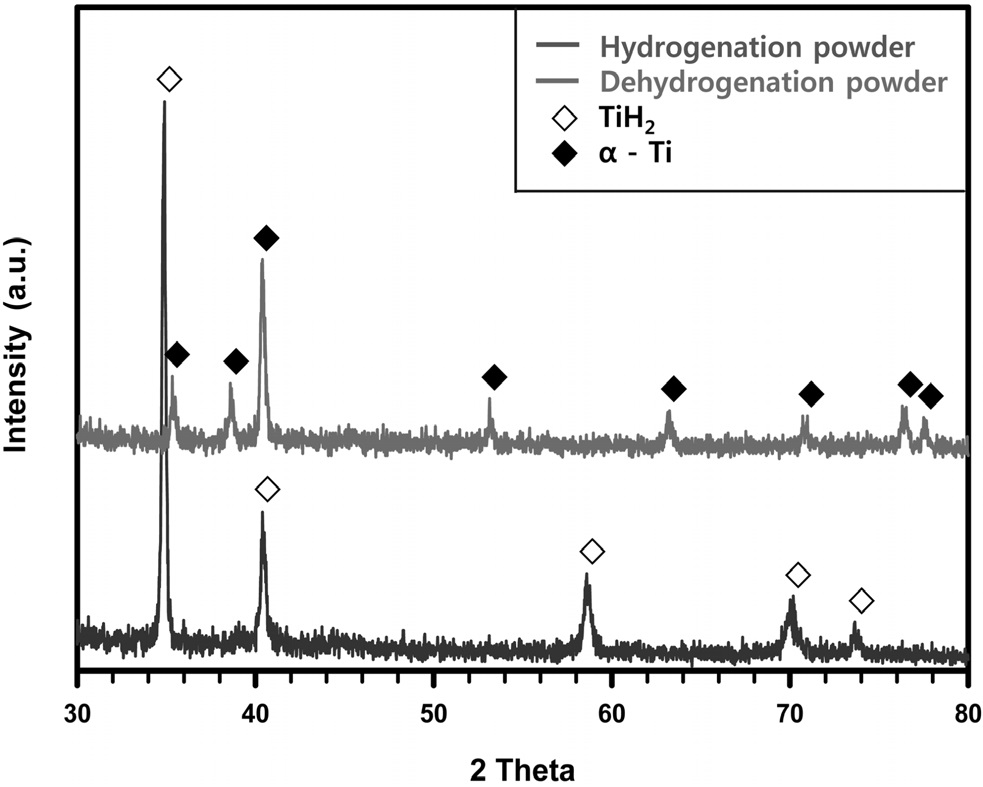
Figure 5에 나타내었다. Ti-Mo 합금의 수소화된 분말은 몰리브덴이 티타늄 격자 내 고용되어 있는 상태로 티타늄 수소화물이 형성된 것으로 확인되었다. Ti-V 합금의 경우도 마찬가지로 바나듐이 고용된 티타늄 합금 수소화물이 형성되었다. 이후 탈수소화된 Ti-Mo와 Ti-V 합금 분말은 수소가 방출되어 α-티타늄 상과 β-티타늄 상이 혼재되어 있는 것을 확인하였다. Figure 5에 나타나듯이 순 티타늄의 경우 수소화 반응이 끝난 분말에서는 TiH2 피크만 관찰되어 완벽한 수소화가 이루어진 것을 확인하였다. 이 순 티타늄 분말을 탈수소화를 진행한 후 얻어진 분말에서는 모두 α-티타늄 상이 관찰되었다. 이로써 Ti-Mo와 Ti-V 합금 스크랩의 HDH 공정을 통해 건전한 분말의 제조가 가능한 것을 확인하였다. 게다가 분말 제조 시 합금원소가 석출되지 않고 완전히 고용된 합금 분말을 제조가 가능함을 확인하였다. 일례로 시판중인 동일 조성의 티타늄 이원계 합금 분말의 경우(아메리칸 엘레멘트-미국, 99.9%, 150 μm) 순 티타늄 또는 합금 원소가 석출되어 있어서 완전한 합금 분말이 아님을 확인할 수 있었다. 따라서 HDH 공정에 따른 합금 분말의 제조 시 합금원소가 완전히 고용되거나 혹은 단일상을 형성하는 조성을 선택하는 것이 중요하다.
산소는 티타늄 분말에 있어서 티타늄 벌크와 마찬가지로 물성에 큰 영향을 미치며 티타늄 분말의 소결 시 산소함량이 높을수록 소결밀도를 저하시킨다[34,35]. 또한 높은 산소함량은 소결체의 취성파괴를 증가시키고, 고온특성을 감소시키게 된다. 이러한 이유로 티타늄 분말의 산소함량을 낮추는 것은 소결체의 특성 향상에 기여하게 된다. Table 3에 Ti-Mo와 Ti-V
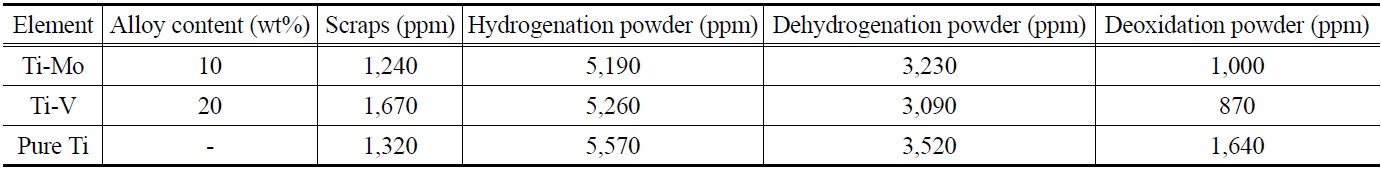
Variation of oxygen concentrations in the Ti alloys and the pure Ti during the HDH and deoxidation processes
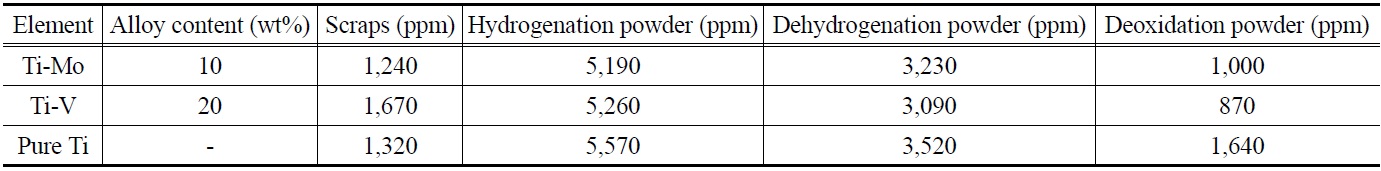
합금과 순 티타늄의 원재료, 수소화, 탈수소화, 그리고 탈산공정에 의해 얻어진 분말의 산소함량을 나타내었다. 먼저 스크랩 원재료의 산소함량은 Ti-Mo는 1,240 ppm, Ti-V는 1,670 ppm이고, 순 티타늄은 1,320 ppm으로 분석되었다. 이후 수소화 공정 후 얻어진 Ti-Mo 및 Ti-V 합금 분말의 산소함량은 각각 5,190 ppm과 5,260 ppm이고, 순 티타늄은 5,570 ppm으로 조사되었다. 일반적으로 티타늄 벌크의 분말화가 진행되면서 수만배 이상 커진 비표면적으로 티타늄 표면에 산화층이 형성되며, 또한 수소화 과정 후 분말의 분쇄 과정에서 외부 산소의 혼입이 발생한 것으로 사료된다. 이후 진공 분위기에서 탈수소를 통해 얻어진 Ti-Mo 및 Ti-V 합금 분말의 산소함량은 각각 3,230 ppm, 3,090 ppm이고, 순 티타늄의 경우 약 3,520 ppm으로 나타났다. 이것은 티타늄 수소화물로 이루어진 분말을 진공 분위기에서 열처리 시 탈수소화가 진행되면서 H2O가 형성되어 탈산이 이루어지기 때문이다. 이러한 탈수소화에 의한 탈산반응은 식 (2)와 같다.
위의 결과에서 나타나듯이 탈수소화가 진행되면서 분말의 산소함량이 2,000 ppm 정도 감소하였지만 여전히 3,000 ppm 이상으로 산소함량이 높았다. 따라서 HDH 공정 후 얻어진각각의 분말들은 고상탈산법에 의해 추가적인 탈산을 진행하였다. 칼슘을 이용한 탈산과정은 Ca (g) + O (in Ti powder) = CaO (s)의 반응식에 의해 이루어진다[36]. Ti-Mo 합금 분말은 탈산 후 산소함량이 1,000 ppm으로, Ti-V 합금 분말은 약 870 ppm으로 감소하였다. 탈산효과는 Ti-Mo와 T-V 합금 분말이 초기 산소함량 대비 각각 약 68% 및 71% 감소한 값이었다. 현재 시판중인 같은 조성의 Ti-Mo, Ti-V 합금 분말의 경우 동일한 입도에서 각각의 산소함량은 약 2,750 ppm, 3,340 ppm으로 측정되었다. 이것은 본 실험에서 제조된 합금 분말이 상용 티타늄 합금 분말보다 산소함량이 상당히 낮다는 것을 의미하며 이에 따른 소결체 특성이 향상될 것으로 판단된다.
반면에 순 티타늄의 경우 탈산이 끝난 분말의 산소함량은 약 1,640 ppm으로 초기 산소함량 대비 약 53% 감소하였다. 티타늄 합금 및 순 티타늄 분말의 탈산 결과로부터 알 수 있듯이 같은 탈산조건에서 순 티타늄 분말이 합금 분말에 비해 탈산효과가 떨어지는 것을 알 수 있다. 일반적으로 칼슘을 이용한 티타늄 내 산소의 탈산은 온도에 따라 산소가 확산을 하면서 표면에서 티타늄 산화층을 형성한다. 표면에 형성된 안정한 티타늄 산화막인 TiO2의 분해는 다음과 같은 단계로 이루어진다. 탈산 온도가 높아짐에 따라 TiO2는 불안정하고 화학적 원자가가 낮은 Ti3O5, Ti2O3 등으로 환원되고, 이후 탈산이 더 진행됨에 따라 원자가가 더욱 낮은 Ti3O, Ti2O 및 TiO로 환원되어 분해될 수 있다[37]. 이때 탈산제인 칼슘의 높은 산소 친화력으로 티타늄 산화층은 분해되어 표면에 칼슘 산화물을 형성하고 이것을 제거함으로써 탈산이 이루어진다. Figure 4에서 확인했듯이 Ti-Mo 및 Ti-V 합금에서는 α 및 β-티타늄이 혼재되어있었다. Song et al.[38]은 티타늄 내 산소의 확산은 β-티타늄이 α-티타늄보다 잘 일어나는 것으로 보고하였다. 이러한 산소의 확산의 차이로 인해 순 티타늄이 티타늄 합금보다 탈산효과가 떨어지는 것으로 판단된다. 게다가, 순 티타늄의 경우 티타늄 원소가 합금 원소인 몰리브덴과 바나듐보다 산소의 친화력이 강하기 때문에 탈산효과가 낮아지는 것으로 판단된다. 결과적으로 β-티타늄 합금인 Ti- Mo 및 Ti-V 합금 스크랩으로부터 HDH법을 이용하여 합금 분말을 제조하였고 칼슘을 이용한 고상탈산법에 의한 추가적인 산소 저감을 통하여 약 1,000 ppm 이하의 저산소 티타늄 합금 분말의 제조가 가능함을 확인하였다.
고용상 서메트용 탄화물 분말을 합성하기 위해 기계적합금화 방법을 사용하였고 티타늄 스크랩과 흑연 분말에 대해 유성 볼밀을 사용하여 아르곤 분위기에서 밀링을 진행하였다. 밀링 후 분말은 열처리를 진행하여 결정화되었으며 이 때 온도는
1,200 ℃, 분위기는 진공이었고 열처리로의 재질은 흑연이었다. 합성된 고용상 탄화물 분말은 고용상 서메트 제조를 위해 사용되었으며 니켈(KENNAMETAL, < 4 μm) 분말과 혼합 후 1,510 ℃에서 1시간 동안 액상소결을 진행하였다. 이 때 분위기는 진공이었고 열처리로의 재질은 흑연이었다.
Figure 6은 합금 스크랩인 Ti-Mo, Ti-V 분말을 원료로 사용하여 합성된 고용상 서메트용 탄화물의 분말 형상을 나타내고 있다. 분말 형상을 통해 마이크론 크기의 입자를 나노 크기 입자들이 응집하여 형성하고 있음을 알 수 있으며 이러한 형상은 기계적 합금화 방법에 의해 분말을 제조할 때 일반적인 모습이다. Figure 7은 합금 스크랩인 Ti-Mo, Ti-V 분말을 원료로 사용하여 합성된 고용상 서메트용 탄화물에 대해 투과전자현미경(transmission electron microscopy, TEM)을 통해 결정립을 관찰한 것으로 위에서 언급한 것처럼 본 연구에서 합성된 탄화물 분말은 나노 크기의 결정립들로 구성되어 있음을 확인할 수 있었다. Figure 8은 기계적합금화 방법을 통해 합성된 고용상 탄화물을 이용하여 TiC-Ni계 서메트를 제조한 후 관찰한 미세조직이다. 본 연구에서 합성된 고용상 탄화물을 사용했을 시(Figure 8(a), (b)) 미세조직은 기존의 서메트(Figure 8(c))와 달리 코어/림 구조가 형성되지 않았음을 알 수 있다. 이런 미세조직의 차이로 인해 기계적 물성에서 고용상 서메트의 경도는 기존 서메트 대비 낮고 파괴인성은 향상될 것으로 예측할 수 있다.
본 실험에서 티타늄 합금 스크랩을 활용하여 고용상 서메트용 탄화물을 합성하는 것이 가능하였고 분말은 나노 크기의
결정립의 응집 형태를 나타내는 것으로 확인되었다. 이 고용상 탄화물을 사용하여 제조된 고용상 서메트의 경우 기존 서메트와 달리 코어/림 구조를 가지지 않아 파괴인성이 향상될 것으로 예상되어 티타늄 합금 스크랩의 응용 가능성을 확인하였다.
그동안 순 티타늄 및 Ti-6Al-4V 합금에만 적용되었던 스크랩의 재활용을 티타늄 이원계 합금 스크랩에 적용하여 스크랩 내 금속 불순물을 제거한 건전한 잉곳 제조가 가능함을 확인하였다. 그리고 티타늄 합금 스크랩의 분말야금으로의 활용으로 저산소 고품위 분말 제조에 관하여 보고하였으며, 또한 티타늄 합금 스크랩의 응용 기술로써 저렴한 티타늄 합금 스크랩을 원재료로 고용상 서메트용 탄화물 분말을 제조하는 기술에 대하여 살펴보았다.
티타늄 이원계 합금 스크랩의 수소 첨가 플라즈마 아크 용해를 통해 금속불순물이 최대 86% 저감된 잉곳을 제조하였다. 이러한 티타늄 합금 잉곳은 VAR 전극으로 활용이 가능하며, GDMS를 이용한 순도분석을 통해 공업용 원재료로써 적합하여 티타늄 합금 원료의 수입대체 효과를 기대할 수 있다. 또한, 티타늄 합금 스크랩으로부터 산소함량이 1,000 ppm 이하의 저산소 고품위 분말을 제조하여 분말야금 분야에 바로 적용할 수 있다. 티타늄 합금 분말을 탄질화물 제조에 활용하여 초경재료 분야의 많은 수요가 기대된다.