In this study, the hydrogen chloride removal using K-based dry sorbents (K2CO3/Al2O3, KEPRI, Korea) was studied with varying the pressure in a fixed bed reactor (15 cm tall bed with 0.5 cm I.d.). Working temperature was 400℃ and feed gas concentration was 750 ppm (HCl vol%, N2 balance). The chloride sorption capacity of sorbent increases with increasing pressure (1, 5, 10, 15 and 20 bar). Also, after forming KCl crystal by reaction with K2CO3 and HCl, owing to the strong bonding energy, sorbent regeneration was practically impossible. Its optical, physical and chemical characterizations were evaluated by SEM, EDAX, BET, TGA and XRD. At 400 ℃ and 20 bar condition, working condition for the dehalogenation process after gasification, K-based dry sorbent showed high HCl sorption capacity and HCl/N2 separation performances comparing with Ca-based and Mg-based dry sorbents.
본 연구에서는 고정층 반응기(높이 15 cm, 내경 0.5 cm)에서 K-계열 건식 흡수제(K2CO3/Al2O3, 한국전력공사 전력연구원)를 이용하여 반응압력 변화에 따른 염화수소 흡수 실험을 수행하였다. 반응온도는 가스화 직후, 필터를 거쳐서 주입되는 것을 가정하여 400 ℃로 설정하였으며, 반응기체 농도는 750 ppm HCl (N2 balance)으로 설정하였다. 반응압력은 1, 5, 10, 15, 20 bar로 증가시켰다. 압력이 증가할수록 K-계열 흡수제의 흡수 성능이 증가하였다. 흡수제를 구성하고 있는 주요 물질인 K2CO3가 HCl 가스와 반응하여 KCl 결정을 형성하였으며, 강한 결합에너지로 인하여 흡수제의 재생이 실질적으로 불가능하였다. 이에 대한 광학적, 물리적, 화학적 특성을 SEM, EDX, BET, TGA, XRD를 이용하여 분석하였다. 400 ℃, 20 bar 조건(가스화 이후 탈할로겐 공정의 온도 및 압력조건)에서 K2CO3 흡수제는 Ca 계열 및 Mg 계열의 흡수제에 비해 높은 HCl 흡수능 및 HCl/N2 분리 거동을 보였다.
석탄가스화 복합발전(Integrated Gasification Combined Cycle, IGCC)의 가스화에서 발생되는 합성가스는 일산화탄소(CO), 수소(H2), 이산화탄소(CO2), 메탄(CH4)과 같은 주요 성분 이외에 질소화합물(NH3, HCN), 유황화합물(H2S), 염소화합물(HCl), 미립자 분진 등의 오염물질이 포함되어 있다. 이러한 오염물질 중 염화수소(hydrogen chloride, HCl)는 질소화합물, 황화합물에 비해 매우 소량으로 함유되어 있으나, 장시간 HCl이 반응기 내에 체류할 경우, 공정 내 가스터빈이나 배관설비의 부식 등 심각한 손상을 일으키게 된다[1-4,9,18].
합성가스 내 오염물질을 제거하는 기술에는 크게 저온습식법과 고온건식법으로 나누어진다. 현재 알려진 오염물질 제거공정에는 장치의 운전이 쉽고 오염물질 제거효율이 높은 저온습식법이 채택되고 있다. 그러나 저온습식법은 합성가스 온도를 상온까지 낮추어 정제한 후 다시 고온으로 만들기 때문에 현열 손실이 발생하게 되고, 석탄가스의 냉각에 의한 타르응축과 정제 후 다량의 폐수가 발생한다. 따라서 이러한 문제점들을 해결하기 위한 폐수처리시설이나 부대시설이 요구되는 단점을 가지고 있다. 고온건식법은 300 ℃ 이상의 고온에서 오염물질의 제거가 가능하기 때문에 열효율을 높일 수 있으며, 설비가 간단하여 습식공정에서 요구되는 폐수 처리나 부대시설에 따른 비용절감 효과도 얻을 수 있다[6].
현재 HCl를 제거하는 고온건식법으로는 활성탄, 알루미나, 알칼리 금속, 알칼리 토금속 등의 고체 입자와의 반응에 의한 방법을 주로 이용하고 있다. 그러나 상기 고체 입자들의 비용은 비교적 고가이며, 따라서 저렴한 비용으로 생산 가능한 입자 개발이 요구되고 있다[7-22]. 현재까지 가장 잘 알려진 HCl제거 공정은 CaO, Ca(OH)2 등을 이용하는 방법이며, 이때의 운전온도는 500 ℃ 이하이다[2-4].
고온 건식 HCl 제거 기술에 대한 연구는 대부분 국외에서 이루어졌다. 최근 들어 국내에서도 고온 건식 HCl 제거용 고체 입자 개발과 HCl 제거 공정개발에 대한 연구가 진행되기 시작하였다[5].
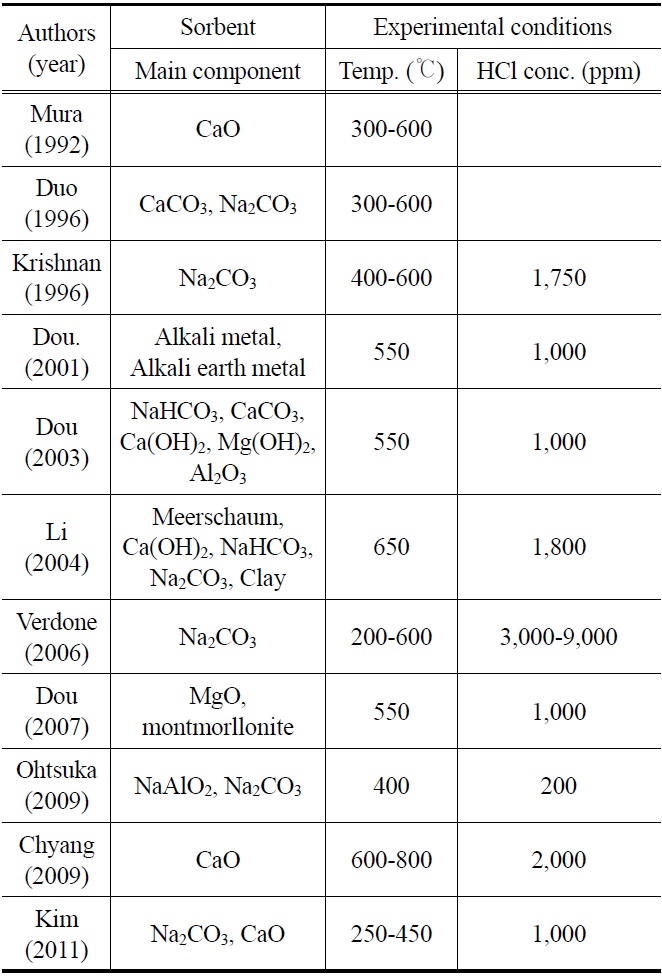
국외의 경우 HCl를 제거하는 방법은 주로 고정층에서 이루어졌다. 알칼리(alkali) 및 알칼리 토금속(alkaline earth metal) 물질을 기반으로 한 고체 입자, 특히 나트륨(sodium) 혹은 칼슘(calcium)기반의 고체 입자는 뛰어난 HCl 제거 효율 때문에 집중적으로 연구가 진행되었다. Chyang et al.[12], Coda et al.[13], Weinell et al.[14], Partanene et al.[15]은 500 ℃ 이상의 온도조건에서 CaO 및 CaCO3 고체 입자를 이용하여 연구를 수행하였다. Dou et al.[16]은 400 ℃의 합성가스 조건에서 Na2CO3입자가 CaCO3입자에 비해 높은 HCl 흡수능을 지님을 보였다. 또한 Na2CO3에서의 HCl 흡수능은 300 ℃나 600 ℃에서 보다 400~500 ℃ 범위에서 더욱 효과적이라는 것을 발견하였다. 또한 Verdone et al.[17]은 Na2CO3 흡수제의 경우, 400~500 ℃의 온도조건에서 최대의 HCl 흡수능을 보임을 보고하였다. Dou et al.[9,18]은 고정층 반응기 적용할 수 있는 Na-, Ca-와 Mg-로 구성된 고체 입자를 개발하였으며, 550 ℃ 실험에서 HCl를 1 ppm 이하로 제거하였다. 이때 사용된 고체 입자는 300~650 ℃의 온도 조건에서 높은 HCl 흡수능을 나타내었다. Chen et al.[19]은 CaO와 CaCO3에 수산화나트륨 용액(NaOH)을 첨가하여 변형시킨 고체 입자를 개발하였다. 450~760 ℃에서 HCl과 반응시키는 실험을 수행하였으며, 수산화나트륨 수용액을 첨가한 고체 입자의 HCl 제거효율이 향상됨을 보고하였다. Li et al.[20]은 해포석(海泡石, meer-schaum), Ca(OH)2, Na2CO3, NaHCO3가 주성분인 고체 입자를 이용하여 HCl를 제거하는 실험을 수행하였다. 550 ℃를 최적 운전조건으로 도출하였으며 흡착 반응은 생성물층 확산(product layer diffusion) 효과보다는 화학반응에 의해 지배를 받는 것으로 평가하였다. 저렴한 고체 입자 개발을 위한 연구의 일환으로 Krishnan et al.[10]은 150 ℃가 넘는 온도에서 Na2CO3로 전환되는 천연탄산염광물(natural carbonate mineral)인 nahcolite를 이용하여 고정층 반응기에서 실험을 수행하였다. 그 결과 400~600 ℃의 온도조건에서 HCl의 농도가 1,750 ppm에서 1 ppm 이하로 감소함을 보였다. Dou et al.[21]은 천연광물(natural mineral)인 montmorillonite (MMt; 30~70 wt%)와 MgO가 주성분인 pellet 형태의 고체 입자를 이용하여 550 ℃에서 HCl를 제거하는 실험을 수행하였다. Ohtsuka et al.[5]은 NaAlO2, Na2CO3가 주요 성분인 고체 입자를 개발하였으며, 400 ℃의 고정층반응기에서 모사합성가스를 이용하여 HCl 제거 실험을 수행하였다. 이때 NaAlO2와 Na2CO3 모두 HCl이 200 ppm에서 1 ppm 이하로 제거되었으며, H2S의 존재 유무에 따라 염소(chlorine) 흡수량이 감소한다는 것을 보여주었다. 또한 NaAlO2가 Na2CO3보다 제거 효율이 우수한 것으로 평가하였다. Kim et al.[22]은 pellet 형태의 Ca 계와 Na 계 고체 입자를 사용하여 반응 온도 250~500 ℃의 고정층 반응기에서 실험을 수행하였다. 그 결과 반응온도가 상승할수록 고체 입자의 흡수능력이 증가하는 것으로 나타났고, Na 계 흡수제가 Ca 계 흡수제보다 HCl 제거 능력이 우수하였다. Table 1에는 최근 국내외의 HCl 제거에 관한 연구동향을 요약하여 나타내었다.
[Table 1.] Summary of previous researches of HCl removal in various fixed beds
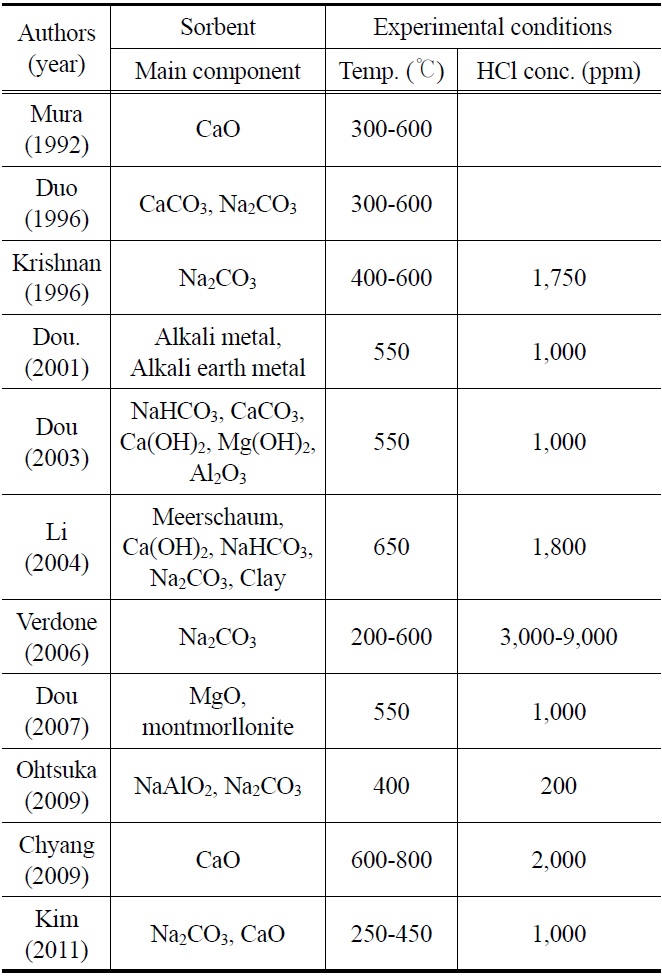
Summary of previous researches of HCl removal in various fixed beds
본 논문에서는 현재 건식 CO2 포집공정에 이용되고 있는 K-계열 건식 흡수제(한국에너지기술연구원, 한국전력공사 전력연구원)를 사용하여 고정층 반응기에서 실험을 수행하였다. 반응압력에 따른 K-계열 건식 흡수제에 대한 HCl 제거 특성과 그에 따른 흡수 능력을 평가하였으며. 또한 입자의 물성분석(SEM, EDAX, BET, TGA, XRD)을 통하여 반응 전과 반응 후를 비교분석하였다.
본 연구에서 사용된 고체 입자는 한국전력연구원으로부터 공급 받았으며, K2CO3가 주성분인 파우더 형태의 건식 흡수제이다. K-계열 흡수제는 분무건조법에 의해 제조되었으며 입자의 형상이 구형이고 입자의 대량생산이 용이한 특징이 있다. K-계열 흡수제의 벌크밀도는 메스실린더를 이용하여 측정하였으며 5회 측정 후 최대값과 최소값을 제외한 3회 측정값의 평균값을 사용하였다. 고체 입자의 평균 입자 크기는 입도분석기(particle size analyzer, S3500, Microtrac)를 이용해 3회 측정한 평균값을 사용하였다. 또한 반응 전과 반응 후 입자의 비표면적, 기공 용적 및 평균 기공 크기에 대한 변화를 알아보기 위해 ASAP 2420 (Micromeritics, USA)을 이용하였다. K-계열 흡수제의 온도에 대한 무게 감소(weight loss)를 알아보기 위해 TA사의 열중량 분석기(TGA, SDT Q-600)를 사용하였다. 실험은 N2 분위기로 25 ℃에서 900 ℃의 온도 범위로 승온하면서 나타나는 K-계열 흡수제의 질량 감소 특성을 확인했다.
K-계열 흡수제의 표면 구조 특성과 반응 전, 후 흡수제의 표면 구조 변화를 알아보기 위해 HITACHI사의 냉각형 전계방사형 주사전자현미경(cold type field emission scanning electron microscope, SEM-4800)을 사용하였다. 또한 HORIBA사의 EDAX (energy-dispersive X-ray spectroscopy, X-max)를 통하여 반응 전 입자의 주요 구성 성분과 반응 후 입자에 대한 구성 성분 변화를 확인하였다. K-계열 흡수제를 구성하고 있는 성분들의 결합 형태를 알아보기 위해 Rigaku사의 X-선 회절분석기(X-ray diffractometer, XRD, D-max 2500PC)를 사용하였다.
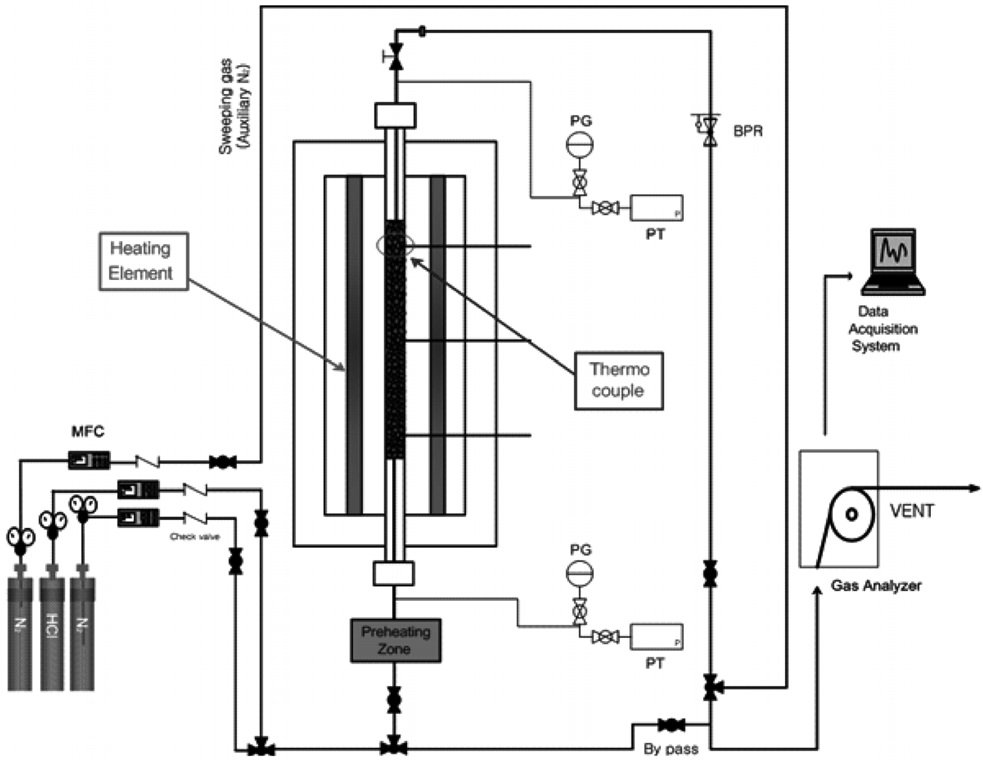
본 연구에 사용된 고정층(fixed bed) 장치의 개략도를 Figure 1에 나타내었다. 고정층 장치는 생성부, 반응부 그리고 검출부로 크게 세부분으로 구성되어 있다.
기체 생성부(gas feeding part)에는 용량과 성질(내부식성 등)이 다른 3대의 MFC (mass flow controller, E5850, Brooks instruments)를 설치하여 반응가스(HCl)의 농도와 반응기의 유입유량을 조절하였다. 반응기체는 N2 (99.99%)에 HCl (1,000 ppm)을 희석시켜 주입하였고, 반응기 하단으로부터 상향 주입(up-flow) 시켜주었다. 또한 반응기체 역류 시, 부식성 기체에 의한 MFC 파손을 방지하기 위해 모든 MFC 후단에 체크밸브(check valve)를 설치하였다.
반응부(reation part)는 내경 0.5 cm, 높이 15 cm인 고정층(fixed bed) 형태의 반응기를 전열로(heater)에 수직으로 설치하였다. 전열로를 이용하여 반응기의 가열 및 온도를 제어하였으며, k-type 열전대(thermocouple)를 반응기의 상, 중, 하단에 설치하여 내부 온도를 파악하였다. 고온 실험시 차가운 기체가 반응기 내부(하단)로 유입되면서 발생하는 부분 냉각을 방지하기 위해, 예열기(pre-heater)를 설치하여 온도 차이를 최소화하였다. 또한 전열로와 예열기에 각각 설치되어 있는 온도조절장치(temperature controller)를 이용하여 반응기 내부온도를 제어하였고, 균일한 온도조건을 유지하도록 하였다. 반응기 압력은 반응기 후단의 BPR (back pressure regulator, DRASTAR)을 이용하여 조절하였으며, 반응기 전단 및 후단의 압력을 확인하기 위해 전자식압력계(electric pressure transmitter)를 설치하였다. 반응기를 기준으로 가스 유입관과 가스배출관(BPR 후단)에 우회(bypass)관을 연결하였고, 각각 밸브를 설치하여 가스의 흐름을 조절하였다.
검출부에는 기체농도측정을 위해 FT-IR 기체분석기(DX-4000, Gasmet, Finland)를 설치하여 반응 전, 후의 기체를 실시간으로 분석하였다. 분석 후 배출되는 기체는 0.1 N 수산화나트륨(NaOH)용액으로 중화시켰다.
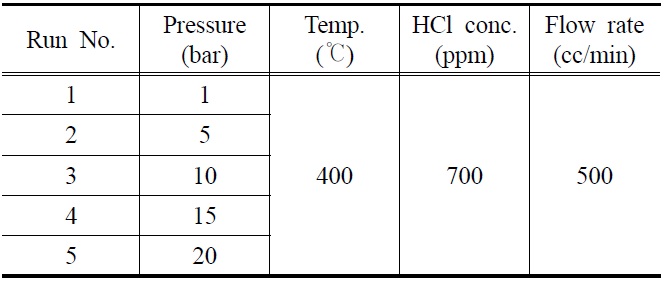
K-계열 흡수제의 HCl 흡수 특성을 확인하기 위해 고정층반응기를 이용한 파과실험(breakthrough test)을 수행하였으며, 실험변수로는 반응압력이 고려되었다. 자세한 실험조건을 Table 2에 요약하였다.
반응기의 충전물질로는 파우더 형태의 K-계열 흡수제와 인조규사(quartz sand, SiO2)를 사용하였으며, 유량 0.5 l/min, 주입 HCl 농도 700 ppm, 반응온도 400 ℃에서 반응 압력(1~20 bar)을 변수로 실험을 수행하였다. K-계열 흡수제와 규사(SiO2)를 고체 입자의 밀도(bulk density)를 고려하여 반응기 부피의 1 : 9 비율로 장입하였다. 장입 과정에서 K-계열 흡수제와 규사의 입자층 중간 부분에 유리섬유를 삽입하여 반응기 내 두
[Table 2.] Summary of experimental conditions
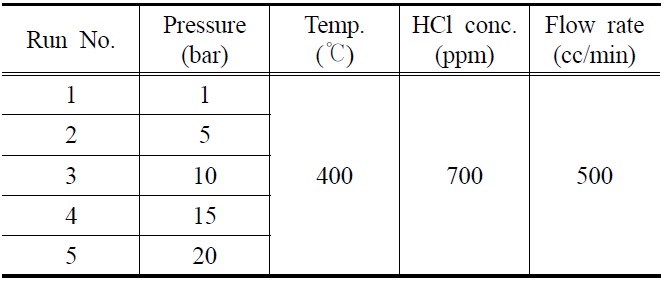
Summary of experimental conditions
고체 입자의 혼합을 방지하였다. 반응기 부피의 1 : 9 비율로 장입된 K-계열 흡수제는 0.428 g이며, 규사는 3.74 g 장입시켰다. 입자를 장입한 후 N2를 주입하면서 목표 온도까지 승온하였으며, 목표 온도에 도달한 후 목표압력까지 가압을 실시하였다. N2 주입 후부터 승온 및 가압이 이루어지는 과정 동안 반응기의 압력 강하(pressure drop)의 여부를 살펴보았다. 또한 목표 온도와 압력에 도달할 때까지 반응기에서 배출되는 기체는 FT-IR 분석기를 이용하여 기체농도를 측정하였다. 여기서 검출상의 모든 기체가 검출되지 않는 조건을 완전한 퍼지 조건(full purge condition)으로 고려하였다. 이후 반응기체(HCl, N2 balance)를 주입하여 K-계열 흡수제가 포화 될 때까지 반응실험을 유지하였다. FT-IR 분석기를 이용하여 기체농도를 측정하였고, 측정 후 분석기에서 배출되는 기체는 0.1N 수산화나트륨 용액으로 중화시켰다.
반응실험 후 주입기체를 HCl혼합기체에서 N2 (99.99 + %)로 전환한 후 감압 및 감온하였다. FT-IR 분석기의 경우도 마찬가지로 완전한 퍼지 조건이 될 때까지 8시간 이상 N2를 주입하였다. 반응 후 채집한 입자는 반응 전 입자와의 비교를 위하여 SEM, EDAX, BET, TGA, XRD 등의 물성 분석을 하였다. K-계열 흡수제의 경우, 반응실험 후 입자 재생이 용이하지 않기 때문에, 매실험 시 Fresh 상태의 K-계열 흡수제를 장입하여 실험하였다.
본 연구에서는 반응압력 변화에 따른 K-계열 흡수제의 HCl 흡수 특성을 살펴보았다. 파과되는 HCl의 농도가 1 ppm 이상이 될 때까지의 시간을 파과시간(breakthrough time)으로 정하였으며, 배출되는 HCl의 농도가 주입 농도와 같아지는 시간을 포화시간(saturation time)으로 정하였다. 또한 실험에 사용된 K-계열 건식 입자는 물성 분석을 통하여 반응 전과 반응 후를 비교하였다.
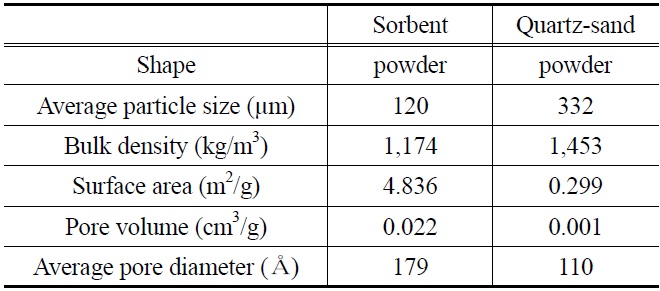
본 연구에 사용된 K-계열 흡수제는 파우더 형태이며, 알칼리 금속(K)을 주성분으로 하고 있다. Table 3에는 반응 전 K-계열 흡수제와 반응 실험에서 사용된 인조규사의 물성 특성을 정리하여 나타내었다. K-계열 흡수제와 인조규사의 밀도(bulk density)는 각각 1,174 kg/m3, 1,453 kg/m3로 나타났고,
[Table 3.] Physical properties of K-based sorbent and quartz-sand
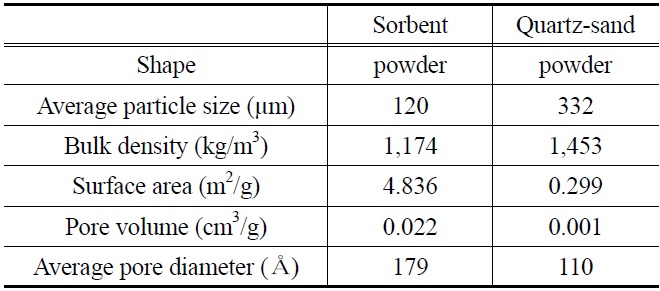
Physical properties of K-based sorbent and quartz-sand
평균 입자 크기(average particle size)는 각각 120 μm, 332 μm로 나타내었다. 또한 K-계열 흡수제와 인조규사의 비표면적(specific surface area)은 각각 4.8368 m3/g, 0.2995 m3/g, 기공용적(pore volume)은 각각 0.0216 cm3/g, 110.14 cm3/g, 평균기공 크기(average pore diameter)는 각각 178.67 Å, 110.14 Å으로 분석되었다.
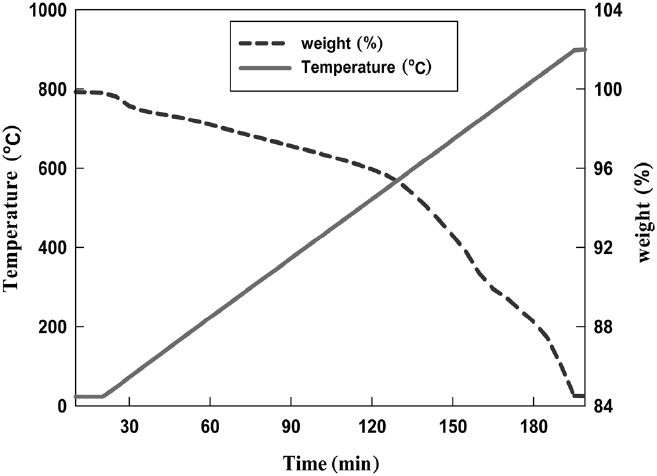
TGA를 이용한 K-계열 흡수제의 분석 결과는 Figure 2에 나타내었다. 100 ℃에서의 급격한 무게 감소는 물리 흡착되어 있던 물의 탈착에 의한 것이고, 600 ℃ 이상에서의 무게 감소는 K-계열 흡수제를 구성하고 있는 성분들의 소결에 의한 것으로 판단된다.
SEM 분석을 통한 K-계열 흡수제의 표면 구조를 배율에 따라 Figure 3에 나타내었다. 저배율(×500) 이미지에서 볼 수 있듯이 파우더는 거의 완전한 구형을 이루고 있으며, 이는 입자를 처음 개발할 때 유동층(건식 CO2 포집)공정을 염두했기 때문이다. 또한 고배율에서 볼 수 있듯이, 입자의 표면은 비교적 고르게 나타났다.
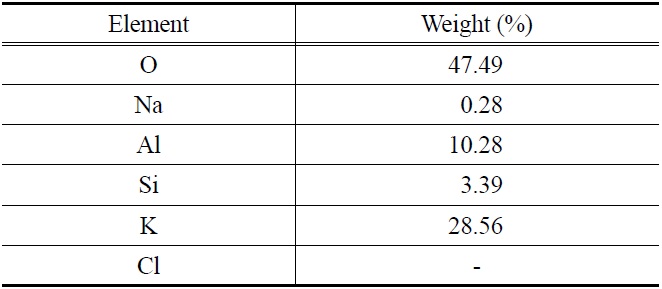
Table 4에는 EDAX를 이용하여 반응 전 K-계열 흡수제(Fresh 입자) 표면의 구성 성분을 분석한 결과를 나타내었다. 주성분은 O 47.49%, K 28.56%, Al 10.28%이고, 그 외에 Si, Na 등의 성분을 포함하고 있었다. 반응 전 K-계열 흡수제 표면의 성분에서 Cl (chloride)은 분석되지 않았다.
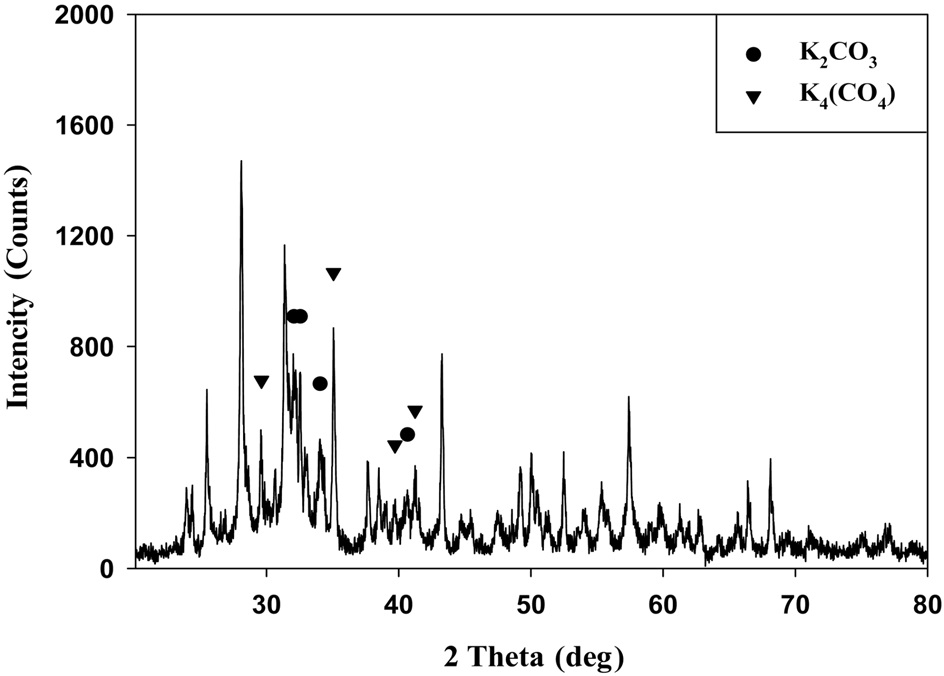
K-계열 흡수제를 구성하고 있는 성분들의 결합 형태를 알아보기 위해 XRD를 이용하여 분석을 실시하였고, 이는 Figure 4에 나타내었다. K-계열 흡수제는 주성분이 K2CO3, K4(CO4)이고, 그 밖에 지지체 물질들로 구성되어 있는 것을 알 수 있었다.
[Table 4.] EDAX analysis of K-based fresh sorbents
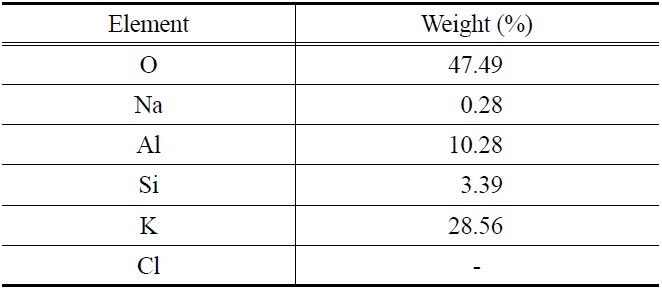
EDAX analysis of K-based fresh sorbents
반응압력에 따른 K-계열 흡수제의 HCl 흡수 특성을 살펴
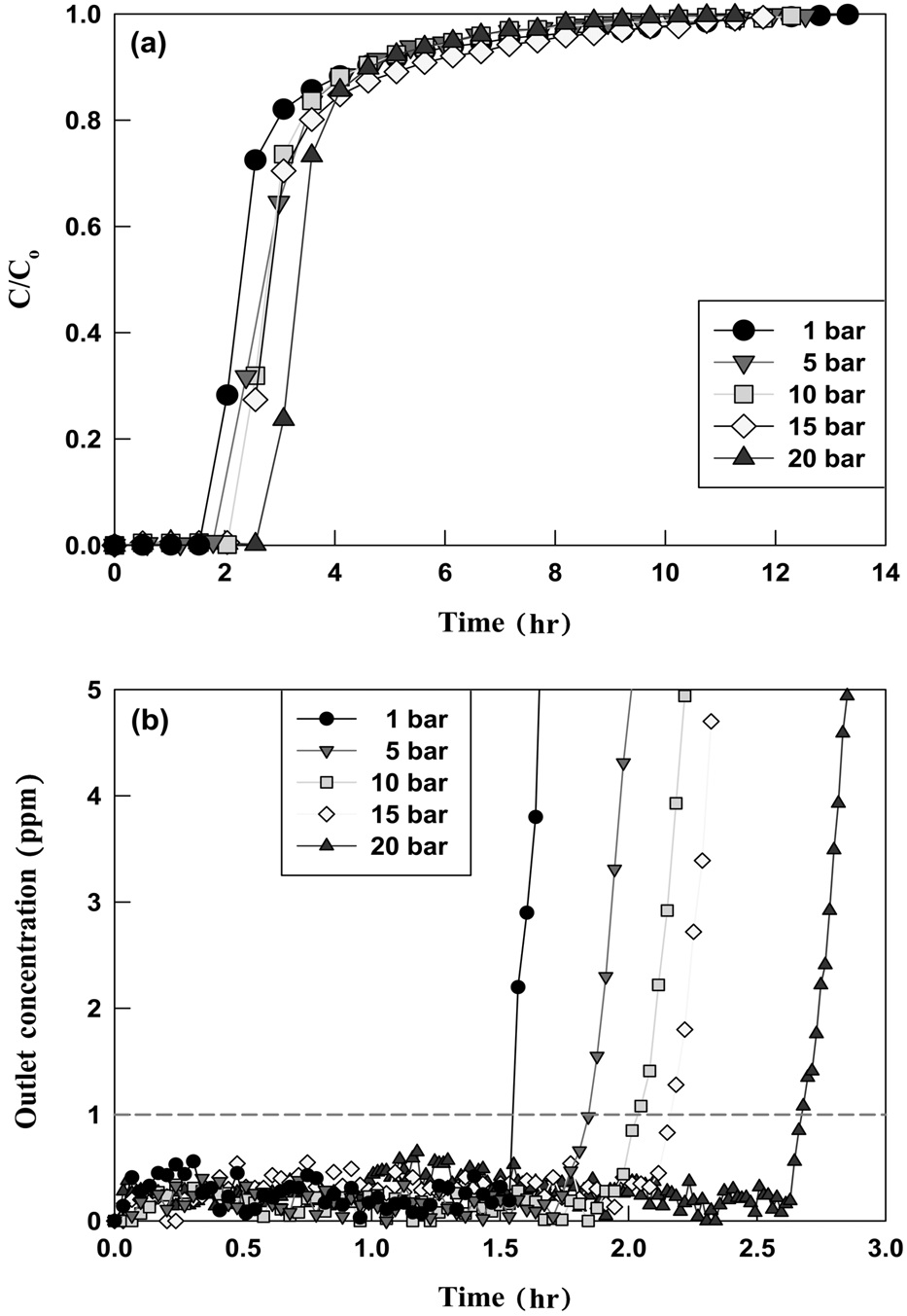
보기 위해 주입 유량 0.5 l/min, 주입 농도 700 ppm, 반응온도 400 ℃인 상태에서 반응압력을 1, 5, 10, 15, 20 bar로 변경하며 실험하였다. 반응 후 시간에 따라 배출되는 HCl의 농도를 (C/Co)계산하여 파과곡선을 Figure 5에 나타내었다.
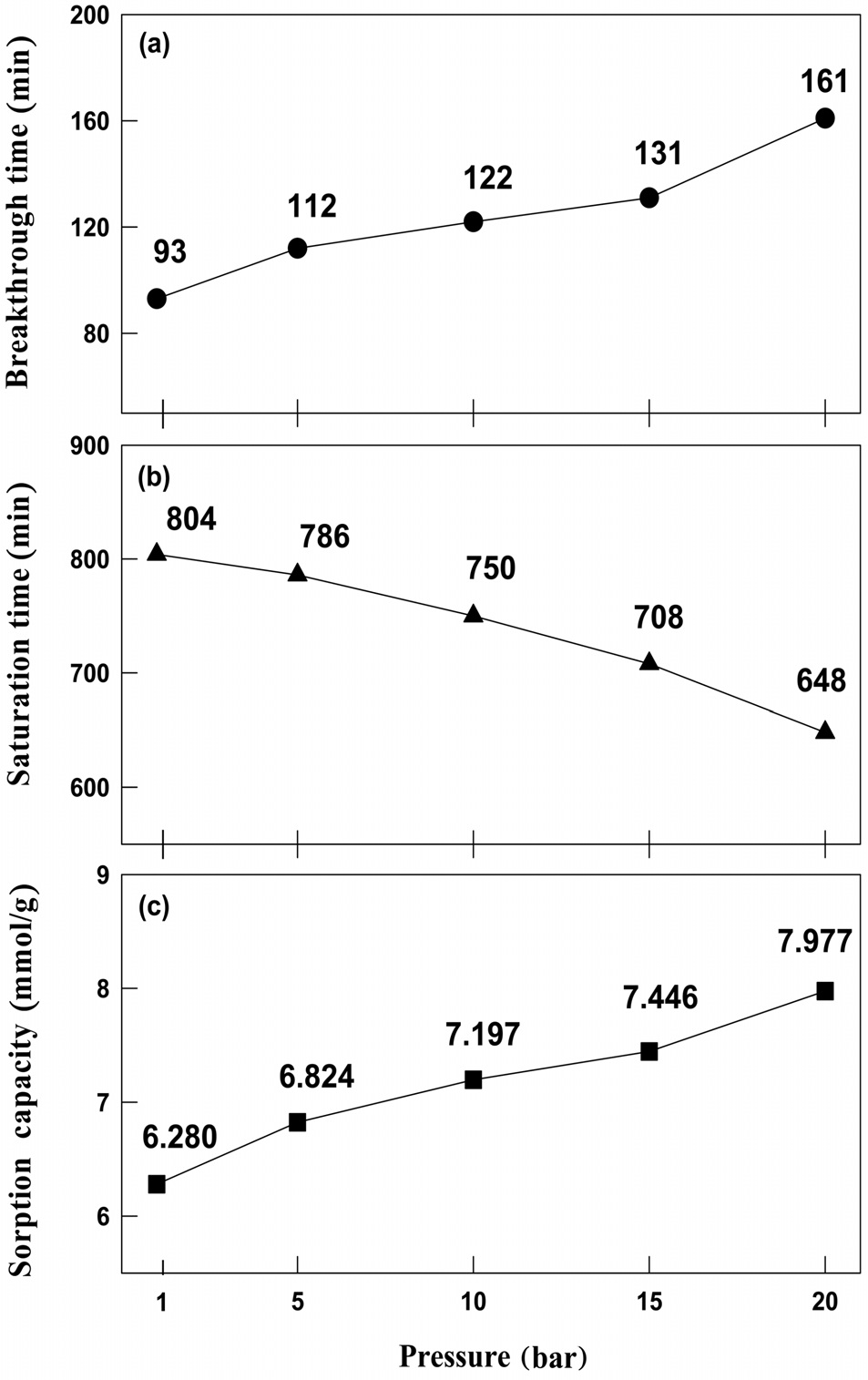
Figure 5에 나타난 바와 같이, 700 ppm으로 주입된 HCl 혼합기체는 모든 반응압력 조건에서 일정시간(파과시간) 동안 1 ppm 미만으로 유지되었다. 이후(파과 후) 출구에서 분석되는 HCl 농도가 급격하게 증가하였고, 포화 상태에서의 HCl 농도는 반응 전 주입되는 HCl의 농도와 같은 값으로 분석되었다. K-계열 흡수제의 반응압력에 따른 파과시간 및 포화시간, 그리고 흡수 성능을 정리하여 Figure 6에 나타내었다. 반응압력이 1, 5, 10, 15, 20 bar로 증가될 때 K-계열 흡수제의 파과시간은 93, 112, 122, 131, 161 min으로 증가하였고, 포화시간은 804, 786, 750, 708, 648 min으로 감소하여, 압력이 증가할수록 공정 적용이 유리해짐을 확인하였다. K-계열 흡수제의 흡수 성능 또한 반응압력이 1, 5, 10, 15, 20 bar로 증가할수록 각각 6.280, 6.824, 7.197, 7.446, 7.977 mmol/g으로 증가하였다. K-계열 흡수제는 압력이 증가할수록 HCl 흡수 성능이 증가하였으며, 실험조건 중에서는 20 bar일 때 HCl 흡수 능력이
가장 우수한 것으로 나타났다. 이는 현재 진행 중인 연소전(precombustion CO2 capture) 공정 운전 압력 조건(20 bar)과 일치한다.
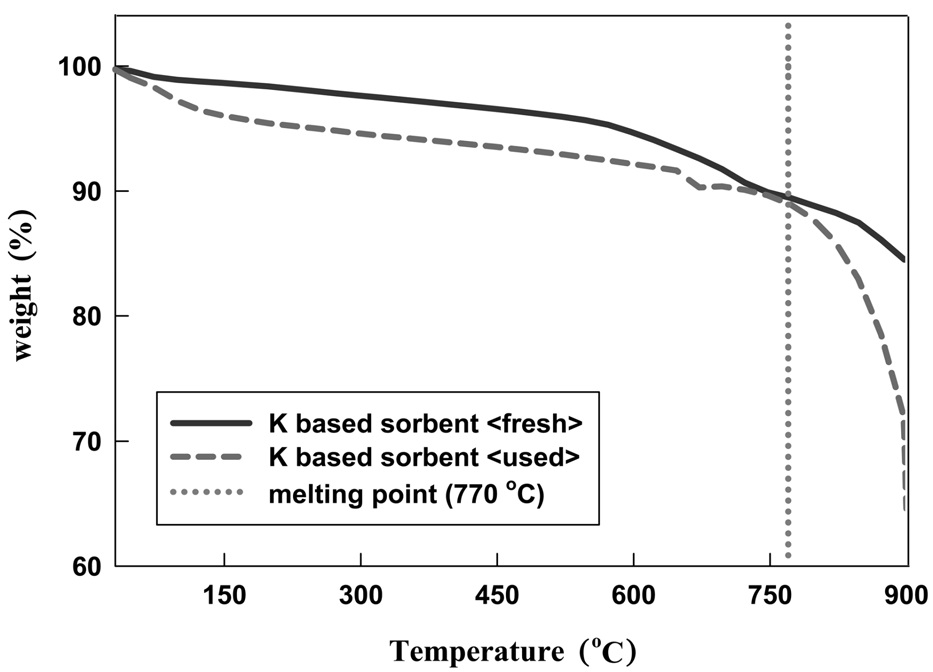
K-계열 흡수제에 대한 반응 전, 후의 TGA 분석 결과를 비교하여 Figure 7에 나타내었다. Figure 7에 나타난 바와 같이 반응 전, 후의 K-계열 흡수제는 770 ℃까지는 비슷한 무게감소를 보이는 것을 알 수 있었다. 이후 770 ℃ 이상에서 반응 후 K-계열 흡수제는 급격한 무게 감소를 나타내었다. 이는 반응 후 입자를 구성하는 KCl의 녹는점이 770 ℃이므로, KCl의 열적변형(thermal deformation)에 의한 무게 감소가 원인인 것으로 판단된다.
압력에 따른 반응 후 K-계열 흡수제의 SEM 이미지를 Figure 8에 나타내었다. 반응 후 K-계열 흡수제는 반응 전(Figure 3)과
[Table 5.] EDAX analysis of K-based sorbents (after reaction)
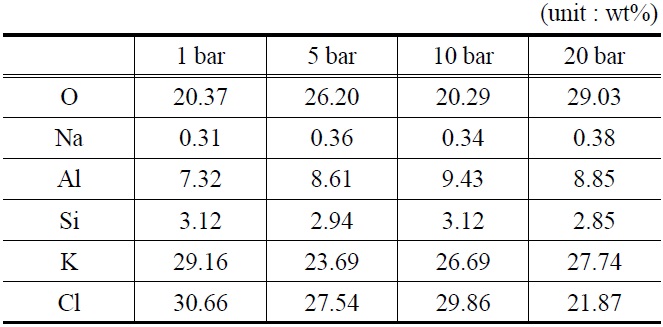
EDAX analysis of K-based sorbents (after reaction)
비교하여 볼 때, K-계열 흡수제 표면의 형상이 거칠게 변화되었으며, KCl로 추정되는 결정(crystal)이 표면에 형성되어 있음을 확인할 수 있다.
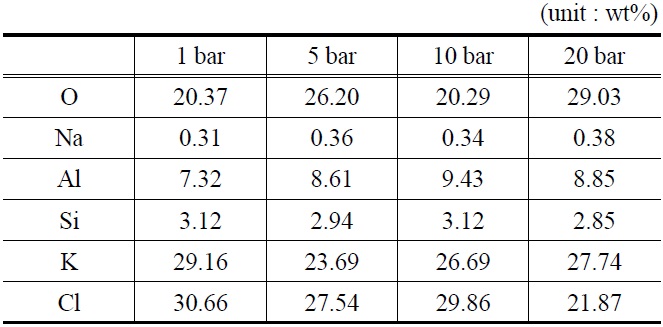
EDAX를 이용하여 분석한 반응 후 K-계열 흡수제의 표면구성 성분을 Table 5에 나타내었다. Table 4에서 볼 수 있듯이, 반응 전 K-계열 흡수제(fresh) 표면에서는 Cl (chloride) 성분이 검출되지 않았으나, 반응 후 Cl (chloride) 성분의 함량이 최대 30.66%로 검출되었다.
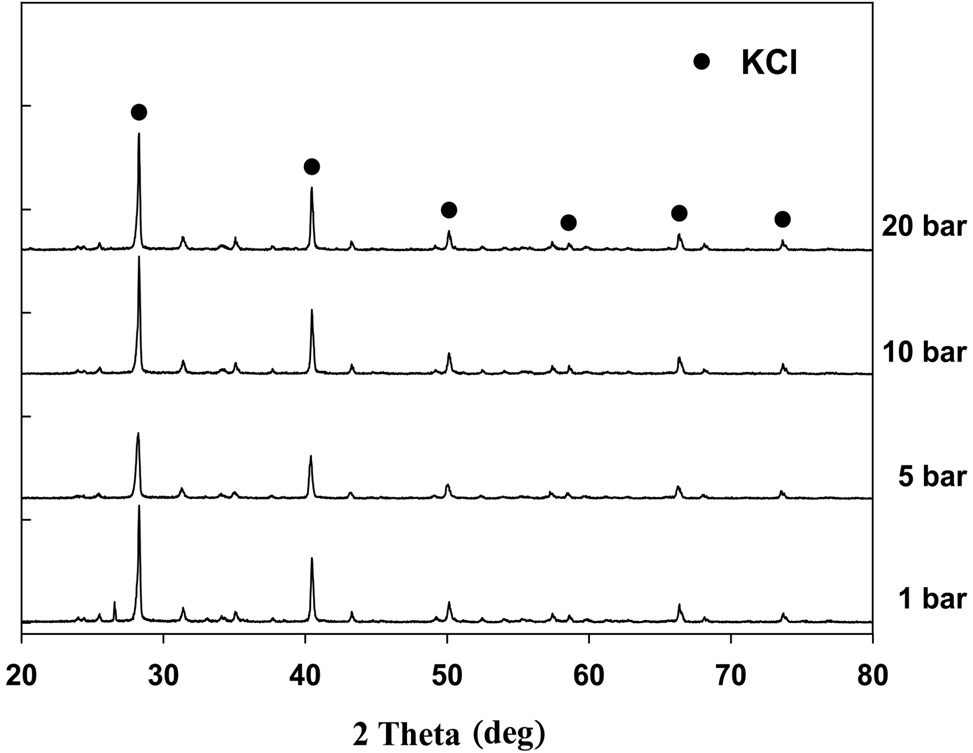
반응 후 K-계열 흡수제를 구성하고 있는 성분들의 결합 형태를 알기 위해 XRD를 분석을 하였고, 그 결과를 Figure 9에 나타내었다. 반응 후 K-계열 흡수제를 구성하고 있는 성분은 KCl과, 그 외에 여러가지 지지체 물질들로 구성되어 있었다. 여기서 K-계열 흡수제의 주성분인 K2CO3는 HCl과 반응하여 KCl로 전환된 것을 확인할 수 있었다.
본 연구에서는 반응압력에 따른 K-계열 건식 흡수제의 HCl 흡수 특성을 연구하였다. 고정층 반응기를 이용한 파과(breakthrough) 특성 및 SEM, EDX, BET, TGA, XRD 등을 이용한 물성분석을 하였다. 실험을 통해 얻어진 결론은 다음과 같다.
1) K-계열 흡수제를 충전한 고정층 반응기에 700 ppm으로 주입된 HCl 혼합기체는 모든 압력 조건에서 일정시간(파과 시간)동안 1 ppm 미만으로 유지되었다. 이후 HCl 농도가 급 격하게 증가하여 포화상태에 이르렀다.
2) 반응압력이 1, 5, 10, 15, 20 bar로 증가할수록 K-계열 흡 수제의 파과시간은 93, 112, 122, 131, 161 min으로 증가하였 고, 포화시간은 804, 786, 750, 708, 648 min으로 감소하였으 며, 흡수능은 6.280, 6.824, 7.197, 7.446, 7.977 mmol/g으로 증 가하였다. 이는 압력이 증가할수록 K-계열 흡수제의 흡수성 능이 향상되어 공정적용이 용이해짐을 의미한다.
3) 반응 후 K-계열 흡수제에 대한 TGA, EDAX, XRD 등의 물성분석을 한 결과, 흡수제를 구성하고 있는 물질(K2CO3)이 HCl 혼합기체의 Cl-기와 반응하여 KCl이 형성됨을 확인하였 으며, 압력이 증가할수록 형성되는 KCl의 양도 증가하였다.