본 연구에서는 등온반응기와 단열반응기로 구성된 0.25 MW 메탄합성 파일롯 공정 실험을 통한 운전 특성을 분석하였다. 등온반응기는 메탄합성 반응을 통해 발생하는 열을 포화수의 유량과 압력을 통해 강제적으로 제어할 수 있는 반응기로 등온반응기와 단열반응기를 조합할 경우 기존 단열반응기만으로 구성된 메탄합성 공정에 비해 반응기 개수를 줄일 수 있다. 또한 합성가스 재순환이 불필요하기 때문에 단열반응기 조합으로 구성된 메탄합성 공정에서 비용의 약 15~20%를 차지하는 재순환 압축기를 제거할 수 있다. 등온반응기로 유입되는 합성가스의 H2/CO 비가 3보다 낮은 경우에는 튜브에 충진된 촉매에 탄소 침적 현상이 일어나 반응기의 차압이 증가하였으며, H2/CO 비가 3으로 공급되는 경우에는 탄소 침적 현상이 일어나지 않고 메탄합성 반응이 안정적으로 유지되어 CO 전환율 99% 이상, CH4 선택도 97% 이상, CH4 생산성 최대 695 ml/h·-cat를 얻을 수 있었다.
천연가스는 난방, 전기생산뿐 아니라, 수송연료와 화학제품 제조의 원료로 사용되는 중요한 에너지원의 하나이다. 천연가스는 일반적으로 가스전에서 생산되는 전통방식의 가스와 셰일가스 또는 석탄메탄층 등의 비전통방식으로 생산되는 가스로 나누어진다[1]. 이 외에도 석탄이나 폐기물, 바이오매스 등을 이용하여 천연가스를 생산할 수 있는데 이 경우 합성천연가스(SNG, synthetic natural gas or substitue natural gas)라고 부른다[2]. 이는 석탄, 바이오매스, 폐기물 등과 같은 저급의 연료가 가스화 반응을 거치면서 일산화탄소(CO), 수소(H2)가 주성분인 합성가스로 전환되고, 합성가스 내에 포함된 일산화탄소(CO), 수소(H2)의 메탄합성 반응을 통해 최종적으로 메탄(CH4)이 주성분인 합성천연가스를 만들어내는 방법에 의한 것이다.
합성천연가스를 생산하는 공정은 1970년대의 석유파동을 계기로 원유가격과 연동되어 동반상승되는 천연가스 가격으로 인해 상대적으로 저렴한 석탄에서 천연가스를 만들어내기 위한 연구로부터 개발되었다. 이 시기의 연구개발의 결과로 1984년 미국에 석탄으로부터 SNG를 생산하는 첫 상용 플랜트가 지어졌으며(Great Plain Synfuel Plant, 미국 North Dakota, 480만m3/일 SNG 생산) GPSP는 최근까지 석탄으로부터 SNG를 생산하는 유일한 상용 플랜트였다. 1980년대 이후 2000년 대까지 석유 및 천연가스 가격의 안정화로 SNG 관련 연구는 대부분 중단되었으나, 2000년대 들어 고유가 현상이 발생하고, 이에 따른 천연가스 가격의 상승에 따라 Coal-to-SNG 연구에 대한 관심이 높아졌다. 특히 중국의 2011년 말 자료에 의하면 석탄으로부터 합성천연가스를 생산하는 프로젝트를 30여개 추진하고 있고 이 중 4개 프로젝트가 중국 정부의 승인을 받았다[3]. 중국 정부로부터 승인받은 플랜트의 SNG 생산량은 연간 총 15.1 Bcm (billion cubic meter, 약 1,100만ton)규모로, 이 중 일부는 2012년 건설 및 시운전 완료 후 상용운전준비 중이다. 또한, 유럽에서는 화석연료로부터의 수송용 연료 의존도를 탈피하고자 바이오매스를 대상으로 한 SNG 생산플랜트의 상용화를 위한 노력을 기울이고 있으며, 스웨덴, 오스트리아, 네덜란드를 중심으로 연구개발이 진행되고 있다.
국제 천연가스는 미국-캐나다 간의 파이프라인, 러시아-유럽 간의 파이프라인, 중동/북아프리카(MENA)-동북아 간의 LNG 등 3개의 권역으로 구분되어 각각의 가격 산정 기준에 따라 거래되며, 우리나라가 속해 있는 중동/북아프리카-동북아 권의 LNG 거래는 일정 물량을 유가연동으로 가격을 결정하는 장기계약 거래가 주를 이룬다[4]. 즉, 국내 도입 천연가스는 대부분 동아시아 지역에서 장기도입에 의한 LNG 수입에 의존하고 있기 때문에 천연가스 가격은 원유가격과 연동되어 있어 원유가의 상승에 따라 천연가스 가격도 동반 상승되며, 원유가가 $120/bbl 이상으로 치솟았던 2008년의 경우 천연가스 도입가격 역시 $16/MMBTU까지 상승하였다[5]. 최근 미국을 중심으로 이루어지고 있는 셰일가스 개발로 미국의 천연가스 가격은 $3~4/MMBTU까지 낮아졌으나 우리나라의 천연가스 가격은 2010년 이후 유가의 상승으로 동북아 LNG 가격이 오히려 크게 상승하여 북미 천연가스와의 가격격차가 더욱 커졌다. 미국에서 천연가스를 수출하여 우리나라가 미국으로부터 천연가스를 도입하려면 LNG 선박을 이용한 수송이 이루어져야 한다. LNG 액화 설비, LNG 선박비용, 기화설비 등에 대한 투자비와 운임 등을 고려하면 수송비용이 $7~10/MMBTU 정도로 예상[4]되기 때문에 미국에서의 천연가스 생산 가격이 $3~4/MMBTU라 하더라도 국내 도입가격은 $10~14/MMBTU 이상이 될 것으로 예측된다. 비전통가스인 셰일가스의 활발한 개발로 미국내 천연가스는 가격이 하락하였고 이러한 가격 하락에 의해 우리나라 천연가스 가격도 영향을 받을 것으로 생각되었다. 하지만, 우리나라의 천연가스 공급은 중동지역으로부터의 장기도입계약에 의존하고 있고, 유가와 연동하는 가격 체계를 유지하고 있어 미국의 천연가스 가격하락으로 인한 직접적인 영향을 받지는 않을 것으로 예측된다. 이러한 이유 때문에 에너지 안보 및 에너지 다원화, 경제성 확보를 위해 석탄으로부터 합성천연가스를 생산하는 기술에 대한 관심과 연구개발이 지속되고 있는 것이다. 이에 따라 국내에서도 포스코 광양제철소에 석탄으로부터 합성천연가스를 생산하는 플랜트 건설이 2014년 완공을 목표로 진행되고 있으며, 국내 발전사 등에서도 플랜트 건설에 대한 검토를 진행하고 있다.
일반적으로 석탄이나 바이오매스 등으로부터 SNG를 생산하는 방법은 크게 3가지로 구분된다. 첫째는 석탄을 산소 및 증기와 반응시켜 합성가스(일산화탄소(CO), 수소(H2))를 생산하고 생산된 합성가스 내에 포함된 오염물질을 정제한 후 청정한 합성가스를 니켈(Ni)계 촉매를 사용하여 메탄(CH4)으로 전환시키는 방법(gasification 기반)이고, 둘째는 고온, 고압 조건에서 직접 석탄이나 바이오매스에 수소를 첨가하는 수첨가스화 방법(hydrogasification 기반)[6], 마지막으로 연료를 700 ℃ 정도에서 촉매와 증기를 사용하는 촉매가스화 방법이다[7]. 이 중 수첨가스화에 기반한 방법과 촉매가스화에 기반한 방법은 아직 상용화가 이루어지지 않은 상태이고, 가스화 방법에 기반하여 SNG를 생산하는 방법만이 상용화 되었다. 가스화 방법에 기반하여 합성천연가스를 생산하기 위해서는 가스화 및 정제 공정, 메탄합성 공정을 거쳐야 하는데, 현재까지 상용화된 메탄합성 공정은 단열반응기의 조합으로 구성되어 있다. 본 연구에서는 기존 상용 SNG 제조 공정에서 사용하고 있는 단열반응기의 조합으로 구성된 메탄합성 공정 대신 등온반응기와 단열반응기의 조합으로 구성된 0.25 MW급 메탄합성 파일롯 공정의 운전 특성을 분석하였다.
현재 상용화가 이루어진 가스화 방법에 기반하여 합성천연가스를 생산하기 위해서는 메탄합성공정을 거쳐야 하는데, 메탄합성 공정에서는 가스화기에서 전환된 일산화탄소(CO), 수소(H2)가 주성분인 합성가스를 메탄(CH4)으로 최종 전환하는 공정으로 주요 반응식은 식 (1)~(3)과 같다.
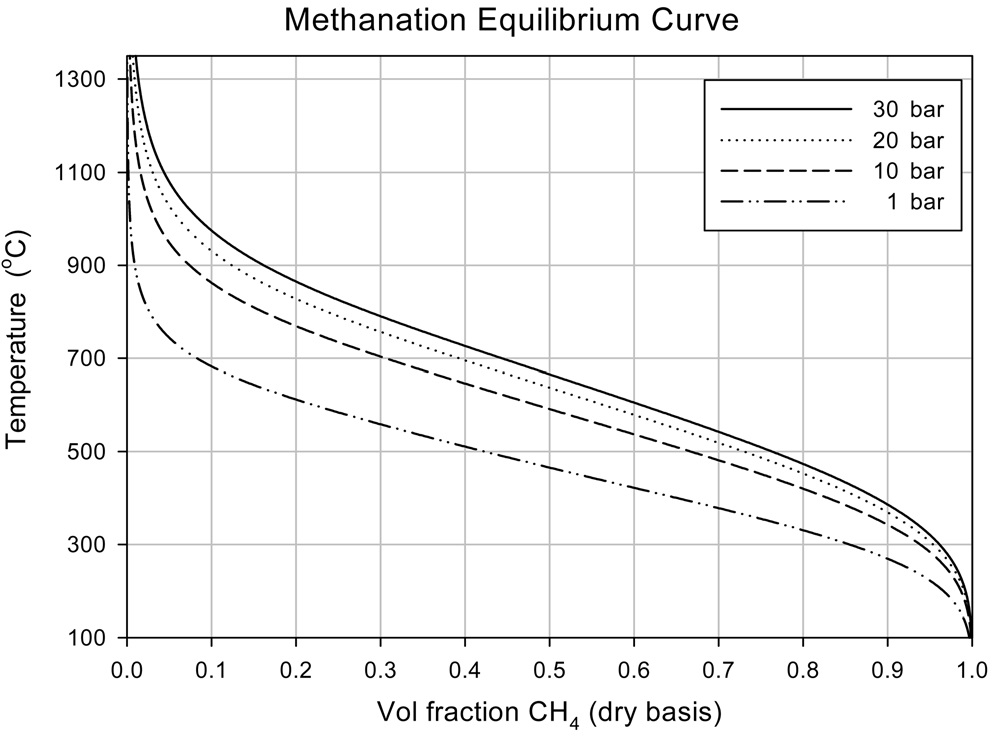
메탄합성 공정은 촉매를 사용하는 공정으로 사용가능한 촉매로는 니켈(Ni), 루테늄(Ru), 팔라듐(Pd), 코발트(Co), 철(Fe), 몰리브덴(Mo), 백금(Pt), 로듐(Rh) 등이 알려져 있으나, 상용공정에서는 대부분 니켈 촉매가 사용된다[8,9]. 메탄합성 공정에서 일어나는 메탄합성 반응은 공급되는 합성가스의 조성(H2/CO 비), 공간속도(space velocity, SV), 반응온도, 반응압력 등에 따라 그 특성이 달라지게 된다[10]. 또한 메탄합성 반응은 매우 빠른 반응으로, 상용공정에서 메탄합성 반응기에 충진되는 촉매의 양이 반응이 일어나는 시간과 비교하여 충분하기 때문에, 메탄합성 반응기 출구에서의 가스 조성이 열역학적 평형으로 계산한 결과와 크게 다르지 않다. 상용공정에서의 설계에서도 열역학적 평형에 근거하여 메탄합성 반응기에서의 조성을 예측한다. 온도와 압력에 대한 메탄합성 반응의 열역학적 평형 조성은 Figure 1에 나타난 바와 같이
온도가 낮을수록, 압력이 높을수록 잘 일어난다. 그러나 식 (1)~(3)에 제시된 바와 같이 메탄합성반응은 매우 강한 발열반응으로 반응이 진행될수록 온도가 높아지기 때문에, 메탄합성 반응이 잘 일어남과 동시에 촉매 보호를 위해 반응기의 온도를 적정 온도 이하로 제어하는 과정이 필요하다.
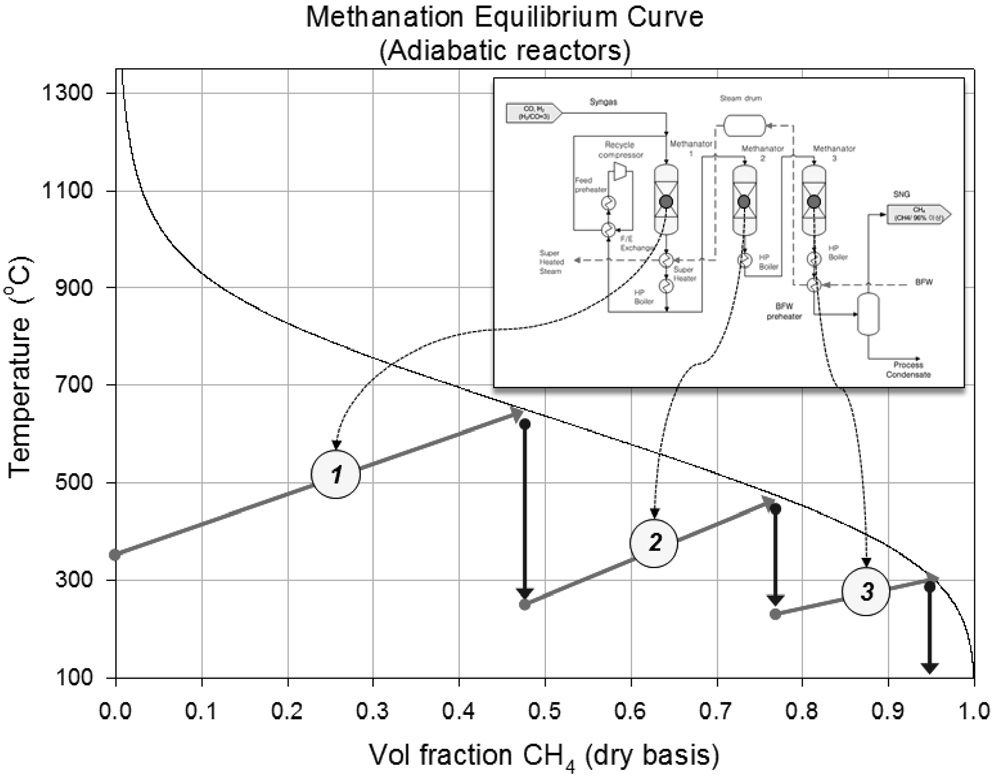
현재 상용화된 메탄합성 공정은 3~5개의 단열반응기를 직렬로 연계하여 반응이 단계적으로 진행되도록 하는 구성으로 이루어져 있으며, 이 경우 메탄화 반응이 진행됨에 따른 반응기의 급격한 온도 상승을 방지하기 위하여 생성가스의 일부를 재순환하여 반응기의 온도를 감소시키거나, 유입되는 합성가스를 여러개의 반응기로 분배하는 방법 등을 적용한다[11]. 예를 들어 단열 반응기 3개로 구성된 메탄합성 공정의 경우, 첫번째 반응기 후단에서 생성가스의 일부를 재순환하는 방법을 적용하면, Figure 2에 나타난 바와 같이, 첫번째 반응기 출구 온도를 700 ℃ 이하로 유지하여 촉매 소결을 방지하고, 두번째, 세번째 반응기를 거치면서 최종적으로 메탄함량 95%정도의 SNG를 생산할 수 있다. 이러한 단열반응기의 조합으로 구성된 메탄합성공정에 대한 기술을 보유하고 있는 회사로는 덴마크의 Haldor Topsøe[12], 영국의 Davy Process Technology, 독일의 Lurgi가 있다.
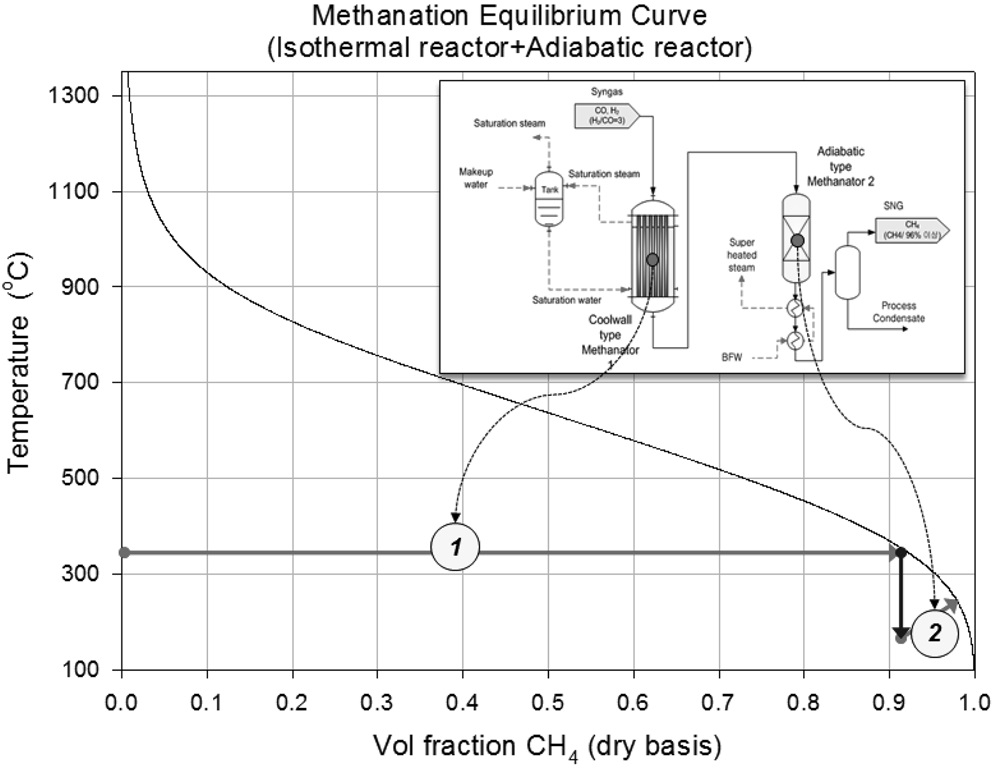
그러나 앞서 언급한 바와 같이 메탄합성 반응이 온도가 낮을수록 전환율이 높기 때문에 메탄합성 반응의 전환율을 높이기 위하여 강제적으로 메탄화 반응에서 발생하는 열을 제거하여 메탄합성 반응기의 온도를 제어하는 등온반응기(Isothermal reactor)를 메탄합성 공정에 적용할 수 있다. 등온반응기와 단열반응기로 구성된 메탄합성 공정의 경우 열역학적 평형 계산에 의하면 Figure 3과 같이 등온반응기를 적용한 첫번째 반응기에서 350 ℃ 정도로 반응기 온도를 유지할 경우 반응기 출구에서의 메탄(CH4) 농도가 90%정도가 되며, 추가로 한 개의 단열반응기를 더 거치게 되면 기존 단열반응기의
조합으로 구성된 메탄합성공정과 마찬가지로 95% 이상의 메탄(CH4) 농도를 얻을 수 있다. 이 경우, 기존 단열반응기 조합의 메탄합성공정과 비교하여 합성가스 재순환이 불필요하게 되어 재순환 압축기 비용을 절감할 수 있으며, 반응기 개수도 줄일 수 있다[13].
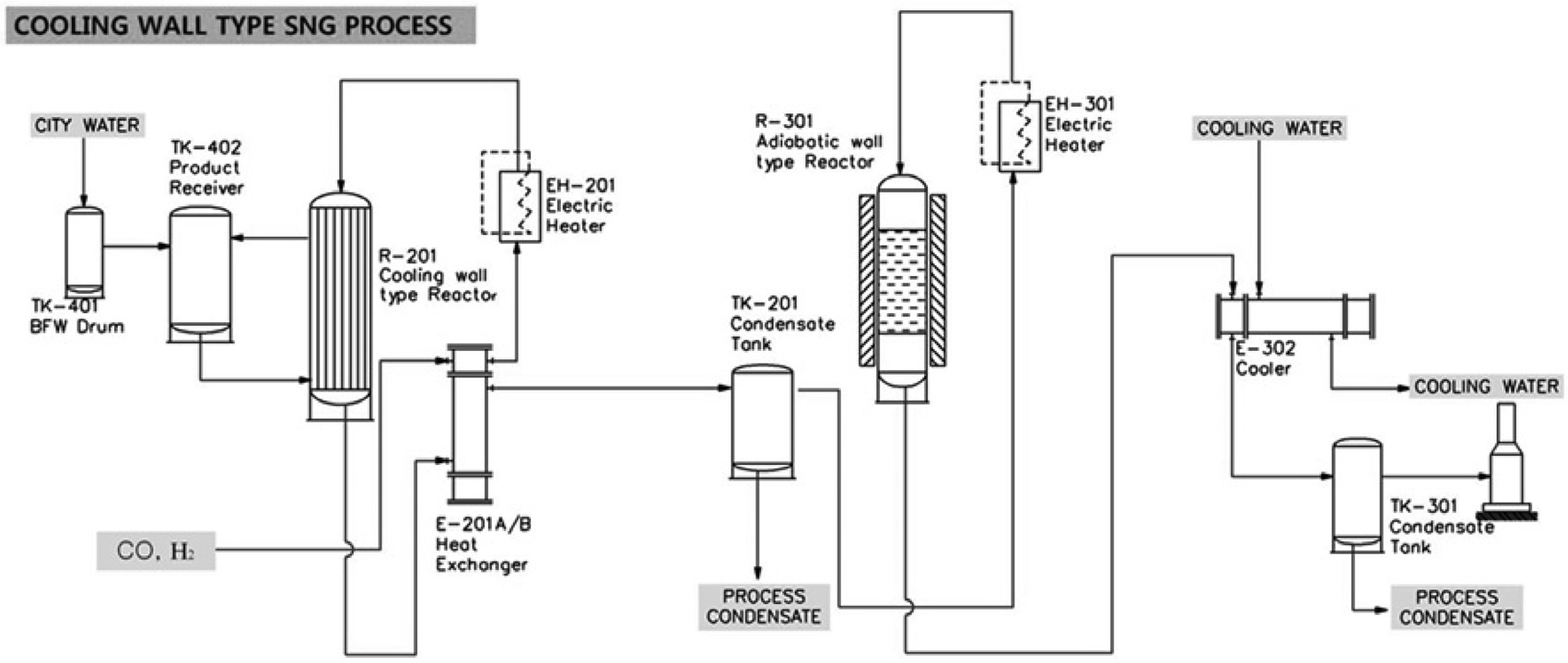
본 연구에서는 메탄합성 공정으로 등온 반응기와 단열반응기의 조합으로 구성된 0.25 MW 규모의 파일롯 플랜트 메탄합성 공정을 구축하고, 운전 특성을 파악하기 위한 실험을 진행하였다. 파일롯 플랜트의 공정 구성도는 Figure 4에 나타내었으며, 설치 모습은 Figure 5에 나타내었다. Figure 4의 공정구성도에서 R201로 표시된 부분이 등온반응기이며 R-301로 표시된 부분이 단열반응기이다. 유입되는 합성가스는 열교환기와 히터를 거치면서 350 ℃ 가까이 예열된 후 등온반응기에서 대부분 메탄이 주성분인 생성가스로 전환되고, 추가로
단열반응기를 거치면서 최종적으로 SNG로 생산된다. 등온반응기는 쉘(shell) 내에 다수의 튜브(tube)가 포함되어 있는 구조로 이루어져 있는데, 튜브내에 촉매가 충진되어 있고, 쉘의 하부에서는 포화수가 공급되어, 튜브에서 일어나는 메탄합성 반응에 의한 반응열을 증발잠열의 형태로 회수하여 쉘 상부로 배출된다. 즉, 메탄화 반응에 의해 발생된 열이 촉매가 충진된 튜브 외측에 채워진 포화수에 전달되어 포화증기를 발생시키기 위한 증발잠열의 형태로 제거되며, 포화수의 공급압력 조절 및 포화수위 조절을 통해 반응제어가 이루어진다.
메탄합성 공정 실험은 반응기 예열, 촉매 환원, SNG 합성반응의 순서로 진행하였으며, 촉매는 상용촉매인 S사의 촉매를 사용하였고, 사용된 촉매는 니켈(Ni) 함량이 약 40% 정도인 활성이 비교적 높은 촉매이다. 메탄합성 공정의 성능을 좌우하는 요인으로는 반응기의 온도, 공간속도, 메탄합성공정으로 유입되는 합성가스의 H2/CO 비, 반응기의 압력 등이며, 메탄합성 공정 성능 평가는 주로 일산화탄소(CO) 전환율(CO conversion), 메탄(CH4) 선택도(CH4 selectivity), 메탄(CH4) 생산성(CH4 productivity) 평가를 통해 이루어진다[9].
본 연구에서 정의한 메탄합성 공정에서의 H2/CO 비, 공간속도, 일산화탄소(CO) 전환율, 메탄(CH4) 선택도, 메탄(CH4)생산성에 대한 정의는 다음과 같다.
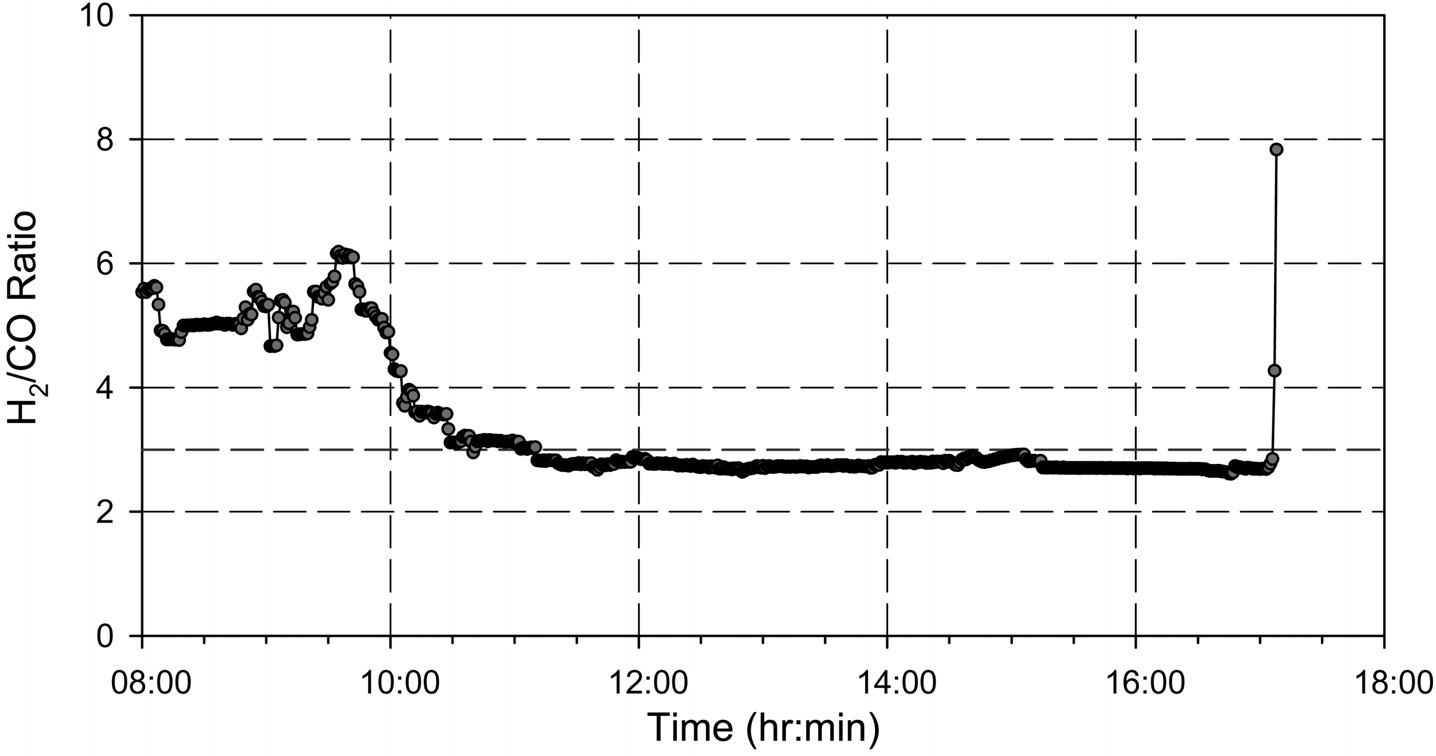
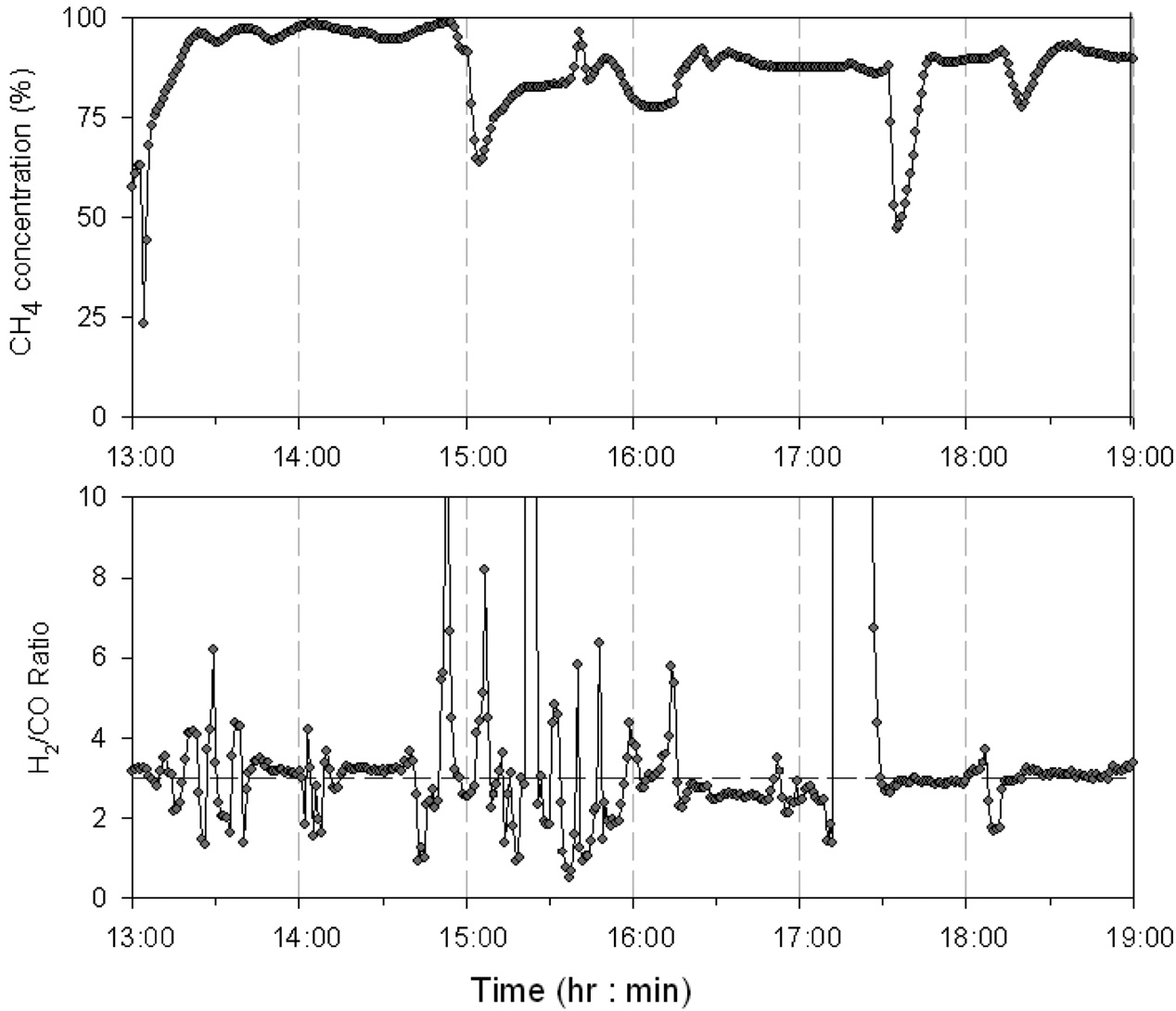
등온반응기와 단열반응기 조합으로 구성된 0.25 MW급 메탄합성 파일롯 공정은 총 2회에 걸쳐 실험을 진행하였는데, Figure 6에 1차 운전시의 메탄합성공정으로 유입되는 H2/CO비와 최종 배출되는 SNG 내의 메탄(CH4) 함량을 나타내었고,
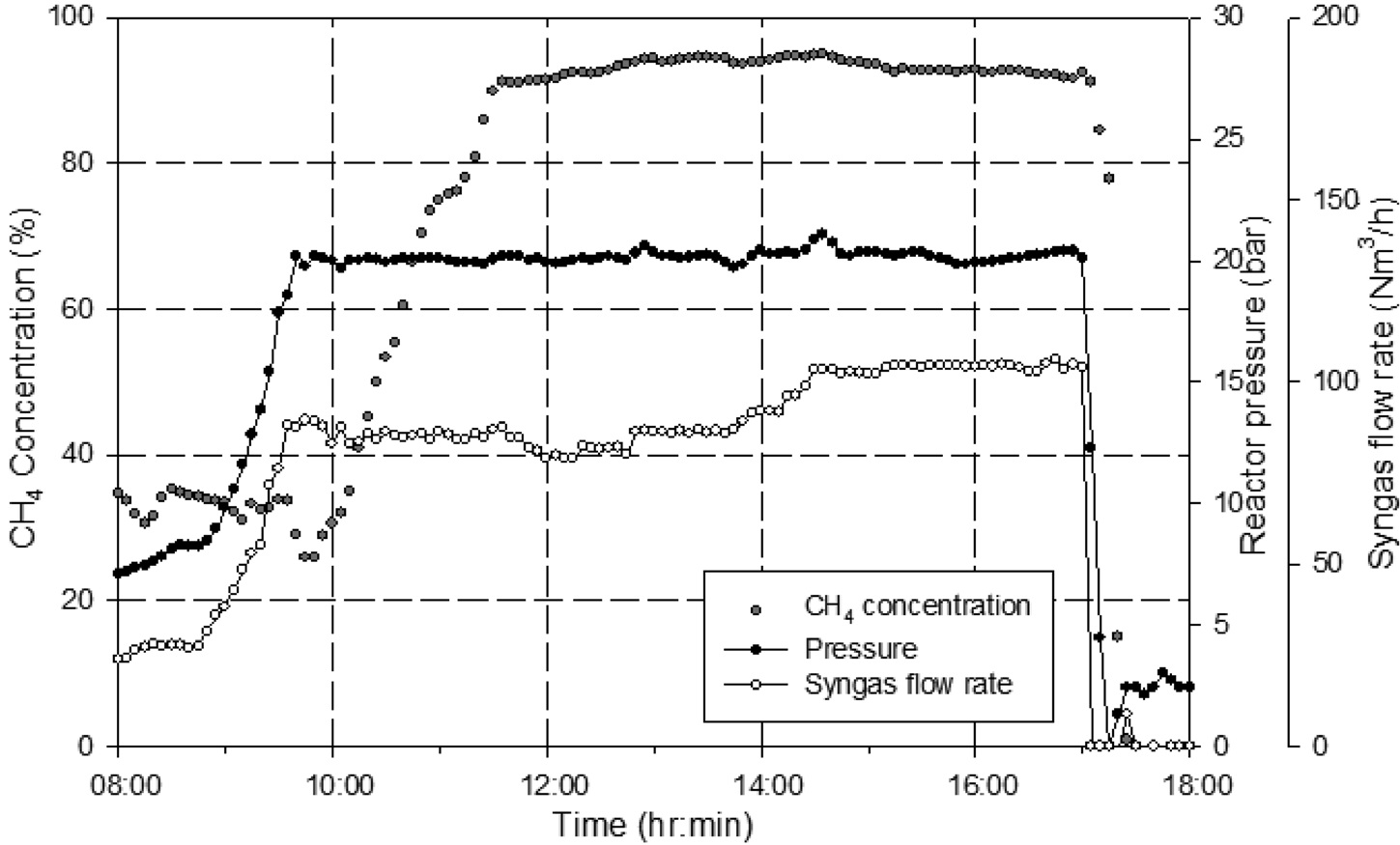
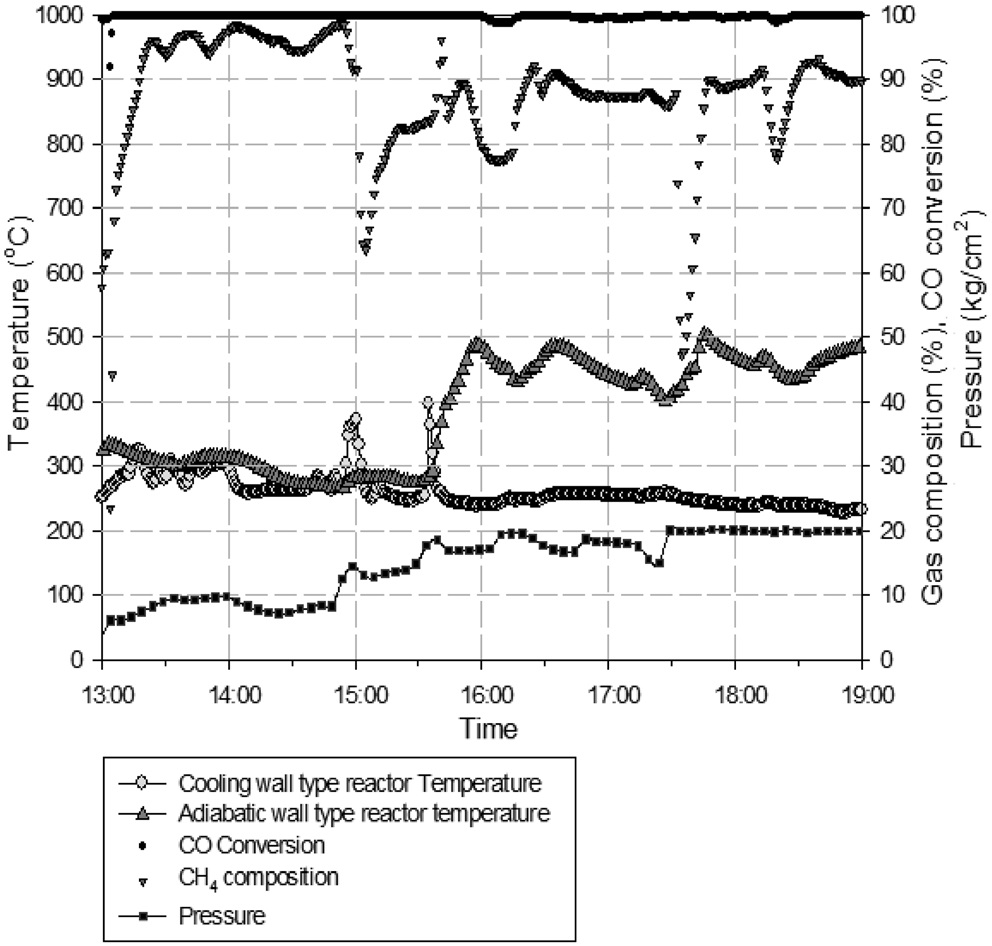
Figure 7에는 1차 운전시의 등온반응기 온도, 단열반응기 온도, 일산화탄소(CO) 전환율, 반응기 압력을 나타내었다. 1차 운전시 합성가스 공급 부분의 수소(H2) 공급이 안정적으로 이루어지지 않아 공급되는 수소(H2)의 유량이 일정하지 않는 현상으로 인해 유입되는 합성가스의 H2/CO 비를 메탄화 반응에서 요구되는 수준인 3으로 조절되지 못하는 구간이 발생하였다. 공급되는 합성가스의 H2/CO 비의 변동은 메탄화 반응에
영향을 미치게 되고 최종 배출되는 SNG의 메탄(CH4) 농도의 변화를 발생시키는 주요한 원인임을 알 수 있다. 또한 H2/CO 비가 3보다 낮게 유지되는 구간에서 촉매 내에 탄소가 일부 침적되어 일정시간 실험 후 등온반응기 차압이 1 bar 정도까지 증가하는 현상이 나타났는데 이는 실험 후 충진되었던 촉매 분석 결과를 통해서도 확인할 수 있었다. 문헌에 따르면 Figure 8에 나타난 바와 같이 H2/CO 비에 따라 탄소가 침적되는 영역을 확인할 수 있는데, 본 실험에서도 실험 후 촉매 채취 및 분석 결과 등온반응기 튜브 내의 촉매 중 상부에 있는 촉매에 탄소가 침적된 것을 확인할 수 있었다.
Figure 9~11에는 2차 운전 결과를 나타내었다. 2차 운전은 반응압력 20 bar, g에서 최대 100 Nm3/h의 합성가스를 공급하여 진행하였으며, Figure 9와 같이 반응기 압력과 합성가스 공급 유량이 안정적으로 유지 되었다. 또한, 공급되는 H2/CO비도 Figure 10에 제시된 바와 같이 3정도 수준에서 안정적으로
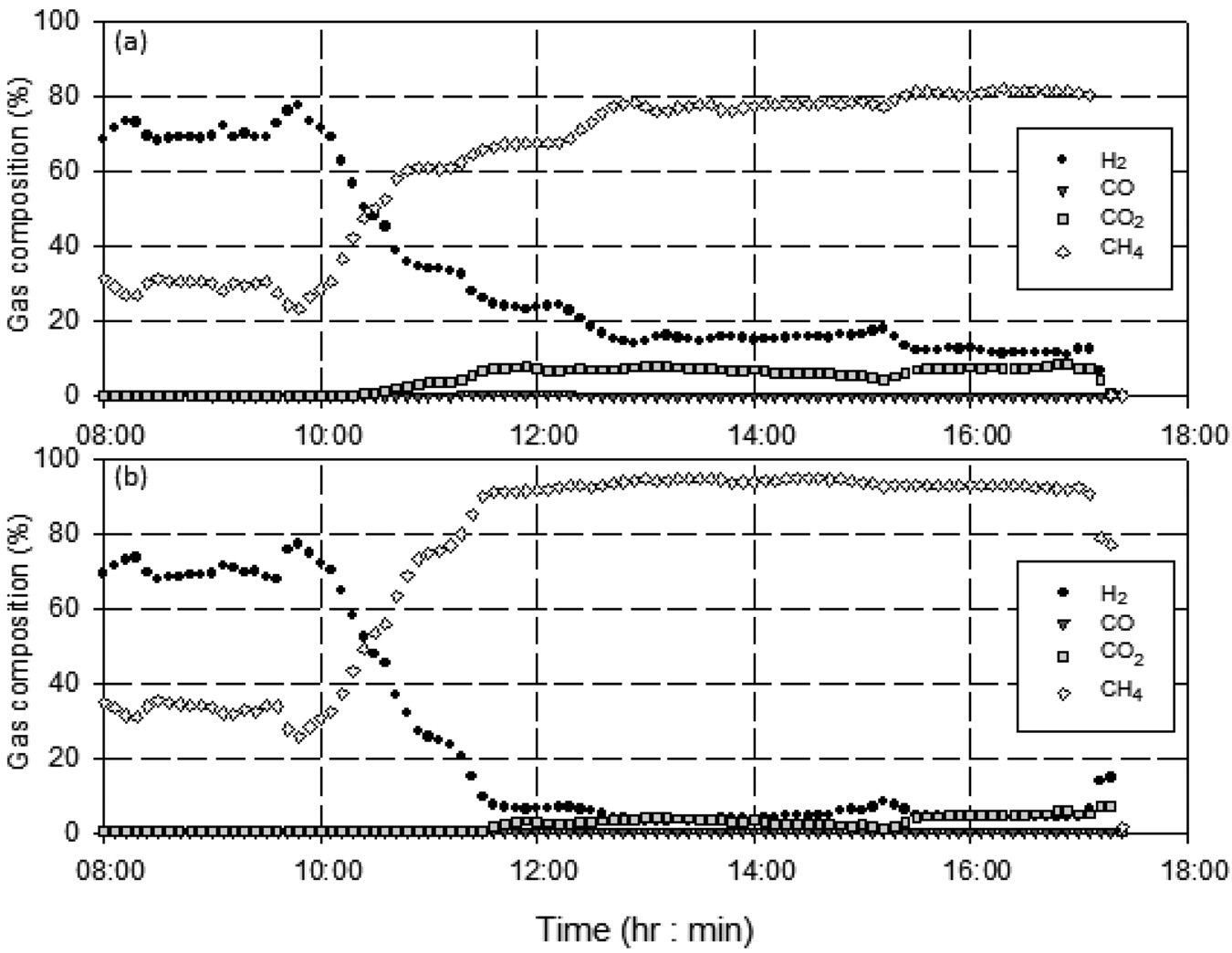
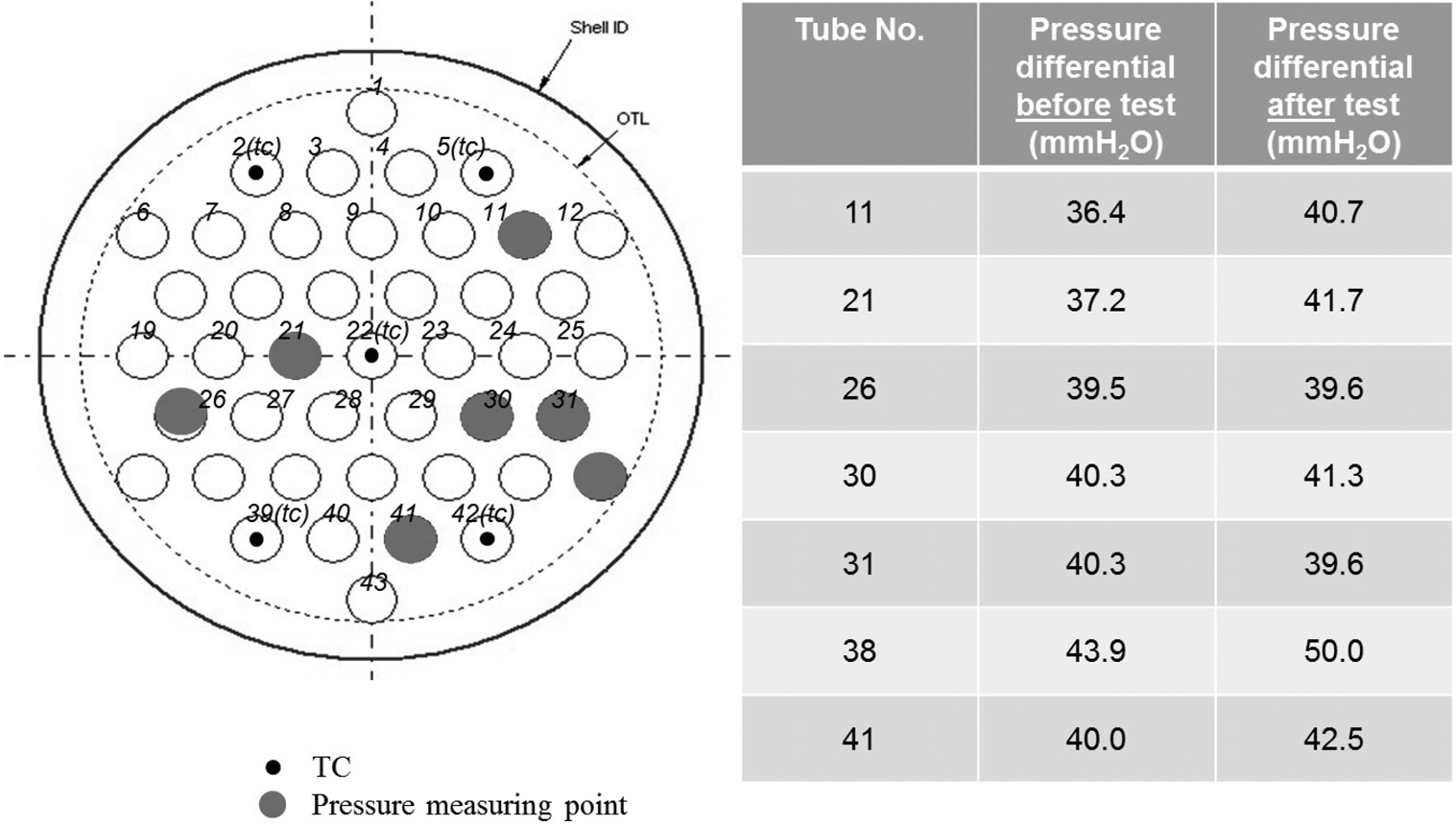
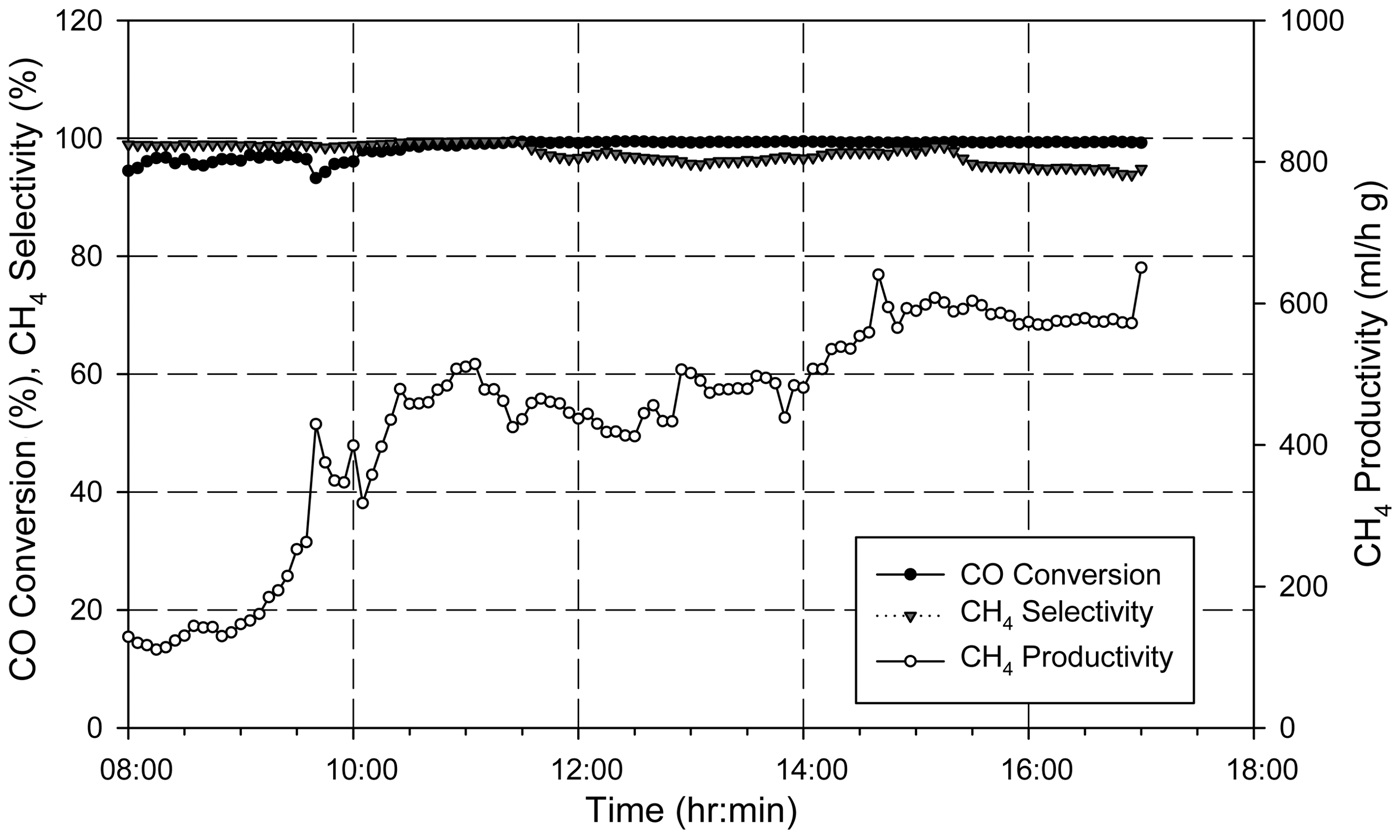
유지되었다. 반응기 압력, 합성가스 공급 유량, 공급되는 합성가스의 H2/CO 비가 일정하게 유지됨에 따라 등온반응기에서의 메탄합성 반응이 안정적으로 유지되어 등온반응기 출구에서의 메탄(CH4) 농도는 약 80% 수준을 나타내었다. 등온반응기에서 일부 미전환된 일산화탄소(CO)와 수소(H2)는 후단의 단열반응기에서의 메탄합성 반응을 거쳐 최종적으로 배출되는 SNG의 농도는 메탄(CH4) 농도는 93~95% 수준, 수소(H2)와 이산화탄소(CO2)를 합쳐 5%미만 수준으로 나타났으며 그 결과는 Figure 11에 나타내었다. 또한 H2/CO 비가 일정하게 유지되어 메탄합성 반응기로 공급되었기 때문에 1차 운전에서 발생하였던 반응기 차압의 증가 현상도 발생하지 않았고, 이를 검증하기 위하여 등온반응기의 촉매가 채워진 튜브 중 일부를 Figure 12와 같이 실험 전후의 차압을 측정하였는데, 실험 전후의 차압에 거의 변화가 없었다. 즉, 운전중의 등온반응기 전후단의 차압 증가 및 촉매가 채워진 튜브의 실험 전후 차압 측정 결과를 통해 2차 운전에서는 촉매내의 탄소 침적 현상이 일어나지 않은 것을 확인할 수 있었다. 일산화탄소(CO) 전환율은 Figure 13에 나타난 바와 같이 99% 이상으로 합성가스 내의 일산화탄소(CO)는 거의 전환되었으며, 메탄(CH4) 선택도는 97% 이상, 메탄(CH4) 생산성은 최대 695 ml/h·g-cat로
나타났다.
본 연구에서는 등온반응기와 단열반응기로 구성된 0.25 MW 메탄합성 파일롯 운전 실험을 통해 반응 특성을 파악하였다. 강제적으로 메탄합성 반응열을 제거하여 일정하게 반응기의 온도를 유지시키는 등온반응기와 단열반응기로 구성된 메탄합성 공정의 운전 결과 등온반응기 후단에서의 메탄농도가 80% 수준으로, 단열반응기의 조합으로 구성된 메탄합성 공정보다 첫번째 반응기에서 높은 전환율을 얻을 수 있었으며, 등온반응기 후단에 한개의 단열반응기를 추가하는 것만으로도 95% 이상의 메탄(CH4) 농도를 얻을 수 있었다. 이는 일반적으로 3~5개의 단열반응기 조합으로 구성된 메탄합성 공정에 비해 반응기 개수를 줄일 수 있다는 것을 의미한다. 또한 유입되는 합성가스의 H2/CO 비가 3보다 낮게 공급될 경우 촉매에 탄소 침적이 일어나 반응기 차압이 증가하고 메탄(CH4) 전환율이 낮아지는 것을 확인하였으며, H2/CO 비가 3으로 안정적으로 유지되는 경우에는 운전 중 반응기의 차압 및 실험 전후 촉매 차압 측정 결과로부터 탄소 침적이 일어나지 않아 최종 SNG 내의 메탄(CH4) 농도 95% 이상, 메탄(CH4) 선택도 97% 이상을 얻을 수 있었다.
Nm3/h : Normal cubic meter per hour
SNG : Synthesis Natural Gas or Substitute Natural Gas
MENA : Middle East North Africa

![Range of carbon deposition with H2/CO ratio and temperature[14].](http://oak.go.kr/repository/journal/12260/CJGSB2_2013_v19n2_156_f008.jpg)