CeO2에 담지된 구리산화물에서 벤젠의 촉매연소 반응에 대해 연구하였다. 담지된 구리산화물 촉매들은 볼밀법과 함침법으로 제조하였고, XRD, FT-IR, TEM 및 TPR에 의해 특성분석을 하였다. 볼밀법으로 제조된 CuO/CeO2 촉매는 높은 담지량에서도 잘 분산된 CuO를 얻었다. 볼밀법으로 제조된 CuO/CeO2 촉매는 함침법으로 제조된 촉매에 비해 높은 활성을 보여주었다. CuO의 담지량이 증가할수록 촉매 활성이 증가하였으며, 10 wt%로 담지된 촉매에서 가장 높은 활성을 나타내었다. 또한, 10 wt% CuO/CeO2 촉매에 소량의 Fe2O3와 CoO의 조촉매 첨가는 CuO의 분산도를 높여 반응활성을 증가시켰다.
방향족 화합물 중 하나인 벤젠은 석유화학, 페인트, 도장시설, 철강제조와 같은 화학공업 산업 전반에 개시물질로써 광범위하게 사용되고 있다. 이러한 휘발성 유기화합물의 제거방법으로 가장 효과적인 것으로 알려져 있는 촉매연소법은 낮은 반응온도에서 작용할 수 있다는 장점을 가지고 있다. 또한, 반응온도가 낮기 때문에 연간 운전비가 적게 들어 경제적이며 장치가 소형이므로 설비 확장이 용이하다는 장점을 가지고 있다. 일반적으로 Pt, Pd와 같은 귀금속 촉매는 휘발성 유기화합물의 산화에 대하여 높은 활성을 보여준다고 보고되고 있다[1]. 그러나 귀금속 촉매의 경우, 고가이고 염소나 황과 같은 촉매독의 존재 시 활성이 급격히 감소하기 때문에 귀금속 촉매와 유사한 활성을 가지면서 저렴한 촉매의 개발이 요구되고 있다. 따라서 이들 귀금속 촉매를 대신할 수 있는 촉매로써 제올라이트(zeolite), 층상점토(pillared clays) 및 페롭스카이트(perovskites) 등이 연구되고 있다[2-4].
이러한 귀금속을 대체하기 위해 전이금속을 이용한 촉매연구가 현재 많이 행해지고 있다. 그 중, 대표적인 전이금속산화물인 CuO를 이용한 촉매를 제조하여 유기 화합물을 제거하는 연구가 많이 진행되고 있다. 또한, 최근 연구에서 CeO2에 담지된 구리산화물 촉매들이 완전 산화반응에서 귀금속 촉매만큼의 활성을 보여준다고 보고되고 있다[5]. 특히, 구리산화물이나 CeO2에 담지된 구리산화물 촉매들은 일산화탄소, 메탄올 및 메탄의 완전 산화반응에서 아주 효과적인 것으로 보고되고 있다[6,7]. 여기서 CeO2는 금속에 대한 지지체 역할뿐만 아니라 산소를 보관하는 능력을 가지고 있으며, 금속의 분산성을 증가시키는 역할도 하고 있다. 또한, 촉매 내부의 활성점에 산소공백을 쉽게 생성시킴으로써 산화반응을 촉진시키는 능력을 가진 것으로 알려져 있다[8]. 이러한 금속과 지지체간의 상호작용은 특정한 반응에서 높은 촉매활성을 설명할 수 있다. 하지만, 이와 같은 금속과 지지체간의 상호작용은 촉매의 담지방법에 따라 달라지며 촉매의 활성에 큰 영향을 미치게 된다[8]. 따라서 다양한 담지방법은 금속촉매의 분산성과 형태에 변화를 야기시키게 되고, 촉매 활성에 있어서 큰 차이를 보여주게 된다. 현재 적용되고 있는 담지방법은 공침전법(coprecipitation method)[9], 함침법(impregnation method)[6] 및 솔-젤법(sol-gel method)[10] 등이 있다. 본 연구실에서는 메조동공체 및 이산화티탄 등에 다양한 방법으로 구리산화물을 담지시켰고 벤젠의 연소반응에 적용시킨 결과를 보고하였다[10,11].
따라서 본 연구에서는 CeO2에 볼밀법(ball mill method)으로 담지시킨 CuO 촉매를 제조하고, 이들의 물리적 특성을 조사하였고, 벤젠의 연소반응에서의 활성을 조사하였다. 또한, 볼밀법으로 제조된 CuO/CeO2 촉매에서 CuO의 담지량의 변화에 따른 화합물들의 물리적 특성 및 벤젠연소반응에서의 활성을 비교하였다.
볼밀법에서는 50 mL 크기의 혼합기에 3 g의 CeO2와 담지량에 따른 CuO 분말과 같이 넣어 준 다음, 알루미나 볼과 함께 ball mill 장치에 넣어 400 rpm의 속도로 24시간 동안 혼합시켜 촉매를 완성시킨다. 이때 CeO2에 CuO의 담지량을 1, 3, 5, 7, 10 wt%로 변화시켰다. 또한, 함침법에서는 먼저 Cu(NO3)2? 2.5H2O를 녹인 수용액을 이용하여 CeO2에 담지를 시켰다. 얻어진 화합물을 100 ℃에서 충분히 건조시킨 다음 500 ℃에서 3시간 동안 소성시켰다.
제조된 촉매의 결정성의 변화를 살펴보기 위해 X선 회절기(X-ray diffraction, XRD, Philips X’pert diffractometer, Cu-Kα)를 이용하였다. 그리고 촉매물질의 전기적 특성을 분석하기 위해 전자스핀공명(electron spin resonance, ESR, JEOL JEXPZ 2000-3000)을 이용하여 측정하였다. 제조된 촉매의 초미세구조 관찰 및 크기, 모양, 크기분포 등을 확인하기 위해 LaB6 필라멘트에 의해 200 kV로 가속된 투과전자현미경(transmission electron microscopy, TEM, JEOL, JEM-2020)을 사용하였다. 촉매들의 산화 및 환원상태를 알아보기 위해 500 mg의 촉매를 충전시킨 후 헬륨으로 희석된 5%의 수소를 사용하여 승온 환원 실험(temperature programmed reduction, TPR)을 행하였고, 승온환원 과정에서 소비되는 수소의 양과 생성되는 물의 양은 질량분석기(mass spectrometer, HIDEN Analytical, USA)를 이용하여 측정하였다.
촉매를 이용하여 벤젠을 제거하는 실험은 고정층 연속반응기를 사용하였다. 반응기는 직경 1 cm, 길이 24 cm인 석영관을 사용하였고, 촉매층에 삽입된 K-type의 열전대가 연결된 온도조절기로 반응온도를 100 ℃에서 500 ℃로 조절하였다. 가스는 헬륨(99.999%)과 산소(99.999%)를 사용하였고 각각의 가스는 수분 트랩을 거쳐서 질량흐름조절기(mass flow controller, MFC)를 거쳐서 유량을 조절하였고, 반응물인 벤젠은 헬륨에 의하여 기화되며 원하는 농도로 조절되어 반응기에 도입되었다. 반응물의 유량은 100 mL/min(공간속도; GHSV = 30,000 hr-1)로 조절하였다. 반웅물과 생성물의 분석은 FID 및 TCD가 장착된 가스 크로마토그래피(HP 5890 series II plus)를 사용하여 분석하였다. 벤젠과 이산화탄소의 분석을 위해 각각 Carbowax 및 Hysep Dip 컬럼을 사용하였다.
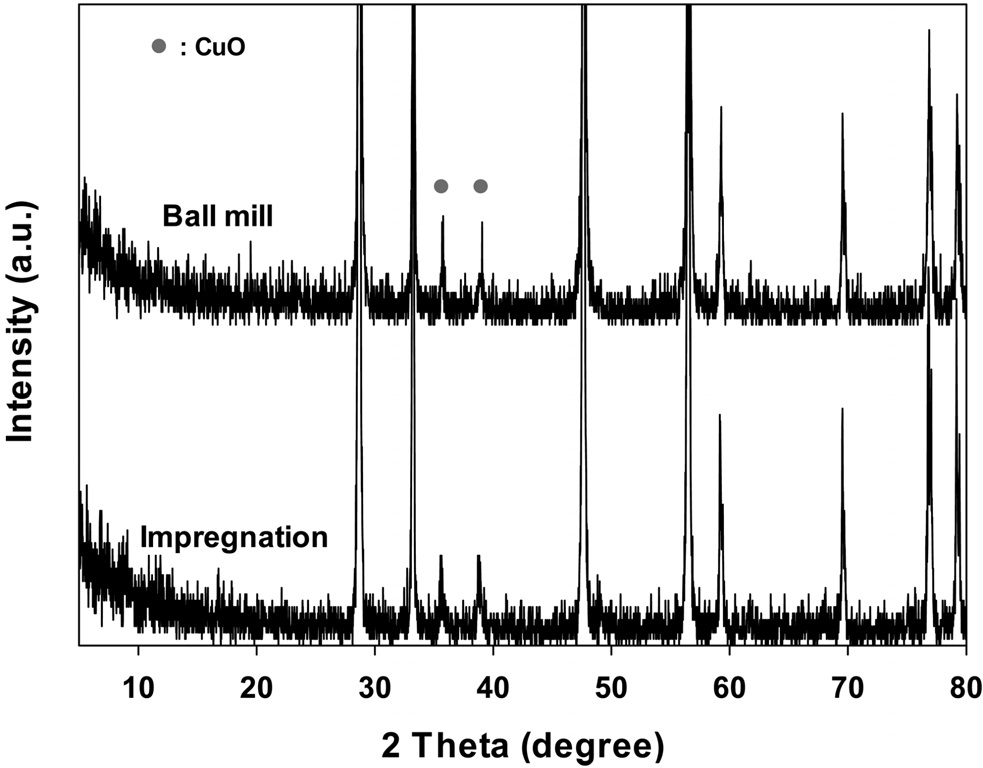
두 가지 방법으로 제조한 CuO/CeO2 촉매의 결정성을 알아보기 위해 XRD 측정을 행하여 그 결과를 Figure 1에 나타내었다. 제조 방법에 상관없이 CuO 피크가 2θ = 35.5°와 38.5°에서 뚜렷하게 나타났으며, 이것은 tenorite형 CuO의 강한 회절에 의해 나타나는 것으로 알려져 있다[12]. 따라서 CuO가 CeO2의 표면에 잘 담지되었음을 알 수 있다. 또한, 촉매들의 결정크기는 X-선 회절 피크에 상응하는 라인의 넓이로부터 미세 결정크기
위의 식으로부터 얻어진 촉매들의 결정의 크기는 21 nm에서 27 nm의 크기를 보여주었으며, 볼밀법으로 제조된 촉매가 가장 낮은 입자 크기를 나타내었다. 이것은 제조공정에서 CuO 입자가 CeO2 입자 위에 분산됨과 동시에 분쇄가 일어나 입자의 크기가 작아지는 것으로 생각된다.
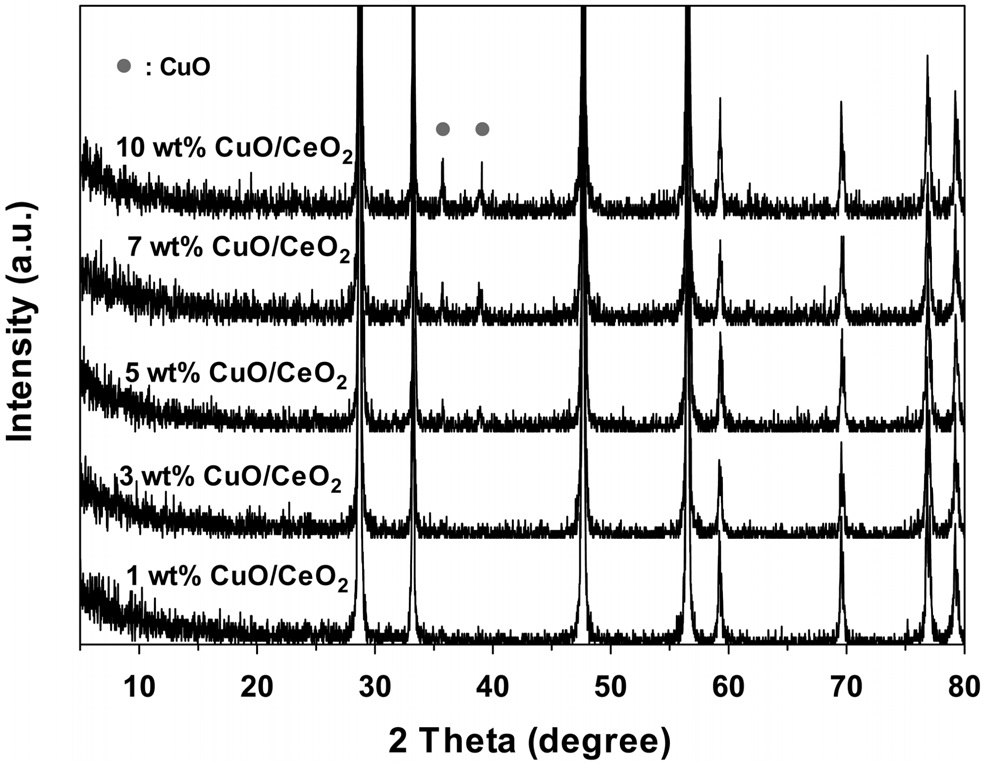
Figure 2에서 볼밀법에 의해 CuO의 담지량을 달리하여 제조한 CuO/CeO2 촉매의 XRD 결과를 나타내었다. 그림에서 나타나듯이 5 wt%가 담지된 경우에 CuO 피크가 약하게 나타나기 시작하였으며, 담지량이 증가할수록 입자의 크기가 증가하는 것을 볼 수 있다.
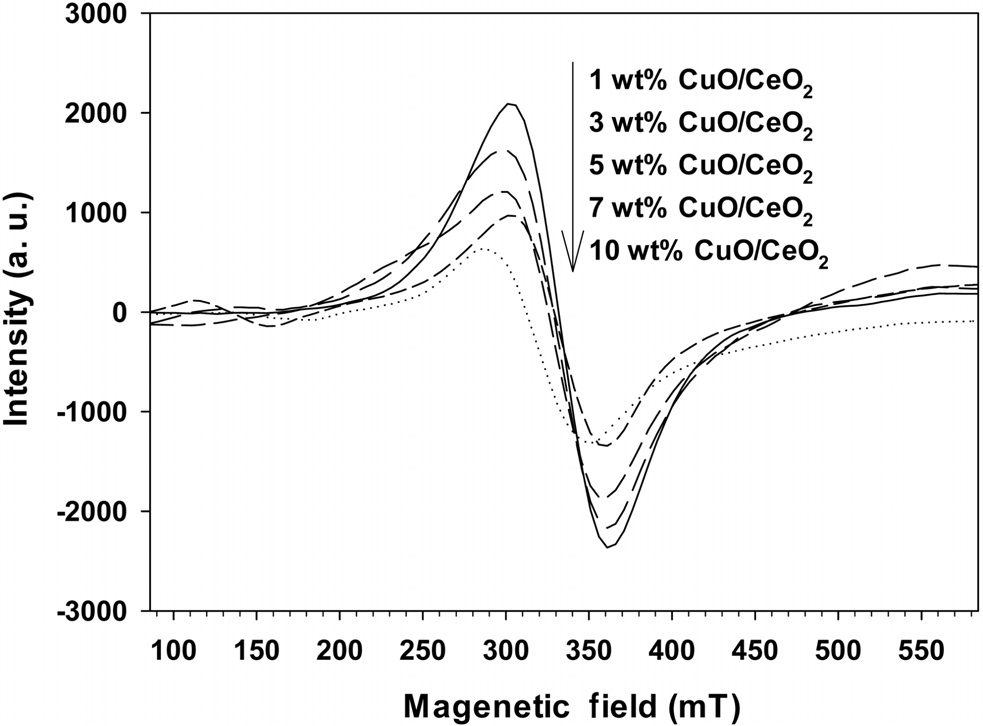
Figure 3에서 볼밀법으로 CuO의 담지량을 달리하여 제조한 CuO/CeO2 촉매의 ESR 결과를 나타내었다. 그림에서 나타난 스펙트럼은 찌그러진 팔면체로 배위된 Cu2+ 이온 때문에 나타나는 것으로 알려져 있으며[14], 잘 쪼개진 스펙트럼은 금속산화물의 표면에 고립된 Cu2+ 이온이 존재한다는 것을 의미한다[15].
CuO의 담지량이 증가할수록 ESR 피크의 크기가 줄어드는 것을 볼 수 있는데, 이것은 가까이 위치한 구리원자와 반자성결합을 형성하는 덩어리와의 강한 상호작용으로 생기는 쌍극자결합 때문으로 담지량이 많이 증가하면 ESR에 의해 검출되지 않게 된다[16]. 그럼에도 불구하고, 10 wt%로 담지된 CuO/CeO2 촉매에서도 ESR 스펙트럼이 여전히 나타나는 것으로 볼 수 있는데, 이전의 이산화티탄에 CuO를 담지시킨 촉매와 비슷한 결과를 보여주고 있다[11]. 이 결과는 CuO의 담지량이 10 wt%일 때도 CeO2의 표면에 비교적 잘 분산되어 있으며, 벤젠의 연소반응에서 활성점으로 작용하고 있음을 의미하고 있다.
제조된 촉매들의 모양과 크기를 알아보기 위해 TEM을 측정하였고, 그 결과를 Figure 4에 나타내었다.
함침법으로 제조한 촉매의 경우 불균일한 크기와 형태를 지닌 입자들이 불규칙적으로 담지된 것을 확인할 수 있었다. 또한, 다른 담지법과 달리 CuO 입자의 크기가 매우 다양하게 나타났으며 입자들 간의 뭉침현상이 쉽게 일어남을 확인할 수 있었다. 그러나 볼밀법으로 제조된 촉매에서는 함침법과는 달리 상대적으로 균일한 형태의 입자들이 담지된 것을 확인할 수 있었다.
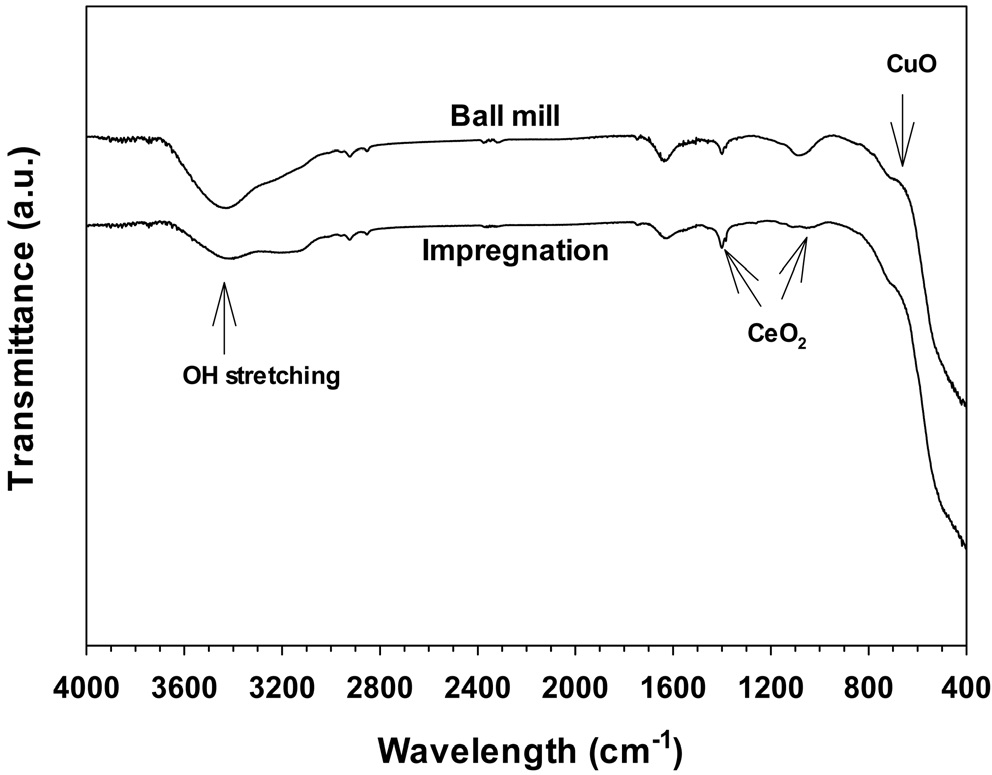
Figure 5에 여러가지 방법으로 제조된 CuO/CeO2 촉매의 FT-IR 측정결과를 나타내었다. 모든 촉매들은 728 cm-1 범위에서 약한 피크를 보여주는데, 이것은 CuO에 기인하는 것이다. 또한, CeO2 입자는 1413, 1072 및 721 cm-1 부근에서 나타나고 있다[16]. 1650 및 3365 cm-1 부근에서 나타나는 피크는 표면 수산기와 연관된 물리흡착된 물에 의한 것으로 생각된다.
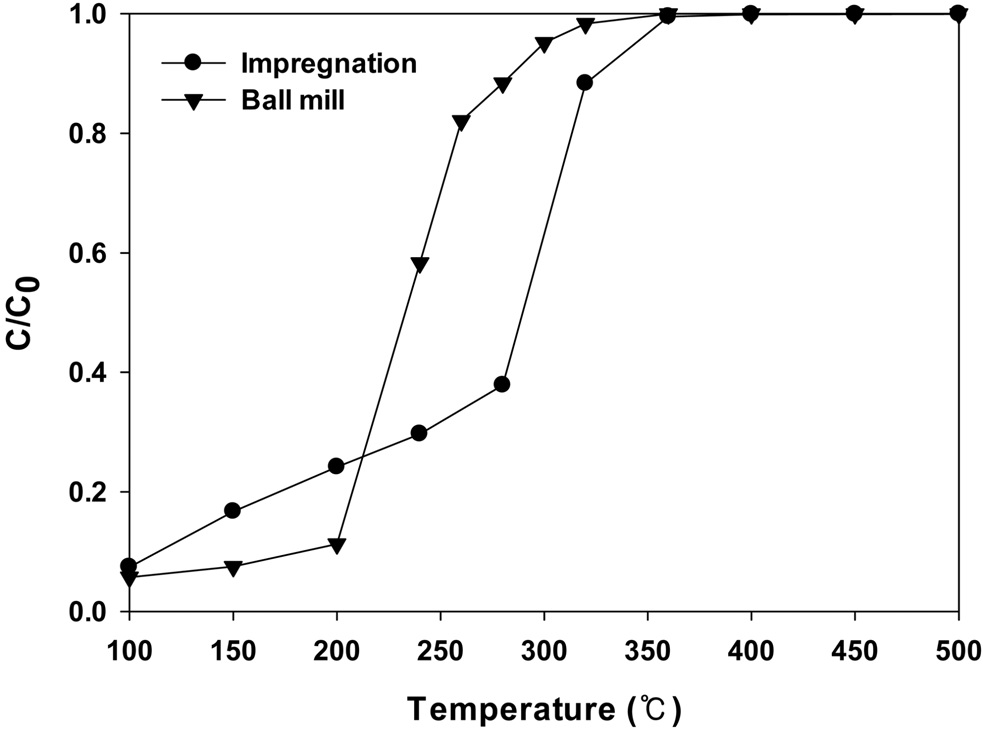
Figure 6에 여러가지 방법으로 제조된 CuO/CeO2 촉매에서 반응온도에 따른 벤젠의 연소반응의 전환율을 나타내었다. 대부분의 연소반응에서 나타나는 반응온도에 따라 전형적인 S형 곡선을 보여주고 있다. 또한, 전환율의 급격한 상승 역시 많은 산화반응에서 나타나고 있는데, 반응 후 배출가스와 함께 과잉으로 생성되는 열때문으로 알려져 있다[11]. 촉매를 사용하지 않은 벤젠연소에서는 2% 정도의 전환율만 보여졌으며, 반응 후 얻어지는 물질은 이산화탄소가 전부였고 다른 탄소를 함유한 물질은 나타나지 않았다.
Figure 6에 나타나듯이 볼밀법으로 담지된 촉매가 가장 높은 연소반응의 활성을 보여주었으며, 320 ℃에서 거의 모든 반응물이 연소되는 것을 볼 수 있다. 따라서 담지방법에 따라 촉매 활성이 달라지는 것을 볼 수 있다.
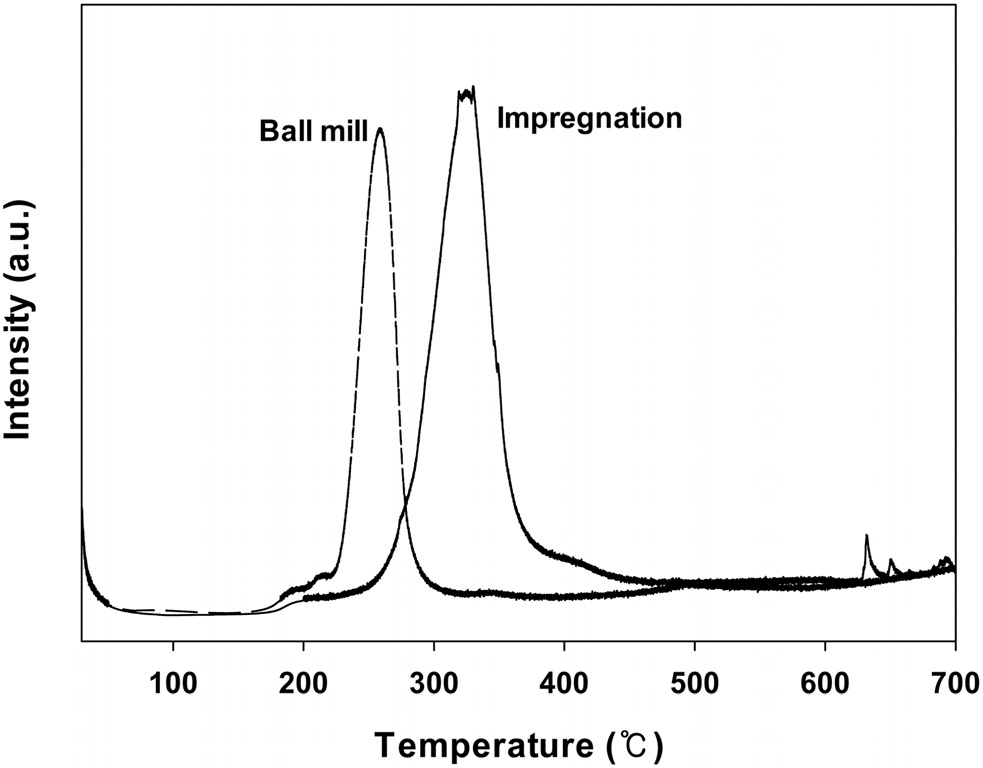
여러가지 방법으로 제조된 CuO/CeO2 촉매들의 산화 및 환원성질(redox property)을 알아보기 위해 수소를 사용한 승온 환원 실험을 행하여 그 결과를 Figure 7에 나타내었다.
볼밀법으로 제조된 촉매의 경우에는 250 ℃ 부근에서 환원 피크가 나타나는 반면에 함침법으로 제조된 촉매의 경우에는 훨씬 높은 325 ℃ 부근에서 환원피크가 나타났다. Gallardomores et al.[18]에 의하면 CuO가 알루미나에 담지된 촉매들의 수소 승온환원 실험에서 두 개의 환원피크가 나타나고 낮은 온도에서 나타나는 피크는 알루미나에 잘 분산된 CuO의 환원에 기인하는 것이고 높은 온도에서 나타나는 피크는 CuO 덩어리에 기인하는 것으로 보고하고 있다. 그러나 본 연구에서는
낮은 온도에서 한 개의 환원피크만 나타나고 함침법의 경우에는 높은 온도에서 작은 환원피크가 나타났다. 따라서 본 연구에서 제조된 촉매들은 CeO2의 표면에 비교적 잘 분산된 CuO만이 존재한다는 것을 의미한다. 또한, 환원피크가 나타나는 온도가 낮아질수록 촉매의 산화환원(redox) 성질이 좋아져 촉매 활성이 증가하는 것으로 이전의 연구에서 나타났다[18]. 따라서 볼밀법으로 제조된 CuO/CeO2 촉매가 가장 우수한 산화환원 성질을 가지므로 높은 활성을 나타내는 것으로 생각된다.
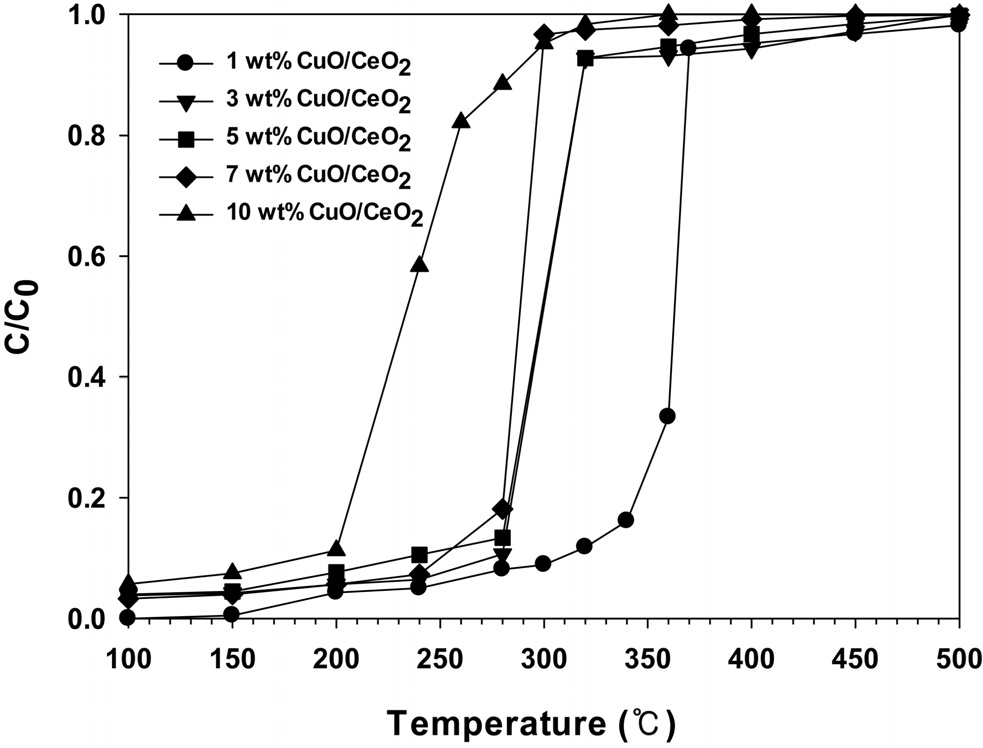
Figure 8에 CuO의 담지량을 달리하여 제조한 CuO/CeO2 촉매에서 반응온도에 따른 벤젠의 연소반응의 전환율을 나타내었다. 순수한 CeO2 촉매는 매우 낮은 반응활성을 보여주었는데, 이것은 벤젠의 연소반응에서 CeO2 표면의 CuO가 반응의 활성점으로 작용한다는 것을 의미한다. 또한, CuO의 담지량이
증가할수록 반응활성이 증가하는 것을 볼 수 있으며, 7 wt%가 담지된 경우에 320 ℃ 부근에서 벤젠이 전부 연소되는 것을 볼 수 있다.
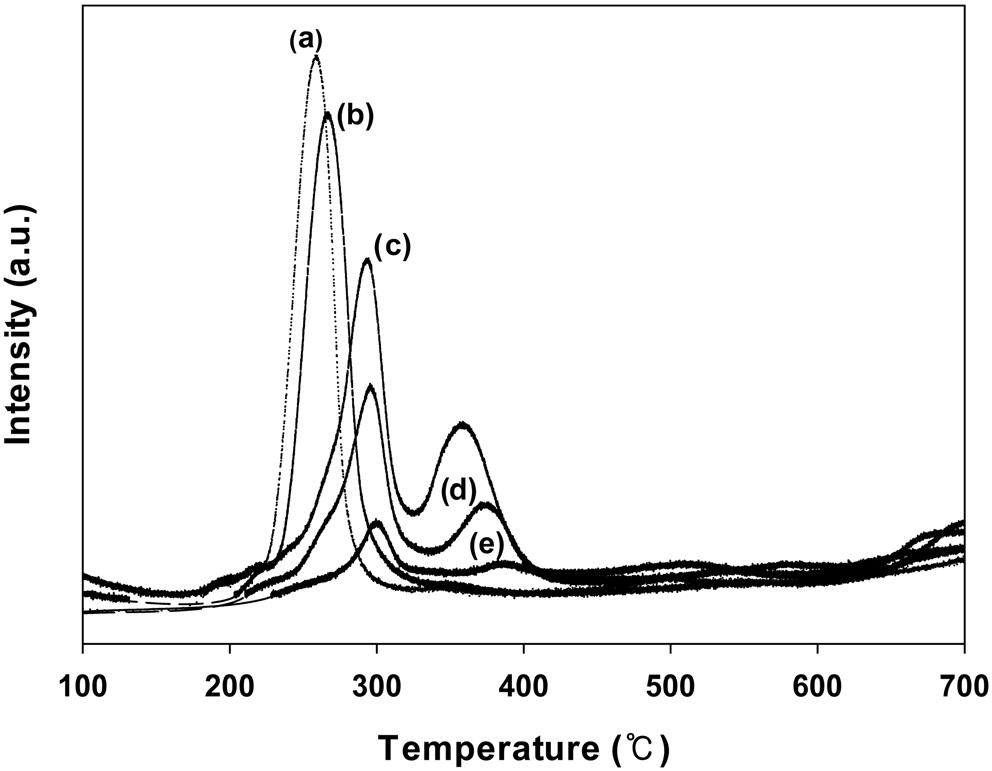
Figure 9에는 CuO의 담지량을 달리하여 제조한 CuO/CeO2 촉매의 수소 승온환원실험의 결과를 나타내었다.
CuO의 담지량이 5 wt% 이하에서는 280 ℃ 부근의 온도와 370 ℃ 부근의 온도에서 두 개의 환원피크가 나타났다. 그러나 CuO가 7 wt% 이상으로 담지된 촉매에서는 250 ℃ 이하의 온도에서 한 개의 환원피크만 나타났다. 또한, 담지량이 증가할수록 낮은 온도에서 나타나는 환원피크의 세기가 커지는 것을 볼 수 있다. 앞에서 언급한 것처럼 낮은 온도에서 나타나는 환원피크는 CeO2 표면에 비교적 잘 분산된 CuO에 기인하는 것으로 벤젠의 연소반응에서 활성점으로 작용하는 것으로 생각된다. CuO의 담지량이 증가할수록 CeO2 표면에 분산된 CuO에 의해 나타나는 피크의 크기가 증가하는 것을 볼 수 있다. 이 결과는 이들 촉매의 산화환원 성질을 향상시켜 활성을 증가시키는 것으로 생각된다.
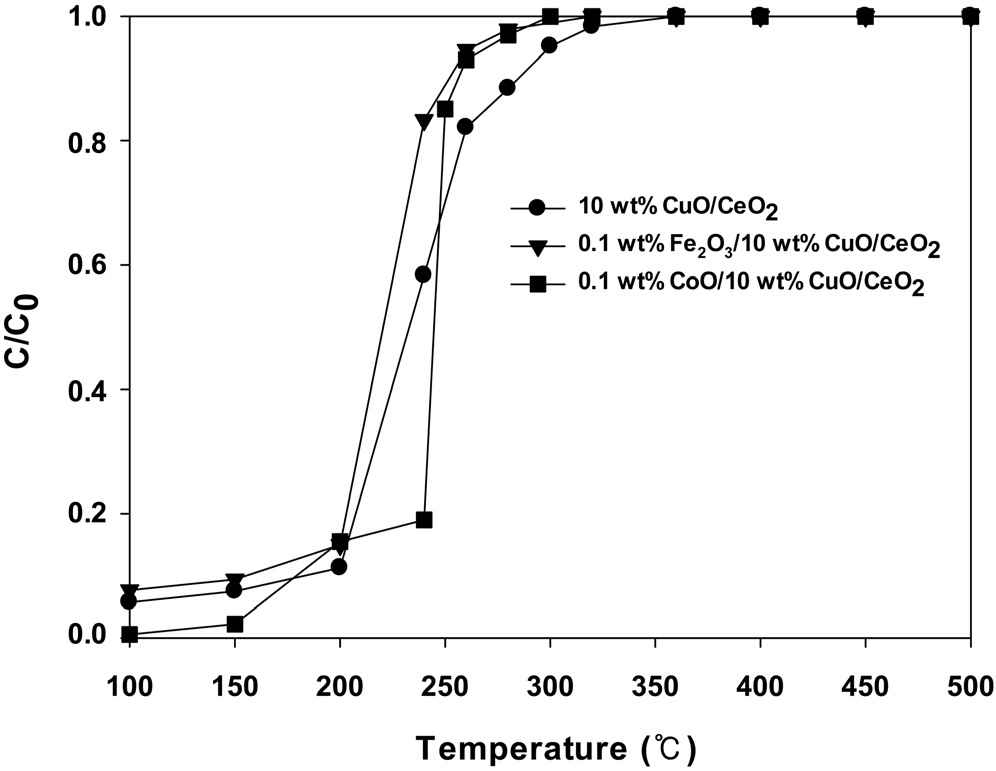
담체 표면에서 CuO의 분산도와 상호작용은 산화반응에서 촉매활성에 큰 영향을 미치며, 이들 성질을 개선하기 위해 조촉매를 첨가하는 경우가 있다[19]. 따라서 본 연구에서는 가장 높은 활성을 보인 10 wt% CuO/CeO2 촉매에 조촉매로써 Fe2O3와 CoO를 소량 첨가한 촉매를 제조하여 벤젠의 연소반응에서 전환율을 구하여 Figure 10에 그 결과를 나타내었다.
그림에서 나타나듯이 10 wt% CuO/CeO2 촉매에 0.1 wt%의 Fe2O3나 CoO의 첨가는 벤젠 연소반응의 활성을 증가시켜 벤젠의 완전연소의 온도를 350 ℃에서 300 ℃로 약 50 ℃ 정도 감소시키는 것을 볼 수 있다. 이것은 조촉매로 첨가된 Fe2O3나 CoO가 CeO2 표면에서 CuO의 분산도를 증가시켜 반응활성을 높이기 때문으로 생각된다. 이와 같은 결과는 Avgouropoulos et al.[20]이 행한 실험과 비슷한 경향성을 나타내고 있다. 또한, Fe2O3나 CoO의 첨가에 의해 CuO의 분산도가 증가하는 것은
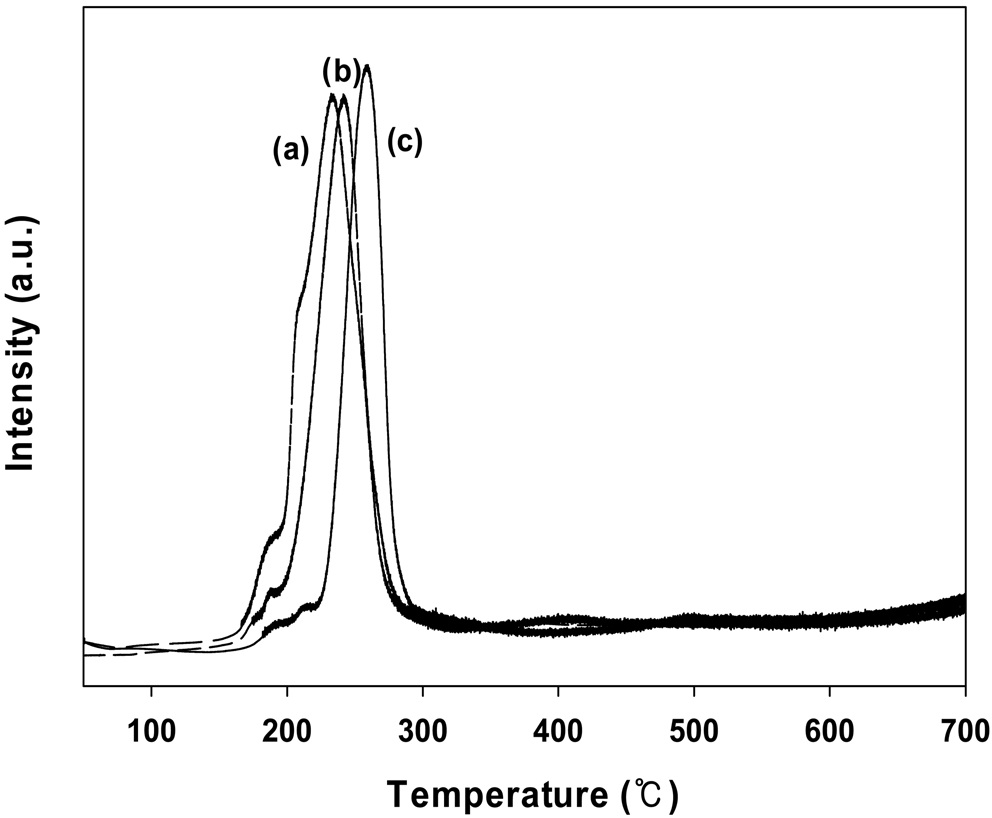
Figure 11의 수소 승온환원 실험 결과에서 확인할 수 있다. 그림에서 나타나듯이 Fe2O3나 CoO가 첨가된 촉매의 TPR 피크는 순수한 10 wt% CuO/CeO2 촉매에 비해 낮은 온도쪽으로 이동하는 것을 볼 수 있다. 따라서 Fe2O3나 CoO가 첨가된 10 wt% CuO/CeO2 촉매에서 잘 분산된 CuO 양이 증가함으로써 촉매의 산화환원 성질을 향상시켜 촉매 활성이 증가하는 것으로 생각된다.
볼밀법 및 함침법을 사용하여 CeO2에 담지된 구리산화물 촉매를 제조하였다. 담지된 구리산화물 촉매들은 XRD, FT-IR, TEM 및 TPR에 의해 특성분석을 하였으며, 벤젠의 완전연소 반응에서의 활성을 조사하였다. 제조법에 관계없이 제조된 촉매들은 tenorite형 CuO 구조를 나타내었으며, 담지량이 5 wt% 이상에서만 CuO 피크가 나타났다. 볼밀법으로 제조된 CuO/CeO2 촉매는 높은 담지량에서도 잘 분산된 CuO가 얻어졌다. 볼밀법으로 제조된 CuO/CeO2 촉매는 함침법으로 제조된 촉매에 비해 높은 활성을 보여주었다. CuO의 담지량이 증가할수록 촉매 활성이 증가하였으며, 10 wt%로 담지된 촉매에서 가장 높은 활성을 나타내었다. 또한, 10 wt% CuO/CeO2 촉매에 소량의 Fe2O3와 CoO의 조촉매 첨가는 CuO의 분산도를 높여서 반응활성을 증가시켰다.