In this study, we investigated the activity of Pd and Cu co-incorporated on mesoporous silica support such as MCM-41 and SBA-15 for catalytic nitrate reduction in water. In pure hydrogen flow, nitrate concentration was gradually decreased with the reaction time, but nitrogen selectivity was too low due to very high pH of reaction medium after the reaction. In order to acquire high nitrogen selectivity, we utilized carbon dioxide as a pH buffer, which resulted in higher nitrogen selectivity (about 40%). For the above reaction conditions, Pd-Cu/MCM-41 showed better performance than Pd-Cu/SBA-15. The physicochemical properties of both catalysts were investigated to figure out the relationship between the characteristics of the catalysts and the catalytic activity on the catalytic nitrate reduction by N2 adsoprtion-desorption, X-ray diffraction (XRD), H2-temperature programmed reduction, X-ray photoelectron spectroscopy (XPS) techniques.
본 연구에서는 중형 기공성 실리카 담체인 MCM-41과 SBA-15를 활용하여 팔라듐과 구리를 담지한 후, 제조 촉매의 수중 질산성 질소 저감 반응 활성을 평가하였다. 순수 수소 공급 반응 조건에서, 질산성 질소의 농도는 반응 시간에 따라 점차 저감 되었지만, 반응기 내부에 높게 형성된 pH로 인해 질소의 선택도가 매우 낮은 문제점이 발견되었다. 이를 해결하기 위해 이산화탄소를 수소와 함께 공급하여 pH의 안정화를 도모하였고, 질소 선택도를 40% 가량 증가시켰다. 상기 두 반응 조건에서 모두 Pd-Cu/MCM-41가 Pd-Cu/SBA-15보다 높은 활성을 나타냈다. 이와 같이 수중 질산성 질소 저감 반응의 활성에 차이를 보이는 두 촉매에 대하여, 질소 흡-탈착, XRD, H2-TPR, XPS 등과 같은 특성 분석을 수행하여 제조 촉매의 구조와 물성이 반응활성에 미치는 영향을 검토해보았다.
수중 질산성 질소(nitrate: NO3-)는 자연적인 질소 순환, 산업 폐수의 방류, 농업 비료 등에 의해 생성되며 잠재적으로 위험한 물질로 규정되어 있다[1,2]. 질산성 질소가 인체에 유입될 시, 체내의 미생물에 의해 아질산성 질소(nitrite: NO2 -)로 전환되며, 이는 인체 내 헤모글로빈의 활성 작용을 방해하여 청색증(blue baby syndrome)을 유발하는 것으로 알려져 있다[3,4]. 이러한 문제점을 방지하기 위해 미국 환경보호청(environmental protection agency, EPA), 세계보건기구(world health organization, WHO), 유럽공동체(european community, EU)에서 각각 10, 25, 50 ppm의 질산성 질소 규제치를 설정하였다[5]. 최근 강화되고 있는 질산성 질소의 허용 기준을 충족하기 위해, 질산성 질소를 제거하기 위한 다양한 방법들이 개발되고 있다. 대표적으로 물리화학적, 생물학적 처리법을 들 수 있는데, 물리화학적 처리법은 역삼투압법, 전기영동법, 이온교환법 등이 대표적으로 활용되고 있다[6]. 하지만 처리 후 발생하는 브라인(brine)을 후처리해야 하는 단점을 보이고 있다[7,8]. 생물학적 처리법 또한 질산성 질소 저감에 적용되고 있지만, 처리수에 잔류해있는 미생물로 인한 2차 오염물이 발견되고 있어 장기적인 대안으로 기대하기 어렵다[9]. 따라서 앞서 개발된 처리법들의 단점을 보완하기 위해, 촉매를 활용한 질산성 질소 저감 기술이 대두되었다[10]. 촉매 처리법은 다른 방법에 비해 비교적 다양한 반응 조건에서 높은 질산성 질소의 저감률을 보이며, 경제적이고 효과적인 처리법으로 평가받고 있다[11]. 촉매를 적용한 질산성 질소의 저감 반응은 다음의 식 (1), (2), (3)과 같이 제시되어 있다.
질산성 질소는 중간 생성물인 아질산성 질소로 환원된 후, 암모늄 및 질소로 최종 전환된다.
질산성 질소 저감 반응용 촉매는 단일 금속보다 이중 금속 (귀금속-비귀금속) 담지 촉매가 높은 활성을 보였다[12-14]. 귀금속은 팔라듐과 백금이 주로 사용되었고, 구리, 인듐, 주석 등이 비귀금속으로 적용되었다[15-18]. 이 중, 팔라듐-구리가 담지된 촉매가 가장 우수한 성능을 나타내는 것으로 보고되고 있다[19-21]. 최근에는 이를 바탕으로 다양한 담체를 적용하여 촉매 성능 개선에 초점을 맞추고 있는 추세이다. Neyertz et al.[22]은 수지(resin)를 담체로 이용하여 파일롯 크기의 공정에 적용한 바 있고, Maia et al.[23]은 나이오븀 산화물(Nb2O5) 및 알루미나(Al2O3)가 효과적인 성능을 나타낸다고 보고하였다. 또한 알루미나-티타니아(TiO2) 등 이중 금속 산화물을 활용하여 촉매 활성 증진을 이룬 연구도 알려져 있다[24]. 하지만 반응 중 반응물 및 생성물의 원활한 물질 전달에 강점을 가지는 중형 기공성 실리카 담체에 대한 연구는 최근까지 발표되지 않았다. 중형 기공성 담체에 활성 금속의 담지 시, 활성 금속의 입자 크기 및 담체 기공 내 활성 금속의 분포 등이 다양한 결과를 보이게 되고, 이로 인해 촉매의 성능이 달라지는 것으로 보고되고 있다[25]. 따라서 본 반응에 적합한 중형 기공성 실리카 담체를 탐색하고, 반응 활성에 영향을 미치는 요인을 파악하는 것은 매우 중요하다고 할 수 있다.
본 연구에서는 중형 기공성 실리카 담체 중 MCM-41과 SBA-15를 활용하여 팔라듐 및 구리를 담지한 촉매를 제조하였으며, 제조된 촉매의 구조, 물성이 수중 질산성 저감 반응의 활성에 어떠한 영향을 미치는지 알아보고자 하였다.
MCM-41 및 SBA-15는 선행 보고된 문헌을 참조하여 제조하였다[26,27]. MCM-41의 합성과정은, 300 mL의 3차 증류수 에 계면활성제인 CTAB (cetyl trimethyl ammonium bromide)을 첨가하여 막대 형태의 미셀(micelle)을 형성시킨 후, 암모니아 수를 첨가하여 실리카의 침전을 유도하는 용액을 제조하였다. 상기 혼합물에 MCM-41 담체의 구조를 이루는 실리카의 전구 체인 TEOS (tetra ethyl ortho silicate)를 첨가하여 1시간 동안 반응시킨 후 침전물을 생성하였다. 생성된 침전물과 액상혼합 물을 여과 분리한 후, 80 ℃에서 12시간 동안 건조하였고, 550 ℃에서 5시간 동안 소성처리 하였다. SBA-15 제조를 위해 triblock 공중합체인 Pluronic P123 (poly(ethylene glycol)-blockpoly( propylene glycol)-block-polyethylene glycol)) 12 g을 341 mL 증류수에 충분히 녹인 후, 염산(37%)을 49 mL 첨가하여 균일한 용액을 제조하였다. 제조된 용액을 상온에서 2시간 동안 교반시킨 후, TEOS 27 mL를 첨가하여 20시간 동안 상온에서 균일하게 혼합시킨다. 균일한 용액을 24시간 동안 80 ℃에서 숙성시키고, 여과하였다. 110 ℃에서 24시간 건조한 후, 550 ℃에서 6시간 동안 소성하였다.
Pd(NO3)2?2H2O (Aldrich, 99%), Cu(NO3)2?2.5H2O (Aldrich, 98%)를 증류수에 녹여 목표하는 담지량(팔라듐: 3 wt%, 구리: 1 wt%)의 전구체 용액을 제조하였다. 이 용액을 이용하여 앞서 제조한 MCM-41, SBA-15에 함침법(incipient wetness method)을 통해 팔라듐과 구리를 담지시켰다. 제조된 촉매는 100 ℃에서 24시간 건조시키고 공기 분위기에서 300 ℃ 소성을 6시간 동안 수행하였고, 200 ℃에서 10% H2/N2 가스를 이용하여 환원 처리를 한 후, 최종적으로 촉매 제조를 완료하였다.
촉매의 비표면적과 기공부피를 측정하기 위해 Micromeritics 사의 ASAP 2010을 이용하여 질소 흡-탈착 분석을 수행하였다. 분석에 앞서 촉매 기공내의 수분을 제거하기 위해 각 샘플을 3 mmHg 하에서 6시간 동안 200 ℃로 가열하여 전처리하였다. 촉매 내 활성금속인 팔라듐 및 구리의 정량 분석을 위해 ICP-AES 분석을 수행하였다. 분석기는 Jobin Yvon사의 138 Ultrace를 이용하였다.
촉매의 결정 구조를 확인하기 위해 X-선 회절(X-ray diffraction, XRD)분석을 수행하였다. Rigaku사 Rotaflex 모델을 이용하였고, X선은 40 kV, 150 mA의 조건으로 사용하였다. 스캔 범위는 10~80°, 스캔 간격은 0.01°, 스캔 속도는 4°/분으로 설정하였다.
제조된 촉매의 환원성은 BELCAT-M-77 (BEL JAPAN Inc.) 을 이용하여 H2-temperature programmed reduction (TPR)분석을 통해 측정하였다. 샘플의 양은 0.05 g이었으며, 200 ℃에서 He을 50 ml/min으로 흘려주면서 1시간 동안 전처리한 후 상온으로 냉각시켰다. 촉매에 5% H2/N2 혼합기체를 30 ml/min으로 흘려주면서 500 ℃까지 승온하며 TPR 분석을 수행하였다.
또한 제조된 촉매 내각 성분의 산화상태를 평가하기 위해 X- 선 광전자 분광 분석(X-ray photoelectron spectroscopy, XPS)을 수행하였고, Al- Kα 광원(1486.6 eV)을 적용하였다. 모든 결합 에너지는 C1s의 결합에너지(284.6 eV)를 이용하여 보정하였다.
수중 질산성 질소 저감 반응의 촉매 활성을 평가하기 위하여, 회분식 반응시스템을 이용하였다. 회분식 반응시스템은 300 mL 반응기와 1,000 rpm까지 구동이 가능한 마그네틱 교반기, 반응기에 환원분위기를 조성할 수 있는 기상 수소의 주입구 및 반응기의 온도를 측정할 수 있는 온도 센서로 구성되어 있다. 기상 수소는 질량 유량계(MFC, 5850E, Brooks)를 통해 반응용액 내부로 주입하였고, 스파저를 이용하여 기상 수소와 반응용액과의 충분한 접촉면적을 갖도록 하였다. 반응기 내 온도 제어를 위해 반응기를 이중 자켓으로 설계하여, 반응기 벽 외부에 목표 온도로 제어된 용액이 흐르게 하였다. 또한 pH의 정확한 측정을 위하여, pH 전극을 반응기 내에 설치하였다. 반응 전, 295 mL의 증류수와 촉매가 혼합된 용액을 질소 가스를 이용하여 퍼지하였고, 수소(90 ml/min)와 5 mL의 반응물(2 mM)을 동시에 주입하여 실험을 수행하였다.
반응 시간에 따른 미전환된 질산성 질소(nitrate), 생성된 아질산성 질소(nitrite) 및 암모늄(ammonium)을 측정하기 위하여, 일정한 간격마다 반응 용액을 추출하였다. 반응 후 질산성 및 아질산성 질소는 Zorbax Eclipse C18 컬럼이 장착된 액체 크로 마토그래피(영린기기)를 통해 측정하였고, 암모늄은 Ionpac CS12A 컬럼이 장착된 이온 크로마토그래피(Dionex)로 분석 하였다.
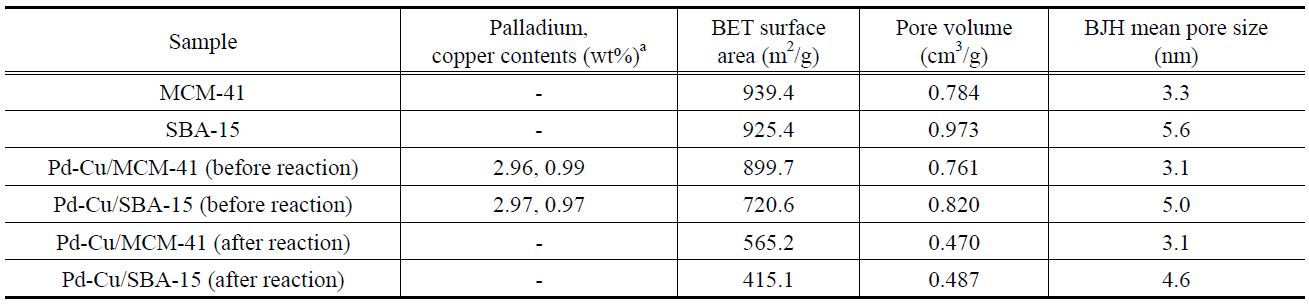
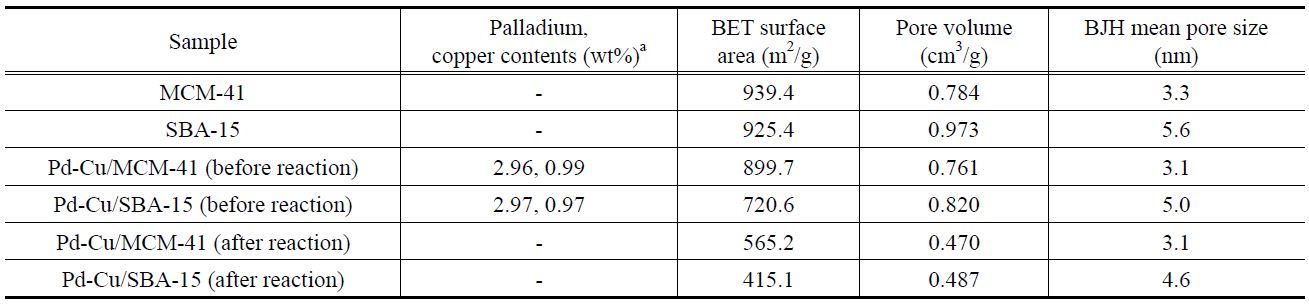
Figure 1에 MCM-41, SBA-15, Pd-Cu/MCM-41, Pd-Cu/SBA-15의 질소 흡-탈착 분석 결과를 도시하였다. 모두 히스테리시스가 잘 발달되어, type IV에 해당하는 흡착 등온선을 나타냈 다[28]. MCM-41 및 SBA-15는 각각 상대압력이 0.30~0.38, 0.50~0.78일 때 흡착된 질소의 양이 급격한 변화를 보였으며, 이는 중형 기공에 의한 질소의 모세관 응축 현상에 의한 것이다. 이러한 현상은 기공의 크기가 일정한 경우에 일어나는 변화로 알려져 있다[29]. Pd-Cu/MCM-41, Pd-Cu/SBA-15의 경우, 담체에 비해 질소 흡-탈착 등온선의 형태가 약간 변화되었다. 담체에 비해 질소 흡착량이 크게 증가하는 상대 압력의 위치가 낮은 쪽으로 이동하였는데, 각각 0.29~0.36, 0.42~0.75인 것으
[Table 1.] ICP-AES results and BET properties of the prepared mesoporous support materials
ICP-AES results and BET properties of the prepared mesoporous support materials
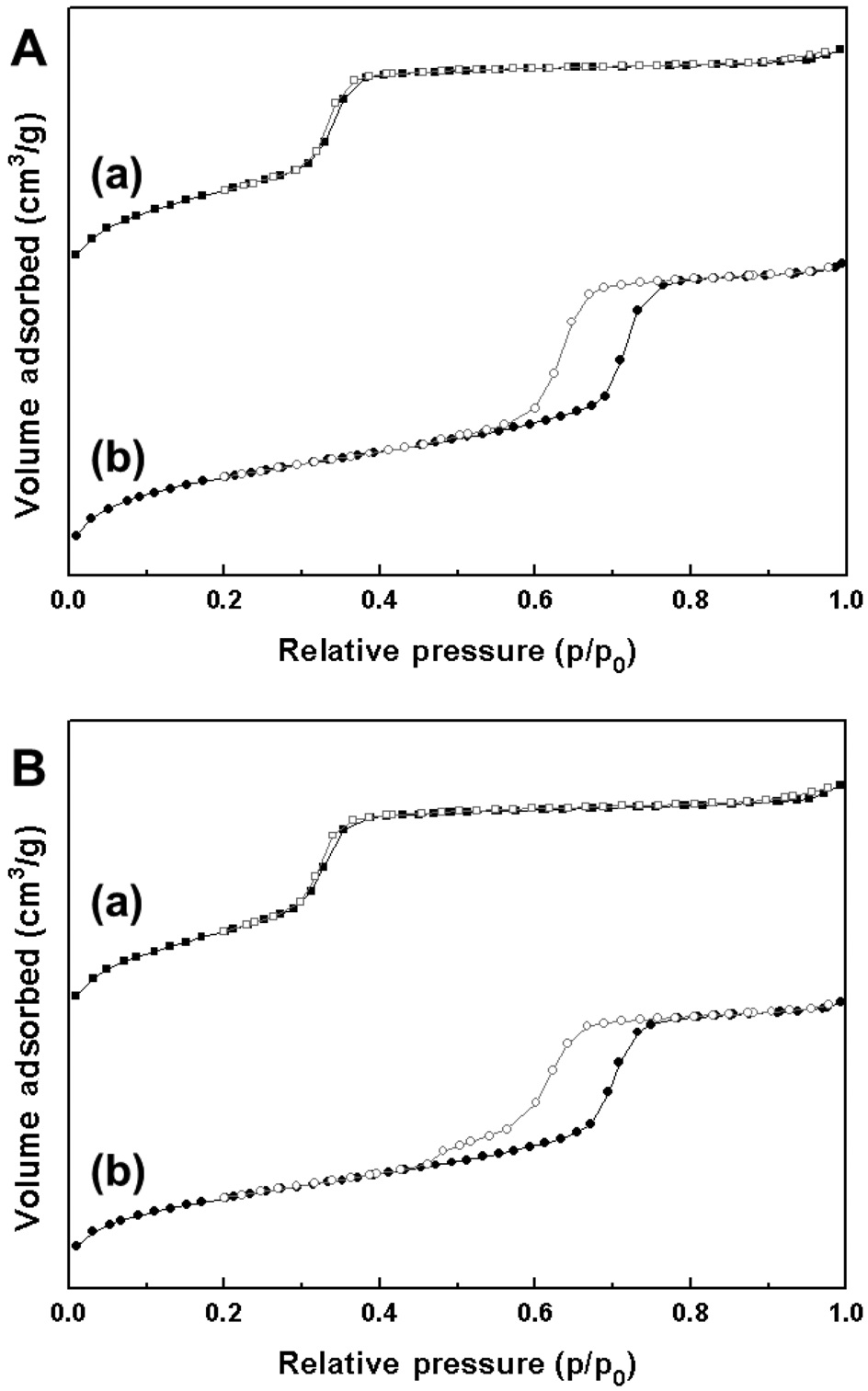
로 나타났다. 이는 팔라듐과 구리의 담지로 인해 각 담체의 기공이 부분적으로 막힌 현상으로 인해 발생한 것으로 판단되었다. Figure 2는 BJH 법을 이용한 각 담체 및 담지 촉매의 기공 크기 분포를 나타낸 것이다. MCM-41 및 SBA-15 담체는 각각 3.3 nm, 5.6 nm의 균일한 중형기공을 가지는 것이 확인되었다.
Pd-Cu/MCM-41과 Pd-Cu/SBA-15의 경우, 전체적인 기공부피와 기공크기가 소량 줄어든 것으로 보였으나, 균일한 구조를 유지하는 것으로 나타났다. Table 1에 각 물질별 비표면적 및 기공 부피, 평균 기공크기, 활성금속의 담지량 결과를 정리하였다.
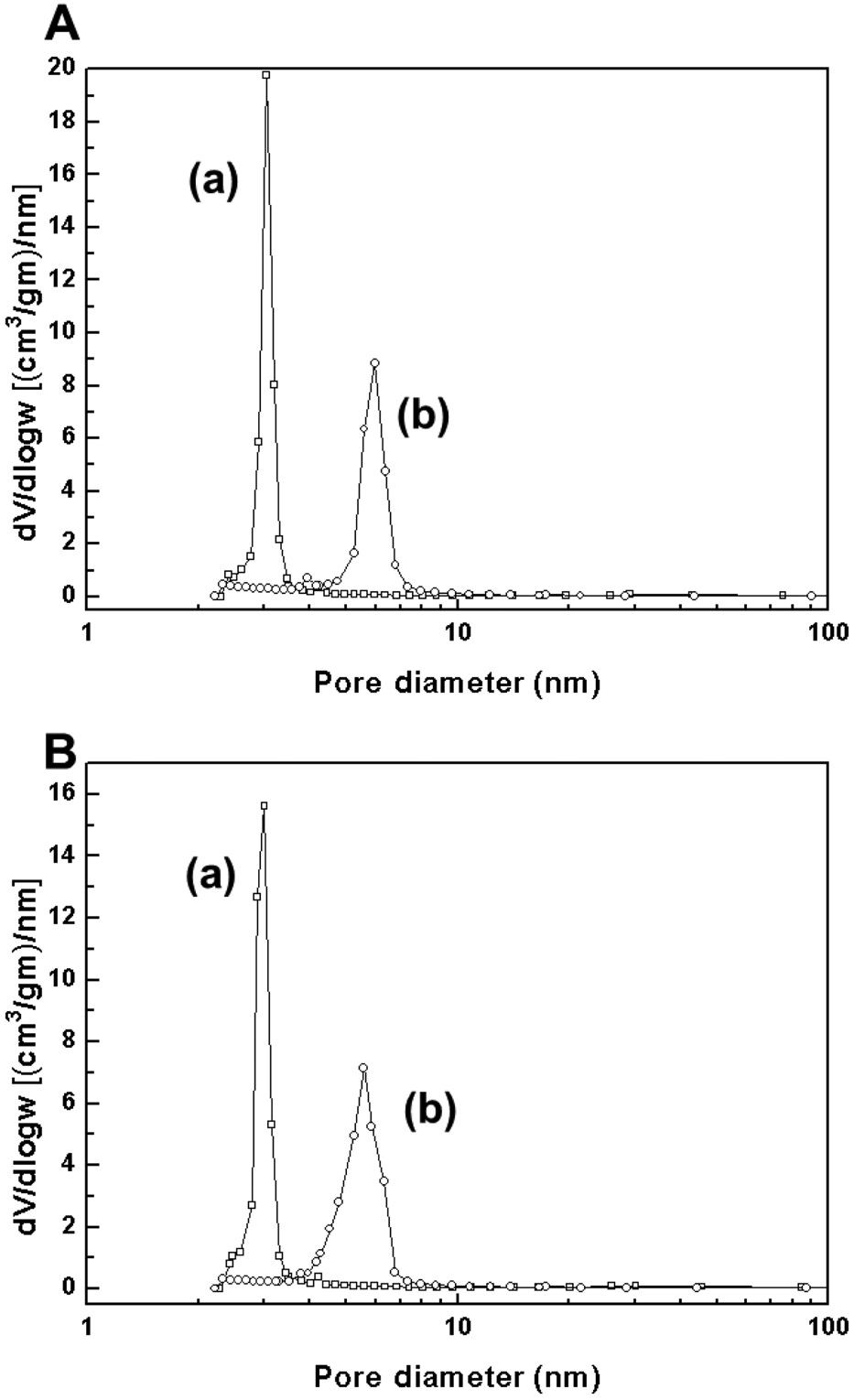
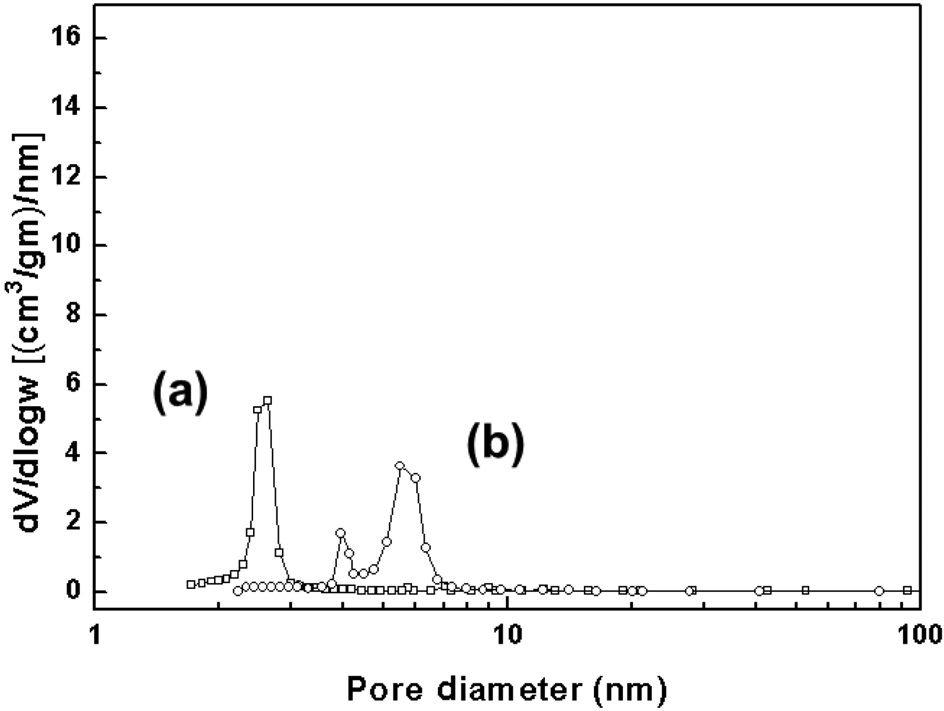
반응 후 촉매의 기공크기 분포 결과를 Figure 3에 나타내었다. 두 촉매는 비표면적과 기공부피가 감소한 것으로 확인되었고, 특히 Pd-Cu/SBA-15는 반응 중 기공 구조가 무너져 두개의 기공크기를 보이는 것으로 관찰되었다. 하지만 Pd-Cu/ MCM-41은 기공 구조가 유지되어, 반응 후에 동일한 기공크기를 가지는 것으로 발견되었다.
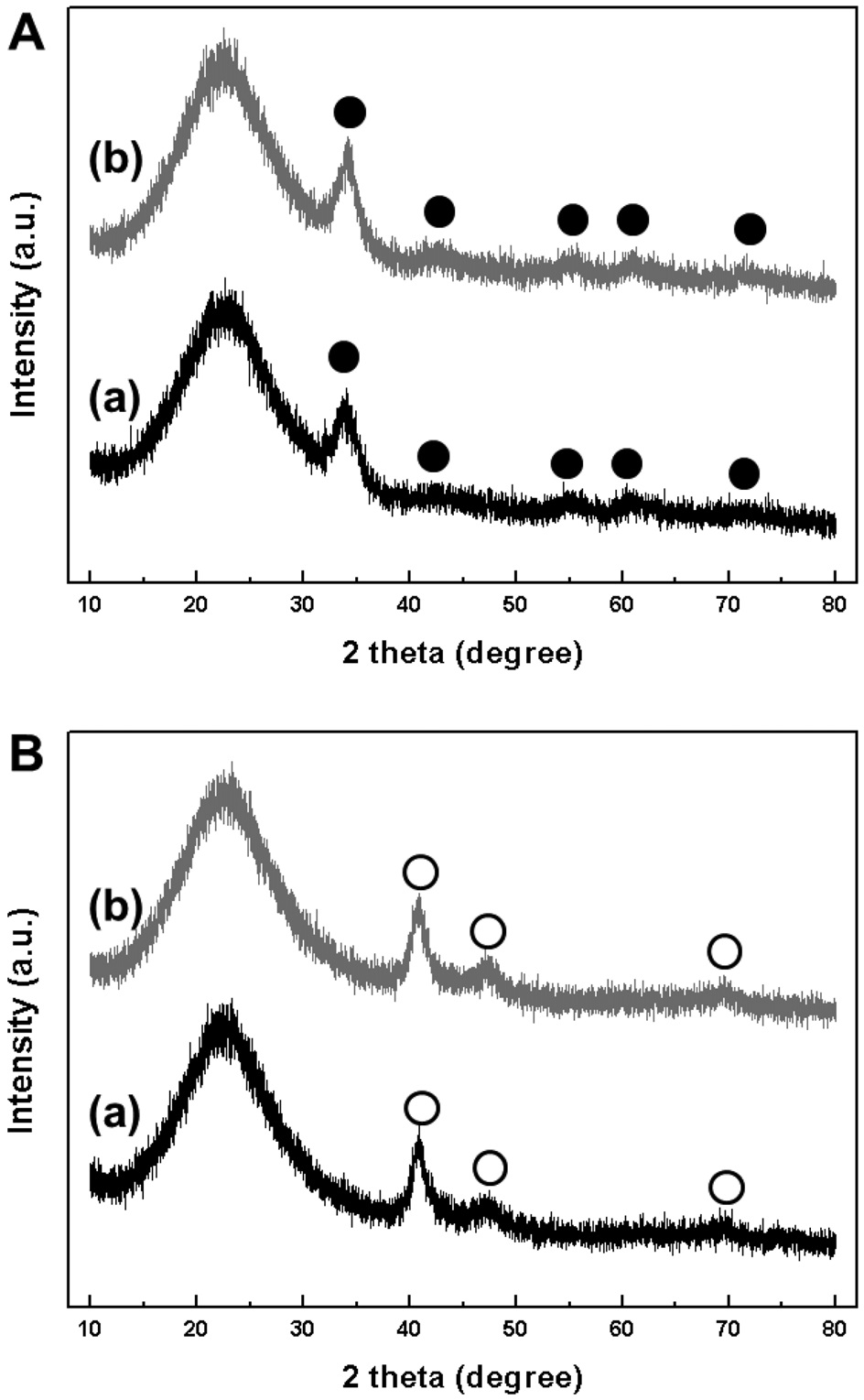
소성 및 환원 처리한 Pd-Cu/MCM-41, Pd-Cu/SBA-15의 결정 구조를 확인하기 위해 XRD 분석을 실시하였다(Figure 4). 모든 분석 결과에서 20°에서 25° 사이에 무정형의 실리카에 해당하는 완만한 피크가 나타났고, 처리법에 따라 각각 크기 및 위치가 동일한 피크가 보였다. 소성 후, 2
두 구리의 특성 회절 피크는 발견되지 않았고, 1 wt%의 낮은 담지량 때문인 것으로 판단되었다. 환원 처리 후에는 2
촉매와 마찬가지로 구리 산화물 및 구리 금속의 특성 피크는 관찰되지 않았다.
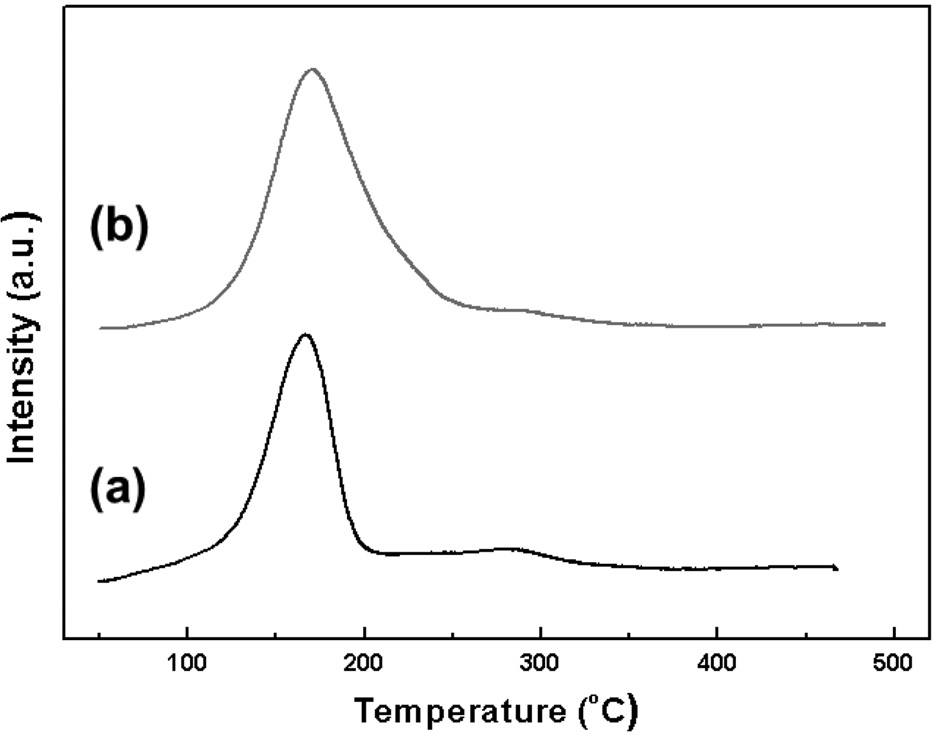
Figure 5는 담체에 따른 제조된 촉매의 환원성을 확인하기 위하여 H2-temperature programmed reduction (TPR)분석을 수행한 결과이다. 두 촉매 모두 약 170 ℃에서 피크가 나타났고, 이는 팔라듐 산화물이 환원되는 것이다[30]. 두 촉매의 팔라듐 환원 피크는 차이를 보이는데, Pd-Cu/MCM-41은 반응 실험 전환원 처리 온도인 200 ℃에서 모두 환원되는 것으로 관찰되었고, Pd-Cu/SBA-15는 약 240 ℃까지 환원되는 것으로 확인되었다. 구리의 환원 온도영역은 200~370 ℃로 보고되어 있는데 [31,32], 300 ℃까지의 저온 영역은 촉매 표면에 분산된 구리의 환원을 나타내고, 고온 영역은 구리 산화물이 환원되는 부분으로 알려져 있다[33]. 두 촉매는 300 ℃까지 매우 완만한 피크를 나타냈고, 촉매 표면에 분산된 구리가 환원되는 것으로 판단되었다. XRD 결과에서 언급한 바와 같이, H2-TPR 분석 결과 또한 구리의 낮은 담지량으로 인해 구리 산화물의 환원 특성이 발견되지 않았다.
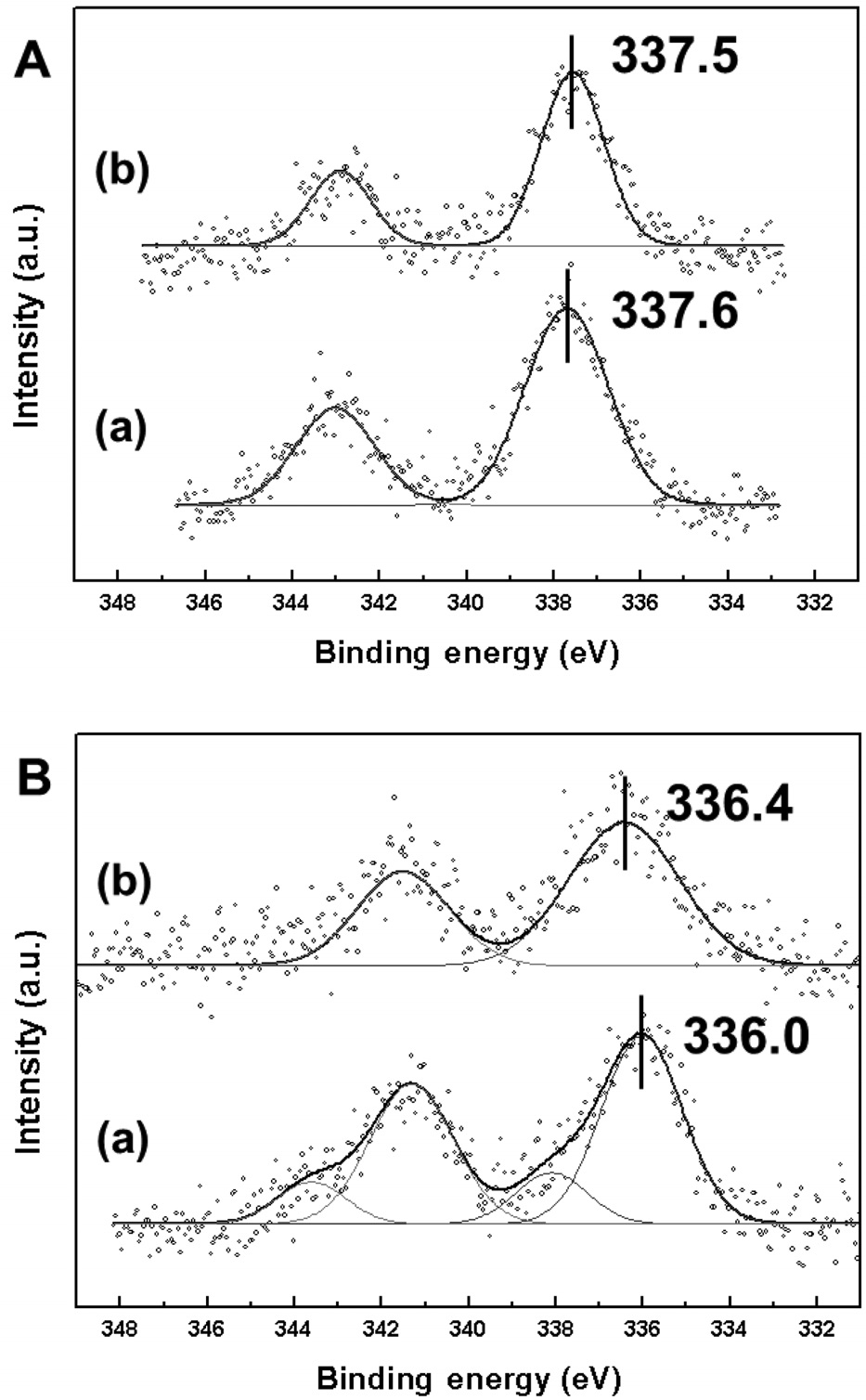
Figure 6과 7은 소성 및 환원 처리한 Pd-Cu/MCM-41, Pd-Cu/
SBA-15의 X-ray photoelectron spectroscopy (XPS)결과를 나타낸 것이다. 두 촉매의 팔라듐 산화상태는 3d5/2 분석 결과를 통해 알 수 있는데(Figure 6), 소성 처리 후에는 팔라듐 산화물(PdO)의 결합에너지(337.2 eV)에 가까운 상태를 보였고, 두 촉매의 결합에너지 차이는 매우 적었다. 반면, 환원 처리 후에는 다른 산화상태를 보였다. Pd-Cu/MCM-41은 336.0 eV의 결합에너지를 가졌고, 이는 팔라듐 금속의 결합에너지(335.8 eV)에 매우 근접한 것이다. 하지만 Pd-Cu/SBA-15는 팔라듐 산화물과 팔라듐 금속의 중간 상태인 336.4 eV의 결합에너지를 보였다. H2-TPR 결과에서 알 수 있듯이, Pd-Cu/MCM-41은 환원 처리 온도인 200 ℃에서 팔라듐 환원이 종료되는 것으로 나타났고, 이에 따라 XPS 분석에서 팔라듐 금속에 근접한 상태를 보이는 것으로 판단되었다.
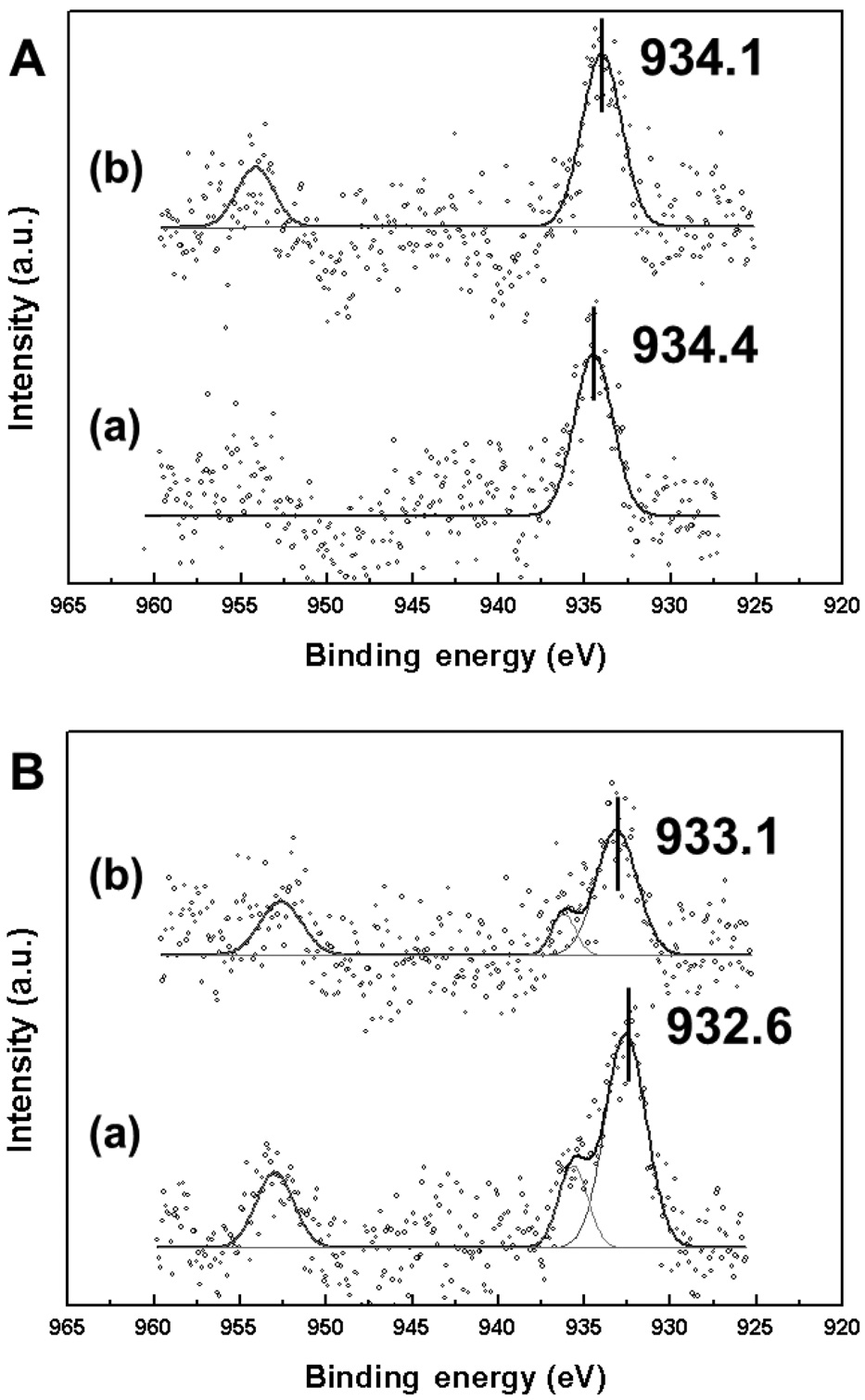
일반적으로 2가의 구리(II) 산화물(CuO)은 934.4 eV, 1가의 구리(I) 산화물(Cu2O)은 932.0 eV, 구리 금속은 932.6 eV의 결합에너지를 갖는다. 각 촉매의 구리 2p3/2 분석 결과, 소성 처리 한 Pd-Cu/MCM-41은 2가의 구리 산화물에 일치하는 결합에너지를 가졌고, Pd-Cu/SBA-15는 약간 낮은 결합에너지를 보였다. 환원 처리 후, Pd-Cu/MCM-41은 구리 금속에 가까운 상태 (932.6 eV)를 가지는 것이 관찰되었고, Pd-Cu/SBA-15에서는 팔라듐과 유사하게 2가 구리 산화물과 구리 금속의 중간 상태(933.1 eV)를 보였다.
3.2. Pd-Cu/MCM-41, Pd-Cu/SBA-15 촉매의 활성 평가
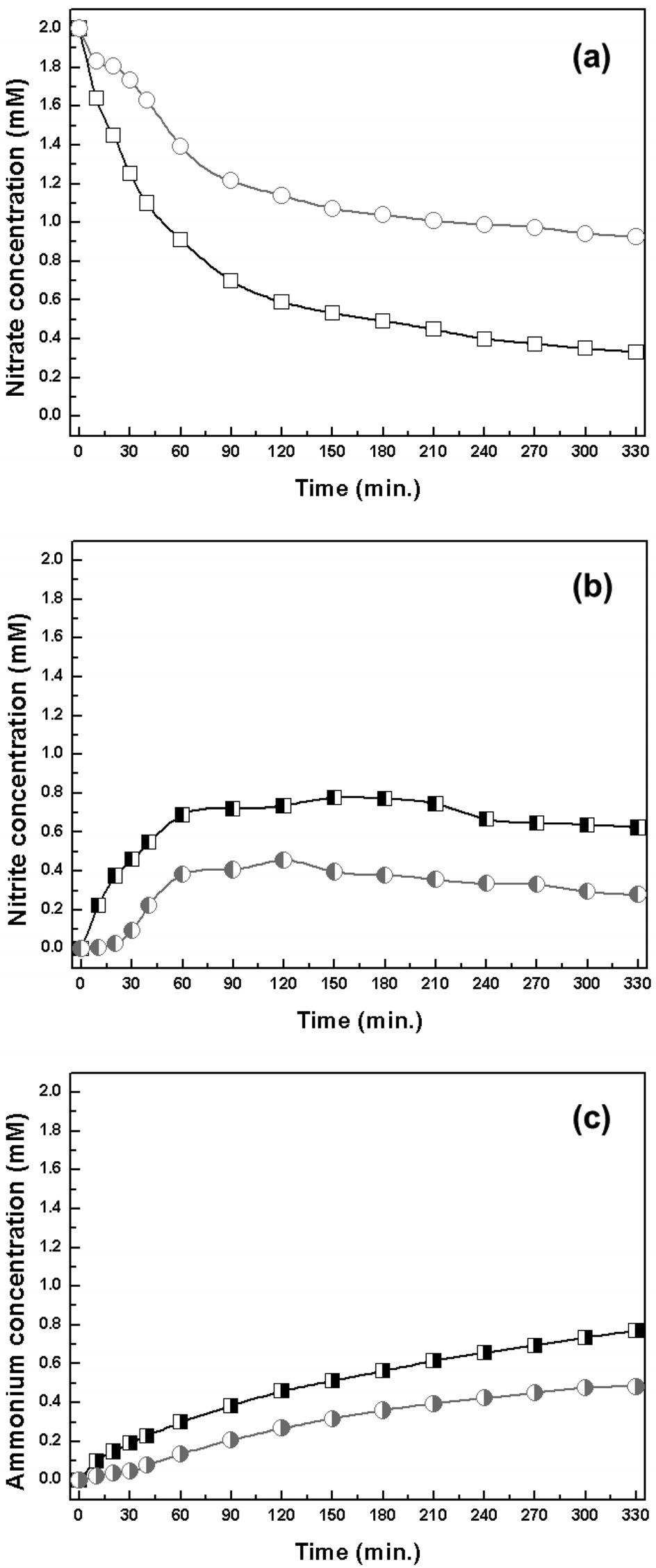
수중 질산성 질소 제거 반응에 적합한 중형 기공성 담체를 탐색하기 위하여, Pd-Cu/MCM-41 및 Pd-Cu/SBA-15를 대상으로 실험을 수행하였다. Figure 8에 반응 시간에 따른 질산성 질소, 아질산성 질소, 암모늄의 농도 변화를 도시하였다. 질산성 질소는 반응 시간에 따라 저감되는 것으로 나타났고, 중간 생성물인 아질산성 질소는 증가한 후 점차 감소하는 것으로 보였고, 최종 생성물인 암모늄은 계속 생성되는 것으로 관찰 되었다. 세 물질의 농도 변화는 전형적인 연속식 반응의 개형이다. Pd-Cu/MCM-41은 Pd-Cu/SBA-15보다 질산성 질소의 빠른 저감 현상을 보였고, 이에 따라 아질산성 질소 및 암모늄이 많이 생성되는 것으로 나타났다. 하지만 Pd-Cu/MCM-41, Pd-Cu/SBA-15은 각각 16%, 29%의 낮은 질소 선택도를 가지는 것으로 확인되었다. 이는 아질산성 질소의 느린 전환으로 인하여, 아질산성 질소가 축적되어 있는 현상이 원인인 것으로 판단되었다. 아질산성의 축적은 반응 중 pH가 높은 환경에서 기인하는데[34], pH가 높아지는 이유는 질산성 및 아질산성 질소의 전환 시 발생하는 수산화기 때문이다. Pd-Cu/MCM-41, Pd-Cu/SBA-15의 반응 후 pH는 각각 11.0, 10.6으로 매우 높다. 따라서 많은 연구자들이 적정 pH를 유지하기 위해, pH 적정기 또는 완충 용액을 적용하는 방법을 시도해왔다[12,35]. 다양한 방법 중, 현재 가장 효과적인 방법은 이산화탄소를 환원제인 수소와 동시에 주입하는 것으로 알려져 있다[36].
Table 2에 수소와 이산화탄소를 90 : 30 ml/min의 비율로 공급한 실험 결과를 나타내었다. 반응 결과, 질산성 질소 전환율은 순수 수소 공급 반응 조건에서의 경향과 유사하게 Pd-Cu/
MCM-41이 Pd-Cu/SBA-15 보다 높은 결과를 보였는데, 각각 5%, 20%의 전환율 증가를 나타냈다. 매우 특징적인 점은 아질산성 질소의 선택도인데, 순수 수소 공급 반응 조건에 비해서 매우 낮은 아질산성 질소가 생성되는 것을 보였다. 이는 이산화탄소의 공급에 따른 반응물의 pH 안정화(약 5.5)로 인해
Nitrate conversion and selectivity toward nitrite, ammonium, nitrogen for catalytic nitrate reduction with CO2 buffer after 330 min of reaction time
아질산성 질소가 매우 빠르게 전환되기 때문인 것으로 판단되었다. 이로 인해 Pd-Cu/MCM-41, Pd-Cu/SBA-15의 질소 선택 도는 59%, 57%로 30~40% 증가한 결과가 관찰되었다.
Pd-Cu계 촉매의 반응 메커니즘은 다양하게 논의되어 왔다[37,38]. 최근 Sa et al.은 질산성 질소는 활성종인 구리 금속에서 환원되고, 동시에 구리 금속은 구리 산화물로 전환된다고 보고하였다[39]. 그 후, 팔라듐에 화학흡착된 수소가 구리 산화물로 옮겨져(spillover), 구리 산화물이 다시 구리 금속으로 변환되는 산화환원(redox)과정이 발생하는 것으로 알려졌다. 따라서 Pd-Cu/MCM-41이 Pd-Cu/SBA-15보다 우수한 활성을 나타내는 이유는 MCM-41 담체에 팔라듐과 구리의 담지 시, 활성금속이 SBA-15 담체에 담지한 촉매보다 금속 상태에 근 접하기 때문인 것으로 사료되었다. 또한 반응 후 촉매 구조 분석 결과(Figure 3)에 따라, Pd-Cu/MCM-41은 반응 후에 일정 한 기공크기를 유지하는 것으로 나타났다. 이는 반응 후 Pd- Cu/MCM-41이 재사용될 수 있는 가능성을 나타내는 것이고, 상기 결과에 따라 MCM-41이 본 반응에 더 적합한 담체로 판단되었다.
본 연구에서는 중형 기공성 실리카 담체인 MCM-41, SBA-15에 동일한 양의 팔라듐과 구리를 담지한 촉매를 대상으로 실험을 수행하여, 수중 질산성 질소 저감에 우수한 활성을 보이는 촉매를 탐색하였다. 질소 흡-탈착 분석을 통해, MCM-41, SBA-15 담체는 각각 3.3 nm, 5.6 nm의 평균 기공크기를 가지며 일정한 구조로 발달되어 있는 것으로 확인되었다. 팔라듐과 구리의 담지 후에, 비표면적, 기공크기 및 기공부피가 소량 줄어든 것으로 보였으나, 중형 기공성을 유지하는 것으로 나타났다.
순수 수소 공급 조건에서, Pd-Cu/MCM-41은 Pd-Cu/SBA-15 보다 빠른 질산성 질소 저감 속도를 보였지만 반응 중에 형성된 높은 pH로 인해 낮은 질소 선택도를 보였다. 질소 선택도의 증가를 위해 이산화탄소를 수소와 함께 공급하였고, 89%의 질산성 질소 전환율, 59%의 질소 선택도를 확보할 수 있었다.
H2-TPR, XPS 분석을 통하여 Pd-Cu/MCM-41는 200 ℃에서 환원 처리 후, 팔라듐과 구리가 금속 상태에 가까운 것으로 나타났다. 또한 반응 후 질소 흡-탈착 분석 결과를 통하여 일정한 기공 구조를 유지하는 것으로 확인되었다. 이로 인해 질산성 질소 제거 반응의 활성종으로 보고된 구리 금속 상태를 가진 Pd-Cu/MCM-41이 우수한 활성을 나타내는 것으로 파악되었다.