고분자전해질 연료전지에서 사용되는 전도성 카본에 백금이 담지된 전극촉매를 콜로이드법을 이용하여 합성하였다. 콜로이드법 합성을 위한 백금 전구체로는 PSA (platinum sulfite acid)를 사용하였으며, 고가의 전구체를 대체하기 위해 CPA (chloroplatinic acid)를 사용하여 합성하였다. PSA를 전구체로 하여 제조한 전극촉매는 10~40 wt% 담지량에서 3.5 nm 이하의 백금 입자크기와 90% 이상의 백금 담지수율을 보였다. CPA를 전구체로 사용한 경우에는 10~40 wt% 담지량에서 4.4 nm 이하의 백금 입자 크기를 보였으며 담지수율은 80% 이상이었다. 제조한 20 wt% Pt/VXC72 전극촉매로 MEA (membrane electrode assembly)를 제조하여 I-V 곡선을 측정하였으며, 제조한 전극촉매를 이용한 막전극접합체는 상용전극촉매를 사용한 경우와 동등한 성능을 보였다.
최근 신재생에너지에 대한 관심과 이산화탄소 저감에 대한 요구의 증가로 인해 고분자전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC)에 대한 관심이 높아지고 있다. 고분자전해질 연료전지는 발전 및 차량용의 용도로 사용이 가능하나, 현재까지도 성능, 내구성, 가격의 세 요소가 충분히 만족되지 못하여 실증 단계에서 상용화 단계로의 이행이 지연되고 있다. 고분자전해질 연료전지에 사용되는 백금계 전극촉매는 위에서 언급한 연료전지의 세 가지 요소 모두에 큰 영향을 미치며, 특히 백금의 특성상 전극촉매의 양산에 의한 가격 저감이 불가능하여 연료전지의 가격 저감에서 전 극촉매가 차지하는 비중이 매우 크다[1,2].
고분자전해질 연료전지용 전극촉매로는 Pt/Carbon 형태가 가장 많이 사용되며, 담체로는 주로 적절한 표면적을 가지는 Vulcan XC-72와 Ketjen black 300과 같은 전도성 카본을 가장 널리 사용하고 있다[3]. 이러한 탄소 담지 전극촉매는 인산형 연료전지에 사용되던 것을 고분자전해질 연료전지용 전극촉매로 적합하게 변형한 것이다. 고분자전해질 연료전지용 백금계 전극촉매의 제조에는 침전법, 콜로이드법, 폴리올법 등이 있으며, 이 중 콜로이드법이 가장 먼저 개발되었다. 콜로이드법은 백금 콜로이드를 탄소담체에 담지시켜 전극촉매를 제조한다. 백금 콜로이드는 백금 전구체 용액에 적절한 산화제나 황화제를 첨가하여 먼저 PtO2 콜로이드 또는 PtS 콜로이드 입자를 제조할 수 있다[4,5]. PtS콜로이드는 그 입자 크기가 5nm 이상으로 크고, 황의 존재에 의해 백금 촉매의 비활성화가 발생할 우려가 있어 전극촉매 제조에 사용할 경우에는 황성분을 제거하기 위해 300 ℃ 이상의 온도에서 열처리 과정을 거쳐야 하는 단점이 있다. PtO2 콜로이드의 경우는 콜로이드 형성 조건이 민감하지 않으면서도 2~3 nm 크기의 콜로이드를 용이하게 제조할 수 있어, 담지된 백금 전극촉매의 제조에 유용하다. 하지만 고가의 백금 전구체를 사용하여야 하는 단점이 있으며, 전극촉매로 사용하기 위해 PtO2/carbon을 Pt/carbon으로 환원하여야 한다. PtO2 콜로이드를 이용하면 전도성 카본 이외에도 다양한 담체에 나노입자의 백금을 용이하게 담지시킬 수 있다[6]. 침전법은 전극촉매뿐만 아니라 일반적인 불균 일계 촉매의 제조에 있어 널리 사용되는 방법으로써 그 제조 공정은 매우 단순하다. 하지만 여러 가지 제조변수의 조절이 까다롭고, 그 제조변수에 따라 그 입자 크기의 변화가 매우 심하다[7].
콜로이드법은 전극촉매의 제조 조건은 간단하나, 백금전구체로 고가의 PSA (platinum sulfite acid, H3Pt(SO3)2OH)를 사용하여야만 한다. 이러한 PSA 제조법에서 사용되는 고가의 전구체를 저가의 염화백금산(H2PtCl6?6H2O)과 나트륨중아황산염(NaHSO3)으로 대체하고자 하는 CPA 제조법이 시도되었으나, 잔류하는 염소기들에 의한 원하지 않는 부반응에 의해 백금의 담지수율이 낮아지게 되고, 이를 막기 위해서는 합성조건의 변경이 필요하다[4].
본 연구에서는 콜로이드법을 이용한 백금 전극촉매의 합성에 있어서 그 제조법을 최적화하고, 또한 백금의 담지량에 따른 전극촉매의 물성변화를 살펴보았다. 또한 고가의 백금 전구체를 대체하기 위해 가장 보편적인 백금 전구체인 염화백금산을 이용하여 콜로이드법 전극촉매를 합성하였으며, 이에 따른 전극촉매의 물성변화를 살펴보았다. 이로부터 콜로이드법을 이용할 경우, 일반적으로 사용되는 침전법에 비해 훨씬 용이하게 전극촉매의 합성이 가능하며 담지수율도 높일 수 있음을 확인하였다. 또한 합성한 전극촉매를 이용하여 막전극접합체(membrane electrode assembly, MEA)를 제조한 후 단전지 (single cell) 활성을 평가한 결과, 상용 전극촉매와 동등한 성능을 보임을 확인할 수 있었다.
백금전구체로는 PSA (H3Pt(SO3)2OH, Strem), pH 조절 물질로는 NaOH (98%, Samchun), 산화제로는 H2O2 (35 wt% in H2O, Aldrich), 탄소 담체로는 Vulcan XC-72 (Cabot)를 사용하 였으며, 용매로는 3차 증류수를 사용하였다.
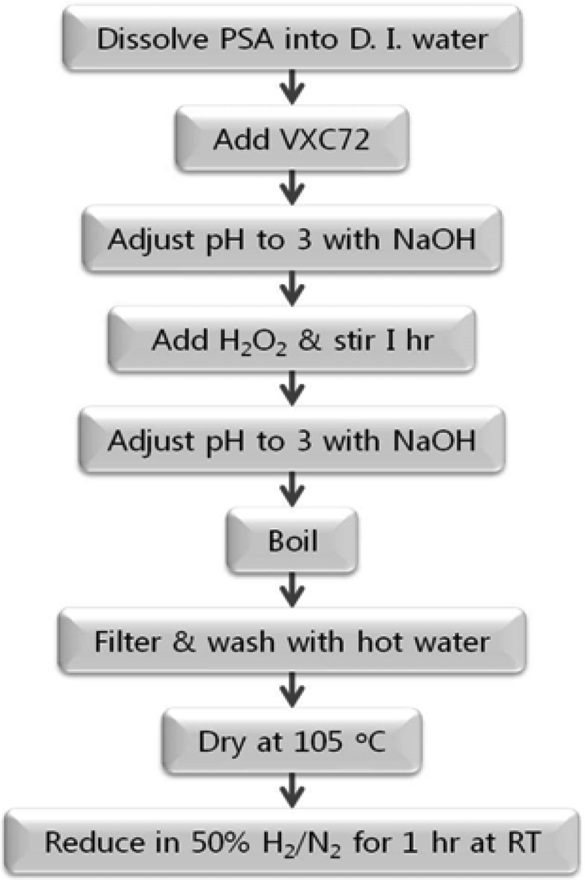
전극촉매의 제조 과정은 Figure 1과 같으며, 제조한 PtO2/VXC72는 3차 증류수로 세척한 후 80 ℃에서 건조하고, 상온에서
50% H2/N2를 흘려 환원시켜 Pt/VXC72를 제조하였다. 이와 같이 전극촉매를 제조하는 방법은 PSA법으로 명명하였다.
백금 전구체로는 CPA (chloroplatinic acid, next chimica), 백금 전구체를 PSA로 전환시키기 위한 물질로 NaHSO3 (58.5%,Junsei), pH 조절 물질로 NaOH (98%, Samchun), 산화제로는 H2O2 (35 wt% in H2O, Aldrich), 탄소 담체로는 Vulcan XC-72 (Cabot)를 사용하였으며, 용매로는 3차 증류수를 사용하였다. 전극촉매의 제조 과정은 Figure 2와 같으며, 제조한 PtO2/VXC
72는 3차 증류수로 세척한 후 80 ℃에서 건조하고, 상온에서 50% H2/N2를 흘려 환원시켜 Pt/VXC72를 제조하였다. 이와 같이 전극촉매를 제조하는 방법은 CPA법으로 명명하였다.
제조한 전극촉매의 백금 담지량은 ICP (inductively-coupled plasma spectrometer, GBC Scientific Equipment Ltd., Integra XMP)를 이용하여 측정하였으며, 전극촉매 중의 백금은 왕수를 이용하여 용해시켰다. 백금의 입자 크기와 분포는 TEM (transmission electron microscope, Philips, TECNAI 20-S)을 이용하여 확인하였으며, 또한 X-선 회절분석기(X-ray diffraction, XRD, Rigaku, Geigerflex D/max-IIIC)로 측정한 백금결정의 Pt(111) 피크의 폭을 이용하여 백금의 입자 크기를 계산하였다. XRD를 이용한 백금의 입자 크기의 계산에는 Scherrer 방정식을 이용하였으며, 계산에서장비에 의한 선폭 증가(instrumental line broadening)는 고려하지 않았다[8]. XRD를 이용하여 계산한 백금 입자 크기와 TEM을 이용하여 확인한 백금의 입자 크기가 동일한 경향을 보이는 것으로 확인되었으며, 이후로는 XRD 피크 분석을 이용하여 백금의 입자 크기를 구하였다. CPA법을 이용한 전극촉매 제조에서 CPA가 NaHSO3의 첨가에 의해 PSA 형 태로 변화하는 것을 확인하기 위하여 UV-Vis 분광광도계(Spectrophotometer) (Agilent, 8453 UV-Vis)를 이용하였다.
2.4. 전극촉매를 이용한 막전극접합체 제조 및 단전지 평가
제조한 전극촉매의 성능을 평가하기 위해 이를 이용하여 막전극접합체를 제조한 후 단전지 평가를 수행하였다. 고분자전 해질막으로는 Nafion112를 사용하였으며, 막전극접합체의 면적은 5 cm × 5 cm를 사용하였다. 제조한 전극촉매는 막전극접 합체의 공기극에 적용하여 성능평가를 수행하였으며 백금의 사용량은 0.35 mg-Pt/cm2이었다. 연료극은 상업용 전극촉매(60 wt% Pt/Carbon, Tanaka Kikinzoku)를 구입하여 사용하였다. 전극촉매 잉크는 이소프로필 알코올(isopropyl alcohol)을 용매로 사용하여 제조하였으며, 이오노머(ionomer)로는 5 wt% Nafion 용액을 사용하였다. 막전극접합체의 제조는 스프레이법을 사용하여 원하는 백금 사용량이 되도록 전극촉매 잉크를 기체확산층(SGL 10BC)에 코팅한 후, 가열 압착기를 이용하여 고분자전해질막과 기체확산층을 가열압착하여 막전극접합체를 제조하였다.
단전지 평가에서 연료극 조건은 수소의 화학양론비(Stoichiometric ratio)는 1.2, 가습기 온도 75 ℃, 공기극 조건은 공기의 Stoichiometric ratio 2.4, 가습기 온도 70 ℃, 그리고 단전지 온도는 70 ℃를 유지하였다. 막전극접합체의 I-V곡선은 단전지의 전압을 OCV (open circuit voltage)로부터 0.4 V까지 0.05 V 간격으로 낮추면서 전류값이 안정된 후 이를 측정하였다.
백금 전극촉매의 제조에 PtO2 콜로이드를 이용하는 제조법은 Ptototech사(E-Tek사의 전신)의 Petrow와 Allen에 의해 출원된 방법으로[4], 이는 균일하면서 3 nm 이하의 작은 크기를 가지는 백금입자의 합성이 가능하다. PtO2 콜로이드의 제조에는 PSA를 전구체로 사용하며, PSA와 산화제인 H2O2와의 반응에 의해 PtO2 콜로이드가 형성되며, 그 반응식은 다음과 같다.
H3Pt(SO3)2OH + 3H2O2 → 2H2SO4 + PtO2 + 3H2O
반응의 진행에 따라 황산이 생성되면서 pH가 점점 낮아지므로, PtO2로의 전환율을 높이기 위해서는 적절한 pH를 유지할 필요가 있으며, 이를 위해서 NaOH와 같은 pH 조절물질의 첨가가 필요하다. PtO2 콜로이드를 이용한 백금 전극촉매 제조의 장점은 2~3 nm 크기의 균일한 크기를 가지는 백금입자가 용이하게 생성되며, 또한 탄소담체에 PtO2 입자가 담지되는 과정에서 전하를 띤 PtO2 콜로이드 입자 간의 반발력에 의해 입자의 뭉침 현상이 억제되는 것이다. 결과적으로 탄소 담체에 작은 크기의 백금입자가 균일하게 분포되게 된다.
PtO2 콜로이드의 제조에 사용되는 PSA는 +2가 상태의 백금을 포함하는 전구체로써 그 제조 과정이 복잡하며 가격이 매우 고가이어서 상업적으로 전극촉매의 생산에 사용하기에는 어려움이 있다. 가장 보편적으로 사용되는 저가의 백금 전구체는 +4가 상태의 백금을 가지는 CPA로써 이를 이용한 PtO2 콜로이드의 제조도 고려된 바 있으나 상세하지는 않다[4]. +4가의 백금을 가지는 CPA를 +2가의 백금을 가지는 PSA 형태로 전환하기 위해서는 NaHSO3와 같은 환원제의 첨가가 필요하며, CPA 수용액에 NaHSO3를 첨가한 후, 이를 가열하면 아래와 같은 반응에 의해 PSA 형태의 백금 전구체가 얻어지게 된다.
H2PtCl6 + 3NaHSO3 + 2H2O
→ H3Pt(SO3)2OH + Na2SO4 + NaCl + 5HCl
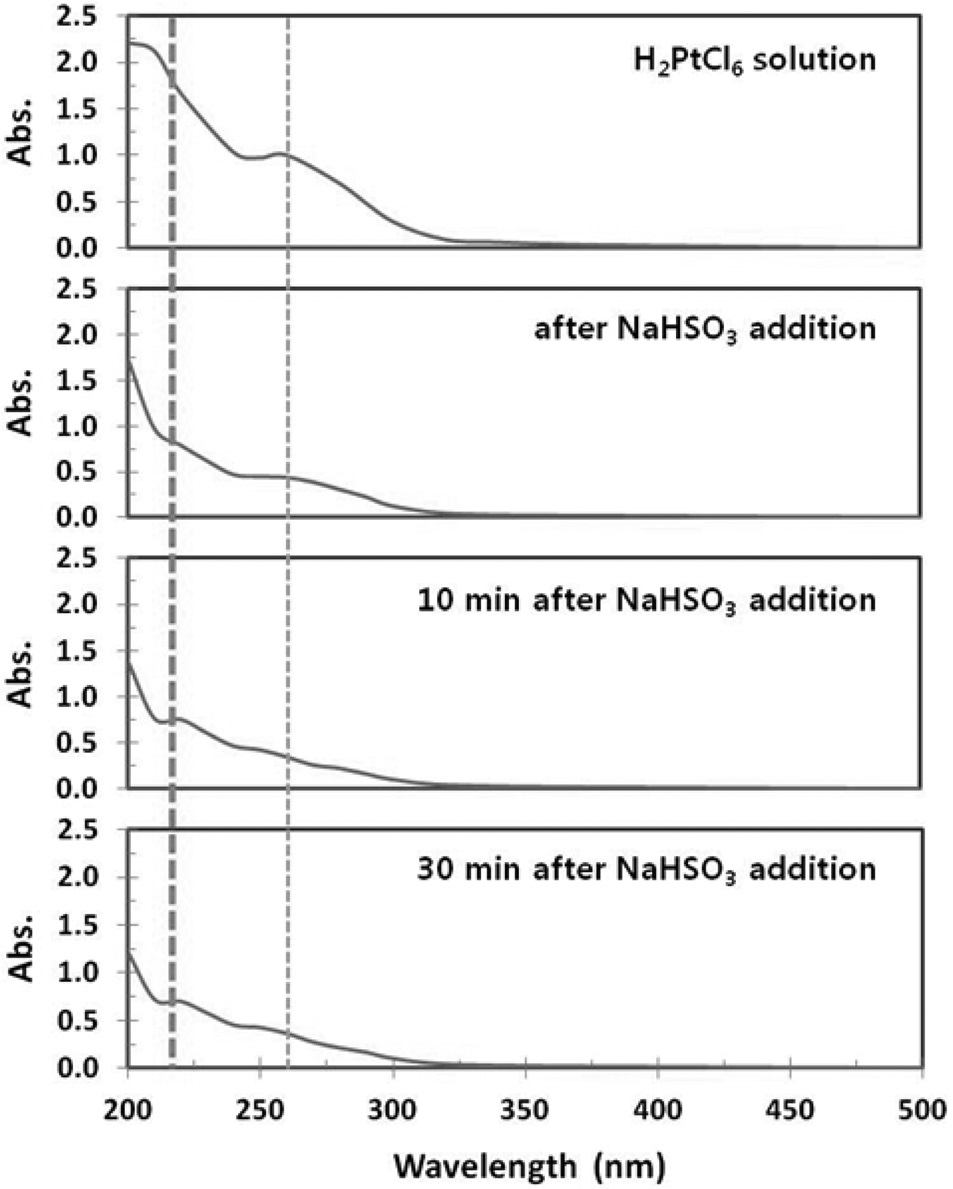
UV-Vis 분광광도계를 이용하여 분석한 결과를 Figure 3에 나타내었다. H2PtCl6 수용액의 경우 260 nm에서 Pt4+에 기인한 광흡수 피크가 보이며, 이는 PtCl62-의 ligand-to-metal 전하이동 때문으로 보고된 바 있다[9,10]. 환원제와 SO3 공급의 두 가지 역할을 하는 NaHSO3를 첨가한 직후에 바로 Pt4+ 피크의 크기가 줄어드는 것을 볼 수 있다. 10분이 지난 후에는 220 nm의 Pt2+에 기인한 광흡수 피크가 생성되면서 260 nm의 피크가 현저히 감소함을 볼 수 있다.
Xin et al.[11]은 수용액 중에서 Pt의 환원 정도가 커질수록 UV 흡수파장이 낮은 쪽으로 움직이며, Pt2+를 가지는 PtCl42-의 경우, 약 220 nm에서 UV 흡수피크가 관찰됨을 보고하였다[11]. 또한 30분이 경과한 후에도 10분이 경과한 때와 유사한 형태의 피크가 관찰됨을 볼 수 있는데, 이로부터 CPA에 NaHSO3를 첨가함에 의해 CPA가 PSA로 전환되며, 70 ℃에서 NaHSO3를 첨가한 후 10분 정도의 시간이면 반응이 충분히 일어남을 알 수 있다. 한편, CPA가 PSA로 전환됨에 따라 다량의 염산이 생성 되어 용액의 pH가 낮아지게 되는데, 이와 같이 용액 중의 염소 이온이 증가하게 되면 과산화수소와 같은 산화제가 존재할 경우에는 PSA와 염소의 반응에 의해 CPA가 생성되는 원하지 않
는 아래와 같은 부반응이 일어나게 된다.
H3Pt(SO3)2OH + 6HCl + 3H2O2 → H2PtCl6 + 2H2SO4 + 5H2O
위와 같이 CPA가 다시 생성되는 부반응을 억제하기 위해서는 용액 중에 자유롭게 존재하는 염소 이온의 농도를 줄이는 것이 필요하며, 그 방법으로는 용매양의 증가를 통해 염소 이온의 농도를 낮게 하거나 용액의 pH를 높이는 방법이 가능하다.
Pt/carbon 전극촉매의 제조에 있어 전도성 탄소 담체로는 가장 널리 사용되는 Vulcan XC-72를 사용하였다. 질소흡착을 이용한 BET 측정과 t-plot 분석을 통해 측정한 Vulcan XC-72의 전체표면적과 미세기공을 제외한 외부표면적은 각각 229, 153 m2/g이었으며, 이 중 외부표면적 153 m2/g만이 백금의 담지에 유용하게 사용된다.
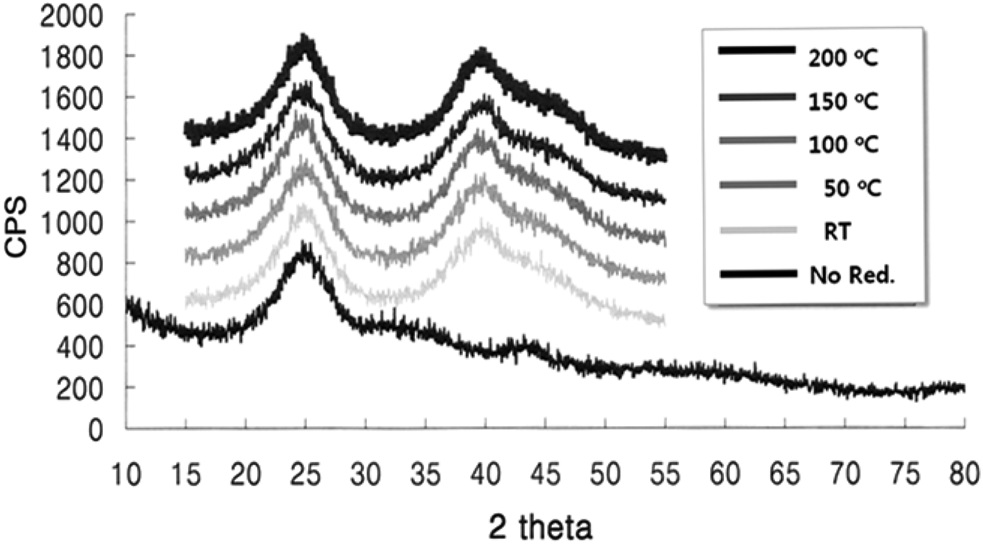
PSA를 전구체로 사용한 콜로이드법을 이용하여 Pt/VXC72 를 제조할 경우, 합성을 통해 얻어지는 담지촉매는 PtO2/VXC72 형태이며, 전극촉매로 사용하기 위해서는 수소로 환원하는 과 정이 필요하다. 50% H2/N2 기체를 이용하여 다양한 온도에서 전극촉매를 환원하였으며, Figure 4를 보면 전극촉매를 환원 하지 않았을 경우, 금속 백금의 피크는 보이지 않고, 2θ = 25° 부근에서 넓게 퍼져 있는 탄소 담체의 특성피크만 보이고, PtO2 의 결정 피크가 보이지 않는 것으로부터 PtO2 입자는 비정질 상태로 존재함을 알 수 있다. 여러 가지 온도에서 환원 처리한 전극촉매의 경우에는 40°에서의 Pt(111) 피크와 47°에서의 Pt(200) 피크가 관찰됨을 확인할 수 있으며, 심지어는 환원온
도가 실온일 경우에도 200 ℃에서 환원시킨 전극촉매와 동일한 결정 구조를 보임을 알 수 있다. 이는 실온에서 환원을 시키더라도 PtO2와 수소가 반응하여 백금과 물이 생기는 반응이 강한 발열반응이어서 전극촉매의 온도가 올라가기 때문이며, 실제로 측정한 결과 50 ℃ 이상으로 온도가 올라감을 확인 할 수 있었다. 따라서 PtO2/VXC72의 환원에는 별도의 가열이 필요하지 않음을 알 수 있었으며, 합성한 전극촉매의 환원은 상온 조건에서 수행하였다.
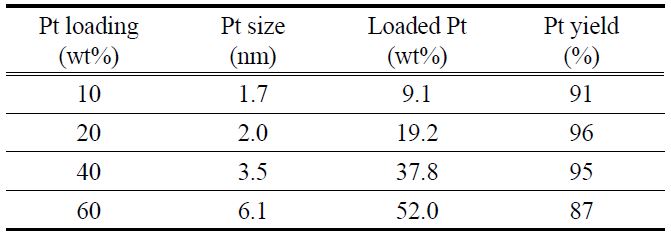
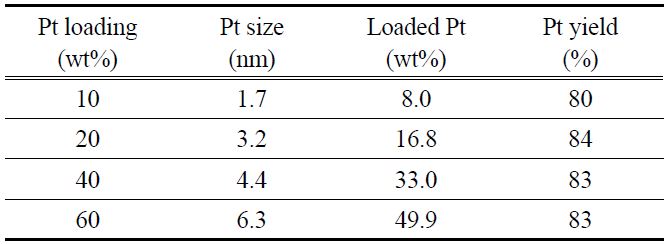
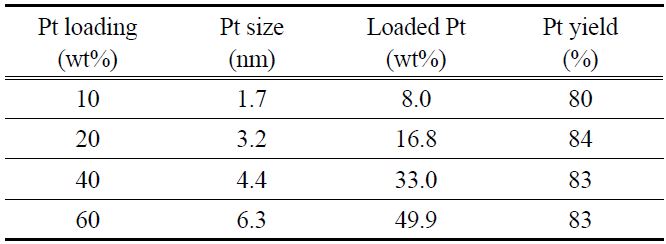
Table 1은 PSA법으로 제조한 전극촉매의 물성을 보여주고 있다. 백금의 담지량이 높아짐에 따라 백금입자의 크기가 증가함을 볼 수 있으며, 10~40 wt% 정도까지는 1.7~3.5 nm로 작은 입자 크기를 유지하지만 60 wt%로 백금의 담지량이 증가하면 6.1 nm로 급격하게 입자 크기가 증가하며, 이는 백금의 사용율이 낮아 전극촉매로 사용하기에는 적합하지 않다. 백금의 입자 크기가 작아질수록 백금의 비표면적이 늘어나지만, 입자 크기가 감소하여 백금의 결정성이 낮아지면 백금 표면의 촉매활성이 낮아지게 된다. 따라서 일반적으로 2~4 nm 크기의 백금입자가 담지되었을 때, 백금의 비표면적과 단위 면적당 활성의 곱이 최적화되어 가장 우수한 활성을 보이는 것으로 알려져 있다[12]. 용액에 포함된 백금이 탄소 담체에 담지되는 수율은 90% 전후의 값을 보였으며, 20과 40 wt%에서 95% 이상의 높은 담지 수율을 보였다. 전극촉매 제조 시에 산화제로써 작용하는 H2O2를 필요한 당량의 10배 이상을 넣었지만 담지율이 최대 96%로써 백금을 100% 담지하는 것은 불가능한 것으로 판단된다.
[Table 1.] Properties of various Pt/VXC72 prepared by PSA method
Properties of various Pt/VXC72 prepared by PSA method
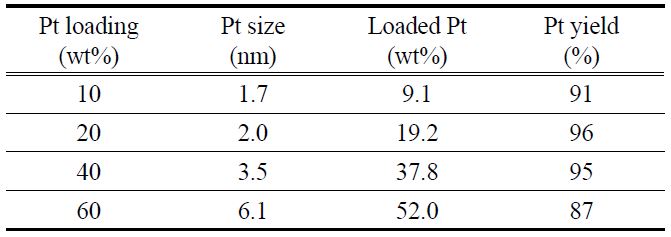
[Table 2.] Properties of various Pt/VXC72 prepared by CPA method
Properties of various Pt/VXC72 prepared by CPA method
Table 2는 CPA법으로 제조한 전극촉매의 물성을 보여주고 있다. 전체적인 경향은 PSA법의 경우와 유사하지만, 전반적으로 입자 크기가 조금 더 크게 생성되는 경향이 있다. 이는 일부 존재하는 PtCl62-가 콜로이드 입자 성장 및 콜로이드 입자의 담지 과정에 관여하기 때문으로 생각되며, 또한 PSA법으로 제조할 때와 달리 용액 중에 불필요한 Na+나 Cl-이온들이 과량으로 존재하여 PtO2 콜로이드 입자가 뭉치는 것이 보다 쉬워지는 것도 원인인 것으로 생각된다. 또한 담지 수율에 있어서도 80~84% 수준을 보여주고 있는데, 이는 Figure 3의 UV-Vis 결과에서 보이듯이 일부의 미전환된 PtCl62-가 존재하기 때문으로 생각된다. 결론적으로 CPA법을 이용하여 전극촉매를 제조할 경우에 원하는 입자 크기의 전극촉매를 합성하는 것은 가능하나, 전극 제조 후 남은 용액 중의 백금을 재사용하는 방안의 강구가 필요할 것이다.
PSA법으로 제조한 여러 가지 전극촉매의 TEM 사진을 Figure 5에 나타내었으며, 이로부터 40 wt%와 같이 높은 담지량의 전극촉매에서도 3~4 nm 크기의 백금입자가 고르게 잘 분산되어 있음을 확인할 수 있었다.
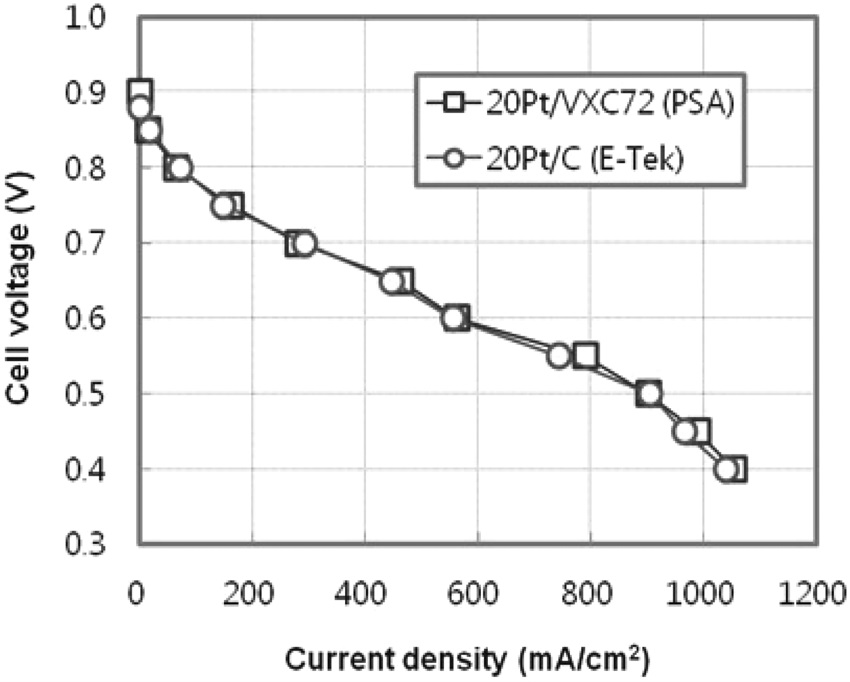
제조한 전극촉매의 성능을 확인하기 위하여, PSA법으로 제조한 20 wt% Pt/VXC72를 공기극에 사용하여 막전극접합체를 제조하였으며, 비교를 위하여는 E-Tek사의 20 wt% Pt/Carbon 촉매를 사용하였다. Figure 6에 단전지 평가장치를 이용하여 측정한 막전극접합체의 I-V 곡선을 나타내었으며, 두 막 전극접합체가 유사한 I-V 곡선을 보여줌을 알 수 있다. 제조한 전극촉매와 상용촉매를 사용한 막전극접합체의 OCV는 각각 0.9 V, 0.88 V이었으며, 0.6 V에서의 전류밀도는 각각 562, 554 mA/cm2이었다. 이상의 결과로부터 제조한 전극촉매의 성능은 상용촉매와 거의 동일함을 확인할 수 있었다.
고분자 전해질 연료전지의 전극촉매로 사용되는 Pt/carbon black을 콜로이드법을 이용하여 합성하였으며, 담체로는 Vulcan XC-72를 사용하였다. PtO2 콜로이드를 이용하는 합성에서는 백금 전구체로 PSA를 사용하며, 제조한 전극촉매는 10~40 wt% 담지량에서 3.5 nm 이하의 백금 입자크기와 90% 이상의 백금 담지수율을 보였다. 고가의 전구체를 대체하기 위해 CPA를 백금 전구체로 사용하여 합성한 경우에는 10~40 wt% 담지량에서 4.4 nm 이하의 백금 입자 크기를 보였으며 담지수율은 80% 이상이었다. 두 경우 모두 60 wt% 이상의 담지량에서는 6 nm 이상의 백금 입자크기를 보였으며, 콜로이드법은 고담지량의 백금 전극촉매를 합성하기에는 부적합함을 알 수 있었다. 합성한 20 wt% Pt/VXC72를 공기극에 적용한 막전극접 합체의 I-V 곡선을 측정하였으며, 이는 상용전극촉매를 사용한 막전극접합체와 동등한 성능을 보였다.