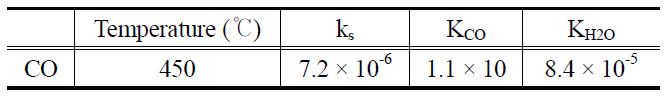In this study, kinetics data was obtained for steam reforming reaction of ethane over the nickel catalyst. The variables of steam reforming reaction were reaction temperature, partial pressure of ethane, and mole ratio of steam and ethane. Parameters for the power rate law kinetic model and the Langmuir-Hinshelwood model were obtained from the kinetic data. Also, sizing of steam reforming reactor was performed by using PRO/II simulator. For the steam reforming reaction of ethane, Langmuir- Hinshelwood model determining the reaction rate by the surface reaction was better suited than a simple power rate law kinetic model. On water-gas-shift reaction, power rate law kinetic model was well fitted to the kinetic data. Reactor size can be calculated for production of hydrogen through PRO/II simulation.
니켈 촉매 상에서 에탄의 수증기 개질 반응과 수성가스 전환반응 반응에 대한 반응속도 데이터를 얻기 위하여 반응온도와 반응물의 분압을 변화시키면서 반응 실험을 수행하였다. 반응속도 데이터를 사용하여 거듭제곱 속도식 모델(power law kinetic model)과 랭미어-힌쉘우드 모델(Langmuir-Hinshelwood model)의 매개변수를 구하였다. 또한 반응 속도 모델식을 적용하여 PRO/II를 이용한 공정 모사를 통해서 에탄의 수증기 개질 반응기 사이징(sizing)을 수행하였다. 에탄을 반응물로 하여 수증기 개질 반응을 수행한 결과, 단순한 거듭제곱 속도식 모델보다 표면반응에 의하여 반응속도가 결정되는 랭미어-힌쉘우드 모델이 보다 적합하였고, 수성가스 전환반응에 대한 반응속도식은 거듭제곱 속도식 모델이 적합함을 보였다. PRO/II 시뮬레이션을 통해서 수소 생산량에 필요한 반응기의 크기를 결정할 수 있었다.
에너지원으로 주로 석탄 및 석유를 이용하여 산업이 발전해 왔으나, 최근에는 부탄, 프로판 그리고 천연가스가 가정과 산업에서 널리 사용되고 있다. 머지않아 수소를 기반으로 하는 산업사회가 이루어질 전망이므로 지금은 탄화수소이용 사회에서 수소이용 사회로 전환하는 과정에 있다고 할 수 있다. 세계적으로 약 48%의 수소생산이 천연가스를 원료로 사용하고 있으며, 30%가 오일, 18%가 석탄을 원료로 사용하고 있다. 천연가스로부터 수소를 생산하는 대부분의 공정에는 수증기 개질법(steam reforming), 부분산화법, 자열 개질법, 건개질법 등이 사용되고 있는데 수증기 개질법이 가장 높은 수율을 보이며, 일반적으로 700~900 ℃ 정도로 높은 온도범위에서 운전된다[1-5]. 개질 반응기는 수소제조설비 및 연료전지 발전 시스템 등에서 천연가스로부터 수소를 얻기 위한 개질기, 디메틸에테르 합성 및 제조를 위한 공정 등에서 광범위하게 사용되고 있다[6-8]. 수증기 개질공정은 식 (1)~(3)과 같이 개질공정과 수성가스 전환반응공정으로 구성된다. 천연가스는 개질기에서 수증기 개질 반응에 의하여 수소와 일산화탄소로 구성된 합성가스로 전환된다. 반응온도와 반응 압력 그리고 탄소에 대한 수증기의 비가 변수가 된다. 보통, 부반응인 탄소 침적을 막기 위하여 수증기/탄소 비는 2.5 이상, 반응온도는 400~900 ℃ 범위에서 운전한다.
수증기 개질 반응식:
수성가스 전환 반응식:
한편, 천연가스를 이용한 수소생산 공정에 예비개질기(prereformer)를 사용하기도 한다. 예비개질은 원료에 포함되어있는 고급 탄화수소를 메탄과 수소, 일산화탄소로 분해하는 공정으로 주로 단열 고정층 반응기를 사용하며, 운전온도는 350~ 550 ℃ 정도로 개질기의 온도보다 낮다[9].
수증기 개질 반응에 사용되는 촉매로는 대개 니켈, 루테늄, 로듐 등 금속 촉매를 많이 사용한다[2]. 수증기 개질 반응의 반응속도식에 관한 연구는 주로 메탄의 수증기 개질 반응이 많이 연구되고 있다[10-12]. 그러나 천연가스의 주 성분인 메탄 외의 성분인 에탄, 프로판 또는 부탄의 수증기 개질 반응의 반응속도식 선정 결과와 이를 이용한 반응기 사이징을 수행한 결과는 찾아보기 힘들다[13].
본 연구는 에탄과 일산화탄소의 수증기 개질 반응의 반응
속도 데이터를 확보하고, 반응속도 데이터를 바탕으로 반응기 크기를 구하는 것을 목적으로 하였다. 상업용 니켈 촉매를 사용하여 반응온도, 공간속도, 수증기/반응물(C2H6, CO) 몰 비 등의 반응 조건을 변화시키면서 에탄과 일산화탄소의 수증기 개질 반응을 수행하고, 그 결과로부터 에탄과 일산화탄소의 수증기 개질 반응에 적합한 속도식 모델을 선정하였다. 또한 속도식 모델을 적용하여 PRO/II 시뮬레이션을 통해서 수증기 개질 반응기 크기를 계산하여 반응온도 및 수소 생산량에 따른 반응기 크기를 계산하였다.
촉매는 상업용 니켈 촉매(FCR-4: Süd-chemie Catalysts Inc., 12 wt% Ni/α-Al2O3, BET 표면적 : 12.3 m2/g)를 사용하였다. 반응기에 상업용 니켈 촉매를 탑재한 상태에서 질소에 희석된 수소(H2 10%)를 흘리면서 500 ℃에서 2시간 동안 환원하였다. 반응 실험에 사용된 촉매의 크기는 75~100 μm이고 0.1 g 을 탑재하여 실험하였다.
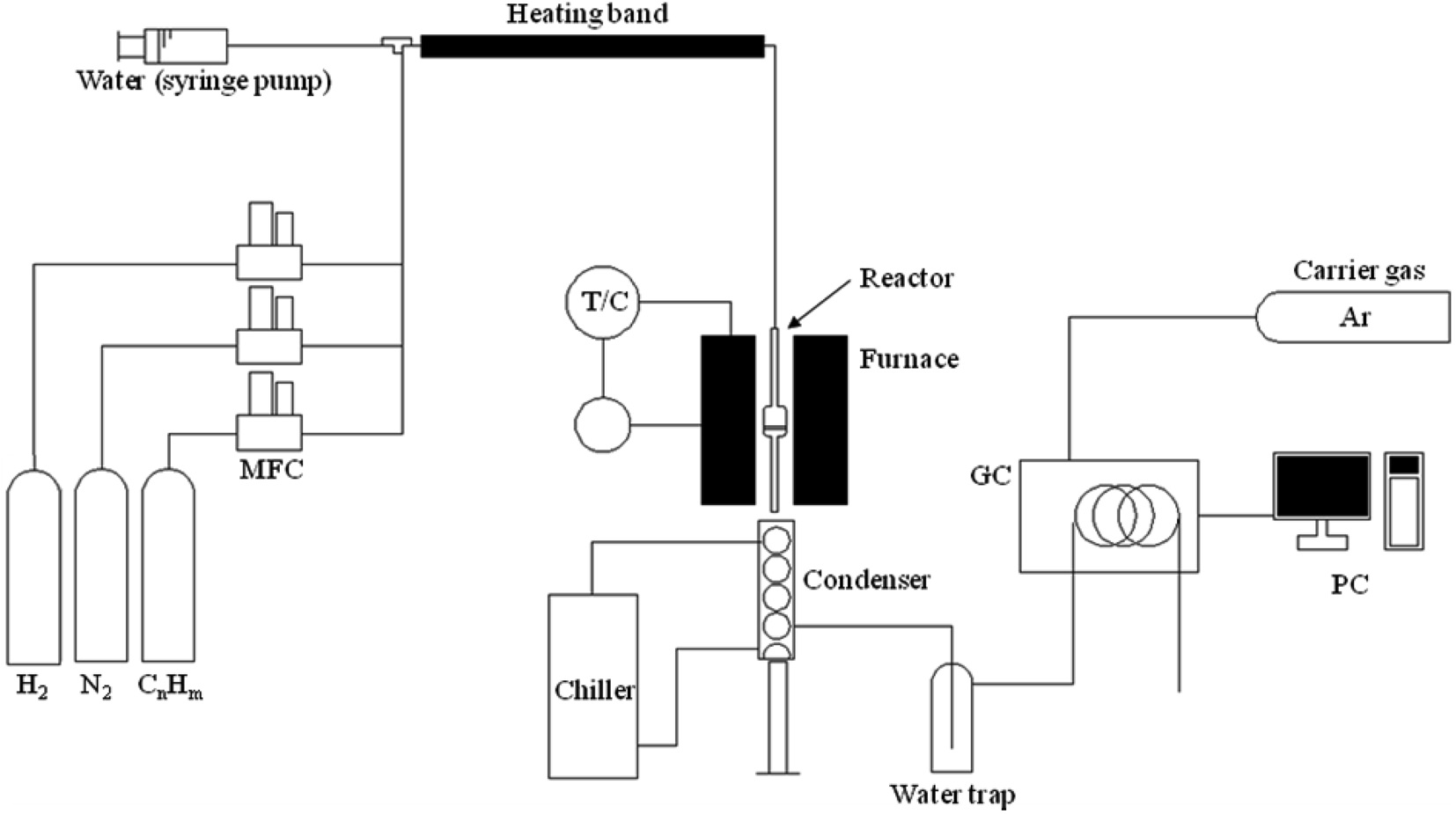
본 연구에는 반응물로 수소, 질소, 에탄, 일산화탄소(기체의 순도는 각각 99.999%, 99.999%, 99.5%, 99.5%)를 사용하였다. 에탄의 수증기 개질 반응은 Figure 1과 같은 실험 장치를 사용하였다. 반응기는 석영으로 제작한 고정층 반응기이며 크기는 내경 10 mm이다. 기체의 유량을 조절하기 위하여 질량 유량조절기(BROOKS 5850E)를 사용하였고 물의 유량은 시린지 펌프를 사용하여 조절하였다. 반응 생성물은 냉각기와 수분트랩에서 수분을 제거한 후, 메탄화 장치(methanizer)가 장착된 가스크로마토그래피(Younglin, YL 6100 TOGA System)를 온라인으로 연결하여 분석하였다.
에탄의 수증기 개질 반응 실험은 반응기에 촉매 0.1 g을 장착하고, 반응온도는 350~550 ℃, 공간속도(gas hourly space velocity, GHSV)는 30,600 h-1으로 일정하게 유지하고, 수증기/탄소의 몰 비(S/C ratio) 등 실험 조건을 변화시키면서 실험하였다. 에탄의 수증기 개질 반응의 반응물은 에탄(C2H6)과 수증 기(H2O)이기 때문에 반응속도 데이터를 얻기 위해서 한 가지 물질의 농도를 일정하게 하고, 나머지 한 가지 물질의 농도를 변화시켜 실험하였다. 에탄의 농도가 일정할 때, 수증기/탄소의 몰 비를 1.5~2.6 범위에서 바꾸면서 반응실험을 수행하였다. 수증기의 농도가 일정할 때의 실험 조건은 질소와 에탄의 비율을 75 : 25~95 : 5로 변화시키면서 실험을 수행하였다.
수성가스 전환반응 실험은 에탄의 수증기 개질 반응 실험에서 사용한 촉매와 동일한 상업용 니켈 촉매 0.1 g을 장착하고, 반응온도는 300~550 ℃, 공간속도(gas hourly space velocity, GHSV)는 87,000 h-1에서 반응실험을 수행하였다. 수성가스 전환반응의 반응물은 일산화탄소(CO)와 수증기(H2O)이기 때문에 반응속도 데이터를 얻기 위해서 한 가지 물질의 농도를 일정하게 하고, 나머지 한 가지 물질의 농도를 변화시켜 실험하였다. 일산화탄소의 농도가 일정할 때, 수증기/일산화탄소의 몰 비를 1.5~2.6 범위에서 바꾸면서 반응실험을 수행하였다. 수증기의 농도가 일정할 때의 실험 조건은 질소와 일산화탄소의 비율을 75 : 25~95 : 5로 변화시키면서 실험하였다.
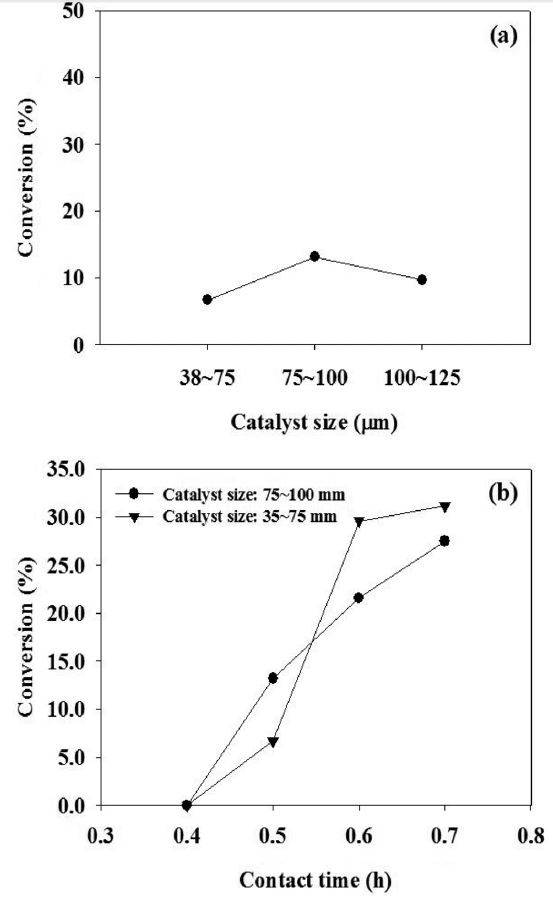
고정층 반응기에서 반응속도 데이터를 얻기 위한 반응 실험을 수행할 때, 전환율을 낮게 하여 미분형 반응기 조건에서 실험하는 것이 속도식을 얻기에 용이하다[14]. 따라서 비교적 낮은 전환율을 갖도록 적합한 반응 조건을 탐색하여 실험하였다. 일반적으로 화학 반응에 대한 반응속도 데이터를 얻기위해서는 반응물이 촉매 층을 통과하는 동안 반응물과 촉매 사이에서의 표면 확산에 대한 영향이 가장 적을 때 실험한다. 따라서 본 연구에서는 반응속도 데이터를 얻기에 적당한 촉매의 크기를 결정하기 위한 실험을 하였다. 촉매 알갱이의 크기는 38~75 μm, 75~100 μm, 100~125 μm로 나누어 접촉시간의 변화에 따른 수증기 개질 반응 실험을 하였다. Figure 2에 나타낸 바와 같이 반응온도 400 ℃, GHSV 30,600 h-1인 조건에서 촉매 크기에 따라서 전환율 변화가 거의 없었다. 따라서 이 조건에서 내부확산저항(internal diffusion limitation)이 거의 없다고 판단할 수 있었다. 또한 75~100 μm 크기의 촉매를 사용한 경우, 접촉시간이 증가하면 전환율이 비례하여 증가 하는 것을 볼 수 있다. 따라서 본 연구에서 반응속도 실험에 가장 적합한 촉매 크기를 75~100 μm 범위로 결정하고 접촉시간을
0.5 h인 조건에서 반응속도 데이터를 도출하였다.
3.2. 에탄 수증기 개질 반응의 거듭제곱 속도식 모델 도출
거듭제곱 속도식 모델은 식 (4)와 같이 표현되며 실험으로부터 산출해낼 수 있는 값들은 활성화 에너지(Ea), 반응차수(α, β) 및 전지수인자(pre-exponential factor, ko)가 있다.
활성화 에너지(Ea)를 구하기 위해서는 식 (4)에 ln값을 취하 면 식 (5)와 같은 형태를 얻을 수 있다.
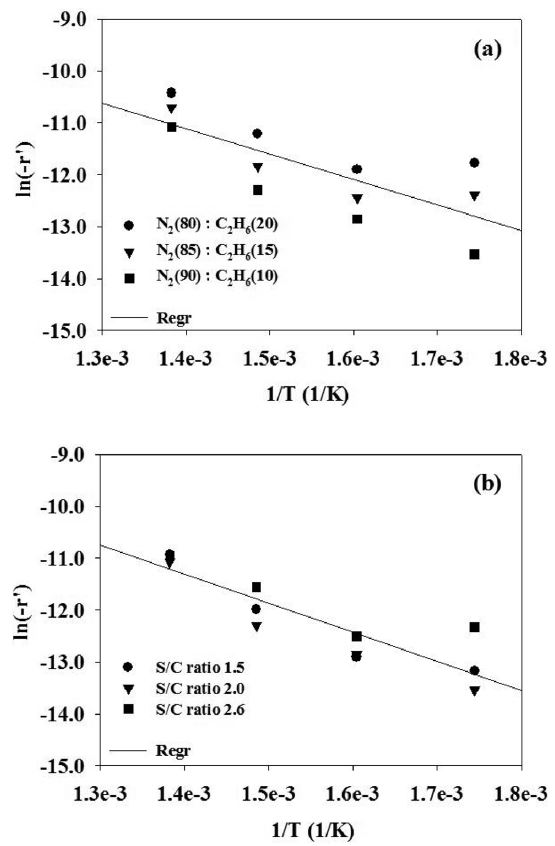
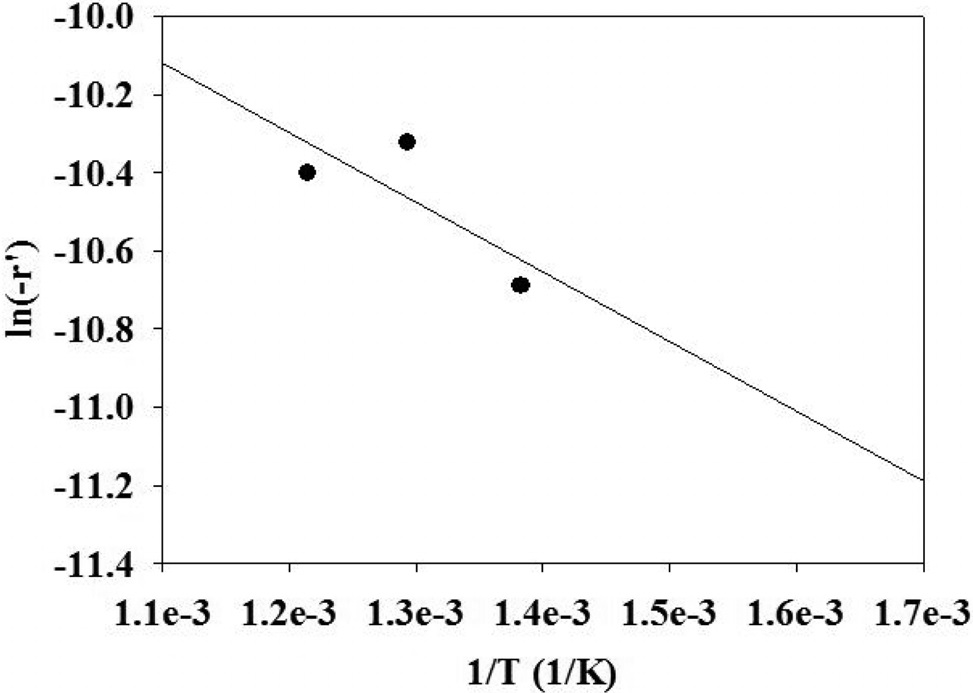
에탄과 수증기의 분압(PC2H6, PH2O) 중에 수증기 분압은 일정하게 유지시키고, 질소와 에탄 분압(PC2H6)의 비를 변화시켜 온도에 따른 반응속도 변화를 Figure 3(a)에 도시하였다. x축을 (1/T)로 하고 y축을 ln(-r’)로 하여 도시하면 선형 관계를 얻을 수 있다. 이 때, 그래프의 기울기인 (-(Ea/R))로부터 계산한 활성화 에너지는 41.0 kJ/mol이었다. 같은 방법으로 에탄의 분압(PC2H6)은 일정하게 유지시키고 수증기 분압을 변화시켜 온도에 따른 반응속도 변화를 Figure 3(b)에 도시하였다. 이 때 얻어진 활성화 에너지는 46.5 kJ/mol이었다. 활성화 에너지는 반응물의 조성에는 영향을 받지 않고 온도의 영향을 받기 때문에 에탄의 수증기 개질반응에 대한 전체의 활성화 에너지는 상기 두 값의 평균인 43.8 kJ/mol로 결정하였다. Huang과 Reimert는 최근 보고된 문헌에서 이트리아로 안정화된 지르코니아에 담지된 니켈 촉매(담지량 37 wt%)를 사용하여 650~730 ℃범위에서 에탄의 수증기 개질반응을 수행했을 때, 활성화 에너지가 80.5 kJ/mol인 것으로 발표한 바 있다[15]. 본 연구에서 얻은 활성화 에너지와 다소 차이를 보이는 것을 볼 수 있는데, 이것은 촉매 중의 니켈 함량이 크게 차이가 나고, 지지체의 종류가 다르며, 또한 반응온도 범위가 다르기 때문인 것으로 해석할 수 있다. 한편 Schädel 등은 로듐
촉매를 사용하여 345~900 ℃ 범위에서 에탄의 수증기 개질반응을 수행했을 때 활성화 에너지가 51.0 kJ/mol인 것으로 발표하여, 본 연구에서 얻은 활성화 에너지와 유사한 결과를 보인 바 있다[2].
반응차수(α, β)를 구하기 위해서는 식 (5)를 풀어 정리하여 식 (6)과 같은 형태로 만들어야한다.
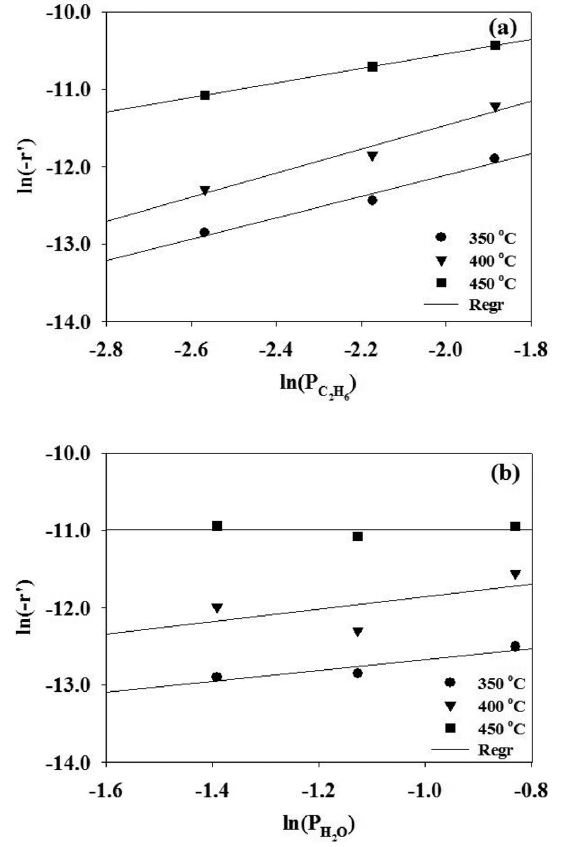
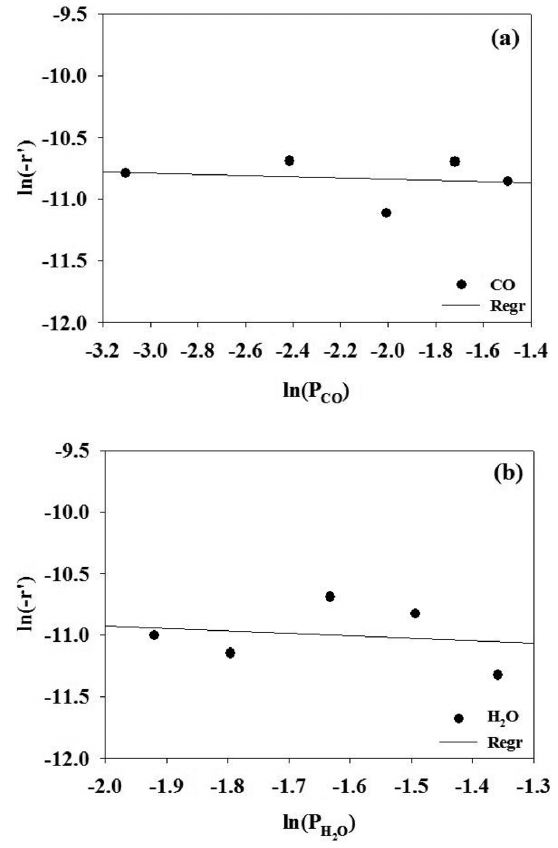
α값을 구하기 위해서 변수를 에탄 분압(PC2H6)으로 하고 반응온도와 수증기 분압(PH2O)은 일정하게 유지시킨 상태에서 실험하였고, β 값을 구하기 위해서는 반대로 변수를 수증기의 분압(PH2O)으로 두고 반응실험을 수행하여 그 결과를 Figure 4에 도시하였다. 이 때 반응차수는 각각의 반응온도에서의 기울기를 평균하여 구하였으며, 에탄과 수증기의 반응차수는 각각 1.3 및 0.5로 나타났다. 앞 절에서 언급한 Huang과 Reimert의 연구 결과와 Schädel 등의 연구 결과에 의하면 에탄의 반응 차수는 0.54~1.58의 범위라고 발표하였는데 본 연구에서 구한
에탄의 반응차수와 잘 일치하는 것을 알 수 있었다[2,15]. 그러나, Huang과 Reimert의 발표에 의하면 수증기의 반응차수는 -0.33~0의 범위여서 본 연구 결과와 다소 차이를 보이고 있다. 이러한 차이는 사용한 촉매가 서로 다르기 때문으로 생각된다.
반응속도 상수(k)는 아레니우스(Arrhenius) 식 (7)으로 표현 할 수 있다. 여기에 자연로그를 취하면 식 (8)과 같은 형태로 바꿀 수 있다.
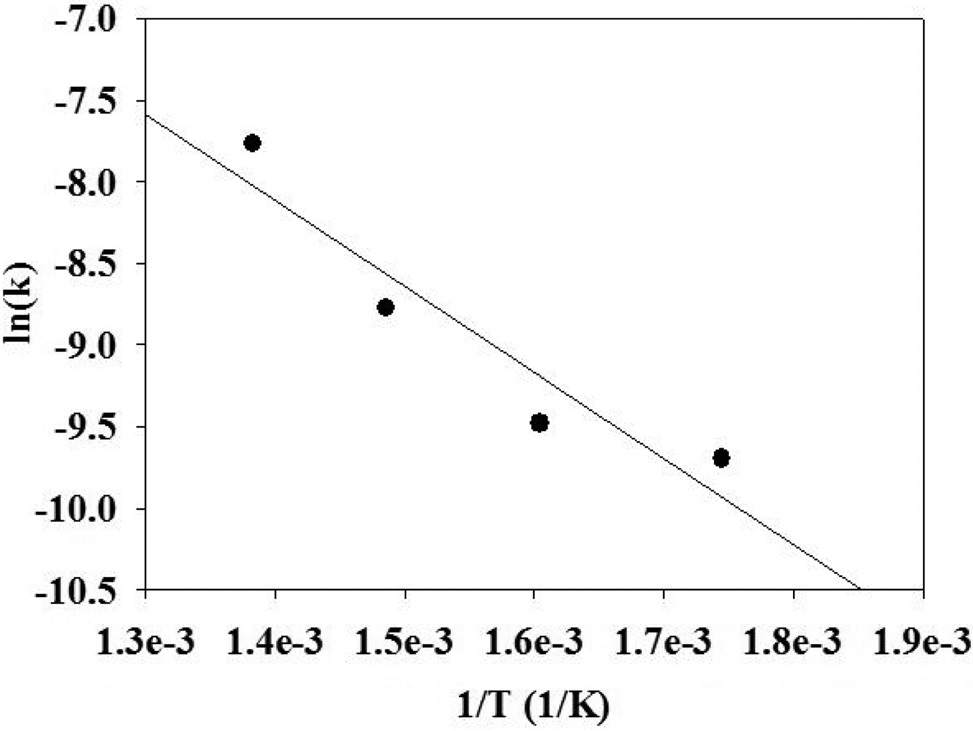
x축은 (1/T)로 하고 y축은 ln(k)로 하여 도시하면 Figure 5를 얻을 수 있다. 이 그래프의 y 절편으로부터 전지수인자(ko)를 결정할 수 있었으며, 이 값은 0.48 mol/gcat.・s・atm(α+β)이었다.
에탄 수증기 개질 반응을 수행하였을 때, 거듭제곱 속도식 모델에 근거하여 얻은 반응속도식을 식 (9)에 정리하였다.
3.3. 에탄 수증기 개질 반응의 랭미어-힌쉘우드 모델식 도출
모든 반응물이 촉매에 흡착되어 활성화된 상태에서 반응에 참여한다는 가정하에 랭미어-힌쉘우드 모델식을 사용하였다. 표면반응이 속도 결정단계이고, 반응식 (1)에서 생성물인 일산화탄소와 수소의 탈착 속도가 상대적으로 빠르다고 가정하면 반응속도식은 식 (10)과 같이 나타낼 수 있다[16].
여기에서 ks는 표면반응의 성격을 나타내는 상수이고 KC2H6 와 KH2O는 각각 에탄 및 수증기의 흡착과 탈착 과정의 평형상
[Table 1.] Parameters of Langmuir-Hinshelwood model for ethane steam reforming reaction

Parameters of Langmuir-Hinshelwood model for ethane steam reforming reaction
수를 나타낸다. 반응온도 350~450 ℃ 범위에서 에탄과 수증기 분압 변화에 따른 반응속도를 구하고, 폴리매쓰(polymath) 프로그램을 사용하여 비선형회귀분석(non-linear regression)을 수행하여 ks, KC2H6, KH2O를 계산하였다. 이로부터 얻은 매개 변수들을 식 (10)에 대입하여 랭미어-힌쉘우드 모델식을 도출하였으며, 매개변수들을 Table 1에 나타내었다. Lee의 연구결과에 의하면 니켈 함량이 45.0 wt%인 촉매를 사용하여 350 ℃의 반응온도에서 에탄의 수증기 개질반응을 수행했을 때, 랭미어-힌쉘우드 모델식의 매개변수는 KC2H6 = 2.052, KH2O = 6.384, ks = 0.189 × 10-2로 보고한 바 있다[9]. 본 연구의 350 ℃ 에서의 결과와 비교하면 에탄의 평형상수(KC2H6)는 유사한 값을 나타낸 반면, 수증기의 평형상수(KH2O)와 표면반응 상수 (ks)는 다소 차이를 보였음을 알 수 있다.
3.4. 수성가스 전환반응에 대한 반응속도 모델식 도출
수성가스 전환반응은 식 (11)의 화학 반응에 따라 탄화수소의 수증기 개질 반응 후에 생성된 수소와 일산화탄소 중, 일산화탄소의 함량을 줄이기 위한 공정이다[10].
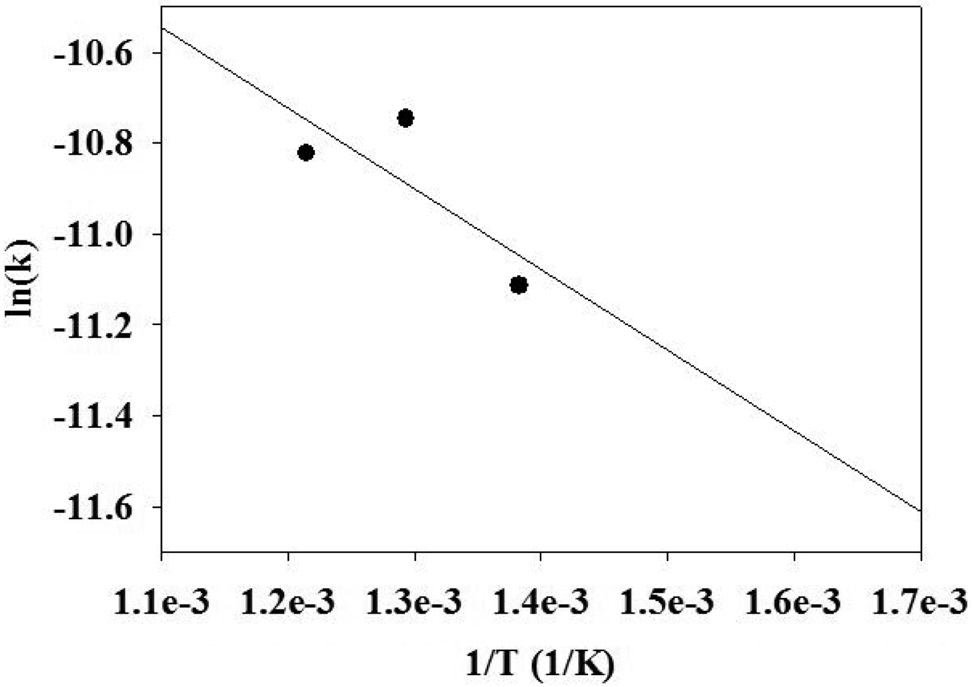
수성가스 전환반응의 반응속도 모델의 매개변수를 얻기 위해서, 에탄의 수증기 개질 반응과 동일한 실험 방법으로 실험을 진행하였다. 반응 실험으로부터 활성화 에너지(Ea), 반응차수(α, β) 및 전지수인자(ko)를 구하기 위한 실험 결과를 Figure 6~8에 도시하였다. 결정된 매개변수를 사용하여 수성가스 전환반응의 반응속도식을 식 (12)와 같이 나타내었다. 수성가스 전환반응에 주로 사용되는 구리 촉매를 사용하여 250 ℃ 이하의 반응온도에서 거듭제곱 속도식 모델을 도출한 기존의 연구 결과에 의하면 활성화에너지, 일산화탄소 반응차수 및 수증기 반응차수는 각각 47.4~69.3 kJ/mole, 0~1.0 및 1.0~1.9 범위인 것으로 알려진 바 있다[17]. 본 연구의 결과와 큰 차이를 보였는데, 이는 수성가스 전환반응에 사용된 금속촉매의 종류가 서로 다르고 기존에 보고된 연구결과는 본 연구의 반응범위보다 훨씬 낮은 온도 범위에서 반응을 수행했기 때문인 것으로 보인다[17].
수성가스 전환반응에 대한 랭미어-힌쉘우드 모델식의 반응
속도식을 도출해내기 위해서 에탄 실험 방법과 동일하게 수행 하였다. 반응 실험을 통해서 결정된 매개변수는 Table 2에 나타내었다.
[Table 2.] Parameters of Langmuir-Hinshelwood model for CO steam reforming reaction
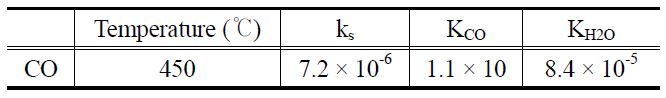
Parameters of Langmuir-Hinshelwood model for CO steam reforming reaction
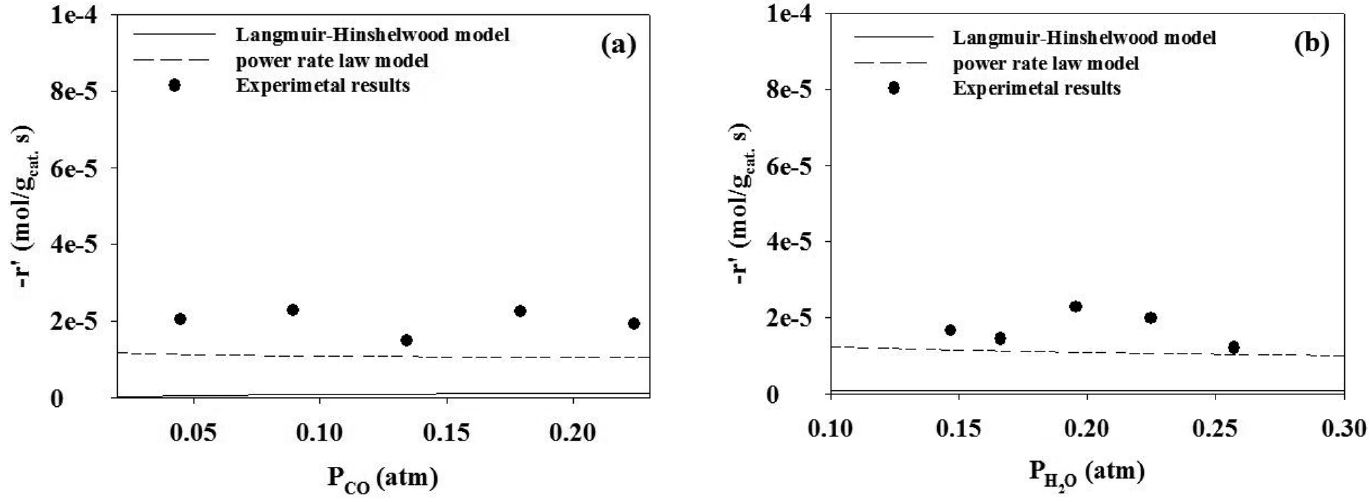
실험으로부터 얻은 반응속도 데이터에 적합한 모델을 판정하기 위하여 거듭제곱 속도식 모델 및 랭미어-힌쉘우드 모델로 비교하였다. 랭미어-힌쉘우드 모델과 거듭제곱 속도식 모델의 부분압은 실험 데이터의 부분압 범위를 포함하여 정하였다. 반응온도 450 ℃에서 두 모델식과 실험 데이터를 Figure 9와 10에 도시하였다. 에탄의 수증기 개질 반응은 랭미어-힌쉘우드 모델이 거듭제곱 속도식 모델보다 실험데이터를 표현하는데 적합한 모델이라는 것을 알 수 있었다. 수성가스 전환반응의 경우에는 거듭제곱 속도식 모델이 랭미어-힌쉘우드 모델보다 적합한 모델이라는 것을 알 수 있었다.
에탄의 수증기 개질 반응과 수성가스 전환반응에 가장 적합한 모델식을 요약하면 다음과 같다.
-rC2H6 = (6.87 × 10-3 × [CC2H6] × [CH2O])/
(1 + 4.41 × [CC2H6] + 5.58 × [CH2O])2
-rCO = 8.42 × 10-6 × EXP(-14.8 × 103/(8.314 × T)) × [CH2O]-0.2
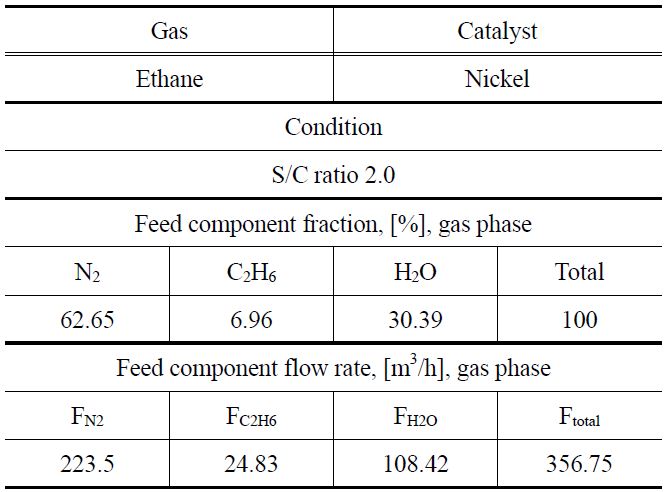
니켈 촉매를 이용하여 에탄의 수증기 개질 반응을 통해서 수소를 생산할 때, 반응기 사이징에 사용된 입력 값을 Table 3에 나타내었으며 이와 같은 입력 값을 이용하여 반응온도를 350, 400 및 450 ℃로 변화시키면서 공정모사를 진행하였다. 반응속도 데이터를 바탕으로 얻은 모델식에 대하여 수증기 개질 반응기 사이징은 PRO/II 시뮬레이션 프로그램을 이용하여 수행하였다. 천연가스 중의 에탄 함량과 유사한 4.33%의 에탄을 포함하는 혼합 가스를 200 m3/h의 유량으로 투입하고,
[Table 3.] Input data of reactor sizing for ethane steam reforming
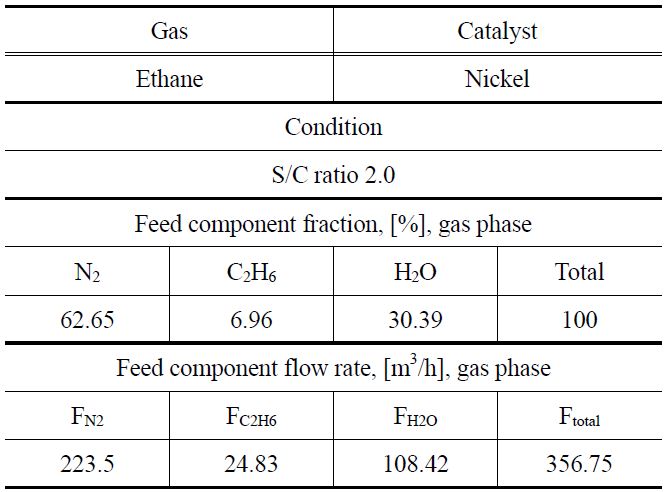
Input data of reactor sizing for ethane steam reforming
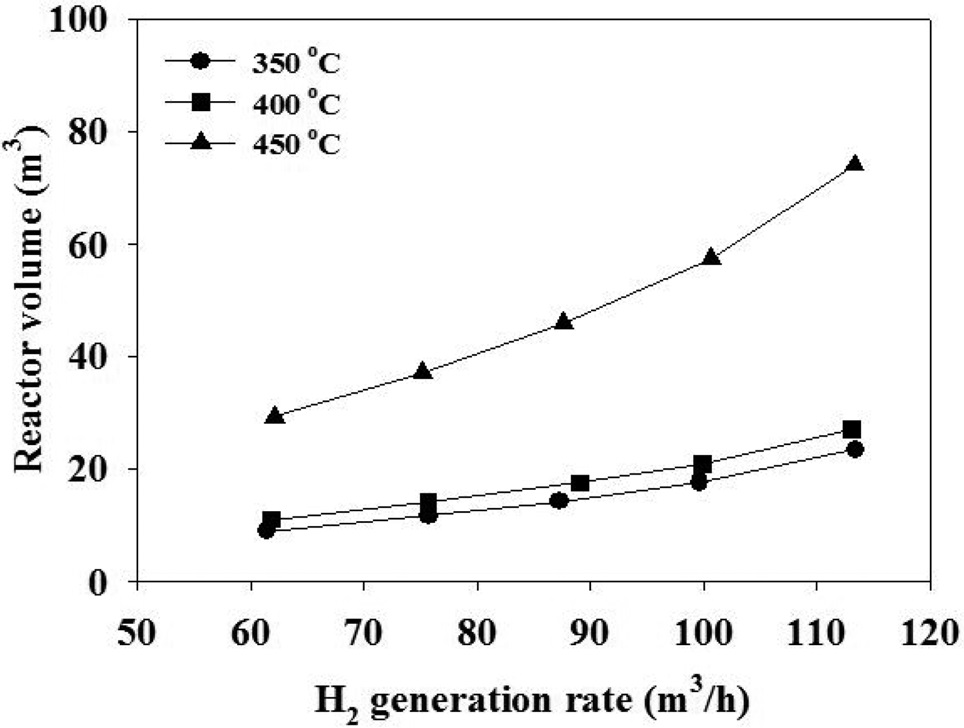
수증기/에탄의 몰 비를 2가 되도록 수증기를 함께 투입하면서 고정층 촉매 반응기에서 수증기 개질 반응을 모사하였다. 촉매의 무게, 밀도 및 공극률로부터 반응기 부피를 정하고, 반응속도 모델식을 적용하여 PRO/II 시뮬레이션 프로그램을 통해서 에탄의 전환율을 계산하였다. 에탄의 전환율로부터 수소 생산량을 계산하고, 수소 생산량과의 반응기 크기와의 관계를 Figure 11에 나타내었다. 이로부터 수소 소요량이 정해지면 이에 필요한 반응기의 크기를 결정할 수 있다. 수소 생산량이 증가하면 이에 필요한 반응기의 크기가 커야 함을 알 수 있으며, 반응기의 온도가 높을수록 필요한 반응기의 크기가 작다는 것을 알 수 있다.
본 연구에서는 상업용 니켈 촉매를 사용한 에탄의 수증기 개질 반응기를 설계하기 위하여 에탄의 개질 반응에 적합한 반응속도식에 대한 연구를 수행하였다. 에탄을 반응물로 하여 개질반응을 수행한 결과, 거듭제곱 속도식 모델보다 표면반응에 의하여 반응속도가 결정되는 랭미어-힌쉘우드 모델이 더 적합함을 확인하였다. 수성가스 전환반응에 대한 반응식은 거듭 제곱 속도식 모델로 적절하게 나타낼 수 있었다. 에탄의 수증 기개질 반응에 대하여 랭미어-힌쉘우드 모델식을 적용하고, 수성가스 전환반응에 대한 반응식은 거듭제곱 속도식 모델을 적용하여 PRO/II시뮬레이션을 통해서 수소 생산량에 필요한 반응기의 크기를 결정할 수 있었다.