리튬이온전지에서 음극활물질의 저장용량을 증가시키기 위하여 주석산화물에 대한 연구가 많이 수행되고 있다. 주석산화물은 기존의 흑연 음극활물질보다 충방전 용량이 높다. 하지만 충방전이 진행되는 동안에 부피팽창률이 높아서 활물질이 파괴되는 현상이 나타나므로 과도한 비가역용량이 문제가 된다. 이를 해결하기 위하여 물리적 완충역할을 하는 물질이 첨가된 복합산화물을 제조하였다. SnO2-SiO2 복합산화물을 솔-젤법을 이용하여 제조하였다. 10 vol% 프로필렌기체를 이용하여 탄소피복을 하여 전기전도성을 증가시켰다. TG/DTA, XRD, SEM과 FT-IR을 이용하여 제조된 물질의 물성을 분석하였으며, CR2032 코인셀을 제조하여 전기화학적인 특성을 조사하였다. 300 ℃로 열처리한 후에 탄소피복한 SnO2-SiO2 활물질의 전기화학적 특성이 가장 우수하였다.
최근에 우리나라의 전력량 최대치에서 전력예비율이 부족하므로, 전기를 안정적으로 공급하는 것이 어렵다. 이를 해결하기 위하여 전기에너지를 저장하는 방법에 대한 연구가 활발히 이루어지고 있다. 전기는 청정에너지이므로 이를 효율적으로 이용하기 위하여 스마트그리드에 대한 연구가 증가하면서, 대용량 리튬이온전지에 대한 관심 또한 증가하고 있다.
리튬이온전지의 중요한 요소는 양극, 음극, 분리막, 전해질이며, 이 중에서 음극은 국산화 비율이 1%로 매우 취약하다. 현재 상용되고 있는 탄소계 물질은 리튬의 이론저장용량(LiC6기준)이 372 mAh/g (818 mAh/ml)으로 제한되기 때문에 이러한 문제점을 극복하기 위해서는 보다 큰 리튬 저장용량을 갖는 음극활물질이 필요하다. 리튬과 반응하여 합금을 형성하면서 기존의 흑연계 물질에 비해 수배의 큰 용량을 가지는 규소(Si)와 주석(Sn)이 대표적인 물질이다.
주석 및 주석합금의 경우 평균 작동전압이 약 0.6 V이고 규소 및 규소합금의 경우 평균 작동전압은 약 0.4 V이다[1]. 주석금속의 이론용량은 784 mAh/g[2,3]이고 규소금속은 리튬금속과 유사한 4,000 mAh/g 이상의 높은 용량을 나타낸다.
규소계 재료와 주석계의 재료는 리튬과 합금화/비합금화 반응을 통해 리튬을 저장하면서 부피팽창이 진행된다. 금속 음극의 부피팽창은 리튬이 금속과 합금화하면서 금속원자 사이의 틈새자리를 차지하면서 반응하여 격자상수가 크게 되는데 기인한다. 규소의 경우 하나의 규소 원자가 최고 4.4개의 리튬과 반응할 수 있기 때문에 부피팽창은 필수적으로 일어 나게되며 약 300%까지 진행될 수 있다[1,2]. SnO2는 리튬 이온과 2단계 과정으로 반응하는데 아래의 식 (1), (2)와 같다.
SnO와 SnO2는 Li2O의 SEI (solid electrolyte interface)를 형성하는 비가역반응(1)을 통해 주석으로 환원되고 주석은 리튬과 Li4.4Sn를 형성하는 비가역반응(2)를 통해서 환원된다. 이 때 생성된 Li2O는 음극에서 부피팽창을 어느 정도 막아주는 안정성을 제공하지만 그 역할은 그리 크지 않다[4-6].
충전 초기에 리튬이 금속과 합금화 반응이 일어나면서 과도한 부피팽창으로 입자내에 균열이 발생하게 되고, 이어서 추가적인 합금화 반응이 지속되면 균열에 의한 파괴로 새로운 표면이 형성되면서 최종적으로 전해질 분해에 의한 SEI막이 표면에 새롭게 형성된다. 부피팽창으로 인한 입자의 균열이 항상 방사형으로 생기는 것이 아니고 불규칙하게 발생하기 때문에 입자 내부 어딘가에는 전해질이 접하지 못하거나 전기적으로 차단되는 부분이 생기게 된다. 이렇게 고립된 파편입자는 전기화학적 반응에 참여하지 못하게 되고 결국 큰 용량 손실이 발생하고 실제 응용을 저해하는 주요 원인이라 할 수 있다[1,7].
부피팽창을 최소화 하는 방법으로 리튬과 반응하는 금속입자의 미세화, 리튬과 반응하는 다중상의 합금, 활성/비활성 금속복합체, 리튬합금/탄소 복합체를 형성하는 방법 등이 제시되고 있다[8].
본 연구에서는 전극의 부피팽창에 따른 기계적인 충격을 최소화하기 위해 리튬과 반응성이 없는 SiO2를 완충재로 사용 하였으며, 프로필렌 기체를 이용하여 탄소 피복을 시켜 전기전도성을 향상시키고자 하였다.
전극 활물질 합성을 위해 SnCl2?2H2O (Junsei, 97 wt%, SnCl2?2H2O), (C2H5O)4Si (Alfa aesar, 99 wt%), C2H5OH (Merck, 99 wt%)와 증류수를 사용하였으며, 솔-젤법을 이용하여 SnO2-SiO2의 복합산화물을 제조하였다[9].
SnCl2?2H2O를 에탄올에 넣고 30분간 교반을 시켜 충분히 용해시킨다. 용해의 과정에서 에탄올의 증발을 막기 위해 파라필름으로 밀봉시킨다. 용해가 완전히 완료된 후 TEOS (tetraethyl orthosilicate)와 증류수를 넣어 파라필름으로 밀봉시킨 뒤 교반시킨다. 교반시키면 수 분 내에 용액의 유동성이 없어져 젤화가 완료된다. 젤화를 거친 젤을 상온에서 24시간 동안 숙성 과정을 거쳐 젤의 강도를 증진시킨 후 숙성이 완료되면 파라필름을 제거하여 건조를 시작하였다. 건조는 상온의 후 드내부에서 약 6일 정도 이루어졌고, 그 뒤에 80 ℃의 강제순환식 오븐에서 1일의 건조 과정으로 충분한 건조가 되게 하여 반응에 사용된 에탄올이 증발되도록 하였다.
건조된 젤의 열처리를 위해 튜브 가열로를 사용하였으며 승온속도 5 ℃/min으로 공기 분위기하에서 300 ℃, 500 ℃, 700 ℃, 900 ℃로 3시간동안 열처리를 진행하였다. 열처리 후 각 시료를 분쇄한 후에 체로 쳐서 입자 크기 별로 분리하였다. 분쇄 과정에서는 분쇄에 의해 영향을 받지 않도록 동일한 시간 동안 진행하였다.
탄소피복을 하기 위하여 각 시료를 승온속도 5 ℃/min으로 알곤 90 vol%/프로필렌 10 vol% 분위기하에서 700 ℃로 10시간 동안 열처리하였다. 열처리 후 각 시료를 분쇄와 체거름을 통해 최종 활물질을 얻었다[10,11].
위 과정으로 합성된 시료의 결정의 형상과 합성정도를 알아보기 위해 열무게분석/시차열분석법(thermogravimetric/differential thermal analysis, TG/DTA), X-선 회절분석법(X-ray diffraction, XRD), 주사전자현미경(scanning electron microscopy, SEM), 푸리에변환-적외선 분광법(fourier transform-Infrared spectroscopy, FT-IR) 등의 분석을 실행하였다. 결정성을 향상시키기 위해서 열처리가 필요하기 때문에 열처리 진행에 앞서 열적특성을 분석하기 위해 TG/DTA 분석을 실행하였다. 측정에 사용된 기기는 SDT-2960 (TA-Instruments)로 공기 분위기하에서 승온속도 10 ℃/min로 900 ℃까지 측정하였다. 또한 결정성 분석을 위해 XRD를 사용하였다. 그리고 입자 크기와 표면 상태를 관찰하기 위하여 SEM 분석을 S-2500C (Hitachi) 기기를 통해 실행하였다. 또한 전기전도도가 향상되었는지 확인하기 위해 전기전도도를 측정하였다.
전기화학적 특성을 측정하기 위하여 제조한 최종 활물질을 음극재로 사용해 활물질 : 도전제 : 바인더를 85 : 10 : 5의 무게 비로 혼합하였고 점도조절을 위해 적정량의 NMP (N-methylpyrrolidinone)를 첨가하였다. 입자의 분산이 잘되도록 초음파 세척기를 이용하여 충분히 분산시킨 뒤 슬러리를 고르게 도포하였다. 도포된 집전체는 강제 순환식 오븐에서 약 2시간 동안 건조시킨 후 전극내부의 전도성을 향상시키기 위해 120 ℃ 온도로 유지되는 열간압연기를 통해 압착하였다. 압착된 전극은 100 ℃ 진공건조기에서 하루 동안 건조하여 수분을 제거하였다.
리튬 금속과 공기 중 수분과의 반응으로 인한 안전성 문제로 인하여, 이슬점이 -70 ℃ 미만으로 유지되는 드라이룸에서 전지조립을 진행하였다. 전지는 CR2032 형태의 코인셀로 제조하였으며, 상대 전극으로는 구리 메쉬에 접합시킨 리튬 금속(99.9 wt%)을 사용하였고, 전해질로는 1 M의 LiPF6염이 용해된 EC : EMC : DMC (1 : 1 : 1 v/v)를 사용하여 반쪽전지의 형태로 전지를 제조하였다.
제작된 코인셀 전지의 사이클 특성, 초기 충?방전 용량 그리고 충?방전 효율 등을 측정하기 위해 충방전실험장치인 Series 4000 (Maccor)을 이용하였고 컷오프 전압은 0.01 V~1.5 V 에서 수행하였다.
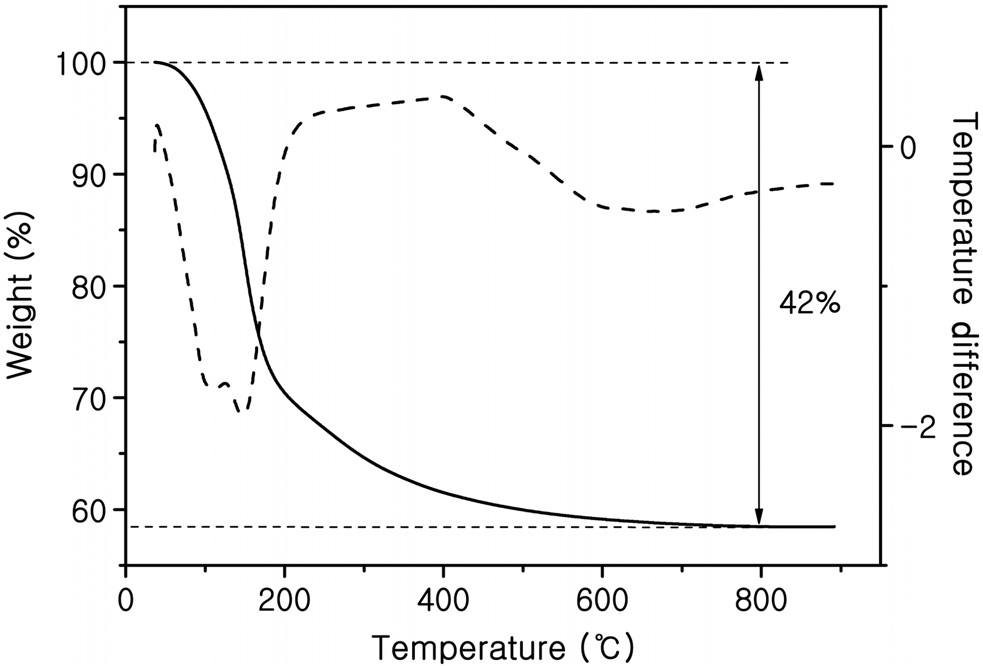
솔-젤법을 통해 합성된 전구체를 열처리하기 전에 TGA/DTA 분석을 실시하여 온도에 따른 물질의 무게감소를 측정하였다고 그 결과를 Figure 1에 나타내었다. 무게감소의 대부분은 솔- 젤반응 중의 가수분해와 축합반응 과정 중에 발생하는 물과 에탄올과 염소성분 등이 날아갔기 때문이다. 시료의 무게감소 가 약 800 ℃까지 42 wt%로 측정되었다.
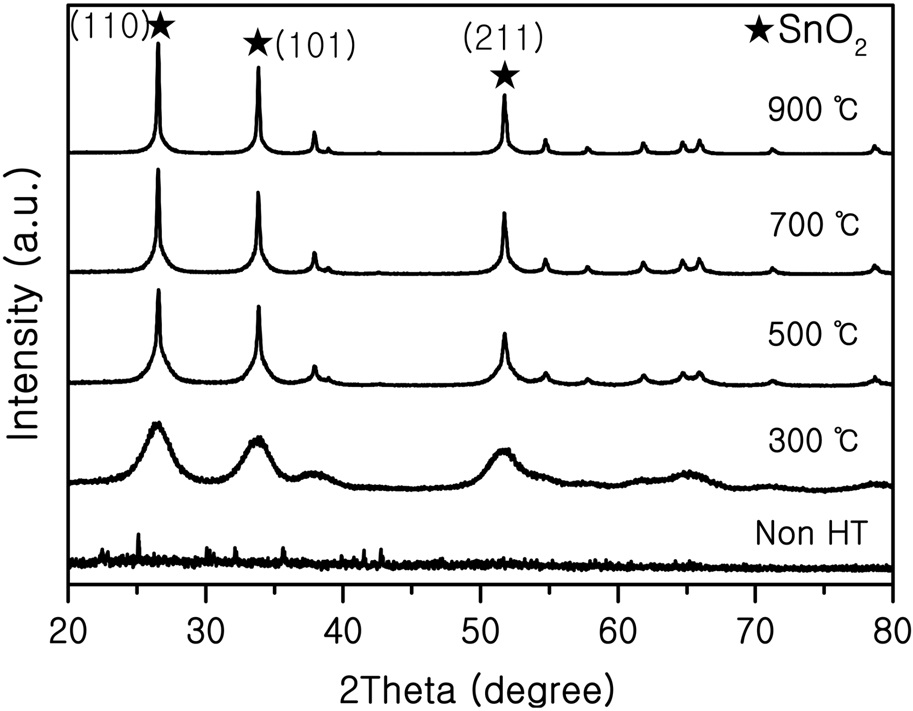
Figure 2에 SnO2-SiO2 시편의 열처리 온도 변화에 따른 XRD 결과를 나타내었다. 약 26.5°, 33.8°, 51.7° 부근에서 피크가 나타났는데 이 피크는 SnO2의 JCPDS 41-1445와 일치하는 것으로 나타났다. 또한 열처리온도가 증가할수록 피크의 강도가 높아지는 것을 확인하였다. 이것은 SnO2 결정이 성장을 하기 때문이며 SEM 분석결과를 보면 확실하게 알 수 있다. SiO2 는 비정질이므로 XRD 피크가 나타나지 않았다. 300 ℃ 시료의
XRD 피크는 넓게 퍼진 형태로 나타났고 500 ℃ 시료 이후부터 피크가 크게 나타났다.
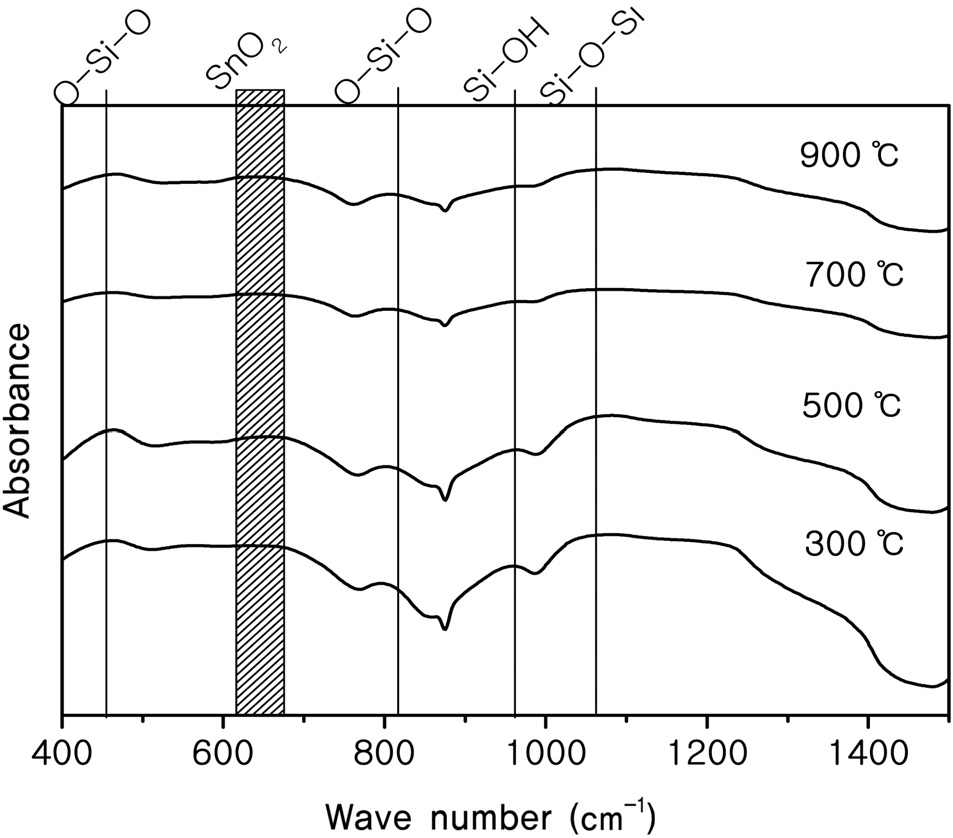
Figure 3에 SnO2-SiO2 시료의 FT-IR 결과를 나타내었으며, XRD 실험에서 확인할 수 없었던 SiO2를 확인하고자 하였다. 시료는 SnO2-SiO2를 300 ℃, 500 ℃, 700 ℃, 900 ℃로 열처리한 시료로 측정하였다. FT-IR 결과에서 460 cm-1 부근에서 O-Si- O의 굽힘진동, 960 cm-1에서 Si-OH, 1080 cm-1 부근에서 Si-OSi의 비대칭 신축진동 등이 나타났다[12,13]. 또한 SnO2는 620- 680 cm-1에서 넓고 강한 형태로 나타났다[14]. FT-IR 분석을 통해 SnO2의 존재와 SiO2의 존재를 확인할 수 있었다. 그리고 Si-OH 결합은 축합반응에서 반응물이 미량 존재한 것이고 700 ℃ 이하로 열처리한 시료에서만 볼 수 있었다.
합성된 SnO2-SiO2의 결정성 및 표면특성을 알아보기 위해 SEM 분석을 하였다. Figure 4는 SnO2-SiO2 활물질을 300 ℃, 500 ℃, 700 ℃, 900 ℃에서 열처리한 후에, 700 ℃에서 탄소 피복한 시료의 SEM 사진이다. 300 ℃열처리 시료에서는 수~ 수십 nm 수준의 입자크기를 가지고 500 ℃열처리 시료부터는 μm 수준의 입자크기로 성장한 것을 확인 할 수 있다. XRD 분석 결과에서도 온도가 증가함에 따라 SnO2의 피크의 세기가 강해진다는 사실과도 잘 일치한다. 그리고 탄소 피복된 시료가 전체적으로 구형모양을 나타내었고 군데군데 구멍이 있는 모습을 나타내었다. 또한 입자 표면에 미세한 입자가 붙어 있는 것으로 확인되었는데 그라인딩 과정에서 분쇄된 입자로 생각되어진다. 또한 탄소 피복된 300 ℃ 시료는 탄소피복을 하기 위해서 700 ℃에서 열처리를 하였는데 입자가 약간 커지기는 했지만 다른 높은 온도에서 열처리한 시료와 비교해 보았을 때 입자크기가 작은 것으로 알 수 있었다.
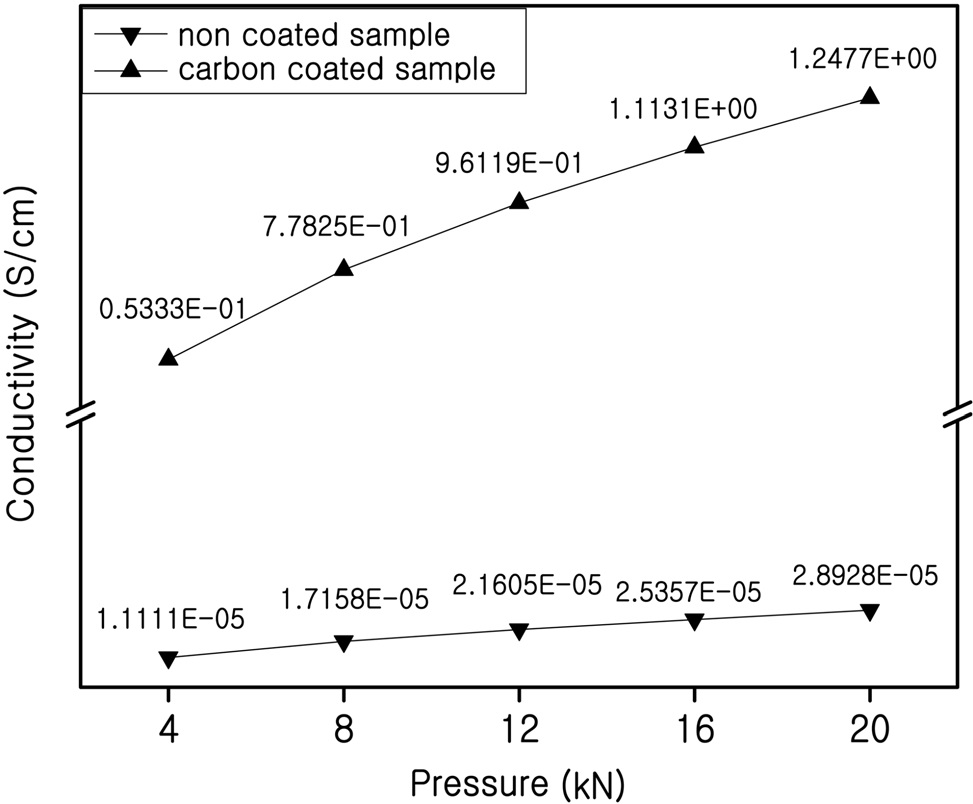
부피팽창으로 인한 입자 내부의 어딘가에 전기적 고립으로 인해 전기전도도가 낮아지는데 이것을 보완하기 위해 탄소 피복을 하였고 그 후 전기전도도가 개선되었는지 확인하기 위해 합성된 SnO2-SiO2의 전기전도도를 측정하였다. 전기전도도
가 증가하기 위해서는 전자가 많던지 아니면 전자의 이동이 빨라야 한다. Figure 5에 탄소 피복되지 않은 300 ℃ 시료와 탄소 피복된 300 ℃ 시료의 전기전도도 비교를 나타내었다. 탄소 피복되지 않은 시료는 4 kN에서 약 1.11 × 10-5 S/cm으로 나타났고 탄소 피복된 시료는 4 kN에서 0.5 × 10-1 S/cm으로 나타났다. 실험결과에서 볼 수 있듯이 탄소 피복을 통해 전기 전도도가 개선된 것을 알 수 있었다. 탄소가 피복되지 않은 시료에서는 압력이 증가할수록 전기전도도가 크게 증가하지 않았다. 이는 SnO2-SiO2가 부도체이기 때문으로 판단된다. 하지만 탄소가 피복된 시료에서는 압력이 증가할수록 전기전도 도가 크게 증가하였다. 낮은 압력에서는 탄소간의 접촉이 작은 부분에서 이루어지지만, 압력이 증가하면 탄소간의 접촉
면적이 커져서 전기의 흐름이 쉽게 발생하기 때문으로 해석 된다.
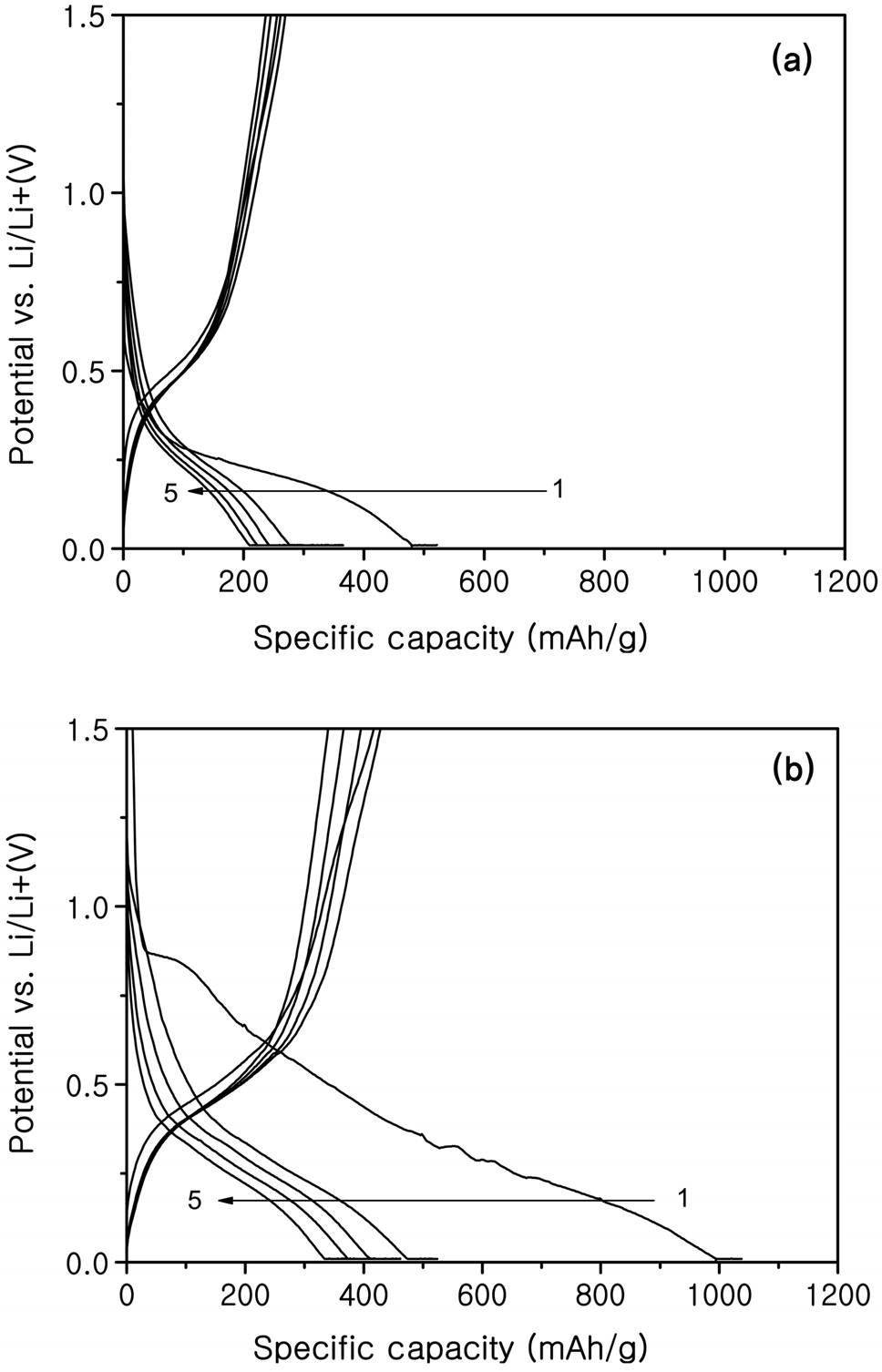
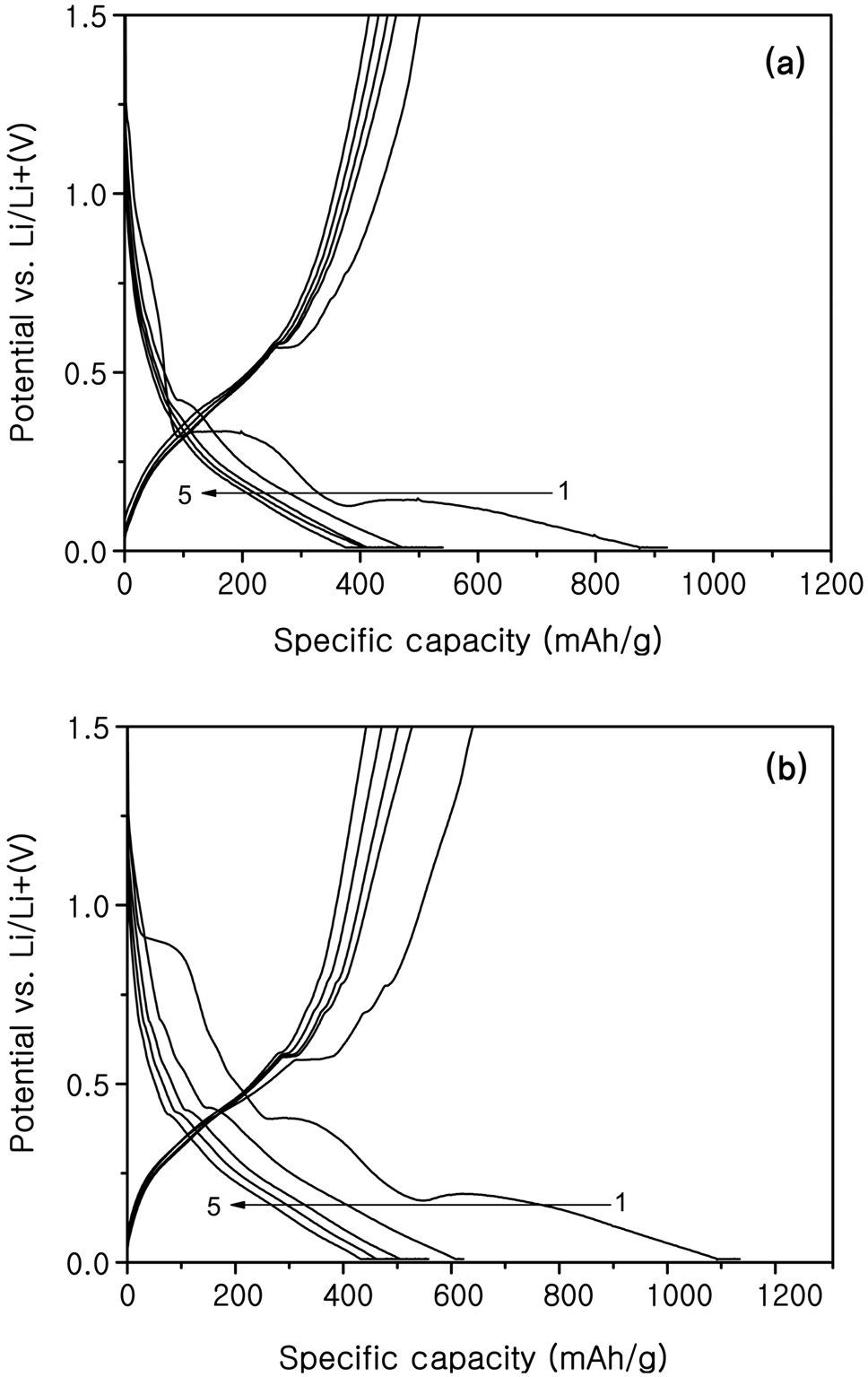
솔-젤법으로 합성된 SnO2-SiO2 활물질로 만든 코인의 전기 화학적 특성을 분석하였다. Figure 6은 탄소 피복되지 않은 300 ℃, 900 ℃로 열처리한 SnO2-SiO2시료의 충방전 곡선이며, Figure 7은 탄소 피복된 300 ℃, 900 ℃로 열처리된 SnO2-SiO2 시료의 충?방전 곡선을 나타내었다. 탄소 피복되지 않은 시료의 충?방전 곡선에서는 리튬과 합금화 반응을 통해 리튬을 저장하는 주석의 특성상 평탄전위는 확인할 수 없었지만 탄소 피복된 시료의 충?방전곡선은 0.4 V 아래에서 두 번의 평탄전위가 발생하는 것을 확인할 수 있었다. 이것은 탄소 피복으로 인한 결과로 나타났고 이 평탄전위는 약 0.3 V와 0.1 V 구간에서 나타났으며, 이 구간에서 탄소의 구조 안으로 리튬의 삽입과 탈리가 발생하기 때문으로 해석된다.
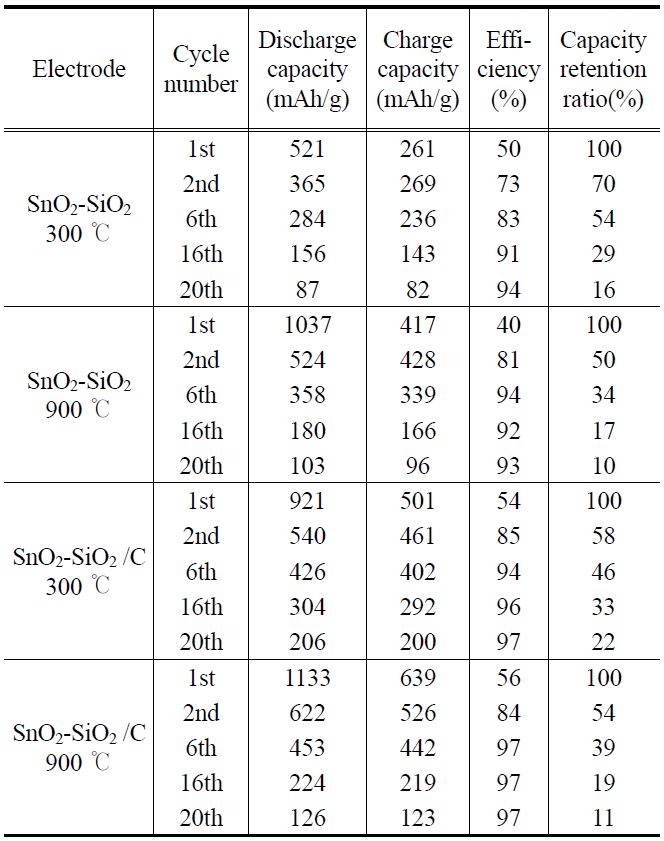
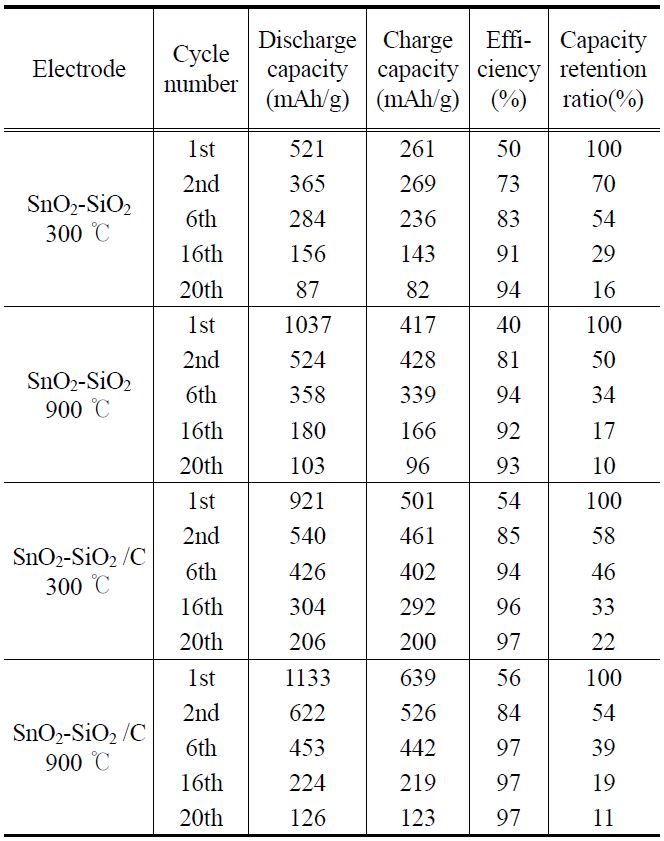
첫 방전 시에 Li2O 형태의 SEI를 형성하는 비가역 용량이 각각 발생하였고 모든 전지에서 충?방전 효율이 50% 정도인 것을 알 수 있었다. 초기용량은 열처리온도가 높을수록 높 았지만 충?방전이 진행된 후 비가역용량이 더 크게 발생하는
것을 알 수 있었다. 탄소 피복된 SnO2-SiO2 300 ℃ 열처리 시료가 첫 방전에는 921 mAh/g, 두 번째 방전에 540 mAh/g, 20회 사이클 후에 206 mAh/g의 용량을 나타내어 용량 유지율면에서 가장 우수한 전지의 형태를 보여주었다.
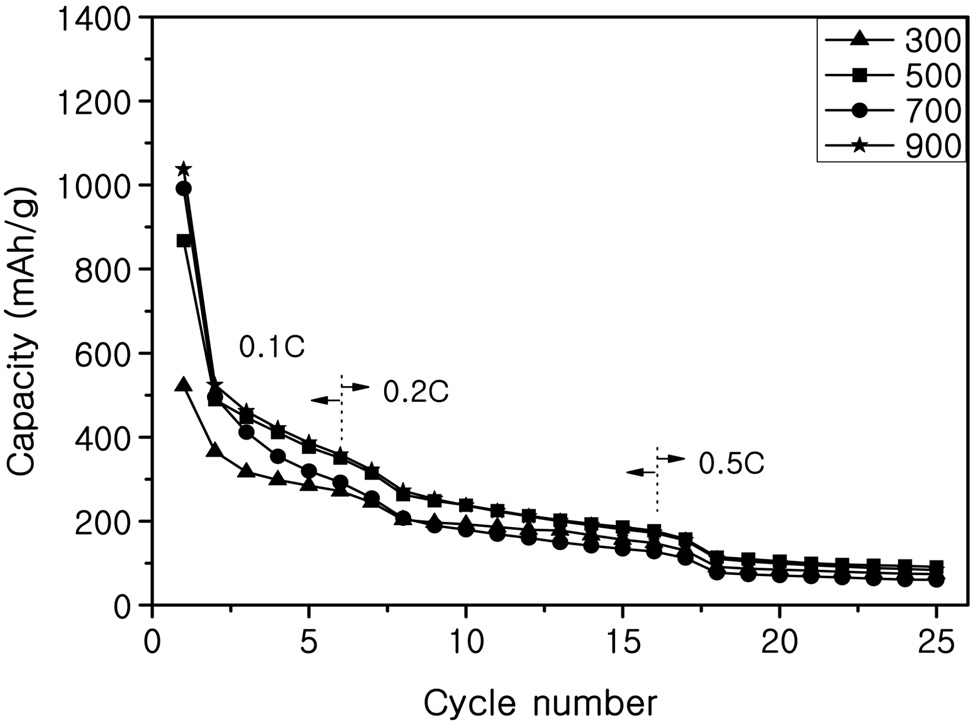
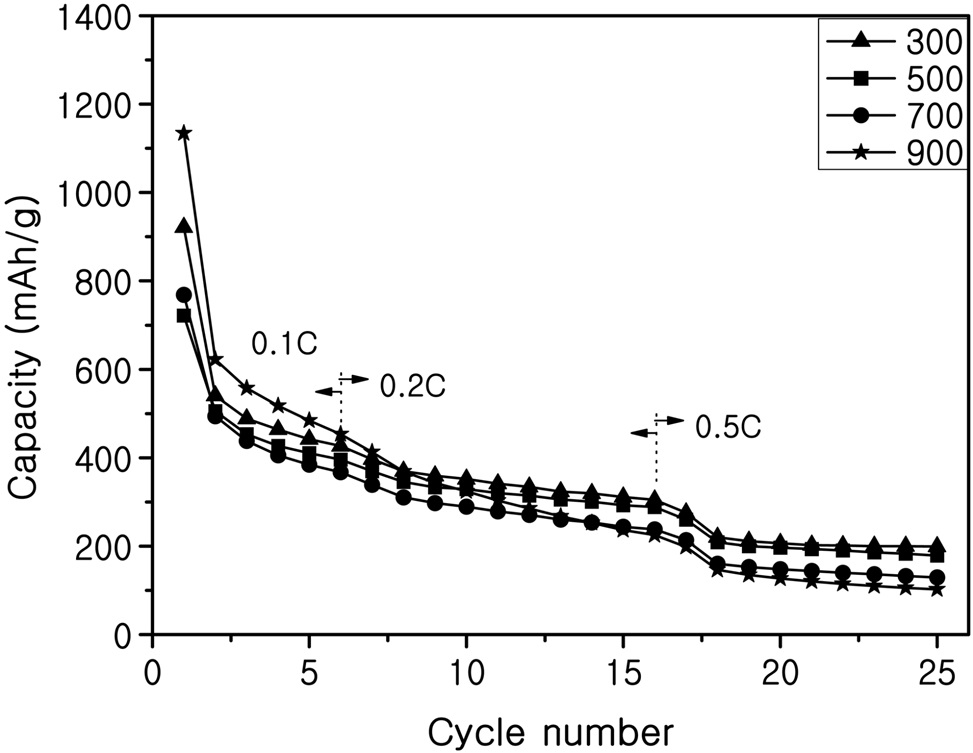
Figure 8은 탄소 피복되지 않은 SnO2-SiO2시료로 제조한 전지의 사이클 특성 테스트 결과이며, Figure 9는 탄소 피복된 SnO2-SiO2시료로 제조한 전지의 사이클 특성 테스트 결과를 나타내었다. XRD 분석결과 300 ℃에서 열처리한 시료의 피크가 작아서 결정성장이 잘 되지 않은 것으로 보이고 SEM 사진에서 보듯이 높은 열처리온도의 시료보다 작은 입자크기를 갖는 것을 보았다. 이러한 결과로 저온 열처리한 전극이 입자 크기가 작아서 부피팽창의 응력을 덜 받기 때문에 사이클 성능이 좋은 것으로 사료된다. Table 1에는 300 ℃와 900 ℃ 시료의 특정 사이클에서 충?방전 용량, 효율, 용량 유지율을 계산하여 정리하였다. 이 결과에서도 볼 수 있듯이 탄소 피복된 300 ℃ 시료가 약 20회 사이클 후 용량유지율이 22%로 가장
[Table 1.] Charge/discharge capacity, efficiency and retention ratio of cells
Charge/discharge capacity, efficiency and retention ratio of cells
나은 사이클 특성을 나타내었고 다른 시료에서도 탄소 피복되지 않은 시료보다 탄소 피복된 시료가 용량유지율이 개선된 것을 알 수 있었다. 한편 SnO2만을 사용하여 실험한 Kim et al.[6]의 결과와 비교하면, SiO2를 완충물질로 사용한 전지의 충방전용량이 증가한 것을 알 수 있었다.
프로필렌 기체는 이중결합을 가지고 있기 때문에 프로판 기체보다 그래핀으로 형성되기 쉽고, 형성된 그래핀은 입자의 표면에서 van der Waals 작용을 하여 정전기적 인력을 가지고 있으므로 표면에 전자가 증가한다는 보고가 있다[15]. 사이클 특성에서 탄소 피복된 시료가 탄소 피복되지 않은 시료보다 전기화학적 특성이 우수하게 나타났고 이는 탄소 피복을 통해서 어느 정도 그래핀으로 형성되고 전기전도도 향상으로 인한 초기 용량과 사이클 특성을 개선시킨 것으로 사료된다.
리튬 이차전지용 SnO2-SiO2 음극활물질을 솔-젤법으로 제조 하였으며, 합성된 SnO2 결정입자가 나노크기로 매우 작게 제조되었다. SnO2와 SiO2가 서로 보완작용을 하여 완충 작용을 하도록 하였으며, 프로필렌 기체로 탄소 피복을 하여 전도도를 증가시킬 수 있었다.
XRD 분석을 통해 SnO2-SiO2가 열처리 온도가 증가할수록 SnO2의 결정이 성장하는 것을 확인할 수 있었다. 비정질 SiO2 의 존재는 XRD 분석에서 확인할 수 없었지만 FT-IR 분석을 통해 확인하였다. 또한 SEM 분석을 통해 SnO2-SiO2의 입자가 열처리온도가 증가할수록 결정성이 성장하는 것을 확인하여 XRD 분석과 같은 결과로 나타났다.
전기화학적 실험을 통해 열처리 온도가 높아질수록 초기 용량개선이 이루어졌다. 하지만 충?방전 효율에서 열처리 온도가 낮을수록 좋은 전지 성능을 나타내었다. 탄소 피복된 시료의 전기전도도가 향상 되었고 초기용량과 사이클 특성이 개선 되었다. 또한 탄소 피복된 시료가 25회의 충방전 후에, 탄소 피복되지 않은 시료에 비해서 높은 용량을 유지하였다.
결과적으로 탄소 피복하고 300 ℃로 열처리된 SnO2-SiO2 시료가 가장 좋은 전지 성능을 나타내었으며, 탄소 피복으로 전기전도도를 향상시켜 사이클 특성을 높일 수 있었다. 하지만 초기 충?방전 후에 발생하는 급격한 용량감소와 사이클이 진행될수록 지속적인 용량감소는 앞으로 연구를 통해 개선되어져야 할 것이다.