본 연구는 염료감응형 태양전지의 구성요소 중 핵심 소재로 주목받고 있는 티타니아(TiO2) 나노입자의 크기와 결정구조에 따른 광전 효율을 비교하고자 하였다. 나노입자의 크기는 용매열법(solvothermal method)을 이용하여 출발 용액의 pH를 조 절하고 결정구조의 차이는 솔-젤법에 의해 얻어진 무정형의 티타니아를 온도를 달리하여 소성함으로써 조절되었다. 그 결 과, 용매법으로는 8.9, 12.8 그리고 20.2 nm의 크기를 가지는 세 종류의 아나타제 티타니아를, 솔-젤법으로는 세 종류의 아나 타제-루타일(anatase-rutile) 혼합결정구조를 가지는 티타니아를 얻었다. 여섯 종류의 샘플 중 20.2 nm 크기의 아나타제 결정 구조의 티타니아를 광 전극으로 사용한 염료감응형 태양전지 단위 셀에서 8.6%로 가장 좋은 광전 효율을 얻었다.
염료감응형 태양전지(dye-sensitized solar cells, DSCs)는 이미 상용화에 성공한 실리콘 태양전지나 현재 연구 중인 유기태양전지에 비해서 많은 장점을 가지고 있다. DSC는 실리콘 태양전지에 비해 재료 단가와 설치비용이 저렴하며, 폴리머 기판을 사용하여 구부림 형태의 태양전지로도 만들 수 있다 [1,2]. 현재 시판되고 있는 실리콘 태양전지가 딱딱한 판상 구 조로만 쓰이는 것과 달리 접거나 말아서 휴대할 수 있기 때문에 태양전지의 사용 용도를 크게 변화시킬 것으로 기대된다. 뿐만 아니라 염료감응형 태양전지라는 이름에서도 알 수 있듯이 다양한 염료를 사용하여 전지의 색을 바꿀 수가 있기 때문에 미적 감각이 요구되는 사용처에도 유용하게 쓰일 수 있다. 한편 야외에서 오랜 시간 태양빛에 직접적으로 노출되는 태양전지의 특성상 유기물로 이루어진 유기물태양전지는 그 구조가 변형되거나 파괴되기 쉽다[3]. 반면 DSC는 오랜 시간 태양에 노출되어 있어도 구성된 재료들의 내광성 및 내열성이 우수하여 장기간 안정성을 보장할 수 있다.
이러한 DSC는 가격 측면에서는 경쟁력을 가지고 있지만, 아직 기술적으로는 몇 가지 문제점을 내포하고 있다. 그 중에서도 효율이 기존 실리콘 전지에 미치지 못한다는 것이 가장 큰 문제점이다. 현재 1.0 cm2 미만인 작은 DSC 단위 셀에서의 효율은 약 12%까지 발표되고 있으나[4], 5 × 5 cm2 모듈의 경우에는 6% 미만의 효율을 나타내고 있다[5]. 실리콘 태양전지가 현재 25%에 달하는 효율을 보이는 것 [6]과 비교하면 DSC가 갖고 있는 가장 시급한 문제는 효율을 높이는 것이라 할 수 있다.
DSC의 기본적인 구조는 작동전극(working electrode), 전해질(electrolyte), 그리고 상대전극(counter electrode)으로 구성 되어 있다[7]. 작동전극에 사용되는 반도체는 여러 종류가 있는데 현재는 주로 TiO2를 광범위하게 사용하고 있다. DSC의 작동 원리는 다음과 같다. TiO2 입자에 흡착된 염료가 빛을 흡수하여 전자가 들뜬다. 그 전자는 TiO2 입자의 전도띠로 이동하여 투명전극(transparent conductive oxide, TCO)으로 이동하고 외선을 따라 상대전극으로 전류가 흐르게 된다. 효율을 높이기 위해서는 DSC의 작동 방식에서 알 수 있듯이 광전극으로 사용하는 TiO2 입자를 나노크기[8] 또는 다공성을 갖게[9] 제조하여 염료를 많이 흡착되게 하거나 전자를 용이하게 전달할 수 있게 하는 것이 관건이 될 수 있다. 하지만, 입자가 너무 작으면, 양자화 된 띠 간격의 감소로 전자와 정공 간 재결합이 일어나 효율이 떨어지거나 염료흡착이 효율적이지 못하게 된다[10]. 또한, 루타일(rutile) 결정구조를 갖는 TiO2의 경우 띠 간격이 3.00 eV로 아나타제(anatase)의 띠 간격인 3.21 eV에 비해 작기 때문에, 전자와 정공 간의 재결합이 쉬워져 오히려 효율 감소의 원인이 될 수도 있다[11]. 반면 루타일결정의 비율이 적으면 전지 내부에서 빛의 산란이 약해져 효율이 오히려 감소한다고도 알려져 있다[12].
본 연구에서는 DSC의 구성요소 중 핵심 소재로 주목받고 있는 광 전극 TiO2 나노입자의 크기와 결정구조에 따른 광전 효율을 비교하고자 하였다. 솔-젤법을 이용하여 얻은 무정형의 TiO2를 소성 온도를 달리하여 결정구조가 다른 세 가지 샘플을 얻었고, 용매열법(solvothermal method)을 이용하여 출발용액의 pH를 조절하여 세 가지의 다른 입자크기의 TiO2 샘플을 얻었으며 이들을 DSC의 광 전극 박막소재로 사용하였다.
2.1. 솔-젤법에 의한 다양한 결정구조의 TiO2 합성
에탄올 200 mL에 티타늄 이소프로프산화물(titanium tetraisopropoxide, TTIP, Junsei) 0.50 mol를 첨가한 후 증류수 36 mL를 천천히 첨가하였다. 적정 시간 동안 교반하여 혼합용액을 균일하게 만든 후 60 ℃의 온도에서 용매성분을 제거하였다. 50 ℃의 건조기에서 24시간 건조시킨 후 얻어진 샘플을 세 개로 나누어 각각 500 ℃, 600 ℃, 800 ℃에서 3시간 동안 소결하였다.
에탄올 200 mL에 증류수 36 mL를 혼합한 후 pH 3, 7, 11이 되게 초산(acetic acid, Junsei 99.7%)과 암모니아 수(ammonia water, Duksan 30%)를 첨가한 후 티타늄 이소프로프산화물 0.50 mol을 서서히 첨가한다. 적정 시간 동안 교반하여 혼합용액을 균일하게 만든 후 고온고압반응기에 최종용액을 넣어서 200 ℃에서 8시간 동안 유지시켰다. 반응이 끝난 후 합성된 TiO2 입자의 표면에 흡착되어 있는 불순물과 미반응 물질을 제거 하기 위해 증류수로 세척 후 50 ℃의 건조기에서 24시간 건조시켰다.
합성된 각 TiO2 분말의 형상은 투과전자현미경(transmission electron microscopy, TEM, H-7600, Hitachi)을 이용하여 관찰하 였으며, 분말의 결정성상과 결정크기는 X선 회절 분석기(X-ray diffraction, XRD, D/MAX-1200, Rigaku)를 사용하여 분석하였다. 결정상 분석의 경우 파장 1.5406Å의 CuKa 음극을 이용하여 40 kV, 100 mA의 조건에서 2 Theta 10-80° 범위로 분석하였다. 결정구조와 입자크기 변화에 따른 흡광도와 발광의 차이는 자외선-가시광선 분광계(Cary 500)와 광 발광계(photoluminescence, PL, LabRam HR) 스펙트럼을 이용하여 측정하였다.
투명전도성기판은 가시광선영역에 대해 80%의 투과율과 고유저항(ρ)이 10 Ω/cm2을 갖는 FTO (F-doped SnO2) 유리 기판을 사용하였다. 태양전지 제조공정은 FTO 유리 기판을 0.5 cm × 0.5 cm = 0.25 cm2의 공간면적으로 하여 적당량의 용매와 바인더를 첨가하여 분산시킨 TiO2 페이스트(30.0 wt-% 함유) 를 FTO 기판 위에 스크린 프린팅 한 후 450 ℃로 소성시킨다. 이것을 무수에탄올과 0.03 mM 루테늄계 유기금속화물(N719) 로 구성된 염료용액에 24시간 동안 담근 후 꺼내 염료가 흡착된 전극 막을 에탄올로 세척하여 상온에서 건조시킨다. 상대전 극에 두 개의 작은 구멍을 뚫고 이온 스퍼터를 이용하여 ~10 nm 두께로 백금을 FTO 전극유리 위에 증착하고 다공성 전극 막 테두리에 절연성 폴리머(SX 1170-60, Solaronix) 벽을 형성 시킨 후 열과 압력을 가하여 두 전극사이에 밀폐작업을 한다. 이 후 FTO 유리 기판에 뚫려 있는 두 개의 작은 구멍을 통하여 요오드 전해질을 두 전극 사이의 공간으로 주입하고, 두 개의 구멍은 실링박막과 얇은 유리판으로 밀폐한다. 위 공정을 통 하여 제작된 태양전지의 활동 면적은 0.25 cm2이다.
광전효율을 측정하기 위하여 두 전극 사이에 전압계, 전류계(Model 2000, Keithley) 및 가변부하를 설치하여 전류 전압 곡선(photocurrent-voltage curve)을 측정하였다. 정 전위 전압 계와 증폭계를 사용하였으며 광원으로 300 W의 제논(Xenon) 램프를 사용하여 AM-1.5 방사도와 유사하도록 램프의 세기 를 조절하였고, 빛의 세기는 전력 측정기와 스마트 열감지기로 측정하였다. 임피던스측정은 0.1~100 kHz인 범위의 주파수에서 10 mV 진폭의 교류 신호로 수행하였으며 적용 바이어스 전압 및 교류 진폭은 DSC의 개방 회로 전압에서 설정되었다.
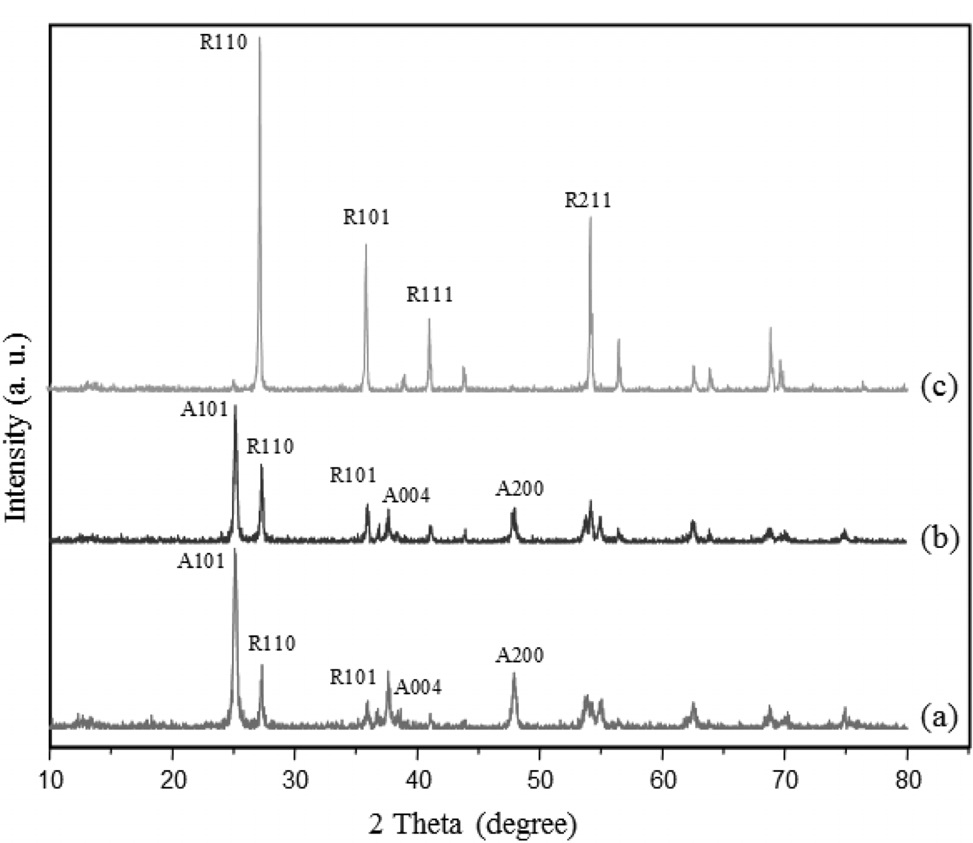
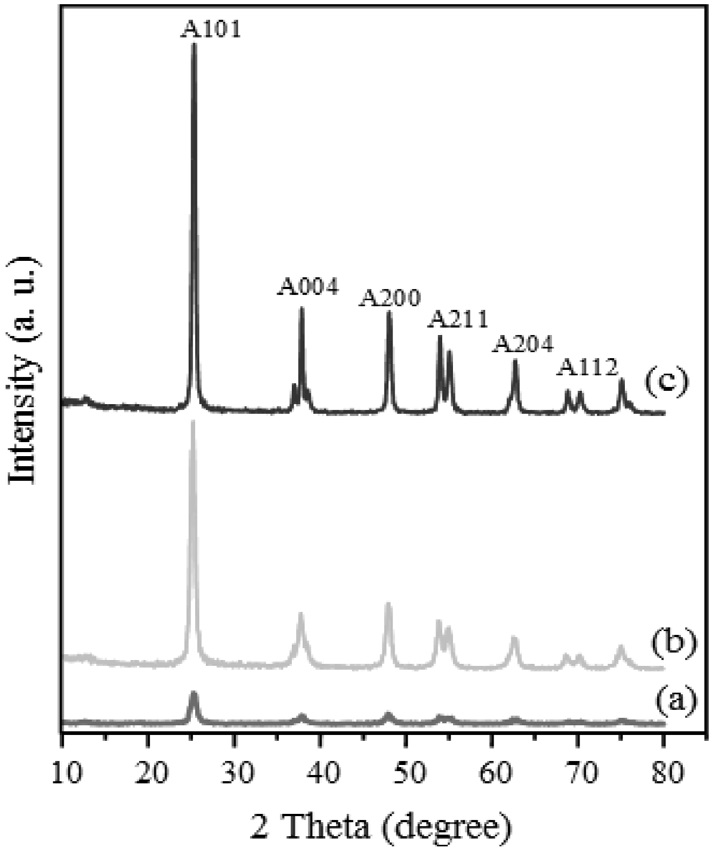
Figure 1은 솔-젤법에 의해 합성된 무정형 TiO2 분말을 소성 온도에 따라 소결한 나노입자의 XRD 패턴을 나타낸 것이다. 500 ℃와 600 ℃에서 소성시킨 시료에서 아나타제[13]와 루 타일[14]의 결정구조가 동시에 나타났으며, 800 ℃에서 소성 시킨 샘플에서는 루타일 결정구조만 나타남을 알 수 있다. 이미 순수 아나타제 TiO2를 전극으로 이용한 DSC 관련 연구는 많은 논문에서 언급되어 있으므로, 본 연구에서는 순수 아나타제
TiO2의 DSC 성능보다 rutile TiO2의 영향에 초점을 맞추고자 하였다. 500 ℃에서 600 ℃로 온도가 증가함에 따라 아나타제 특이결정면인 (101)면의 피크강도가 감소하고 루타일 특이결정면인 (110)면의 피크강도는 증가함을 알 수 있었다. 이를 통해 온도가 증가할수록 TiO2 결정구조가 아나타제에서 루타일로 변하는 것을 알 수 있었다. 일반적으로 XRD 피크의 선폭이 커질수록 결정체 크기는 작아진다. 결정체의 크기를 구하기 위해서 다음의 Scherrer 식을 사용하였다[15].
Scherrer's equation: t = 0.9 λ/βcosθ
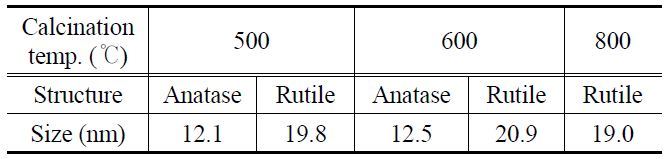
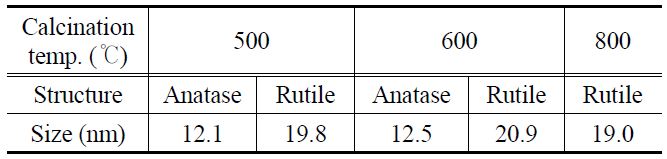
t는 특이 면에 대한 결정면 사이즈, λ는 입사되는 X-선의 파장을 나타내며, β는 최대피크 반치 폭, 그리고 θ는 회절 각을 나타낸다. 아나타제와 루타일 결정구조의 특이(101)면과 (110)면에 대해서 그 값을 계산한 결과를 Table 1에 나타내었다. 500 ℃에서 소성한 입자에서는 아나타제와 루타일의 결정크 기가 각각 12.1 nm와 19.8 nm이고, 600 ℃에서 소성한 입자의 경우 각각 12.5 nm와 20.9 nm이며, 800 ℃에서 소성한 입자에서는 19.0 nm의 순수 루타일결정면 크기를 나타내는 것을 확인하였다.
Figure 2는 합성한 나노입자의 TEM 이미지를 나타낸 것이다. 500 ℃에서 소성한 TiO2 입자의 경우 26.3 nm로 비교적 구형의 작은 크기의 입자 수가 많았다. 그러나 600 ℃와 800 ℃에서 소성한 입자의 경우 약 37.6 nm와 93.1 nm로 크기가 큰 것이 많이 보이고 일반적으로 입자들이 크게 뭉쳐있는 모습을 보였다. 특히 800 ℃에서 소성한 나노입자들의 경우는 아주 크게 뭉쳐있는 경우가 많았으며 TEM 사진으로는 각각의 입자의 크기를 정확히 알기가 쉽지 않았다. 일반적으로 솔-젤법으로 합성한 나노입자가 뭉친 정도가 큰 이유는 소성과 정 중 벌크 입자들 간의 강한 불규칙적 응집에 그 원인이 있는 것으로 사료된다.
[Table 1.] Crystallite size analysis from XRD results
Crystallite size analysis from XRD results
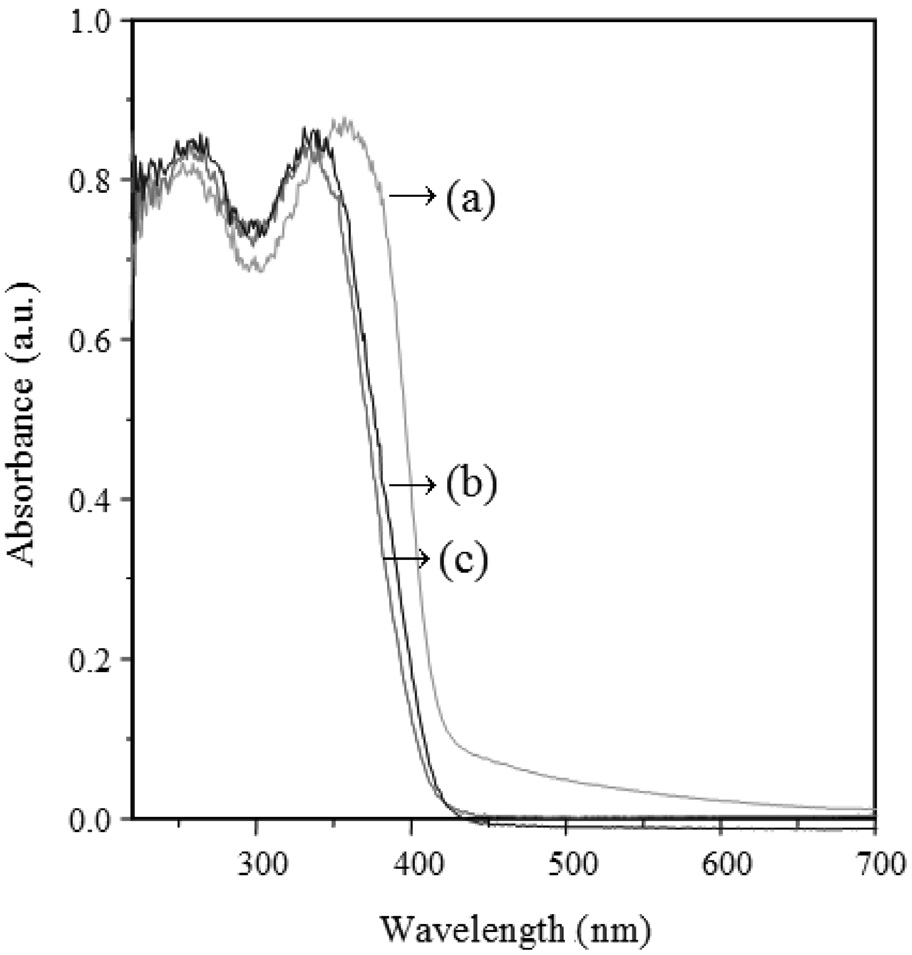
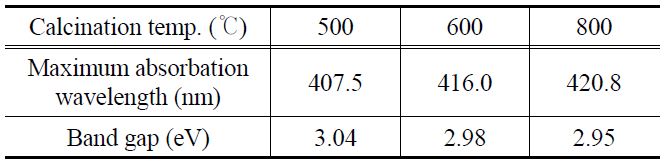
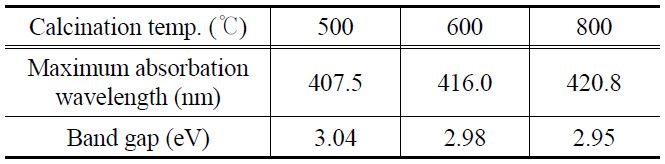
Figure 3은 합성된 나노입자의 흡수분광 스펙트럼인 자외선- 가시광선 커브를 나타낸 것이다. 일반적으로, 반도체 물질에서 밴드 갭은 물질이 흡수하는 파장의 범위와 밀접한 관련이 있 다[16]. 소성온도가 증가할수록 커브는 장파장으로 이동하는 것을 확인하였고, 이것은 작은 에너지의 띠 간격을 가지고 있다고 예측할 수 있다. 현재 DSC에서 TiO2의 띠 간격이 광전 효율에 미치는 영향에 대해서는 의견이 분분하다. 띠 간격이 작아짐으로써 TiO2 입자 자신도 가시광선을 흡수하는 역할을 하여 광 흡수율을 높이는 효과를 가져 올 수도 있고, 반면에 띠 간격이 작아지면 상대적으로 전도대로 여기된 전자들과 최 외각 띠에서 형성된 정공간의 재결합을 촉진시켜 TCO전극으로의 전자 전달을 억제할 수도 있다. 외삽에 의해 측정한 파장의 수치를 E = hv/λ 식에 대입하여 계산한 결과를 Table 2에 나타내었다. 500 ℃, 600 ℃, 800 ℃에서 각각 3.04 eV, 2.98 eV, 2.95 eV로 루타일 결정구조의 띠 간격 에너지가 아나타제 결정구조의 띠 간격 에너지보다 작다는 것을 알 수 있었다.
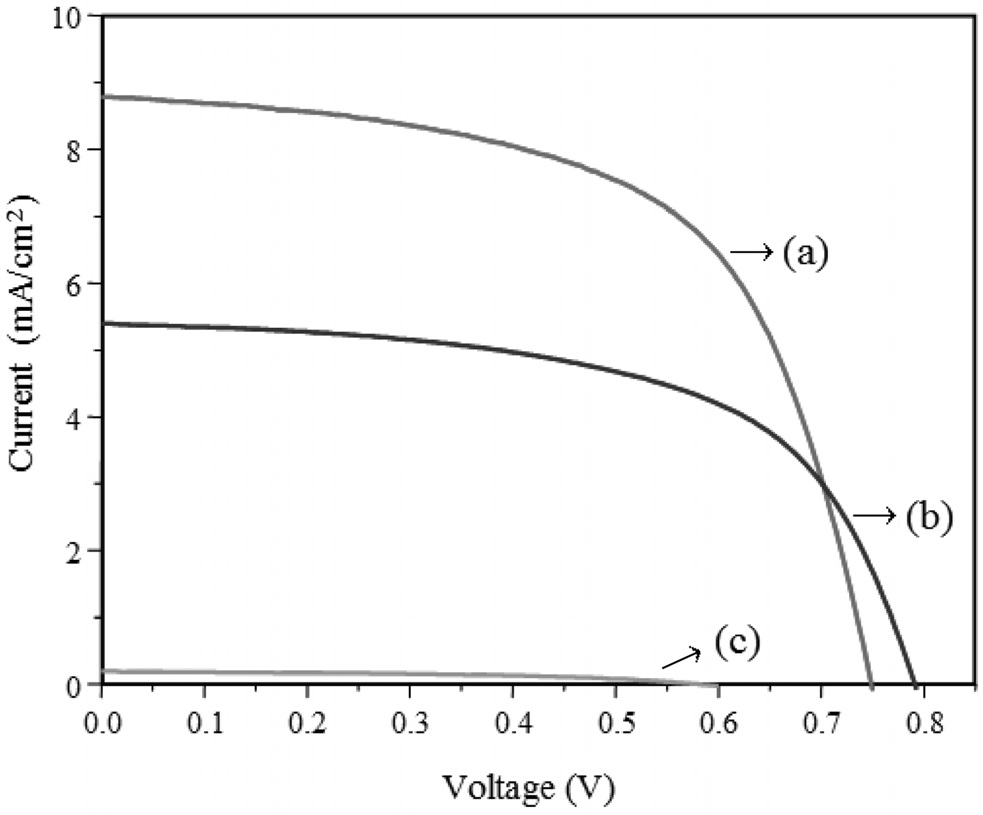
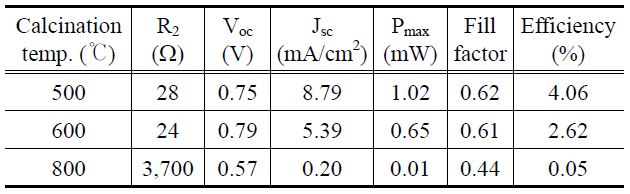
Figure 4는 위에서 합성한 TiO2 나노 입자를 사용하여 제 작된 DSC 광전변환 효율을 위해 측정된 I-V 커브를 제시하 였으며, Table 3에 광전변환 효율 성능을 임피던스와 비교하 여 나타내었다. 충전율과 효율은 식 (1)과 (2)를 통하여 계산하 였다[17].
The band gap energies calculated from UV-Visible spectra of TiO2 obtained at different temperatures
그 결과, 500 ℃에서 소성된 TiO2-DSC에서 가장 우수한 광전효율을 보였으며, 이때 Jsc는 8.79 mA/cm2이고, 충전율이 0.62, 그리고 셀 효율이 4.06%를 나타내었다. 이 결과는 아나타제 결정구조가 루타일 결정구조에 비해서 보다 DSC 광 전극 소재로써 효율적임을 보여주고 있다. 아마도 결정구조에 따른 광전효율의 변화는 앞에서 언급한 입자크기 및 띠 간격과 그 상관관계를 가지는 것으로 사료된다. 즉 루타일 결정구조를 가진 TiO2 입자에서는 띠 간격이 작아져서 전도대로 여기된 전자들과 최외각 띠에서 형성된 정공간의 재결합이 촉진되고 TCO전극으로의 전자 전달이 억제되어 결국 DSC 전류량이 감소하였고, 또한 루타일 결정구조로 갈수록 입자 사이즈가 증가하여 광 전극으로 코팅하였을 때 입자들 간 뭉침 현상이 심해져 충전율이 감소했을 것으로 예상할 수 있다.
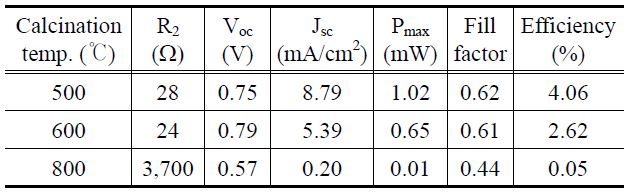
Analysis of photovoltaic efficiency and impedances of DSCs assembled by TiO2 particles obtained at different temperature
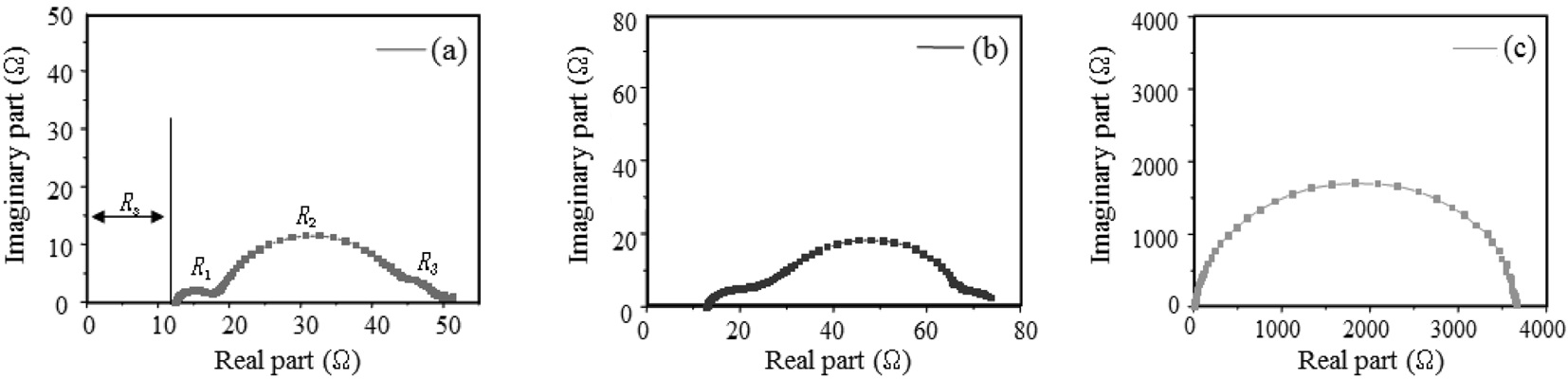
Figure 5는 나이퀴스트 선도(Nyquist plot)를 통해 얻어진 임피던스 곡선이다. Rs는 TCO의 표면저항을, R1은 상대전극과 전해질 사이의 계면의 전하이동 저항과 TCO와 TiO2 사이의 계면의 접촉 저항을 함께 관여한다. R2는 TiO2와 염료 계면에서의 전자의 이동과 재결합 저항에 대한 반원을 나타내며, R3는 전해질 내 이온종의 확산에 관련된 저항을 나타낸다[18]. DSC에 사용된 TCO 기판과 상대전극, 그리고 전해질은 모두 동일하므로 Rs, R1, R3값은 거의 차이를 나타내지 않는다. 일반 적으로 DSS에서는 전극소재를 달리했을 때 R2의 값이 가장 크게 변한다. Figure 5와 Table 3에서 볼 수 있듯이, 전체 저항 값은 소성온도가 높아질수록 커지고, 효율은 감소하는 것을 볼 수 있다. 임피던스 커브를 분석해보면 800 ℃의 경우에는 R2값이 첫 번째 반원 R1과 세 번째 반원 R3에 비해 매우 커서 한 개의 반원 그래프만 나타났다. 이를 효율 그래프에서 보면 다른 곡선들과 비교할 때 800 ℃에서 전류 값이 현저히 떨어지고 있음을 볼 수 있다. 이는 Figure 4에서 언급한 내용과 일치한다. 밴드 갭의 작은 루타일 결정구조로 인한 전자와 정공 간에 재결합으로 인한 TCO전극으로의 전자 전달의 억제가 결국 저항을 증가시키는 원인이 되었으며, 또한 루타일 결정구조의 큰 입자 사이즈에 의한 입자들 간 뭉침 현상으로 염료에서 TiO2 입자 표면으로의 전자 전달이 용이하지 못하여 저항이 크게 걸린 것으로 보인다. 결론적으로 아나타제와 루타일 결정구조가 혼합된 TiO2를 이용하여 DSC의 광전효율을 비교한 결과, 루타일 결정 구조의 함량이 증가할수록 DSC의 성능이 저하됨을 알 수 있었 다. 특히 고온에서의 소성과정을 통해 제조된 루타일 TiO2의 경우 입자간의 강한 응집으로 TiO2 전극의 매우 중요한 요소인 표면적을 충분히 확보할 수 없게 되어 염료의 흡착 량이 줄어들게
되고 결국 이는 DSC의 성능을 저하시키는 결과를 초래하였다.
Figure 6은 용매열법에 의해 pH에 따른 입자 크기를 조절하여 합성한 TiO2 나노입자의 XRD 패턴이다. 모두 TiO2 아나타제 결정 구조를 보이고 있으며, 특성 피크로써 25.3°, 37. 93°, 48.10°, 55.12°, 62.52°, 69.00° 2θ에서 (d101), (d004), (d200), (d105), (d211), (d204)의 결정면을 확인하였다. 주 피크인 (101)면 피크의 선폭증대를 기준으로 하여 Scherrer 식으로 결정체 크기를 구한 결과, pH는 3, 7, 11로 pH가 증가함에 따라 피크강도
가 증가하고, 입자의 크기도 7.1 nm, 12.4 nm, 19.8 nm로 증가하였다. 이것은 TiOR 분자들의 가수분해와 이들 분자들 간의 축합반응이 알칼리용액 내에서 보다 빠르고 쉽게 일어날 수 있어 같은 시간에서 산 용액에서 반응시킨 입자들보다 결정 성장이 증가하기 때문이다.
Figure 7은 TEM 이미지를 나타낸 것이다. 전체적으로 구 형의 입자를 가지고 있는 것을 알 수 있으며, pH가 3, 7, 11로 증가할수록 8.9 nm, 12.8 nm, 20.2 nm 로 입자의 크기가 점점 증가하였다. 이는 XRD 패턴으로 부터 Scherrer 식으로 계산한 결과와 경향성이 일치함을 확인할 수 있다.
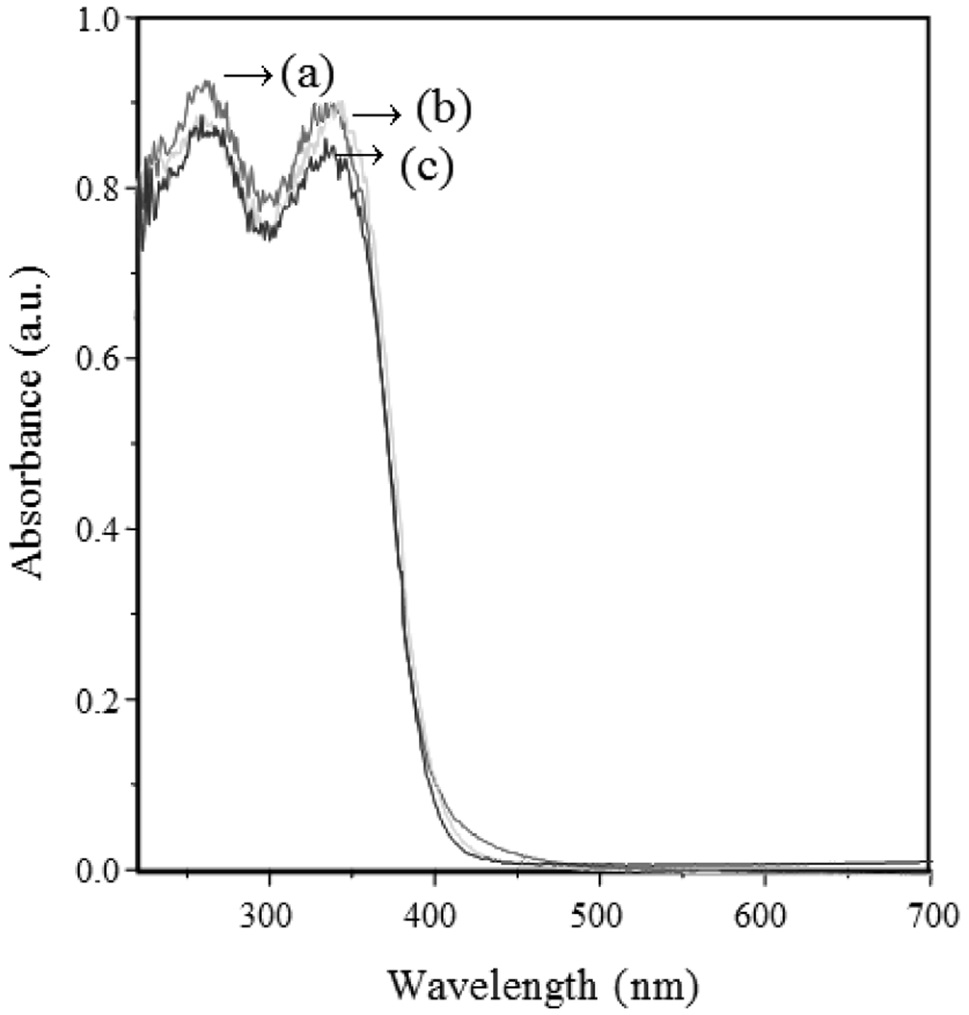
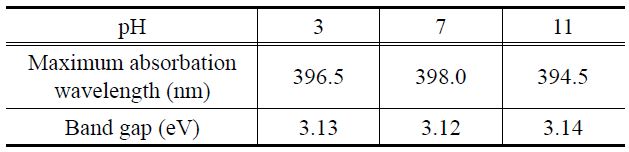
Figure 8은 pH에 따라 합성한 TiO2 나노입자들의 흡수분광 스펙트럼인 자외선-가시광선 커브를 나타낸 것이다. 그래프를 통해 세 가지 샘플이 유사한 파장 범위와 흡광도를 가지고 있다는 것을 확인하였다. 그래프에서 하강하는 부분의 접선을 잡아 X축까지 내려 X축과 만나게 한 부분이 강한 차단, 즉 흡수가 최소값이 되는 부분이다. 이 값이 바로 TiO2 내 전도띠와 최외각 띠 사이의 띠 간격에 상응하는 파장 값이며, 이를 통해 띠 간격을 계산한 결과, pH에 상관없이 세 가지 TiO2 샘플에서 거의 유사한 띠 간격을 확인하였으며, 약 3.12 eV의 띠 간격을
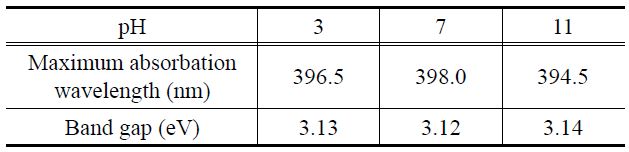
The band gap energy induced from UV-Visible spectra of TiO2 particles obtained using solvothermal method at different pHs
나타냈다.
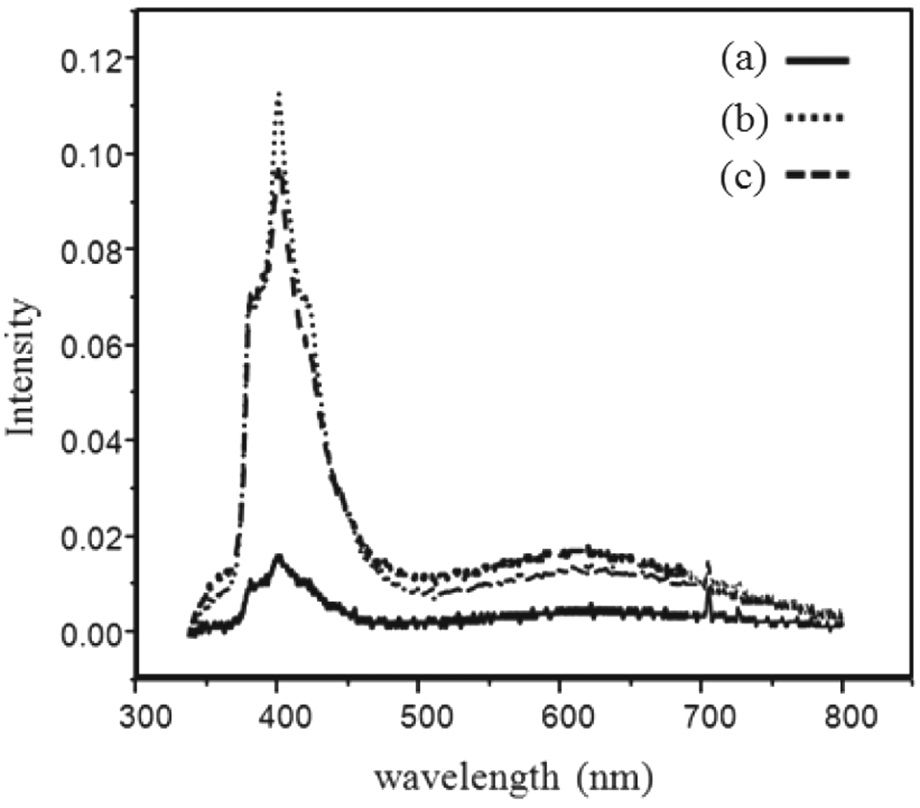
Figure 9는 합성한 TiO2 나노 입자의 형광 스펙트럼 즉 광 발광계 커브를 보여주고 있다. 시료에 빔을 주사시켜주면 최 외각 띠의 전자가 전도띠로 여기되고, 여기된 전자들은 일반 적으로 높은 에너지 준위에 있다가 곧 진동 이완에 의해 전도 띠 끝으로 내려오게 된다. 이중 다수의 전자는 다시 최외각 띠로 떨어지며 전자-정공 재결합을 형성한다. 한편, 일부 전자와 정공은 최외각 띠와 전도 띠 사이에 존재하는 주게 준위나 받게 준위로 이동한 다음 일정시간 경과 후 재결합하게 된다 [19]. DSC의 성능을 좌우하는 요인 중의 하나가 염료에서 생성된 전자가 TiO2의 표면을 따라 이동할 때 전자의 손실이 적고 전해질의 정공과 재결합이 이루어지지 않아야 한다. 따라서 재결합이 작아야 전자-정공의 재결합이 느리게 형성되는 것을 의미한다. PL 측정결과를 살펴보면 pH = 11의 경우 가장 작은 재결합 값을 가지는 것을 확인할 수 있었다. 반면에 pH = 3과 pH = 7에서 얻어진 TiO2 입자의 경우 재결합이 상대적으로 큰 것을 알 수 있다.
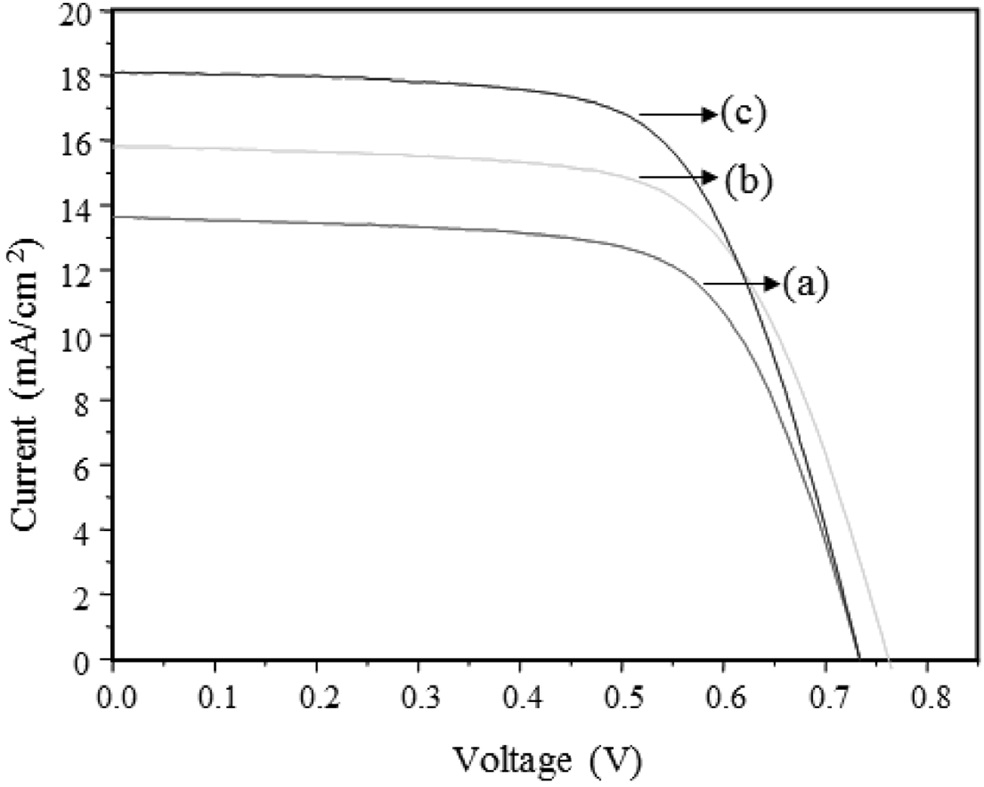
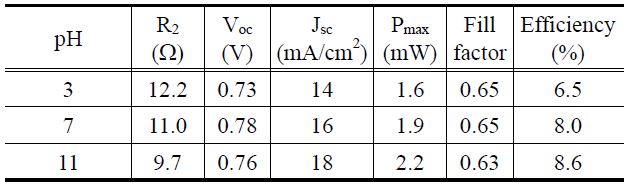
Figure 10은 제조한 TiO2 나노입자를 DSC의 전극소재로 적용하여 0.5 × 0.5 cm2 단위 셀을 제작하여 광전 효율을 측정한 결과를 보여준다. 측정 결과 pH = 3, 7, 11로 갈수록 전류 값인 Jsc값이 14, 16, 18 mA/cm2로 증가하였고, 광전 효율도 6.5%, 8.0%, 8.6%로 증가하였다.
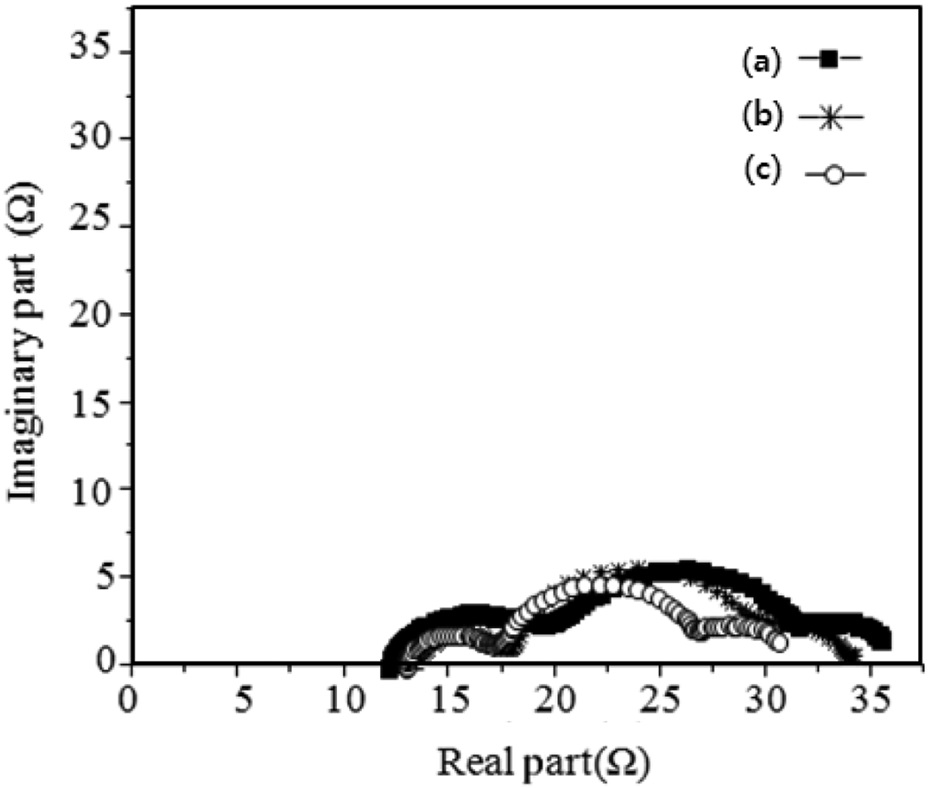
Figure 11과 Table 5는 다양한 pH에서 얻어진 세 가지 입자 크기를 갖는 TiO2를 이용하여 단위 셀을 제작하여 임피던스와 셀 효율을 비교한 것이다. Figure 5에서 언급한 것처럼 반원의 너비가 넓다는 것은 곧 그 반원에 해당하는 부분의 저항이 크다는 것을 의미한다. 특히 두 번째 반원은 TiO2 표면과 염료, 그리고 전해질 사이에 걸리는 저항으로 본 연구에서는 이 두 번째 반원의 너비가 전지의 효율과 직접적인 관계를 가지고 있음을 예상할 수 있다. 세 종류의 단위 셀에 대해 각각 두 번째 반원의 너비를 측정한 결과, pH가 낮아지는 순으로
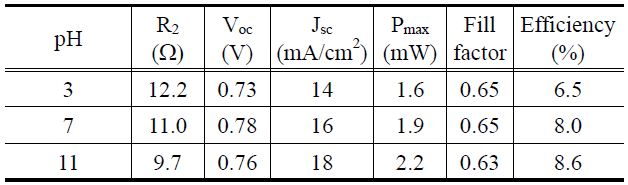
Analysis of photovoltaic efficiencies and impedances of DSCs assembled by TiO2 particles obtained using solvothermal method at different pHs
너비가 큼을 알 수 있었다. 따라서 pH = 11에서 얻어진 TiO2- DSC에서 저항이 가장 작아 전자의 흐름이 용이하게 이루어져 광전효율 성능이 가장 우수한 것으로 판단할 수 있다. 또한 이 결과들은 결정성과 입자의 크기와 관련이 있는 것으로 보이며, pH = 11인 알칼리 용액에서 얻어진 TiO2 아나타제 결정의 경우 결정성이 우수하여 결정 내에 결함 수가 감소했음을 예상할 수 있다. 따라서 결함으로 인한 전자 트래핑현상이 적어져 TiO2 표면에서의 전자의 흐름이 용이하여 TCO전극으로 전달되는 전자의 수가 증가하고 결론적으로 DSC 효율이 증가한 것으로 보인다. 더욱이 pH = 11에서 얻은 TiO2 입자의 크기는 20.2 nm로 일정한 모양을 가지고 있으며 입자들 간의 상호결합으로 인한 벌크 기공을 어느 정도 만들 수가 있어 이로 인한 TiO2 박막 위의 표면적이 넓어져 염료가 쉽게 흡착할 수 있는 자리를 마련해 줄 수 있다. 하지만 입자크기가 10.0 nm 이하로 너무 작을 경우에는 나노입자 표면이 매우 불안정하여 이들 나노입자들은 서로 간의 결합으로 안정화되고자 함 으로써 입자들 간 엉김현상이 증가된다. 따라서 이러한 나노 입자들을 분산시켜 TCO전극에 코팅한 후 열처리를 할 경우, 입자크기가 큰 경우와 마찬가지로 나노입자들 간 수축현상이 커져 TCO전극을 덮는 박막두께가 감소하여 전지의 충전율 이 감소하고 TCO로 전달되는 전자의 수는 감소하게 되어 결국 DSC 광전변환 효율이 저하하는 것으로 사료된다.
솔-젤법을 이용하여 소성 온도에 따른 TiO2 결정구조를, 용매열법을 이용하여 pH변화에 따른 TiO2 입자크기에 변화를 주고자 하였다. 소성온도가 증가할수록 입자내의 루타일 결정 구조의 함량이 증가하였고 입자의 크기도 증가하였으며, 반면 띠 간격은 줄어들었다. 이 결과 DSC의 내부 저항이 증가되어 효율이 감소하였다. 결국 아나타제 결정구조의 비율이 커질수 록 DSC에 적합한 전극소재임을 확인하였다. 용매열법을 이용하여 pH에 따라 TiO2를 합성한 결과, pH가 3, 7, 11로 증가 할수록 8.9 nm, 12.8 nm, 20.2 nm로 입자의 크기가 점점 증가 하였고, pH = 11인 조건에서 합성된 TiO2 나노입자는 발광 강도가 가장 낮아 전자와 정공 간 재결합하는 전자의 수가 적어 TiO2에서 FTO 전극유리로 이동하는 전자가 많아지고 결국 광 전효율이 가장 우수하다는 것을 확인하였다. 또한 pH = 11에서 합성한 TiO2 나노 입자가 내부저항이 가장 낮고 8.6%로 전지의 효율이 가장 높았다. 따라서 본 연구에서는 pH = 11인 조건에서 합성한 약 20.0 nm 크기의 아나타제 TiO2 입자가 DSC에 가장 적합한 소재임을 알 수 있었다.