Carbon-rich coal can be utilized as a fuel for direct carbon fuel cell (DCFC). However, left-behind ash after the electrochemical oxidation may hinder the electrochemical reactions. In this study, we produced ash-free coal (AFC) by thermal extraction and then tested it as a fuel for DCFC. DCFC was built based on solid oxide electrolyte and the electrochemical performance of AFC mixed with K2CO3 was compared with AFC only. Significantly enhanced power density was found by catalytic steam gasification of AFC. However, an increase of the power density by catalytic pyrolysis was negligible. This result indicated that a catalyst activated the steam gasification reactions, producing much more H2 and thus increasing the power density, compared to AFC only. Results of a quantitative analysis showed much improved kinetics in AFC with K2CO3 in agreement with DCFC results. A secondary phase of potassium on yttria-stabilized zirconia (YSZ) surface was observed after the cell operation. This probably caused poor long-term behavior of AFC with K2CO3. A thin YSZ (30 μm thick) was found to be higher in the power density than 0.9 mm of YSZ.
탄소가 다량 포함된 석탄을 직접탄소연료전지(direct carbon fuel cell, DCFC) 연료로 사용 시 무기물인 회분은 반응 후 남아 접촉계면을 물리적으로 덮어 연료전지 성능을 저하시킨다. 본 연구에서는 회분이 제거된 무회분탄(ash-free coal, AFC)을 제조하고 이를 증기 가스화 촉매와 함께 도입한 후 DCFC 연료로써의 특성을 알아보았다. 고체산화물 연료전지(solid oxide fuel cell, SOFC) 기반의 DCFC에 무회분탄과 가스화 촉매인 탄산칼륨을 연료로 도입한 경우와 무회분탄만을 도입한 경우를 비교하였다. 열분해 반응 조건에서는 두 경우의 전력밀도 차이가 크지 않으나, 증기 가스화 조건에서는 촉매가 도입된 무회분탄이 상대적으로 높은 전력밀도 상승을 나타냈다. 이것은 증기 가스화 반응이 촉매에 의해 활성화되어 더 많은 양의 수소가 생산되었기 때문이다. 촉매 유무에 따른 수소 생성양의 차이를 가스크로마토그래피(gas chromatography, GC)로 정량 분석한 결과, 탄산칼륨첨가는 수소 생산 속도를 증가시킴을 확인하였다. 시간 경과에 따른 전력밀도의 감소는 촉매가 첨가된 연료에서 더 빠르게 나타났는데, 이는 촉매의 칼륨성분이 전해질과 반응하여 이성질 화합물을 형성하기 때문으로 생각된다. 얇은 두께의 전해질(30 μm) 도입에 의해 전력밀도가 향상되었다.
석탄을 사용하는 화력발전은 세계 전기 생산의 약 40%를 차지한다[1]. 저렴하고 풍부한 에너지원인 석탄은 중국, 인도와 같은 신흥경제국가들의 경제성장과 더불어 그 소비가 더욱 증가할 것으로 예상된다[2]. 하지만 석탄 연소는 온실가스, 황산화물, 질산화물 등의 오염물질을 배출하므로, 이를 방지하기 위한 석탄 청정이용 기술은 중요하며 현재 다양한 연구가 진행되고 있다.
많은 석탄 청정이용 기술 중, 탄소화학에너지의 전기에너지로의 전환 기술인 직접탄소연료전지(direct carbon fuel cell, DCFC)가 최근 많은 관심을 받고 있다. DCFC는 고체 연료를 사용함으로 연료의 저장 및 수송이 편리하고 안전하며, 또 탄소를 포함하는 다양한 연료(석탄, 바이오매스, 폐기물)를 이용할 수 있다[3]. DCFC는 고체 탄소가 직접 반응에 참가하므로 일반적으로 기체 연료보다 전력밀도가 낮아진다. 이에 최근 많은 연구자들이 연료전지에 고체 탄소 가스화에 의한 생성 가스를 DCFC 연료로 활용하는 방안을 연구하고 있다[4-6]. 현재 이산화탄소에 의한 석탄 가스화 반응을 DCFC에 적용한 연구가 활발히 진행되고 있다[4,5]. 하지만 증기 가스화 반응을 적용한 경우는 드물다. 비슷한 예로 Dicks et al.[6]는 메탄의 수증기개질(steam reforming)을 통해 생산된 수소에 의해 고체산화물 연료전지 성능이 개선됨을 확인하였다.
석탄 가스화는 석탄을 고온, 고압 조건에서 수소와 일산화탄소로 변환하는 기술이다. 석탄은 증기와 만나면 석탄증기반응(식 (1))으로 일산화탄소와 수소가 생성된다. 생성된 일산화탄소는 수증기와 수성가스전이반응(식 (2))을 일으켜 수소와 이산화탄소 등을 생성한다[7].
석탄 가스화로 생성된 수소와 일산화탄소는 다양한 합성연료와 화학물질 합성의 중간체로 이용되며, 또한 가스터빈을 통한 전력 생산에 이용된다[7]. 하지만 석탄 가스화 반응을 DCFC에 적용 시 석탄 내 회분들이 연료극에 쌓여 탄소성분의 이동을 막아 효율을 감소시킬 수 있다[8]. 또 회분성분은 전해질과 반응하여 전도도를 감소시킬 수 있다. 석탄의 회분을 제거하기 위한 실험으로 Li et al.[9]는 석탄을 산 처리하여 회분을 제거한 후 이에 따른 용융탄산염연료전지의 특성을 살펴보았다. 이외에도 무회분탄 제조를 위한 다양한 시도가 있었으며 그 중에서 유기용매 추출법에 의한 회분 제거가 가장 성공적이었다. 본 연구에서도 유기용매 추출법을 사용하여 무회분탄을 제조하고 이를 DCFC 연료로 평가하였다[10].
석탄 가스화 반응은 촉매의 도입에 의해 활성화될 수 있다[11]. 하지만 석탄 내 회분은 촉매와 반응하여 촉매 활성이 저

Proximate/ultimate analysis and calorific value of Samhwa raw coal and its ash-free coal (*: as received, wt%, **: dry & ash-free, %)
하될 수 있으므로 본 실험에서는 무회분탄을 연료로써 촉매와 혼합하여 촉매 가스화 반응이 DCFC 성능에 미치는 영향을 평가하였다[12,13]. 탄산칼륨은 가장 효과적인 석탄 가스화 촉매로 알려져 있다[14]. Wang et al.[14]과 Sharma et al.[15]는 무회분탄을 탄산칼륨과 혼합하여 촉매가 증기 가스화 반응속도에 미치는 영향을 연구하였고, 이때 무회분탄의 증기 가스화 반응은 탄산칼륨 도입에 의해 크게 증가함을 보고하였다. 본 실험에서는 탄산칼륨을 무회분탄 증기 가스화 촉매로 사용하여 DCFC 연료극에서의 전기화학적 거동에 미치는 영향을 평가하였다. 정량적 평가를 위해 열분해 및 증기 가스화 반응에 따른 가스 조성을 분석하고 이를 DCFC 전력밀도와 연관하여 토의하였다. 또한 이트리아 안정화 지르코니아(yttria-stabilized zirconia, YSZ) 두께에 따른 전력밀도 값을 비교하였다.
무회분탄 제조에는 인도네시아 갈탄인 삼화탄을 대상으로 비극성 용매인 1-methyl naphthalene (1-MN)을 사용하였다. 석탄(입자크기 < 74 μm) 20 g과 용매 200 g을 회분식 고온고압반응기에서 혼합한 후, 350 ℃에서 1시간 동안 석탄의 용매 가용성분을 추출하였다. 추출용액을 금속소결필터를 사용하여 고체 불가용 성분과 분리하고, 이를 진공오븐에 넣고 300℃에서 12시간 동안 건조하여 무회분탄을 얻었다[16]. 무회분탄의 공업분석, 원소분석 결과를 Table 1에 나타내었다.
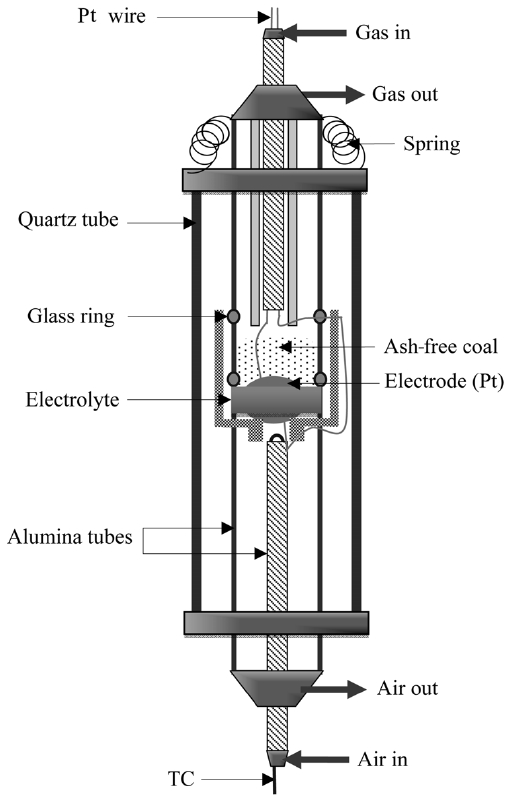
DCFC 성능 측정 장치를 Figure 1에 나타냈다. 전해질은 8 mol%의 이트리아(Y2O3)가 첨가된 YSZ (TOSOH Zirconia, TZ-8Y, TOSOH corp.)를 압착 성형 후 1,350 ℃에서 4시간 소결하여 만들었다. YSZ 디스크 직경은 20 mm이고 두께는 0.9 mm와 30 μm를 사용하였다. 연료극과 공기극은 백금 페이스트(Heraeus 6926)를 사용하여 950 ℃에서 소결하여 준비하였다. 전류 집전을 위해 백금선과 백금망을 사용하였으며, 유리 고리를 YSZ와 알루미나튜브 사이에 넣어준 후 유리 고리의 연화점(glass softening temperature) 821 ℃ 이상으로 승온하여 단위전지를 가스 기밀하였다. 일반적으로 연료극은 300 sccm 질소, 공기극은 200~500 sccm 공기를 흘려주었다. 3 vol% 수증기 공급을 위해 수중 기포 발생기(water bubbler)를 사용하였다. 측정온도는 800~950 ℃이며, 운전하지 않을 경우 단위전지는 800 ℃에서 100 sccm 질소를 흘려주며 유지하였다. 정전류법(galvanostatic techniques)으로 전력밀도를 측정하였다. 이때 특정 전류에서 10초 동안 관찰된 전압의 평균값을 이용하였다.
DCFC 연료로 도입된 무회분탄의 증기 가스화 기체 생성물을 가스크로마토그래피(gas chromatography, GC, Agilient 6890)를 통해 분석하였다. 석영 고정층 반응기(직경: 13 mm, 길이: 460 mm) 중간에 약 3 mm 두께의 유리 기포(frit)를 설치하여 그 위에 석탄 시료를 놓은 후 30 vol% 증기를 100 sccm 질소와 함께 흘려주며 700 ℃에서 반응 생성물을 분석하였다. 반응 시 생성된 물과 타르는 반응기 하단의 트랩 및 필터를 이용하여 제거하였다. 열전도도 검출기(thermal conductivity detector, TCD)를 사용하여 12분의 간격으로 생성가스를 분석하였다. 무회분탄의 촉매 가스화 실험을 위해서 10 wt% 탄산칼륨과
무회분탄을 막자 사발로 고체 혼합 후 평가하였다. DCFC 반응 후 전극 표면을 주사전자현미경-에너지 분산형 X선 분광법(scanning electron microscopy-energy dispersive X-ray spectroscopy, SEM-EDX, Hitach S-4800)을 통하여 관찰하였다.
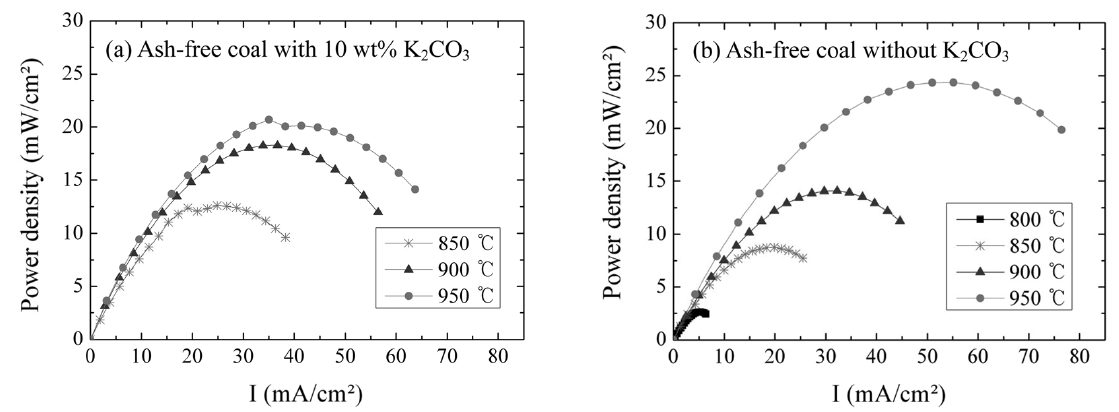
무회분탄을 DCFC 연료로 사용하여 질소 분위기와 온도 800~950 ℃에서 전력밀도를 측정하였다. Figure 2(a)는 10 wt% 탄산칼륨을 무회분탄에 첨가하여 연료로 사용한 결과 최대전력밀도(Pmax)는 ~12 mW/cm2 (850 ℃), ~18 mW/cm2 (900 ℃), ~20 mW/cm2 (950 ℃)였다. 온도 증가에 따라 최대전력밀도값도 증가했다. 촉매 없이 무회분탄만을 연료로 사용한 경우의 Pmax는 ~9 mW/cm2 (850 ℃), ~14 mW/cm2 (900 ℃) ~25 mW/cm2 (950 ℃)로 촉매가 첨가된 경우와 유사한 온도 의존성을 보였다(Figure 2(b)). 온도 850 ℃와 950 ℃ 사이에서 전력밀도의 차이는 촉매 도입의 경우 ~8 mW/cm2였고 무회분탄만을 연료로 사용한 경우의 그 차이는 ~16 mW/cm2였다. 즉 온도의존성은 촉매 첨가에 의해 줄어들었다. 이러한 차이는 상대적 저온 열분해 시 탄산칼륨에 의해 연료가스(수소, 일산화탄소)의 발생 촉진에서 기인하는 듯하다.
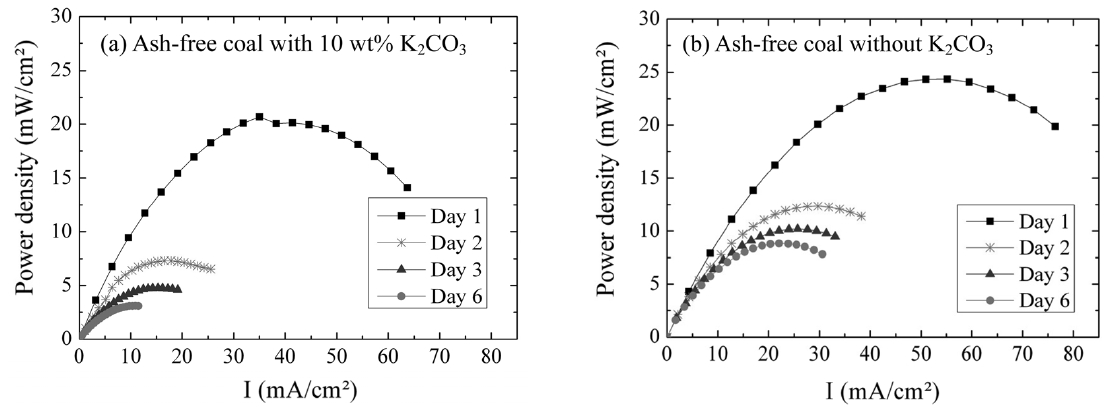
Figure 3은 열분해 분위기에서 무회분탄을 연료로 사용한 DCFC의 장시간 거동을 950 ℃에서 살펴본 결과이다. Figure 3(a)는 10 wt% 탄산칼륨을 무회분탄과 혼합한 경우로 첫 번째 측정일(Day 1)에서 Pmax는 ~20 mW/cm2, 두 번째 측정일(Day 2)에서 ~7 mW/cm2, 세 번째 측정일(Day 3)과 여섯 번째 측정일(Day 6)에서 각각 ~5 mW/cm2, ~3 mW/cm2로 시간 경과에 따라 감소하였다. 첫 번째 측정일과 두 번째 측정일의 Pmax 차이는 ~13 mW/cm2로 하루 사이에 급격히 감소하였고, 이후 감소 폭은 줄어들어 여섯 번째 측정일의 Pmax 값에서 수렴하는 경향을 보였다. 여섯 번째 측정일의 Pmax 값은 첫 번째 측정일에 얻어진 값의 ~15% 수준으로 줄었다. 무회분탄만을 연료로 사용한 경우(Figure 3(b)), 일반적인 경향은 촉매가 첨가된 무회분탄 연료와 유사했다. 즉 첫 번째 측정일에서 Pmax
는 ~25 mW/cm2를 보이다 점차 감소하여 두 번째 측정일에는 ~13 mW/cm2, 세 번째 측정일과 여섯 번째 측정일은 각각 ~10 mW/cm2, ~8 mW/cm2의 Pmax를 나타냈다. 또한 시간 경과에 따라 수렴하는 모습을 보이고 여섯 번째 측정일의 Pmax는 첫 번째 측정일의 ~30%로 정도로 감소하였다. 장시간 운전 시 시간에 따른 Pmax 감소 정도는 열분해 반응 조건에서 촉매가 포함된 경우가 무회분탄만이 사용된 경우보다 컸다. 이는 촉매인 무회분탄과 연료극과의 직접적인 접촉이 시간의 경과에 따라 원치 않는 반응을 야기하였고, 결국 전체 전지저항이 증가하였기 때문으로 추측된다.
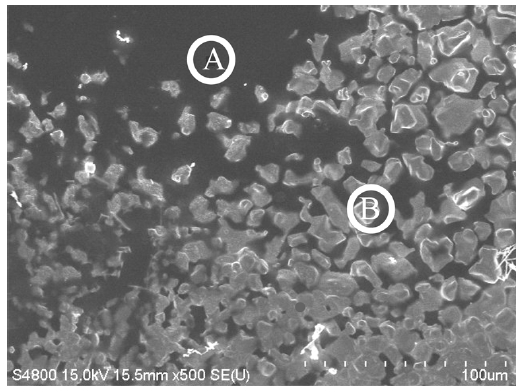
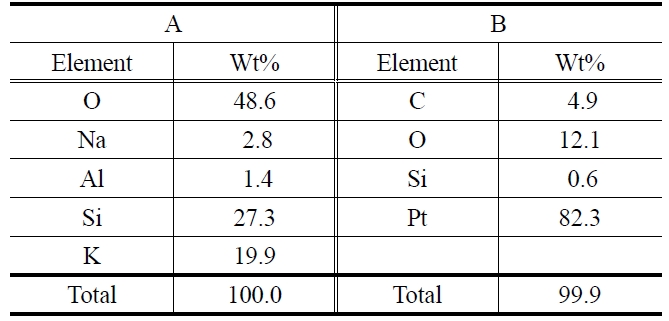
촉매 도입은 상대적으로 빠른 Pmax 감소를 보였는데 보다 자세한 원인을 확인하기 위해 13일 동안 전기화학 반응 후의 전해질 표면을 주사전자현미경을 이용하여 관찰하였다. Figure 4는 YSZ 표면의 주사전자현미경 사진이며 이는 에너지 분산형 X선 분광법을 통하여 전극 표면 성분을 분석하였다(Table 2). Figure 4의 B 위치에서는 ~0.6%의 규소(Si)를 제외하면 예상되는 82.3%의 백금(Pt), 4.9%의 탄소(C), 12.1%의 산소(O) 등이 주로 검출되었다. 전극 표면에서 탄소 검출은 DCFC 비활성화 원인으로 알려진 탄소 침착물이 전극 표면을 덮어 전기화학반응이 방해되었을 가능성을 보여준다[17,18]. 반면 A 위치에서 가장 많이 검출된 성분은 산소(48.6%)와 규소(27.3%)이
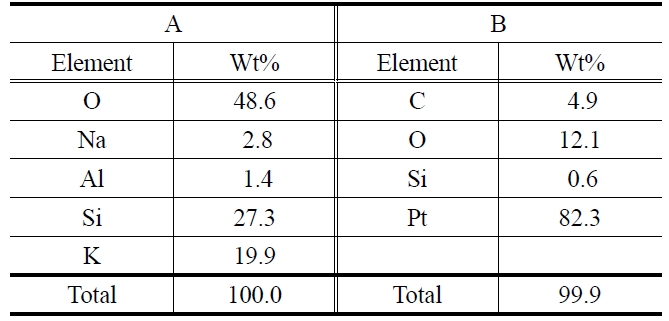
EDX analysis of YSZ surface after 13 days operation of DCFC fueled by ash-free coal with 10 wt% K2CO3
다. 이는 가스기밀을 위해 전해질과 접촉했던 유리 고리의 성분에 기인한다. 또한 탄산칼륨의 오염에 의해 칼륨(19.9%)도 검출되었다. 이미 알려진 바와 같이 규소와 칼륨 모두 전해질인 YSZ와 반응하여 이성질 화합물을 형성함으로 저항을 증가시킬 수 있고, 시간 경과에 따른 전력밀도 감소 원인 중 하나가 된다. 추후 실험에서는 이에 대한 방지책을 마련할 것이다.
3.2. 무회분탄의 촉매 증기 가스화가 DCFC 성능에 미치는 영향
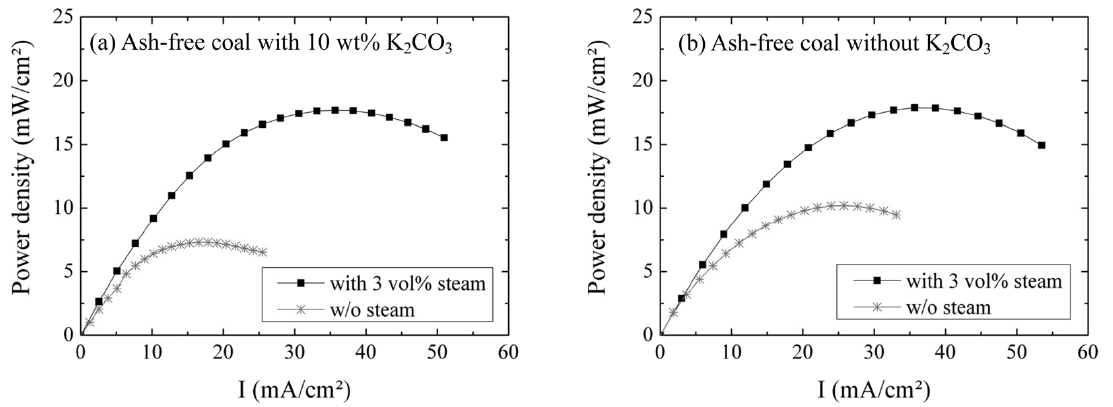
무회분탄의 증기 가스화 반응성은 가스화 촉매인 탄산칼륨의 혼합 여부에 따라 달라질 수 있다. 본 절에서는 촉매 여부가 DCFC 성능에 미치는 영향을 살펴보았다. Figure 5는 950 ℃에서 DCFC의 증기 가스화 반응을 나타낸 것인데 질소를 운반기체로 이용하여 3 vol%의 증기를 공급하였다.
Figure 5(a)는 10 wt% 탄산칼륨이 혼합된 무회분탄을 연료로 사용한 DCFC로 증기 가스화 조건에서 Pmax는 ~18 mW/cm2이고 열분해 조건에서 Pmax는 ~7 mW/cm2였다. 증기 3 vol%를 도입한 결과 Pmax는 140% 이상 증가하였다. 무회분탄만이 연료로 사용된 경우도 수증기 공급에 의해 Pmax의 상승이 있었으나 그 폭은 촉매가 도입된 경우보다 작았다. 즉, 열분해 분위기에서 Pmax는 ~10 mW/cm2를 보인 후, 수증기 첨가에 의해 ~18 mW/cm2로 ~80% 증가하였다. 촉매 반응의 전력밀도 증가는 촉매의 증기 가스화 반응 활성 작용에 의해 더 많은 양의 연료가스(수소, 일산화탄소)가 생성되었기 때문으로 짐작
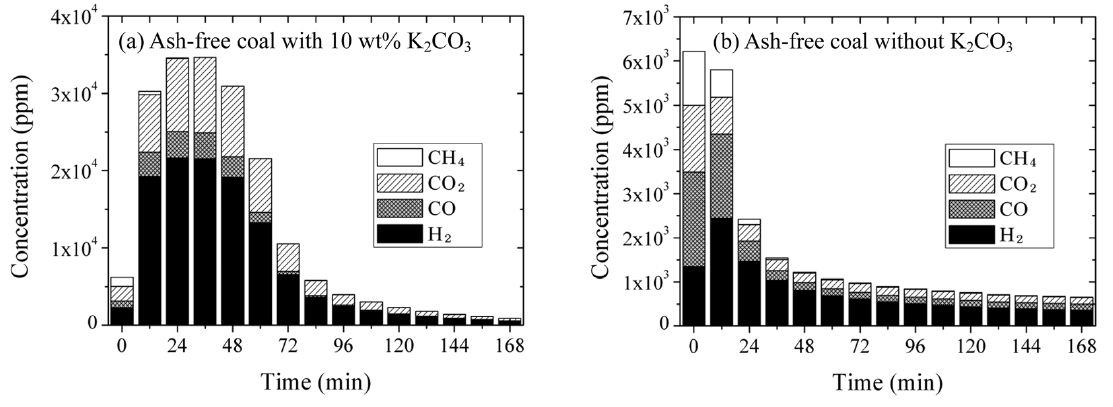
된다. 앞서 열분해 조건(Figure 2(a), Figure 3(a))에서는 촉매가 전력밀도 향상에 긍정적 영향을 주지 못한 반면 증기 가스화 반응에서는 촉매에 의한 DCFC 성능 향상을 확인할 수 있었다. Figure 6은 700 ℃에서 증기 가스화 반응 생성물을 가스크로마토그래피로 정량 분석한 결과이다. Figure 6(a)에서 보이듯이 탄산칼륨 첨가 시 반응 시작 24분 후에 가스 생산량은 최대가 되었으며 이때 ~22,000 ppm 수소와 ~3,400 ppm 일산화탄소가 생산되었다. 또한 빠른 반응 속도를 보여주며 반응 시작 100분 이내에 대부분의 무회분탄이 가스화되었다. 반면 촉매 없이 무회분탄만이 존재하는 경우의 증기 가스화 반응성은 크게 떨어졌다. Figure 6(b)에서 보이듯이 반응 후 12분에 수소와 일산화탄소 생성양이 최대가 되나, 수소는 ~2,400ppm만이 생성되어 촉매 반응으로 생성된 수소보다 ~90% 적었다. 반응 속도도 느려서 반응 시작 168분 후에도 500 ppm의 수소 및 일산화탄소 생성이 관찰되었다. 수증기는 무회분탄과의 석탄증기반응(식 (1))으로 생성된 일산화탄소와 수성가스변위반응(식 (2))에 의하여 연료로써 유용한 수소를 생성한다[5,11]. 가스화 생성물 분석은 DCFC 측정 조건과 다르게 700 ℃에서 진행되었다. 본문에 900 ℃에서 진행한 가스 생성물 분석 결과를 나타내지는 않았지만 탄산칼륨이 포함된 무회분탄의 700 ℃에서의 반응성은 촉매 없이 900 ℃에서 반응
한 무회분탄보다 높았다. 700 ℃에서 관찰된 촉매에 의한 반응성의 증대 효과(Figure 6)는 900 ℃에서 촉매를 첨가한 경우에도 유사할 것이다. 결국 Figure 5에 나타난 수증기에 의한 DCFC 전력밀도 상승 원인은 반응 생성물인 연료가스(수소, 일산화탄소)들이 전기화학적 반응에 참여하였기 때문임을 확인할 수 있었다[19]. 본 논문에 나타내지 않았지만 무회분탄에 촉매의 혼합 여부와 상관없이 DCFC전력밀도는 이산화탄소의 공급에 의해서도 상승함을 관찰할 수 있었다[4].
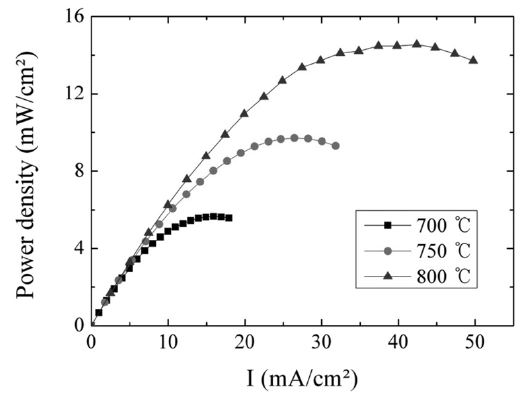
Figure 7은 무회분탄만을 연료로 사용하고 YSZ 30 μm를 사용하여 전해질 저항을 감소시킨 음극 지지체(NiO-YSZ) DCFC의 온도에 따른 전력밀도를 측정한 결과이다. 얇은 전해질을 사용하였을 때 Pmax는 700 ℃에서 ~6 mW/cm2, 750 ℃에서 ~10 mW/cm2, 800 ℃에서 ~15 mW/cm2였다. Figure 2(b)는 0.9 mm YSZ에서 측정한 무촉매 반응의 전력밀도인데 800 ℃에서 Pmax는 ~2 mW/cm2이다. 30 μm 두께의 YSZ 사용은 0.9 mm YSZ보다 전해질 저항을 줄일 수 있었고 0.9 mm YSZ보다 7배 이상 높은 출력을 얻을 수 있었다. 연료극 지지형인 NiOYSZ는 환원 처리 없이 적용하여 전체 단위전지의 열린 회로전압이 약 0.7 V를 나타냈다. 이 값은 전해질 지지형인 0.9 mm
YSZ에서 얻은 약 1 V에 비해 적은 값이다. 이것은 DCFC 실험에 사용된 연료극이 산화물 형태이기 때문이며, 환원 분위기에서 니켈로 전환하여 실험한다면 더 높은 출력을 기대할 수 있을 것이다[5].
DCFC에 무회분탄 촉매 가스화를 연료원으로 사용하고 그 전기화학적 특성을 평가하였다. 열분해 분위기에서 무회분탄과 함께 도입된 탄산칼륨 촉매는 DCFC 성능 향상에 영향을 미치지 못했다. 하지만 촉매에 의한 증기 가스화 반응의 최대출력은 열분해 반응 대비 140% 이상 증가하였다. 이것은 촉매도입이 연료가스(수소, 일산화탄소) 생성양을 증가시켰기 때문이며, 이는 가스분석을 통해 확인하였다. 하지만 장시간 반응 시 탄산칼륨은 전해질 표면에 이성질 화합물을 형성하여 전해질 저항을 증가시켰다. 또한 고체 연료를 사용하는 DCFC에서도 전해질 저항 감소를 통한 전력밀도 향상이 가능함을 확인하였다.