본 연구에서는 보다 효율적인 광 전기화학적 수소제조를 위하여 광촉매로써 산화텅스텐에 티타늄을 함침하여 Ti/WO3 나노입자를 제조하였다. 제조한 Ti/WO3의 물리적 특성은 X-선 회절분석법(XRD), 주사전자현미경(SEM), 발광분광계(PL), 원자간력 현미경(AFM), 정전기 현미경(EFM)을 통해 확인하였다. 메탄올/물 (1/1) 광분해 수소제조 실험 결과, 순수 아나타제 티타니아나 산화텅스텐 광촉매보다 Ti/WO3 광촉매에서 촉매활성이 향상되었으며, 0.5 g의 0.10 mol % Ti/WO3 촉매를 사용한 경우 8시간 반응 시 3.02 mL의 수소가 발생되었다.
과학기술의 발전과 더불어 전 세계적으로 화석연료의 소비량이 급증하고 있다. 한정된 매장의 화석연료는 점점 고갈되어가고 있으며, 화석연료의 연소로 인해 발생하는 이산화탄소량의 증가로 지구온난화가 가속화되고 있는 실정이다. 이에 발맞추어 화석연료를 대체할 친환경적이면서 무한한 청정에너지 개발에 대한 연구가 세계적으로 주목받고 있다. 화석연료의 대체 에너지로는 태양열, 지열, 풍력, 조력 등 자연에너지와 물을 원료로 하는 수소에너지 등이 연구, 개발되고 있다[1]. 그 중, 수소에너지는 청정에너지로써의 역할 뿐만 아니라 에너지 저장매체로써의 기능 또한 담당할 수 있어 주목 받고 있다[2].
수소는 물, 저급 알코올, 또는 탄화수소와 같은 유기물질로부터 제조가 가능하므로, 그 양이 거의 무한정에 가까운 연료이다[3]. 또한 수소를 연료로 사용할 경우에 연소 시 공해물질이 생성되지 않는다는 장점을 갖고 있다. 수소를 제조하는 방법 중 물을 전기분해하는 방법이 친환경적이면서 가장 효율적이나 아직까지 기술적인 면에 있어 상용화되기까지는 시간이 걸릴 전망이다. 현재 가장 경제적인 수소제조 방법은 탄화수소와 같은 화석자원의 개질[4]에 의한 생산이 대표적이다. 하지만 이 방법은 화석자원의 고갈과 이산화탄소의 배출 등의 문제를 피할 수 없다. 수소를 제조하는 가장 친환경적인 방법은 앞서 언급한 바와 같이 물을 분해하여 수소를 생산하는 것으로 수소를 대규모로 제조할 수 있다면 진정한 청정에너지원이 될 수 있을 것이다.
본 연구에서는 광촉매를 사용하여 물을 수소와 산소로 분해하고자 하였다. 광촉매에 흡수된 광 에너지는 원자가 전자대(valence band)에서 정공(hole)을, 전도대(conduction band)에서는 광전자(photoelectron)를 생성시킨다. 생성된 광전자와 정공은 광촉매 표면으로 이동하여 물과 만나 환원과 산화반응을 통하여 수소와 산소를 2 : 1로 발생시킨다. 이 반응은 높은 자유에너지를 수반하므로 태양광에너지를 통해 효율적으로 물을 분해할 수 있는 광촉매가 필요하다. 광촉매로는 산화아연, 황화카드뮴, 황화아연, 티타니아 등의 반도체들이 이용되고 있는데 이 중 티타니아가 대표적이다[5-8].
티타니아(TiO2)는 수용액에서 화학 및 광화학적 부식에 뛰어난 내구성을 가지며 친수성과 광활성이 높기 때문에 수소 생산에 매우 좋은 광촉매로 간주되고 있다. 그러나 순수한 티타니아는 광 에너지에 의해 생성된 전자·정공 쌍이 빠르게 재결합되고, 역반응이 쉽게 일어나며 다소 긴 띠 간격으 로 인해 가시광선에 의한 활성도가 낮다. 따라서 전자·정공 쌍의 재결합과 역반응의 방지를 위해 최근 들어 금속담지, 금속이온의 골격치환[9,10], 복합 반도체[11] 등이 이용되고 있다.
본 연구에서는 물 분해용 광촉매 수소제조 시스템을 이용하여 수소를 제조함에 있어 가장 중점적으로 연구되어야 할 광촉매 소재로써 Ti/WO3 나노 광촉매를 합성하여 최외각 띠에서 전도대로의 전자 이동속도를 향상시켜 광촉매 성능을 장시간 유지시키고자 하였다. 촉매합성은 함침법에 의해 환원분위기에서 티타늄 출발물질을 산화텅스텐에 담지하여 Ti/WO3 나노 광촉매를 제조하였고, 물 및 저급 알코올 광분해에 대한 수소제조 성능을 평가하였다. 제조한 Ti/WO3의 물리적 특성은 X-선 회절분석기(X-ray diffraction, XRD) 주사전자현미경(scanning electron microscopy, SEM), 발광 분광계(photoluminescence, PL)로, 광화학적 특성은 원자간력 현미경(atomic force microscopy, AFM), 정전기현미경(electrostatic force microscopy, EFM)을 통하여 분석하였고, 광분해 반응을 통해 얻은 수소와 산소의 양은 기체크로마토그래피를 이용하여 측정하였다.
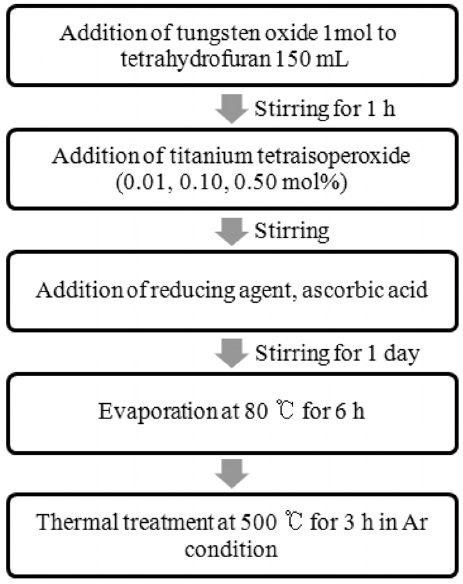
2.1. 솔-젤법과 함침법에 의한 Ti/WO3 광촉매 합성
우선 담체로 사용된 산화텅스텐을 제조하기 위해 솔-젤법[12]을 이용하였다. 100 mL 에탄올 용매에 0.1 mol의 WCl6
(99.9%, Junsei)를 첨가한 후 암모니아수를 첨가하여 pH 10을 맞추었다. 10시간 교반 후 원심분리기를 이용하여 침전물을 취한 후 50 ℃에서 24시간 건조시켰다. 건조된 샘플을 500 ℃에서 3시간 소성시켜 산화텅스텐을 얻었다. 비교대상인 티타니아(titanium tetraisopropoxide 출발물질)도 동일한 방법으로 합성하여 얻었다. 환원분위기에서 티타늄을 산화텅스텐에 담지시키기 위해 Figure 1과 같이 테트라하이드로푸란(tetrahydrofuran, THF) 150 mL에 1.0 mol의 WO3를 첨가한 후 1시간 동안 교반하였다. 그 후 티타늄 출발물질인 티타늄 이소프로프 산화물(titanium tetraisopropoxide, Junsei)을 각각 0.01, 0.10, 0.50 mol%로 첨가한 후 환원제로 아스코르브산를 첨가하였다. 혼합용액이 균일하게 섞이도록 하루 동안 더 교반하였다.
최종 균일 콜로이드 혼합물은 증발기를 이용하여 80 ℃에서 6시간 동안 용매를 증발시켰다. 건조된 샘플을 전기로에 넣어 아르곤 분위기에서 500 ℃까지 3 ℃/min으로 승온시킨 후 약 3시간 동안 유지하여 소성시켜 Ti/WO3 나노 입자를 얻었다.
제조된 Ti/WO3 나노입자의 결정구조 분석을 위해 X-선 절분석기(X-ray diffraction, XRD, D/MAX-2500, Rigaku)를 이용하였다. 입자의 크기와 형상은 주사전자현미경(scanning electron microscopy, SEM, S-4100, Hitachi)으로 관찰하였고, 입자표면에서의 전기적 특성을 원자간력 현미경(atomic force microscopy, AFM, XE-100, PSIA), 정전기현미경(electrostatic force microscopy, EFM)으로 살펴보고, 발광 분광계(photoluminescence, PL, Uni-TOP-3000, Uni-Think)를 이용하여 광화학적 특성을 측정하였다.
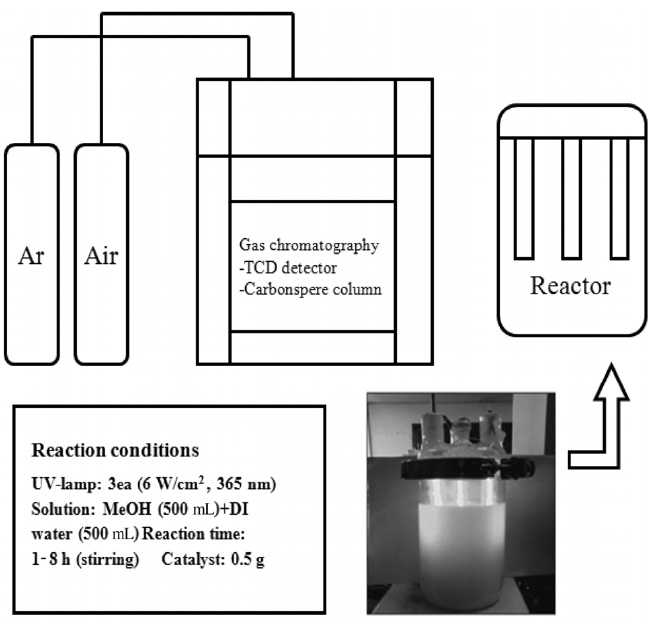
Figure 2와 같이 연구실에서 직접 제작한 액상 광 반응기를
이용하여 증류수와 메탄올 혼합 용액을 분해하여 수소제조 성능평가를 하였다. 메탄올 500 mL와 증류수 500 mL의 혼합용액 1.0 L를 파이렉스(pyrex) 반응기에 넣고, 합성된 광촉매 0.5 g을 첨가하였다. 365 nm 파장의 UV-램프(6 × 3 W/cm2 = 18 W/cm2, 길이 30 cm, 지름 2.0 cm; Shinan) 광을 조사하였고, 1시간 단위로 발생하는 기체를 250 mL 실린지를 이용하여 200 mL를 분취해 열전도도 검출기(thermal conductivity detector, TCD) 기체크로마토그래피(gas chromatography, GC, model DS 6200; Donam Instruments Inc.)에 주입하여 측정하였다.
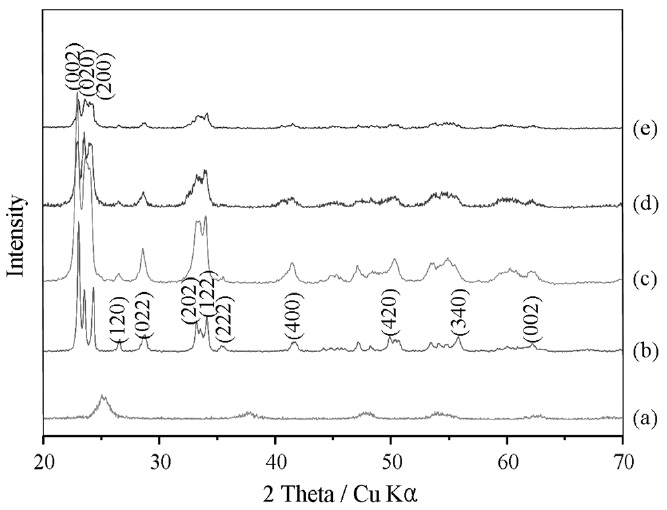
Figure 3은 순수한 TiO2, WO3, Ti/WO3 나노입자의 XRD 패턴을 나타낸 것이다. WO3는 단사정계 결정 구조로, 23.15, 23.61, 24.37, 26.62, 28.96, 33.30, 34.19, 35.69, 41.92, 49.94, 55.95, 56.10, 62.31° 2θ에서 (d002), (d020), (d200), (d120), (d112), (d022), (d202), (d122), (d222), (d400), (d420), (d402), (d340), (d002)의 결정면을 확인하였다. TiO2는 티타니아 아나타제 골격 구조를 보이고 있으며, 특성 피크로써 25.3, 37.93, 48.1, 55.12, 62.52, 69° 2θ에서 (d101), (d004), (d200), (d105), (d211), (d204)의 결정면을 확인하였다[13].
일반적으로 피크의 선폭증대가 커질수록 결정체의 크기는 작아진다. 결정체 크기를 구하기 위해서 Scherrer 공식 t = 0.9 λ/βcosθ을 사용하였다[14]. t는 특정 면에 대한 결정면 크기, λ는 입사되는 X-선의 파장을 나타내며, β는 최대피크 반치폭, 그리고 θ는 회절 각을 나타낸다. 특정 면 (002)에 대해서 그 값을 계산한 결과, WO3, 0.01, 0.10, 0.50 mol% Ti/WO3에서 각각 12.47, 9.32, 8.27, 9.21 nm의 결정면 크기를 나타내는 것을 확인하였다.
Figure 4는 Ti/WO3의 SEM 이미지를 나타낸 것이다. WO3 는 대체적으로 50 nm 두께의 나노 로드와 시트 형태의 입자 형상을 갖는 것을 알 수 있었으며, Ti이 첨가됨에 따라 로드형태는 감소되고, 시트 형태의 입자가 증가하는 것을 확인하였다. 일반적으로 로드 형태보다 시트 형태일 때 촉매의 표면적이 증가하여 활성을 높이는 것으로 알려져 있다[15,16].
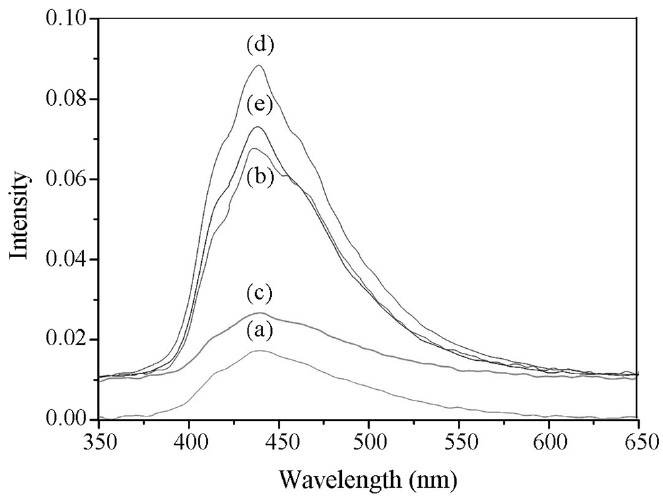
Figure 5는 합성된 나노 광촉매의 형광, 즉 PL 스펙트럼을 보여주고 있다. 반도체 물질에 빛을 쪼여주면 최외각 전자대에서 전도대로 전자가 들뜨게 된다. 이 들뜬 전자가 다시 바닥 상태로 떨어지면서 방출하는 에너지가 PL 정도를 의미한다. 들뜬 전자가 많을수록 바닥상태로 떨어지면서 방출하는 PL
곡선의 강도가 증가한다.
들뜬 전자의 증가는 최외각 전자대의 정공을 증가시키고 이렇게 생성된 들뜬 전자와 정공이 물이나 산소를 만나면서 생성되는 OH 라디칼이 증가하여 결국 촉매의 광 활성을 증가 시키게 된다. 일반적으로, 반도체 물질에서 띠 간격은 물질이 흡수하는 파장의 범위와 밀접한 관련이 있다[17]. Figure 5에 E = hc/λ식을 이용하여 띠 간격을 구하였다. 순수한 TiO2와 WO3는 각각 3.20와 2.85 eV이고 Ti가 첨가됨에 따라 2.83, 2.80 eV로 파장이 단파장으로 이동하다가 티타늄이 0.50 mol 이상 첨가되었을 경우 2.82 eV로 파장이 장파장으로 다시 이동하는 것을 볼 수 있었다. 또한 Ti/WO3는 티타늄의 첨가량이 많아질수록 PL 강도가 높아지며, 0.50 또는 0.10 mol을 첨가하였을 때 순수한 WO3보다 더 높은 세기를 보였다. 이 결과로부터 Ti/WO3가 순수한 TiO2나 WO3보다 더 높은 광활성을 보일 것으로 예상할 수 있다.
Figure 6은 WO3과 Ti/WO3의 AFM과 EFM 이미지를 나타낸 것으로 촉매표면에서의 전하의 이동을 알 수 있다. 밝은 부분이 나노 입자의 표면상의 전하의 흐름을 의미하는데, AFM은 전기를 걸어주지 않았을 때의 광 촉매 표면을 나타낸 것으로 Ti/WO3 입자들 간의 전하 흐름이 WO3 표면에서 보다 더 용이함을 볼 수 있다. EFM을 통해 전류를 걸어주었을 때 Ti/WO3 입자 표면에서의 더 강한 전하 흐름을 확인하였다. 이를 통해 WO3보다 Ti/WO3 표면에서 여기된 전자들의 흐름이 더 자유롭다는 것을 알 수 있었다.
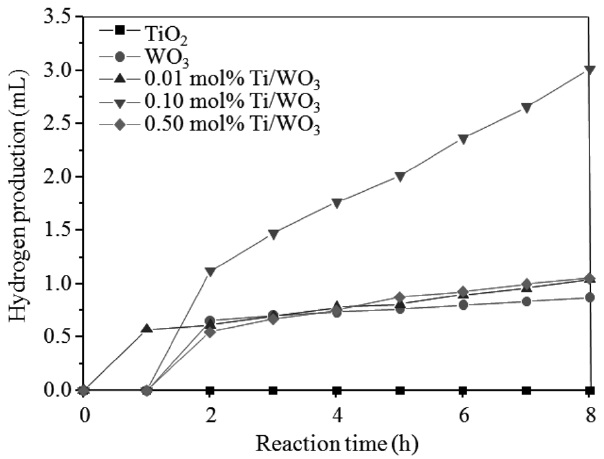
본 실험에서 합성한 Ti/WO3 나노 입자들을 이용하여 메탄올/물 광분해를 통해 제조한 수소발생 누적량을 Figure 7에 제시하였다. Ti/WO3는 순수한 TiO2와 WO3보다 높은 수소발생 누적량을 나타내고 있으며, 특히 0.10 mol%의 Ti가 첨가되었을 때 8시간 반응 시 3.02 mL의 수소가 누적된 것을 확인 할 수 있었다. 일반적으로 순수 TiO2를 사용하여 물이나 메탄올을 분해할 경우 수소가 거의 발생하지 않지만 환원력이 우수한 금속이온(구리(Cu), 은(Ag), 백금(Pt) 등)을 TiO2에 1~10%
무게비로 함침한 경우, 수소의 발생량은 2시간 누적 시 2~40mL로 급격히 증가한다[18,19]. 하지만 시간이 지날수록 첨가된 금속이온은 TiO2로부터 여기된 전자들을 받아들여 금속으로 완전히 환원되어 더 이상 촉매로써의 능력은 발휘할 수 없게 되고 결국 수소의 발생량은 현저히 감소하게 된다. 또한 본 실험과 유사한 Ti/W계 촉매인 GeTi3W9O37 광촉매[20]를 사용한 경우 메탄올 분해에 의한 수소가 32시간 후 누적 시 pH1.0에서 400 μmol로 아주 적은 양이 발생하였다. 하지만 본 연구에서 사용된 Ti/WO3 광촉매의 경우는 8시간 수소 누적량이 3.02 mL로 다른 Ti/W계 촉매와 비교하여 우수한 활성을 나타내고 있다.
솔-젤법과 함침법을 이용하여 합성한 Ti/WO3 나노입자들의 XRD 패턴 분석결과, 0.10 mol% Ti/WO3에서 결정크기가 가장 작았으며, SEM 이미지 분석결과, Ti이 첨가됨에 따라 로드 형태의 입자가 감소되는 것을 확인하였다. EFM 이미지 분석결과, Ti/WO3 표면에서 전하가 더 용이하게 흐르는 것을 볼 수 있었다. 또한 PL 분석결과로 WO3보다 Ti/WO3가 더 작 은 띠 간격을 가지고, 들뜬 전자의 수가 보다 많다는 것을 확인하였다. 이는 광촉매 표면이 더 쉽게 활성화됨을 예상할 수 있으며 정공에 보다 많은 OH 라디칼이 생성되는 것을 의미한다. 광 전기화학적 수소제조를 실시한 결과, 순수 TiO2와 WO3와 비교했을 때 Ti/WO3에서 보다 많은 양의 수소가 생산되었다. 특히 0.10 mol% Ti/WO3 광촉매를 사용한 경우 8시간 후에 3.02 mL의 수소 누적량을 보였다.