본 연구에서는 산성을 갖는 Fe-ZSM5를 담체로 활용하여 Pd, Pt 등 귀금속을 담지한 후, 제조 촉매의 암모니아의 선택적 산화반응 활성을 평가하였다. 이들 중 Pt/Fe-ZSM5가 Pd/Fe-ZSM5 보다 높은 활성을 나타냈다. 또한 Pt/Fe-ZSM5 촉매에서 ZSM5 구조체 내 Fe의 이온교환량을 달리한 촉매의 실험을 수행하여, 암모니아의 선택적 산화반응에 가장 우수한 활성을 보이는 최적 조성비를 탐색하였다. 그 결과, Fe의 이온교환량이 적을수록 반응 활성이 증가하는 경향을 보였고, 저온 영역인 250 ℃에서 100%의 암모니아 전환율을 나타냈다. 이와 같이 암모니아의 선택적 산화반응에 효과적인 Fe-ZSM5 담체에 대하여, ICP-AES, BET, XRD, NH3-TPD 등과 같은 특성 분석을 수행하여 제조 촉매의 구조와 물성이 반응활성에 미치는 영향을 검토해보았다.
최근 디젤엔진에서 배출되는 배기가스인 질소산화물 (NOx)과 입자상 물질은 환경오염에 큰 영향을 미치는 것으로 알려져 있어, EURO-6, Tier 2 등의 디젤엔진 배기가스 규제가 강화되고 있는 실정이다[1]. 디젤 엔진의 기계적 개선을 통해 배기가스의 배출 정도를 낮추고 있으나, 그 효과에 한계가 있어 배기가스 후처리 기술이 추가적으로 적용되고 있는 추세이다. 입자상 물질의 배출문제는 DPF (Diesel Particulate Filter) 장치를 통해 저감 효과가 크게 나타나지만[2], 질소산화물 제거 문제는 가솔린엔진에 적용되고 있는 삼원촉매 만으로는 그 효과를 기대하기 어렵다[3]. 디젤 질소 산화물의 저감 기술로는 다양한 후처리 기술이 있는데, LNT (Lean NOx Trap), LNC (Lean NOx Catalyst), Urea SCR (Selective Catalytic Reduction) 등이 개발되고 있고, 이 중 Ures SCR 시스템은 특히 높은 질소 산화물저감효율로 각광받고 있다[4-6]. Urea SCR 시스템은 urea 수용액의 가수분해를 통해 생성된 NH3를 환원제로 하여 질소 산화물을 제거하는 기술이다. 하지만 Urea SCR 시스템에서 질소산화물의 환원 반응에 참여하고 남은 미반응 NH3가 대기 중으로 배출되는 NH3 slip 현상이 발생하는 문제점이 있다. NH3 slip의 저감을 위한 방법으로는 촉매에 의한 선택적 산화 반응 (Selective Catalytic Oxidation, 이하 SCO)이 대표적이다.
한편, 대기 중 오염뿐만 아니라 하?폐수 내 고농도 암모니아성 질소로 인한 부영양화 등의 오염이 심화되고 있어, 이를 제거하기 위한 다양한 물리?화학적 방법들이 개발되고 있다. 이들 중 수중에 공기를 불어넣어 암모니아성 질소를 가스상 NH3 로 배출하는 암모니아 탈기법(Ammonia stripping)이 매우 효과적인 것으로 알려져 있는데[7], 대기중으로 배출되는 NH3 가스의 후처리 방안(Off gas treatment)에 대한 논의가 이루어지고 있다. 이 또한 NH3-SCO 시스템으로 해결할 수 있을 것으로 기대되므로, 높은 효율의 기상 암모니아 처리 방법의 개발은 매우 중요한 것으로 판단된다. NH3-SCO 시스템은 NH3 를 산소 존재 하에서 촉매 반응을 통해 선택적으로 물과 질소로 산화하는 반응을 토대로 한다.
하지만 NH3 산화 반응은 적용 촉매에 따라 다음과 같은 여러 부반응들을 통해 질소 산화물의 농도가 오히려 증가하는 역효과가 문제될 수 있다.
따라서 위와 같은 부반응을 방지하고 N2로의 반응을 선택적으로 강화하기 위해 국내외에서 다양한 촉매 개발이 진행되고 있다. 초기에는 Co3O4, MnO2, FeOx, V2O5, MoO3 등의 금속 산화물[8,9]이나 다결정성 구조를 가지는 금속[10]을 대상으로 NH3-SCO에 대한 연구가 진행되었으나, 최근에는 Pd, Pt 등 귀금속을 활용하여 적용촉매의 저온 산화능 개선에 초점을 맞추고 있는 추세이다. 또한 담체에 대한 연구가 본격적으로 이루어지면서 담체의 표면 산세기, 비표면적, 결정 구조와 NH3-SCO 활성과의 상관관계에 관한 연구들이 주로 진행되고 있다. 그 예로 비표면적을 극대화시킨 SiO2[11] 등이 담체로 활용되고 있으며 Al2O3[12-14], ZrO2[15], 제올라이트[16-18] 등의 산성 담체가 주로 응용되고 있다. 특히 제올라이트는 ZSM5, Mordenites, Beta, Ferrierite, Clinoptilolite, Chabazite, Fausasite 등 다양한 담체가 활용되고 있으며, Fe, Cu, Co, Ni, Mn 등 다양한 전이금속들을 이온교환하여 적용된 사례가 보고된 바 있다[16]. 제올라이트의 종류에 따른 기공 구조 및 산 특성 외에도 제올라이트와 적용 금속 간의 이온교환량에 따라 NH3-SCO 활성이 영향을 받으며, 다양한 Metal-Zeolite 중 Fe-ZSM5가 우수한 NH3-SCO 활성을 나타낸 것으로 보고되고 있다[16].
본 연구에서는 저온 NH3 산화능이 우수한 귀금속 물질로 Pd, Pt를 산성 담체로써 활용이 가능한 Fe-ZSM5와 조합하여 NH3-SCO 촉매를 제조하였으며, 제조된 촉매의 구조, 물성이 NH3-SCO 활성에 어떠한 영향을 미치는지 알아보고자 하였다.
Fe-ZSM5는 액상 이온 교환법으로 제조하였다. 일정한 양의 FeCl2·4H2O (99%, Aldrich)를 증류수에 녹여 FeCl2 수용액을 제조하고, ZSM5 (Si/Al = 25, CBV5524G, Zeolyst)를 첨가하여 24시간 상온에서 교반하여 이온교환 시킨다. 교반이 끝난 후, Chloride 이온이 제거될 때까지 증류수를 이용하여 촉매를 세척하였다. 여과된 샘플을 12시간 동안 120 ℃에서 건조시킨 후, 공기 분위기에서 6시간 동안 500 ℃에서 소성시킨 후 제조를 완료하였다.
Pd(NO3)2 (Aldrich, 99%) 용액을 이용하여 목표하는 담지량의 전구체 용액을 제조하였다. 이 용액을 이용하여 앞서 제조한 Fe-ZSM5와 함침법(Incipient wetness method)을 통해 Pd를 담지시켰다. 또한 Pt/Fe-ZSM5 촉매는 Pt(NH3)4(NO3)2 (Aldrich, 99.995%)를 목표하는 담지량에 맞게 전구체 용액을 만든 후, Fe-ZSM5에 함침하여 제조하였다. 제조된 촉매는 120 ℃에서 12시간 건조시키고 공기 분위기에서 500 ℃ 소성을 6시간 동안 수행한 후 최종적으로 촉매 제조를 완료하였다.
촉매의 비표면적과 기공부피를 측정하기 위해 Micromeritics사의 ASAP 2010을 이용하여 질소 흡착 BET 분석을 수행하였다. 분석에 앞서 촉매 기공내의 수분을 제거하기 위해 각 샘플을 3 mmHg 하에서 6시간 동안 300 ℃로 가열하여 전처리하였다. 촉매 내 금속의 정량 분석을 위해 ICP-AES 분석을 수행하였다. 분석기는 Jobin Yvon사의 138 Ultrace를 이용하였다.
촉매의 결정 구조를 확인하기 위해 XRD 분석을 수행하였다. Rigaku사 Rotaflex model을 이용하였고, X선은 40 kV, 150 mA의 조건으로 사용하였다. 스캔 범위는 3~60°, 스캔 간격은 0.01°, 스캔 속도는 4°/min으로 설정하였다. XRD 분석시 내부 표준물질로 니켈 파우더(Sigma-Aldrich)를 일정 비율(10 wt%)로 샘플에 혼합한 뒤 분석하였다.
Fe 이온교환량에 따른 Fe-ZSM5 산세기의 측정은 BELCATM- 77 (BEL JAPAN Inc.)을 이용하여 NH3-TPD 실험을 통해 분석하였다. 샘플의 양은 0.1 g이었으며, 500 ℃에서 He을 35 mL/min으로 흘려주면서 1시간 동안 전처리한 후 상온으로 냉각시켰다. 촉매에 3% NH3/He 혼합기체를 50 mL/min으로 흘려주면서 100 ℃에서 1시간 동안 NH3를 흡착시킨 후 50 mL/min의 He 흐름 하에서 600 ℃까지 5 ℃/min의 속도로 승온하면서 탈착되는 NH3의 농도를 연속측정 하였다.
또한 NH3-SCO 활성이 매우 우수한 Pt/Fe-ZSM5 내의 Fe, Pt의 형상을 확인하기 위하여 HRTEM (200 kV Schottkey FEG, FEI Tecnai F20)을 이용하였다.
암모니아 산화반응의 촉매 활성을 평가하기 위하여, 상압의 고정층 반응기를 이용하였으며, 반응기는 1/2 inch 원통형 석영관을 사용하였다. 제조된 촉매(60 mg)를 고정층 반응기에 충진시킨 후, K-type 열전대를 촉매층 전단에 위치하여 반응 온도(200~500 ℃)를 제어하였다. 반응물의 총 유량은 500 mL/min으로 설정하였고, 반응물의 농도는 암모니아 2,000 ppm, 산소 6.5%로 구성하였으며 각각의 반응가스는 압력 조정기와 질량 유량계(5850E, Brooks)를 이용하여 일정한 유속으로 반응관에 공급하였다. NH3의 흡착을 방지하기 위하여 모든 관에 heating band를 장착하여 150 ℃로 가열하였다. 반응 후 가스 중 질소는 Molecular Sieve 컬럼이 장착된 가스 크로마토그래프 (M600D, 영린기기)의 열전도도검출기를 통해 측정하였고, 다른 생성물인 NO, NO2, N2O, 미반응 NH3는 퓨리에변환적외선 분광기 (Spectrum GX, Perkin-Elmer)로 분석하였다.
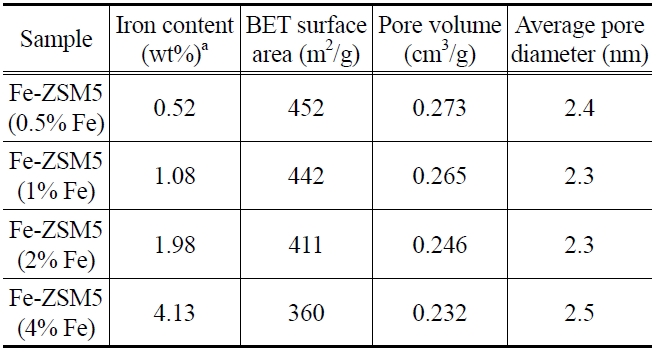
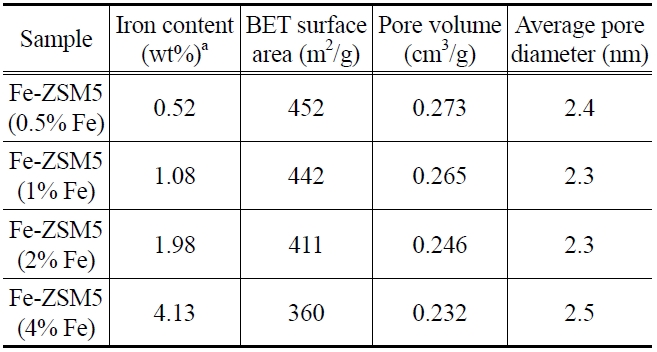
Table 1에 Fe-ZSM5 담체의 Fe 함량과 BET 결과를 나타내었다. ICP-AES 결과에 따르면, Fe는 이온교환량에 따라 목표한 담지량에 ± 0.5% 이내로 근접한 결과를 보였다. Fe 이온교환량이 감소함에 따라 비표면적과 기공부피가 증가하였고, Figure 6(a)의 실험 결과와 비교하면 이온교환량이 작아질수
[Table 1.] ICP-AES and BET results of Fe-ZSM5
ICP-AES and BET results of Fe-ZSM5
록 증가된 비표면적에 백금 담지가 효과적으로 이루어져 우수한 활성을 보였을 것이라 판단되었다. 촉매들의 평균 기공 크기는 2.3~2.5 nm으로 거의 유사했다.
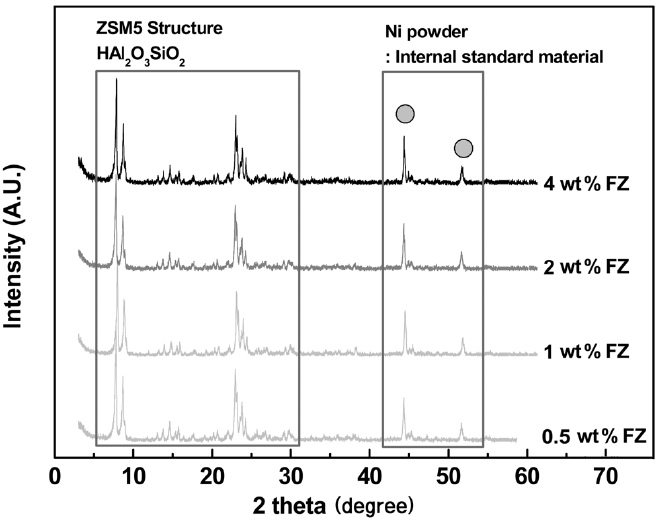
Figure 1은 이온교환량을 달리한 Fe-ZSM5 담체의 XRD 분석 결과이다. 5~31° 범위 내 피크들은 ZSM5 격자의 특성 회절 피크들을 나타낸다. 네 촉매 모두 일정한 크기의 피크들을 보여 Fe 이온교환량 변화에 따른 ZSM5 구조의 손실은 없는 것으로 판단되었다. Table 1의 Fe 이온교환량이 증가함에 따른 기공 부피의 감소가 Hematite (Fe2O3)의 생성 때문이라 예상하였지만 Hematite 특성 회절 위치인 33.15°, 35.65°에서 피크들이 발견되지 않았고, 이외에도 여타 Fe 산화물의 특성 피크들이 발견되지 않았다. Qi et al.은 6.7 wt% 이하의 Fe가 담지된 Fe-ZSM5 촉매에서는 Fe 특성 피크가 발견되지 않는 것으로 보고하여[19], Figure 1의 결과와 일치하는 것으로 확인되었다.
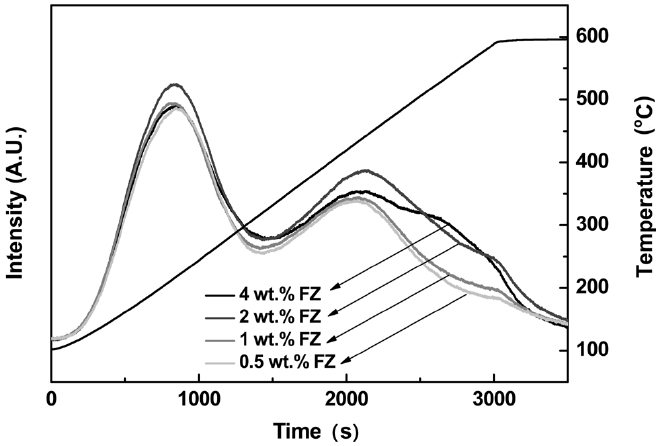
Figure 2에 Fe-ZSM5의 NH3-TPD 결과를 나타내었다. 피크는 150~280 ℃ 영역과 350~500 ℃ 영역에 하나씩 존재하는데 일반적으로 나타나는 두 개의 피크 중 고온에서의 피크가 Bronsted 산점에 해당된다고 보고된 바 있다[20]. 210 ℃ 부근에서 네
촉매의 피크가 유사하게 형성되었고, 피크 면적은 2 wt% Fe- ZSM5가 다른 촉매에 비해 근소하게 컸다. 고온 영역에서는 0.5, 1 wt% Fe-ZSM5가 420 ℃에서 피크를 보였고, 2, 4 wt% Fe-ZSM5는 20 ℃ 가량 상승된 440 ℃에서 피크가 존재하였다. 피크가 보다 높은 온도에서 발생하는 점과 피크 면적이 늘어나는 것으로 보아 Fe를 2 wt% 이상 이온교환하면 Bronsted 산점에 영향을 주어 NH3-SCO 활성의 차이가 발생하는 것으로 판단되었다.
Figure 3은 0.1 wt% Pt / 0.5 wt% Fe-ZSM5의 HRTEM 분석 결과이다. Figure 3(a)에서 Fe가 평균 10 nm 크기로 균일하게 분포되어 있음을 확인할 수 있다. 20~30 nm 가량의 크기를 가진 검은 덩어리는 Fe 산화물로 분석되었는데 분포가 넓게 형성 되어있지 않으므로 촉매 활성에 큰 영향을 미치지 않는 것으로 판단되었다. Figure 3(b)는 450,000 배 확대된 이미지인데, 이 이미지를 통해 Pt의 담지 상태를 확인할 수 있었다. Pt는 EDX 분석 결과 대체로 Fe 위에서만 발견되었으며, Pt의 평균 크기는 1 nm 이하에서 매우 고르게 분포되어있음을 확인할 수 있다.
3.2. Pd/Fe-ZSM5, Pt/Fe-ZSM5 촉매의 NH3-SCO 활성 평가
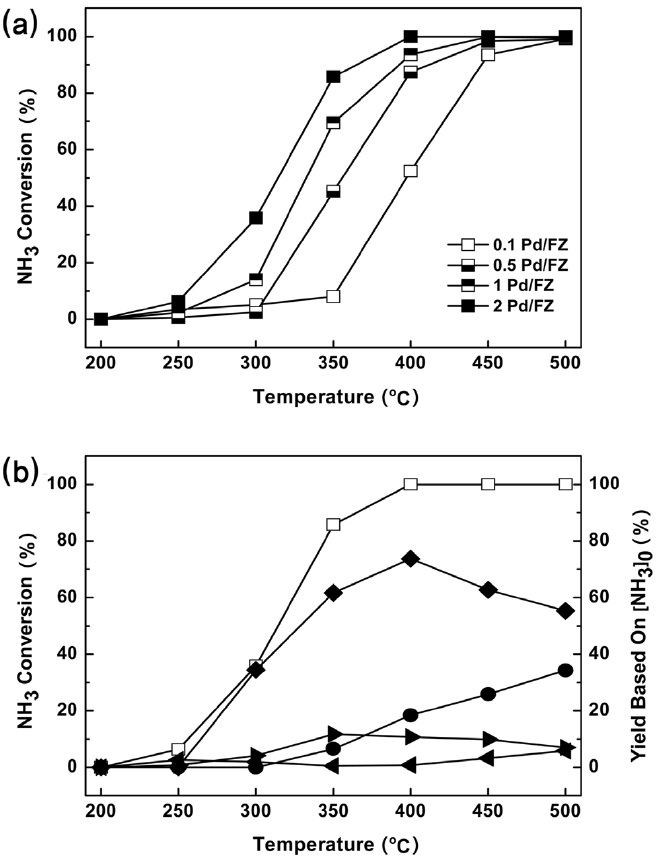
NH3 전환반응에 효과적인 촉매의 활성성분을 탐색하기 위하여, 2 wt%의 일정한 Fe 이온교환량을 가진 Fe-ZSM5 담체에 Pd, Pt을 담지하여 실험을 수행하였다. Figure 4(a)는 Fe-ZSM5에 Pd 담지량을 달리하여 실험을 수행한 결과이다. Pd 담지량이 늘어날수록 NH3 전환율이 상승했고, 2 wt% Pd 담지 촉매가 전 온도 구간에 걸쳐 여타 Pd 담지량의 촉매들에 비해 10~20% 높은 NH3 전환율을 보였다. Figure 4(b)는 2 wt% Pd/Fe-ZSM5에 의한 생성물 수율을 나타내고 있는데, 350 ℃ 이상에서 90 % 이상의 NH3 전환율, 15% 이하의 NO2, N2O 수율을 보였다. 같은 온도 구간에서 NO 수율이 증가하였지만 55% 이상의 N2 수율을 보였다.
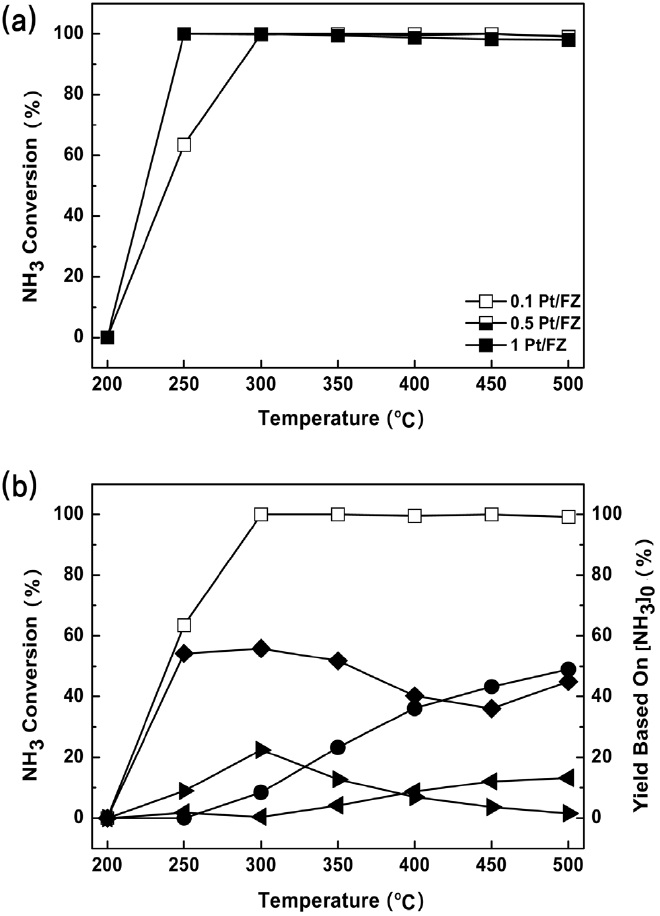
Pd 외에 NH3-SCO 활성이 우수한 것으로 알려진 Pt를 Fe- ZSM5에 담지한 촉매를 평가해보았다. Figure 5(a)에 따르면 Pt의 담지량을 달리한 촉매를 대상으로 한 실험 결과, 모든 촉매가 300 ℃ 이상에서 NH3 전환율이 100%에 이르는 우수한 활
성을 보였다. 250 ℃에서 0.1 wt% Pt/Fe-ZSM5가 타촉매 실험결과에 비해 낮은, 약 63%의 NH3 전환율을 보였지만 담지량 대비 효과 측면에서 Pt 담지량은 0.1 wt%를 목표로 하여, 촉매 성능을 개선하는 것이 적절하다고 판단되었다. Figure 5(b)는 0.1 wt% Pt/Fe-ZSM5의 생성물 수율을 나타낸 결과이다. N2O 수율이 300 ℃ 부근에서 20% 이상을 보였지만 해당 온도 부근에서 55% 가량의 N2 수율을 유지하였다.
Pt/Fe-ZSM5는 Pd/Fe-ZSM5에 비해 90% 이상의 NH3 전환율에 도달한 온도가 100 ℃ 이상 낮았으며, N2 수율 측면에서도 350 ℃ 이하에서 강점을 보이는 바 Pd 촉매보다 우수하다고 평가되었다.
3.3. Fe 이온교환량에 따른 Pt/Fe-ZSM5 촉매의 NH3-SCO 활성 평가
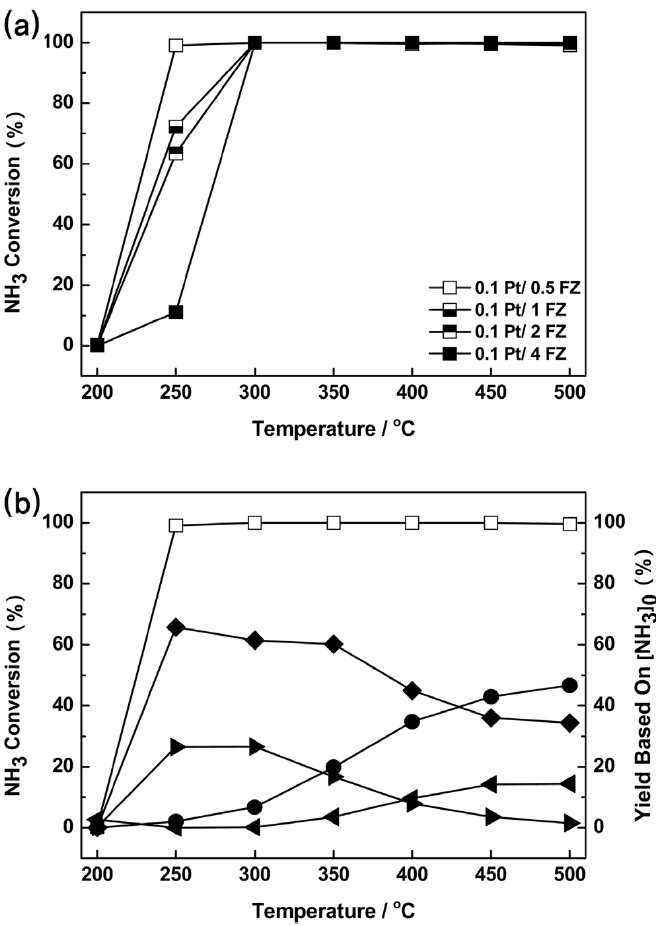
앞서 수행한 실험 결과에서 우수한 NH3-SCO 활성을 보였던 0.1 wt% Pt/Fe-ZSM5에서 Fe-ZSM5 담체의 Fe 이온교환량을 변화하면서 NH3-SCO 활성의 변화를 관찰하였다. Figure 6(a)에 의하면 Fe 이온교환량이 작을수록 NH3 전환율이 100%에 도달하는 온도 범위가 넓어짐을 알 수 있다. 그 결과 0.1 wt% Pt/0.5 wt% Fe-ZSM5 촉매는 250 ℃ 이상에서 NH3 전환율이 100%에 이르는데, 이는 Figure 5(a)의 1 wt% Pt / 2 wt% Fe-
ZSM5 촉매와 유사한 수준의 성능으로 확인되었다. 0.1 wt% Pt / 0.5 wt% Fe-ZSM5 촉매의 생성물 수율은 Figure 6(b)에 도시하였다. 400 ℃를 기점으로 NO2, N2O 수율이 온도 변화에 따라 서로 trade-off 하는 경향을 보였다. 500 ℃로 근접할수록 NO 수율이 증가함에 따라 N2 수율이 40% 미만으로 낮아졌지만 250 ℃의 저온에서 70%에 이르는 매우 우수한 활성이 관찰되었다.
0.1 wt% Pt / 0.5 wt% Fe-ZSM5는 1 wt% Pt / 2 wt% Fe- ZSM5에 비해 Pt의 담지량이 매우 낮음에도 불구하고 Fe 이온교환량 변화에 의한 담체의 성질 변화를 도모하여 NH3-SCO 활성이 극대화 되었다. Figure 5(b) 결과와 비교하면 100%의 NH3 전환율이 250 ℃까지 유지되었고, 250~350 ℃ 구간에서 N2 수율이 10~20% 가량 높게 형성된 것으로 보아, NH3-SCO 반응에 최적 조성을 가진 촉매로 판단되었다.
본 연구에서는 산성 담체로써 활용이 가능한 Fe-ZSM5에 Pd, Pt을 담지한 촉매를 대상으로 실험을 수행하여, NH3-SCO에 우수한 활성을 보이는 촉매의 활성성분과 조성을 탐색하
였다. Fe의 이온교환량(2 wt%)이 고정된 Fe-ZSM5 담체에 Pd, Pt을 담지한 촉매의 활성을 비교한 결과, Pt/Fe-ZSM5가 90% 이상의 NH3 전환율과 40~50% 이상의 질소 수율을 보이는 온도 범위가 넓었으며, 특히 매우 적은양의 귀금속을 담지한 0.1 wt% Pt / 2 wt% Fe-ZSM5 촉매가 우수한 활성을 보였다. 본 촉매 조성의 최적화를 위해 철의 이온 교환량을 변화시켜 실험을 수행한 결과, 0.1 wt% Pt / 0.5 wt% Fe-ZSM5가 일반적으로 암모니아 산화 활성이 낮은 250 ℃ 영역까지 100%의 NH3 전환율을 보였다. 따라서 본 연구 대상 촉매에 대한 실험 결과, Pt이 Pd에 비해 소량의 담지로도 저온에서 암모니아의 전환에 탁월한 것으로 나타나므로, Pt/Fe-ZSM5가 NH3-SCO 반응에 매우 적합한 촉매로 판단되었다.
Fe-ZSM5 담체에 따른 XRD 분석으로, 담체의 구조가 활성에 미치는 영향은 없는 것으로 나타났다. NH3-TPD 결과에서는 Fe의 이온교환량에 따라 Bronsted 산점의 변화가 있는 것으로 확인되었다. 또한 가장 우수한 활성을 보인 0.1 wt% Pt / 0.5 wt% Fe-ZSM5 촉매의 HRTEM 분석 결과, Pt이 촉매 표면에 매우 고르게 분포되어 있는 것으로 나타났다. 종합하면, Fe의 이온교환량에 따른 담체의 산성 변화와 Pt 분포의 변화가 NH3-SCO 활성에 영향을 미치는 것으로 판단되었으며, FT-IR, H2- TPR 등 다양한 분석법을 통하여 촉매 물성과 활성의 상관관계 규명이 필요할 것으로 보인다.
최근 자동차 배가스와 수처리 시설 내 암모니아 제거 기술에 관한 성능은 주로 저온 영역에서 평가되고 있으므로, 해당 반응 조건에서 우수한 활성을 가지는 기술의 개발 여부가 중요한 요소이다. 상기 Pt/Fe-ZSM5 촉매는 특히 배가스 내의 반응 조건에서 우수한 활성을 보이므로 자동차 배가스의 암모니아 저감에 큰 기여를 할 것으로 예상되며, 또한 수처리 시설에 안정적으로 적용이 가능할 것으로 기대된다.