수소생산을 위한 메탄의 부분산화용 촉매로 알루미나에 담지된 코발트와 니켈 촉매를 함침법으로 제조하였다. 이들 코발트와 니켈 촉매에 조촉매 성분 Mg, Ce, La와 Sr을 첨가하여 초촉매 효과를 조사하였다. 메탄의 부분산화반응을 위한 촉매의 활성은 상압, CH4/O2 = 2.0에서 450~650 ℃의 온도영역으로 조사하였다. 촉매의 특성은 BET, XRD와 SEM/EDX를 이용하여 조사하였다. 0.2 wt%의 조촉매 성분의 첨가로 촉매성능의 상승효과를 얻을 수 있었다. 500 ℃ 이상의 온도에서는 Co/Al2O3에 Mg을 첨가한 촉매가 가장 우수한 메탄 전환율과 수소 선택성을 나타내었다. 낮은 온도 영역에서는 Ni/Al2O3에 Ce와 Sr을 첨가한 촉매가 Co계 촉매보다 우수한 반응특성을 나타내었다. Co/Al2O3와 Ni/Al2O3에 조촉매를 첨가한 경우 촉매의 표면적이 증가하는 것으로 나타났다.
에너지원으로 사용할 수 있는 자원은 여러 가지가 있으나, 천연가스는 화석연료 중 석유에 버금갈 만큼 풍부한 매장량을 가지고 있으며 세계적 에너지원의 약 22%를 차지하고 있다. 에너지의 수요는 계속 증가하고 있으나 IEA (International Energy Agency, 국제 에너지 기구)에서는 향후 30년 내에 에너지 소비량 중 천연가스가 30~40%로 증가할 것으로 전망하고 있다[1]. 천연가스는 대부분이 메탄으로 이루어져 있고, 천연가스는 다양한 분야에서 이용되고 있으며 연소를 통하여 발생되는 에너지를 이용하는 방법과 화력발전, 버스 등의 디젤을 대체하여 매연 등 환경오염을 줄이기 위한 동력원으로 사용되기도 한다[2]. 그리고 개질 반응을 이용하여 합성가스를 생산하고 생산된 합성가스를 이용하여 메탄올이나 에틸렌 등을 합성하기 위한 유용한 화학물질의 원료로 사용되기도 한다[3,4]. 또한 최근에는 수소생산을 통하여 전기를 생산하기 위한 에너지 운반체로의 활용에 많은 연구가 진행되고 있다[2].
메탄으로부터 수소를 얻기 위한 합성가스 제조공정으로 대표적인 몇 가지 공정이 알려져 있다. 첫째로 현재 상업화되어 있는 수증기 개질공정(SMR, Steam Methane Reforming)은 1962년에 개발되었고 메탄의 수증기 개질(SMR)은 전세계 수소생산의 40%에 달할 정도로 광범위하게 적용되며 소규모의 1 ton/h H2 이하의 수소생산 규모로부터 대형 암모니아 설비에서의 100 ton/h H2의 수소생산 규모까지 다양하다[5]. 그러나 이 공정의 반응은 흡열반응으로 에너지를 소비가 많은 공정이며 반응 후 생성물인 CO : H2의 몰 비가 1 : 3으로서 Fischer-Tropsch 공정과 메탄올 합성 공정 등에 이용하려면 CO : H2의 몰 비를 1 : 2로 재 조정하여야하는 단점이 있다[1,6,7]. 둘째는 이산화탄소 개질반응(CO2 reforming)이다. 이산화탄소를 이용한 합성가스 제조에 최근 지구온난화와 관련하여 관심이 높아지고 있지만 이산화탄소 개질반응의 경우 탄소 침착 가능성이 수증기 개질반응보다 커서 문제점으로 작용하고 있다[8-13]. 셋째로는 1929년에 Liander 등에 의해 제안된 메탄의 부분산화법이다. 메탄의 부분산화 공정은 수증기 개질공정과 이산화탄소 개질반응 공정에 비하여 발열반응으로서 에너지 비용을 절감할 수 있고, 생성물인 CO : H2의 몰 비가 1 : 2이므로 메탄올 합성이나 Fischer- Tropsch 공정에서 바로 이용이 가능하다는 장점들을 가지고 있다. 메탄의 부분산화반응과 주요 개질반응은 다음과 같다 [1,7,14].
반응 (1)은 직접 경로에 의해 합성가스가 생성되는 반응으로 반응 (1)만을 활성화하는 촉매의 합성이 메탄의 부분산화반응에서 중요하다. 이론적으로 CH4와 O2가 활성화되는 모든 온도에서 순수한 합성가스 생성이 가능하다. 이 공정이 상업화가 된다면 에너지 부분이나 경제성 부분에서 많은 비용 절감효과를 가져올 수 있을 것으로 기대된다.
메탄의 부분산화반응을 위한 촉매로 담지된 Co와 Ni촉매가 우수한 반응특성을 나타내는 것으로 알려져 있으며 이들 Co와 Ni촉매와 관련된 연구가 많이 진행되어 왔다[7,15,16]. Co 촉매와 Ni 촉매에 Mg, Ca, Sr, Ba, Ce, La, Y 그리고 Na와 같은 조촉매를 첨가한 경우 CH4 전환율과 H2 선택성이 상승하는 것으로 알려져 있다[17-20].
본 연구에서는 γ-Al2O3에 담지시켜 제조된 메탄의 부분산화용 Co와 Ni촉매를 합성하고 Mg Sr, Ce와 La의 금속을 첨가하여 이들 금속의 조촉매 효과를 조사하였다.
촉매제조를 위한 금속성분으로 Ni(NO3)2?6H2O (Aldrich Chemical Co. 99.99%), Co(NO3)2?6H2O (Aldrich Chemical Co.99. 99%), Ce(NO3)3?6H2O (Aldrich Chemical Co.99.99%), La(NO3)3 ?6H2O (Aldrich Chemical Co.99.99%), Mg(NO3)3?6H2O (Aldrich Chemical Co.99.99%), Sr(NO3)3?6H2O (Aldrich Chemical Co. 99.99%)를 사용하였다. 담체로 γ-Al2O3 (Strem Chemical, Inc., 185 m2/g)을 사용하여 건식 함침법(incipient wetness impregnation) 으로 금속성분을 담지 시켰다. 담체는 120 ℃에서 24h 건조한 후에 사용하였고 일정 양의 금속성분을 담지 시킨 후에 120 ℃에서 8 h 동안 건조시키고 550 ℃에서 4 h 동안 소성시켜 촉매로 사용하였다. 조촉매 성분이 첨가된 촉매는 10 wt% Co 촉매와 10 wt% Ni 촉매에 0.2 wt%와 1 wt%의 금속성분 농도가 되도록 조촉매 성분을 동시에 함침시켜 담지시켰다. 촉매명은 담지량, 금속종류/담체 순으로 구분하여 나타내었으며, 10Co/Al2O3은 γ-Al2O3에 10 wt% Co가 담지 되어 있는 것을 나타내고 10CoMg/Al2O3은 γ-Al2O3에 10 wt% Co와 0.2% Mg를 담지시킨 촉매를 나타낸다.
촉매는 반응기 내에서 50 mL/min의 H2로 550 ℃에서 4 h 동안 환원시킨 후에 반응특성을 조사하였다. 반응기는 내경 20mm, 높이 70 mm인 U자형 석영 미분반응기를 사용하였고, 촉매는 기본적으로 0.5 g을 사용하였다. 반응온도는 650 ℃에서 -1 ℃/min으로 온도를 점차 내리면서 측정하였고, 반응가스는 기본적으로 169 mL/min (CH4 : O2 : N2 = 2 : 1 : 3.75)의 속도로 MFC (Mass Flow Controller)를 사용하여 가스의 유량을 조절하여 공급하였다. 반응 후의 가스는 GC (Hewlett Packard HP58 90II)의 TCD (Thermal Conductivity Detector)로 Mol Sieve 5A PLOT (30 m × 0.53 mm ID, Supelco Inc.)을 분리관으로 사용하여 분석하였다. 사용된 촉매의 표면적을 측정하기 위하여 BET (Quantachrome Autosorb-1)를 사용하였으며, 각 단계에서 생성된 성분을 확인하기 위하여 XRD (Philips X'pert MPD 3040)를 사용하였고, 촉매표면에서의 금속성분의 분포도는 SEM/EDX (JEOL JSM-5610)를 사용하여 조사하였다. CH4의 전환율과 H2와 CO의 수율 및 선택도는 다음과 같이 계산되었다.
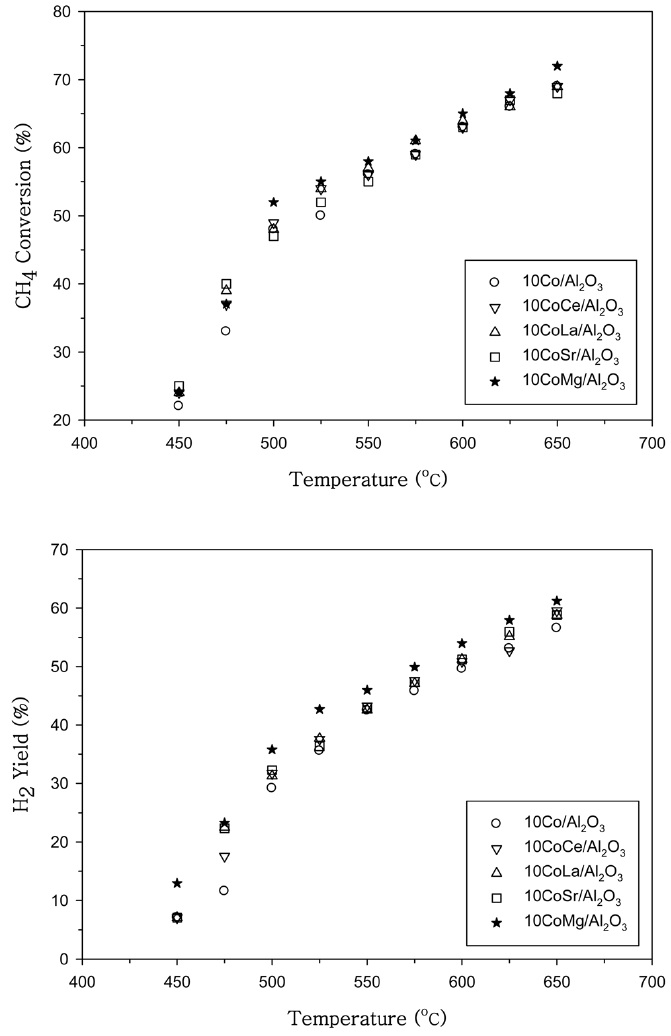
Lee et al.[16]은 메탄 부분산화용 Al2O3에 담지된 코발트와 니켈 촉매에서 코발트와 니켈의 담지량은 10 wt%가 적절한 것으로 보고하였다. 10Co/Al2O3 촉매에 다양한 조촉매 성분을 0.2 wt% 첨가한 Co 촉매의 CH4 전환율과 H2 수율을 Figure 1
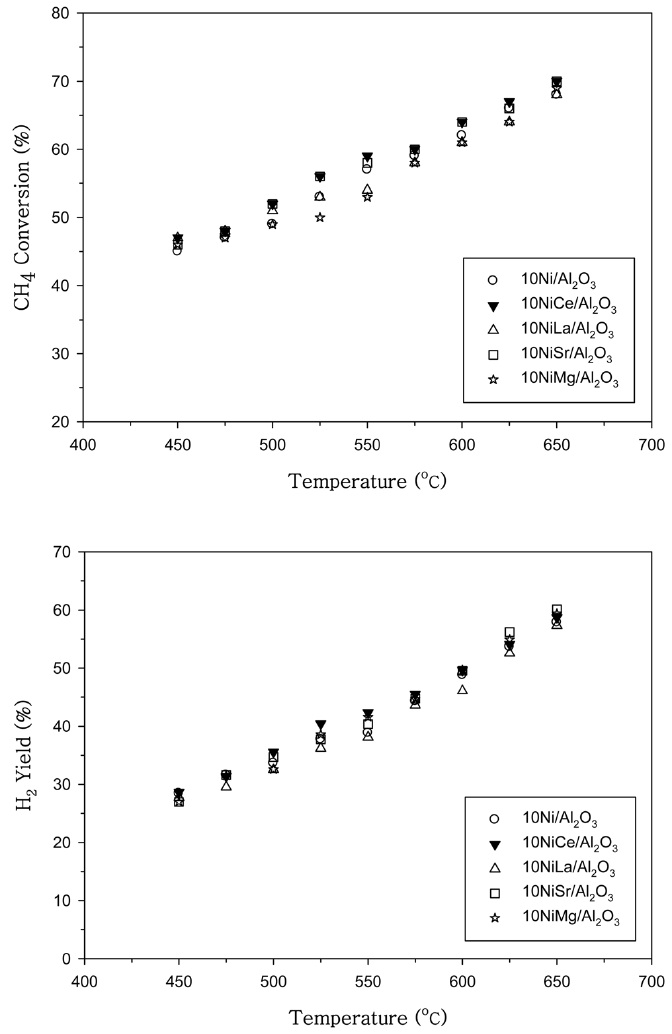
에 나타내었다. 500 ℃ 이상의 온도영역에서 Ce, La, Sr과 Mg을 첨가한 경우 CH4 전환율을 증가시켰다. Mg을 첨가한 경우 가장 큰 CH4 전환율을 나타내었으며 H2 수율에서도 Mg을 첨가한 경우 가장 우수한 특성을 나타내었다. 10Ni/Al2O3 촉매에 다양한 조촉매 성분을 0.2 wt% 첨가한 촉매의 CH4 전환율과 H2 수율은 Figure 2에 나타내었다. 10Ni/Al2O3 촉매에 Ce과 Sr를 첨가한 경우에 500 ℃ 이상의 온도영역에서 CH4 전환율을 증가시켰으나 Co 촉매에서와 다르게 Mg을 첨가한 경우 조촉매 작용이 거의 나타나지 않았다.
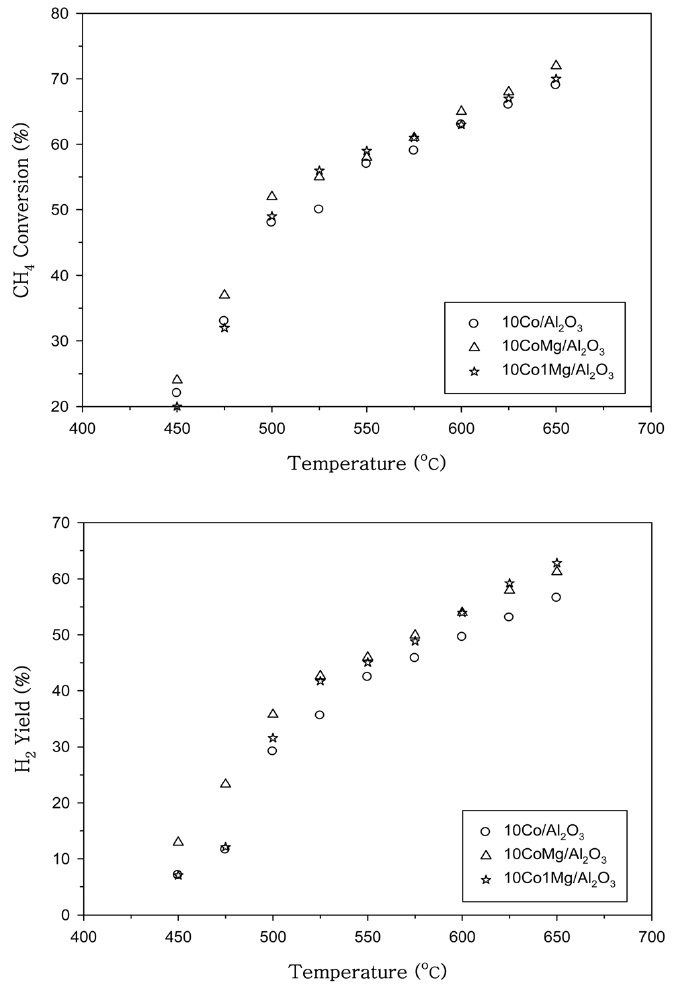
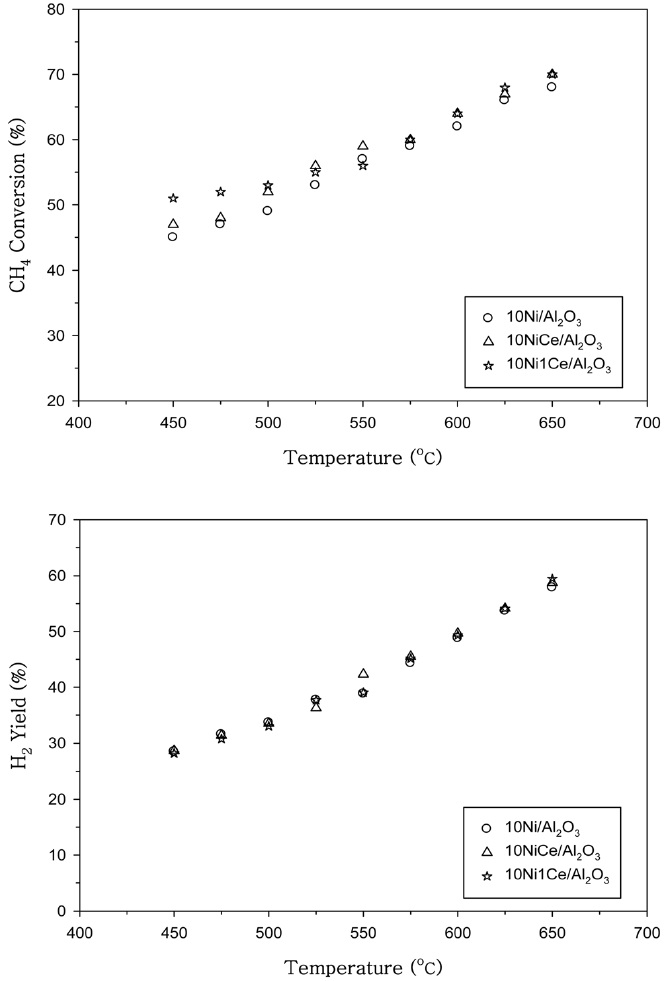
Co 촉매에 첨가된 Mg의 양을 0.2 wt%와 1 wt%로 변화시켜 첨가한 경우의 CH4 전환율과 H2 수율을 Figure 3에 나타내었다. Mg성분이 0.2 wt% 정도 첨가된 Co 촉매에서 조촉매 작용이 우수함을 알 수 있었다. Ni 촉매에 첨가된 Ce의 양을 0.2 wt%, 1 wt%로 변화시킨 경우의 CH4 전환율과 H2 수율을 Figure 4에 나타내었다. 500 ℃ 이상의 온도에서는 0.2 wt%의 Ce를 첨가한 촉매에서 우수한 조촉매 작용을 나타내었으며, 500 ℃ 보다 낮은 온도에서는 Ce 첨가량을 1 wt%로 증가시키면 CH4 전환율이 다소 증가하는 것으로 나타났다.
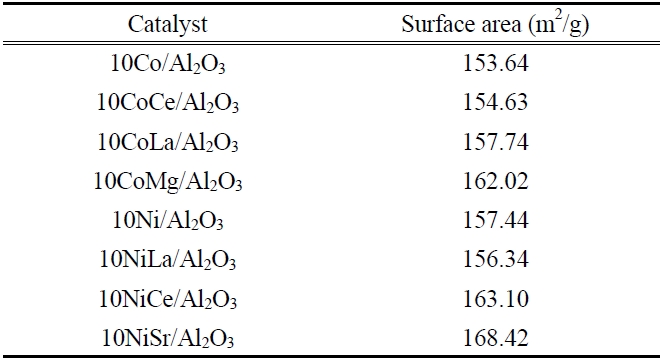
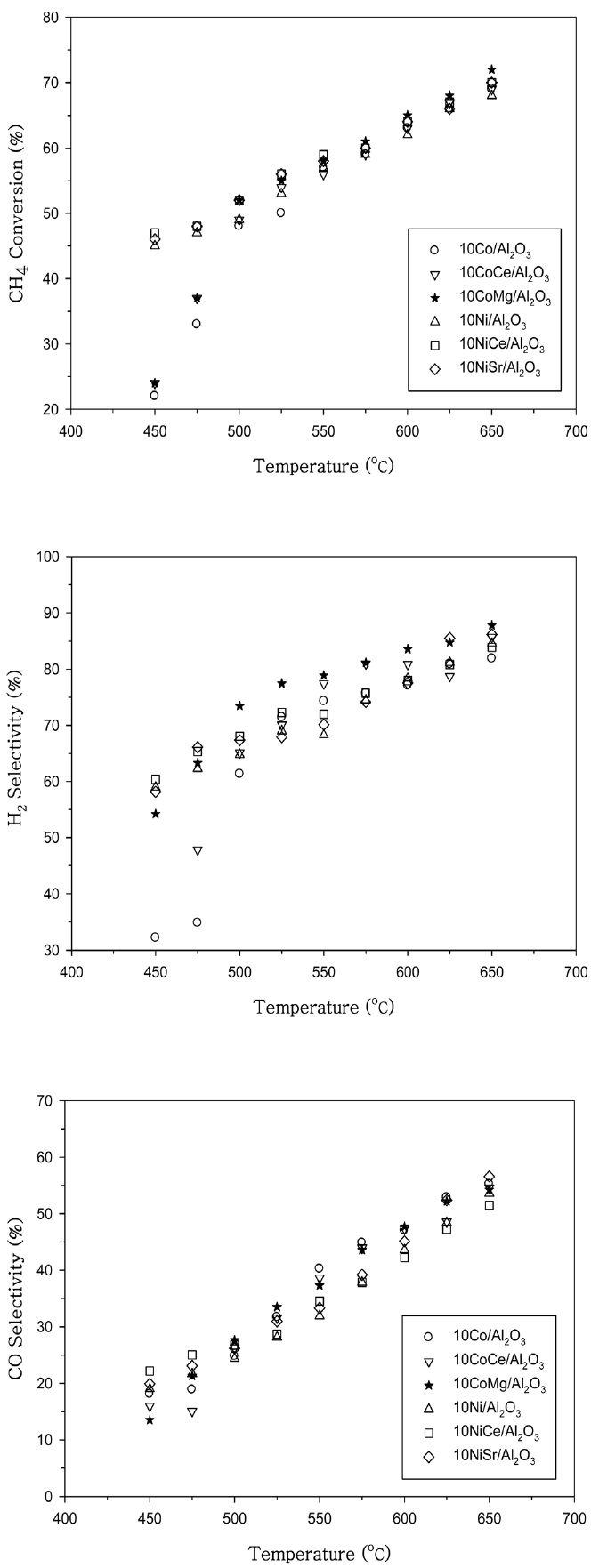
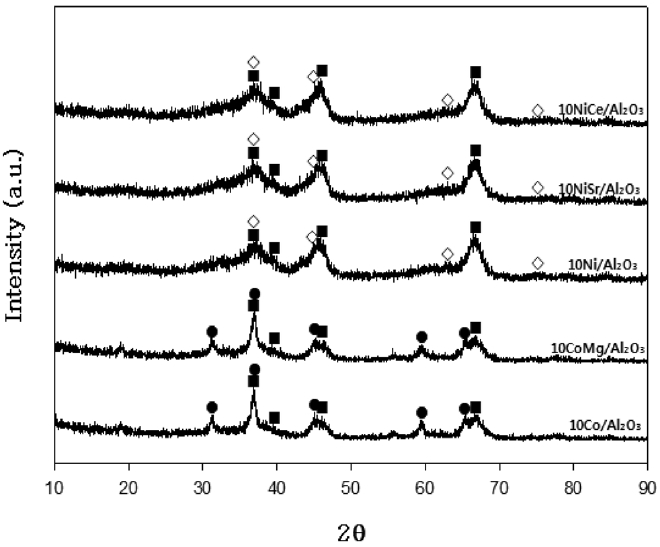
반응특성이 우수한 것으로 나타난 Co와 Ni 촉매에서의 CH4
전환율, H2 선택성과 CO 선택성을 비교하여 Figure 5에 나타내었다. 500 ℃ 이상의 온도에서는 Co에 Mg을 첨가한 10Co Mg/Al2O3 촉매의 반응특성이 우수한 특성을 나타내고 있으며 500 ℃ 미만의 낮은 온도영역에서는 Ni에 Ce을 첨가한 10Ni Ce/Al2O3 촉매가 높은 CH4 전환율과 H2 선택성을 나타내었다.
Gao et al.[14]은 Co에 Ca를 첨가한 촉매에서 Ca는 Co3O4의 크기와 Co 금속의 입자 크기를 감소시키며 CoAl2O4의 환원과 분산뿐만 아니라 Co의 재 산화를 억제하는데 효율적으로 작용하기 때문에 효과적으로 촉매 활성을 높여준다고 하였다. Yu et al.[18]의 연구결과에서는 탄소 침적을 약화시키고 Co3O4의 분산에 효과가 있는 알칼리 토금속 Mg, Ca, Sr 그리고 Ba로 시험한 결과 Sr이 첨가된 Co-Ni-Sr/Al 촉매가 높은 활성과 선택성을 나타내었다.
Lucredio et al.[20]은 Co에 첨가된 Ce과 La의 작용으로 산소의 흡착과 분해반응으로 탄소를 기화시키려는 성질 때문에 탄소 침적을 감소시키고 CO 선택성을 상승시킨다고 하였다. Zeng et al.[17]은 Ni 촉매에 Y와 Ce을 첨가한 경우에 Y와 Ce의 탄소 침적에 대한 저항효과가 우수한 것으로 보고하였다.
Dajiang et al.[19]은 Ni/γ-Al2O3 촉매에 Na, Sr, Ce 그리고
La을 첨가하여 그 효과를 알아보았는데 Ni, Sr, Ce 그리고 La을 첨가한 것이 첨가하지 않은 것에 비해 CH4 전환율과 H2 선택성이 모두 상승하는 효과가 나타났다. 그중에서 La와 Ce을 첨가한 것이 가장 우수한 효과를 보였는데 이는 La와 Ce을 첨가하면 Ni의 환원성을 증가시켜 반응성이 높아지기 때문이라고 하였다.
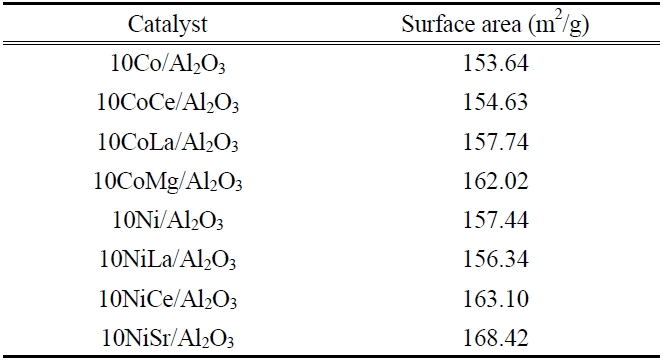
La, Ce, Sr, Mg의 조촉매가 첨가된 Co와 Ni 촉매의 BET를 사용해 측정한 표면적을 Table 1에 나타내었다. Table 1에 나타난 결과를 살펴보면 Co촉매에서는 La와 Mg을 첨가한 촉매에서 표면적이 높게 나타났고 Ni 촉매에서는 Ce과 Sr을 첨가한 촉매의 표면적이 높게 나타났으며 표면적이 큰 촉매에서 반응활성도 크게 나타났다. 이는 촉매에 조촉매가 첨가되면 분산효과의 증가로 촉매활성이 증가하는 것으로 볼 수 있다. Seo et al.[20]의 중형기공성 알루미나에 담지시킨 니켈촉매를 이용한 액화천연가스의 수증기개질반응에 의한 수소제조에서 니켈 비표면적이 가장 높은 촉매가 가장 높은 반응활성을 나타내었다. 이들 결과로부터 니켈 비표면적이 중형기공성 알루미나 담체에 담지된 니켈촉매의 반응활성을 결정하는 중요한 변수임을 알 수 있다고 하였다.
Lucredio et al.[21]은 Co촉매에 첨가된 La과 Ce 양이온들은 촉매 표면에서 서로 용착되는 성질이 있어 격자사이에서 서로 모이게 되고 이온 반지름이 커짐으로써 촉매 표면적을 높여준다고 하였다. Yaquan et al.[22]은 Ni 촉매에 Y를 첨가한 것이 Ni 촉매보다 표면적이 더 크게 나타났다고 하였으며 이는 Y2O3 로 Ni2+이온이 분산되어 NiO의 증대로 표면적이 더 커진 것이라고 하였고 이로 인하여 Ni 촉매의 활성이 증가한다고 하였다.
[Table 1.] Surface area of various catalysts
Surface area of various catalysts
이들 문헌상의 결과와 비교하면 실험에서 나타난 조촉매 첨가효과는 분산도의 증가와 Co와 Ni의 환원성 증가에 기인하는 것으로 생각된다.
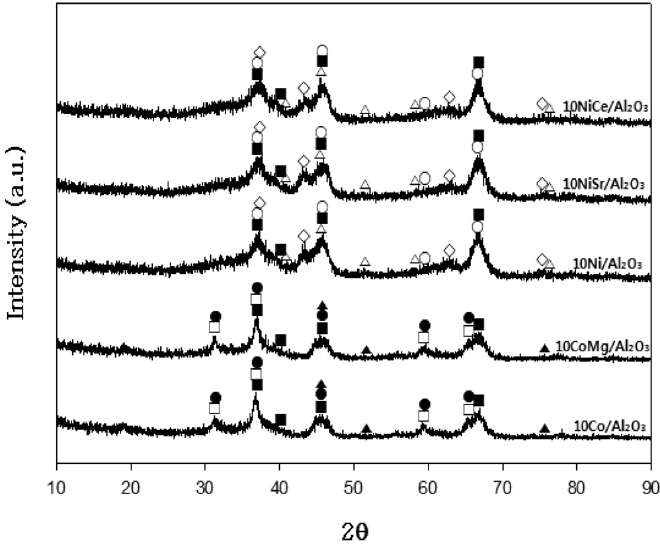
촉매의 소성 후와 반응 후의 XRD 분석결과를 Figure 6과 7에 나타내었다. Co/Al2O3 촉매의 Co 성분은 소성 후에 Co3O4의 산화물 형태로 존재하며 활성화 단계에서 Co 금속으로 환원됨을 알 수 있다. Ni/Al2O3 촉매에서는 Ni 성분이 소성 후에 NiO의 산화물 형태에서 활성화로 Ni 금속으로 환원되는 것으로 나타났다. 촉매의 비활성화 특성을 조사하기 위하여 650 ℃에서 30시간 동안 반응시킨 경우에 촉매의 활성이 변화 없이 계속 유지되는 것으로 나타났으며, 반응 후에도 비활성의 원인으로 알려진 CoAl2O4와 NiAl2O4의 형성은 거의 관찰되지 않았다.
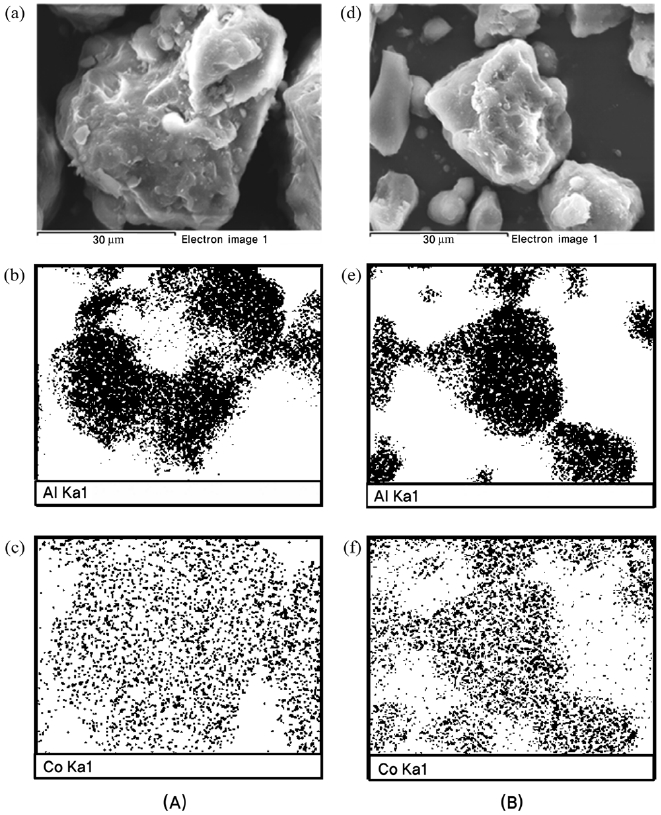
Figure 8과 9에는 대표적인 10CoMg/Al2O3와 10NiCe/Al2O3 촉매의 소성 후와 반응 후의 SEM/EDX 결과를 나타내었다. 이들 촉매에서 소성 후와 반응 후에 Co성분과 Ni 성분은 잘 분산되어 있는 것으로 나타났다.
Co촉매와 Ni촉매에서 0.2 wt% 조촉매 성분의 첨가로 메탄전환율과 수소 선택성을 증가시키는 효과를 얻을 수 있었다. 500 ℃ 이상에서는 Co 촉매에 Mg을 첨가하였을 때 메탄 전환율과 수소 선택성이 상승하는 조촉매 효과가 가장 우수한 것으로 나타났다. 500 ℃ 미만의 낮은 온도영역에서는 Ce과 Sr을 첨가한 Ni 촉매에서 높은 메탄 전환율과 수소 선택성을 나타내었다. 조촉매가 첨가된 Co촉매와 Ni촉매의 경우 표면적을 증가시키며 분산도가 증가하는 것으로 나타났다. SEM/EDX 분석 결과 Co와 Ni 성분은 소성 후와 반응 후에도 잘 분산되어 있는 것으로 나타났다.