일반적인 알칸의 탈수소화반응은 흡열반응으로 진행되며 탈수소된 알켄 화합물인 에틸렌, 프로필렌, 부텐 등의 생성물과 수소를 방출해 내는 부피가 증가하는 반응으로 진행된다[1-5]. 알칸화합물의 직접적인 탈수소화반응은 흡열반응으로 반응 중에 온도 조절이 전체적인 알켄화합물 생산에 있어 중요 인자가 되며 반응 중에 생성되는 탄소 침적으로 인해 촉매의 비활성화를 피할 수 있는 다양한 방법이 시도되고 있다. 경질올레핀 중 특히 에틸렌, 프로필렌, 부틸렌, 부타디엔 등은 고분자 합성에 있어 단량체로 사용된다[2]. 에틸렌과 프로필렌은 폴리에틸렌과 폴리프로필렌의 주 원료로 사용하며, 부틸렌은 연료첨가제, 합성고무, 가소제 등을 제조하는데 원료로, 이소부틸렌은 폴리부텐, 연료첨가제인 MTBE (Methyl Tertiary Butyl Ether) 합성의 원료로 사용되고 있다. 이러한 알켄 화합물은 석유화학의 단량체로 다양한 석유화학제품 생산에 근간이 되는 물질로서 그 수요가 점차적으로 증가하고 있다.
경질올레핀의 주생산 공정으로는 스팀 첨가 열분해(Steam Cracking), 유동층 촉매분해공정(Fludized Catalytic Ctacking, FCC) 등이 사용되고 있다. FCC 공정과 열분해 공정은 높은 에너지 소비량과 높은 CO2 배출량으로 인해 에너지 절감 공정에 대한 대책이 강구되고 있다. 최근 산업화가 가속화됨에 따른 경질올레핀의 수요는 지속적으로 증가한 반면, 석유자원의 고갈에 따른 원유가의 상승에 따라 경질올레핀의 가격은 지속적으로 상승하고 있다. 따라서, 경질올레핀을 생산할 수 있는 알칸화합물의 직접적인 탈수소화 공정에 대한 관심과 기대는 점점 높아지고 있다.
이러한 탈수소화 공정의 주촉매는 백금근간 촉매와 크롬 근간 촉매로 크게 구분할 수 있다[1]. Pt를 근간으로 한 촉매의 경우 사용되는 지지체의 종류로는 Al2O3[6-9], 제올라이트[10], SBA-15[11,12], MgAl2O4, ZnAl2O4[13,14] 등이 있으며 증진제로[15,16]는 Sn, Zn, Ce, Ga, In, Ge 등이 사용되며 상호 조합에 따라 활성의 변화가 존재한다. 백금과 증진제 사이의 고유한 상호작용과 더불어 지지체와의 상호작용은 백금의 전자구조와 더불어 물리적인 입자크기와 결정구조를 달라지게 한다. 입체기하학적 효과로는 증진제 물질이 고온의 반응조건에서 백금입자의 소결현상을 막아줌으로서 높은 분산도를 유지할 수 있는 역할을 하는 것으로 인식되고 있으며, 또한 백금의 입자크기를 작게 유지시켜 분산도를 증진시켜줌으로써 탈수소화 반응에 대한 활성점의 양을 높여 주고 탄화수소의 수첨 분해반응을 저해하고 탄소침적을 억제함으로서 원하는 선택도를 증진시키고 촉매의 안정성을 높여주는 역할을 한다. 증진제를 첨가함으로서 백금 자체가 가지고 있는 전자적 밀도를 변화시킬 수 있는 Pt-증진제 간의 합금을 형성함으로써 백금의 전자구조의 배치를 달라지게 하여 활성을 증진시키고 있다. 이러한 영향은 백금 및 증진제의 전구체 종류, 촉매 제조 방법에 대해 많은 영향을 미치게 된다. 또한, 반응물에 첨가되는 비활성 기체의 비율, 촉매의 비활성화를 억제하기 위하여 추가되는 수소의 양, 반응 온도등의 실험 변수는 원하는 알켄 화합물의 수율에 많은 영향을 미치게 된다.
따라서 본 연구에서는 부탄 탈수소화 반응에 있어서 반응조건의 영향을 확인하기 위해서 널리 알려진 Pt-Sn/θ-Al2O3를 제조하였으며, 기초적인 특성분석을 실시하였다. 또한 다양한 반응조건에서 부탄 탈수소화 반응에 대한 활성을 검토하여 부탄 탈수소화 반응에 대한 활성화에너지와 더불어 부탄 및 수소에 대한 반응차수를 멱수법칙을 사용하여 측정하였다.
상업용 γ-알루미나(CONDEA, SBET = 188 m2 g-1, total pore volume = 0.675 cm3 g-1)를 승온속도를 2 ℃ min-1으로 유지하여 1050 ℃에서 2시간 동안 소성하였다. 소성된 알루미나는 세타상을 유지하였으며 감마상의 알루미나는 관찰되지 않았다. 소성된 θ-Al2O3는 300 μm 이하의 사이즈로 분쇄하여 Sn, Pt를 함침법을 이용하여 0.5 wt% Pt-0.75 wt% Sn/θ-Al2O3를 제조하였다 Sn을 알루미나 지지체에 담지하기 위해서 2 wt% Sn (JUNSEI, 97% SnCl2·2H2O)이 용해된 1 M HNO3 (SK Chem., 60% HNO3) 수용액을 제조하였으며, 알루미나에 담지된 Sn의 함량은 0.75 wt%였다. Sn이 담지된 알루미나 지지체를 승온속도를 2 ℃ min-1으로 유지하여 600 ℃에서 4시간 동안 소성하였다. 소성후 Sn이 담지된 알루미나 지지체에 0.5 wt% Pt를 2 wt%의 H2PtCl6 (Sigma-Aldrich)수용액을 이용하여 담지하였으며, 건조 후 500 ℃에서 4시간 소성하였다.
촉매의 구조적 성질을 살펴보기 위해 Siemens D-5005 기기를 사용하여 X-선 회절분석(X-ray Diffraction, XRD) 분석을 하였다. CuKα의 파장(1.5418 Å)을 사용하였으며, 사용한 전압과 전류는 30 mA, 50 kV이고, 0.12 degree min-1의 주사 속도로 2θ = 10~90°의 범위에서 측정하였다. 제조된 촉매의 질소 흡ㆍ탈착 등온선, 기공분포, 비표면적 및 총 기공부피는 액체질소 온도 하에서 질소흡착으로 Micromeritics사의 ASAP 2020을 사용하였다. P/Po = 0.05~0.2 범위 내에서 측정한 값으로 비표면적을 구하였다. 기공크기에 대한 분포는 탈착 등온선으로부터 BJH(Barret-Joyner-Halenda)식을 이용하여 구하였다. 총 기공부피는 P/Po = 0.995에서의 흡착량으로 계산하였다. 백금의 분산도 측정을 위해 Micromeritics사의 ASAP 2020을 이용하여 수소 화학흡착 실험을 실시하였다. 0.5 g의 시료를 60 cm3 min-1의 수소를 흘려주며 승온속도는 10 ℃ min-1으로 600 ℃에서 2시간 처리하였다. 전처리 후에 600 ℃에 10-4 torr까지 진공을 유지하여 흡착되어 있는 수소분자를 제거하고, 50 ℃로 냉각한 뒤 25~100 torr의 수소압에서 화학흡착을 실시하였다. 물리흡착된 수소를 제거한 뒤 수소를 다시 흡착하여 화학흡착된 수소의 양을 측정하였다. 사용한 양론지수는 H/Pt = 1로 가정하였다. 또한 Pt-Sn/θ-Al2O3 촉매의 환원거동을 알아보기 위해 AutoChem 2920을 사용하여 H2-승온환원(Temperature Programmed Reduction, TPR)을 수행하였다. 0.05 g의 촉매를 승온 속도 10 ℃ min-1으로 상온에서 400 ℃까지 온도를 올린 후 아르곤으로 400 ℃에서 2시간 동안 전처리하였다. 온도를 상온으로 내린 다음, 5% H2/Ar (30 cm3 min-1)을 흘려주면서 상온에서 800 ℃까지 10 ℃ min-1으로 승온시키며 수소 소모 정도를 측정하였다. 또한 촉매의 산성 성질을 측정하기 위해서 NH3-승온탈착(Temperature Programmed Desorption, TPD)를 AutoChem 2920에서 수행하였다. 전처리 조건은 헬륨가스를 사용한 것을 제외하고 H2-TPR과 같다. 전처리 후, 100 ℃에서 5% NH3/He (30 cm3 min-1)으로 1시간 동안 NH3를 흡착시켰다. 동일온도에서 He (50 cm3 min-1)을 흘려주면서 물리 흡착된 NH3 분자를 제거시켰으며 안정화 될 때까지 유지하였다. 안정화된 후 100 ℃에서 800 ℃까지 10 ℃ min-1으로 승온시키며 탈착되는 NH3를 측정하였다.
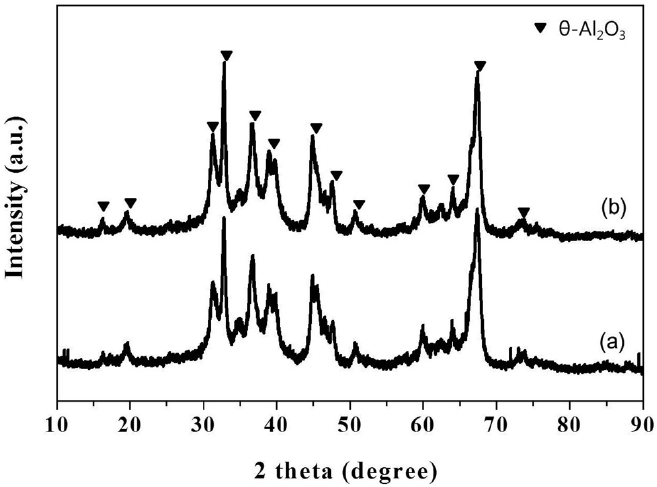
제조된 0.5 wt% Pt-0.75 wt% Sn/θ-Al2O3 촉매의 물리화학적 특성을 알아보기 수소화학흡착, 질소 물리흡착, NH3-TPD를 수행하였다(Table 1). 제조된 촉매의 X-선 회절분석 결과를 Figure 1에 나타내었다. 일반적으로 알루미나는 열처리 과정에 의해 고온에서 다양한 구조의 결정으로 상전이가 일어난다[17]. 지지체로 사용된 알루미나는 1050 ℃에서 2시간 소성함에 따라 θ-알루미나의 결정상으로 상전이 되었다. 또한 알루미나의 결정구조에 따른 산-염기 특성에 대해서는 알루미나의 결정구조에 따라 표면의 산점의 양이 달라진다는 보고가 되어 있으며, θ-알루미나의 산점의 양이 다른 결정구조의 알루미나에 비해 크게는 4배에서 적게는 2배가까지 적다는 것을 보고하였다[18]. 기존 연구결과에 따르면 촉매의 산점은 Pt 촉매의 탈수소화 반응에 있어 중요한 역할을 한다는 보고가 있지만, 많은 양의 산점은 탄소침적을 일으키는 활성점으로

Physicochemical properties of 0.5 wt% Pt-0.75 wt% Sn/θ-Al2O3 catalyst used for the dehydrogenation of n-butane
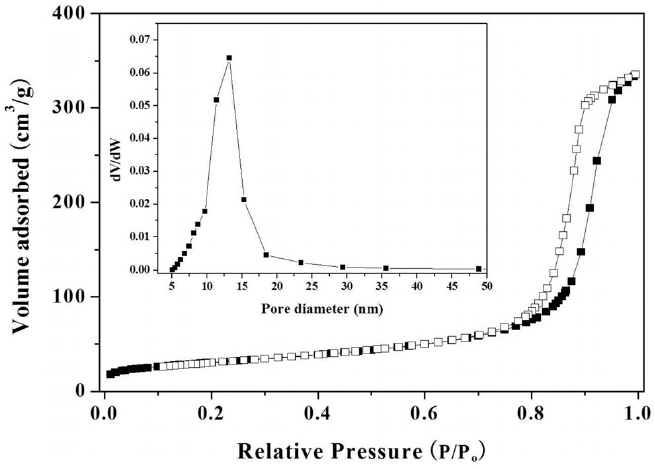
작용하여 촉매를 비활성화 시킨다. 또한, 500 ℃ 이상의 고온에서 운전되는 탈수소화 반응의 공정에서 산점은 크레킹 반응을 촉진시킴으로써 촉매의 선택도를 낮아지게 한다. 본 연구에서 사용한 γ-알루미나를 100~900 ℃까지 암모니아 탈착 실험을 통해 산점의 양을 알아본 결과 795 μmol NH3 g-1이었다. Table 1에 나타낸 Pt-Sn/θ-Al2O3의 산점의 양이 446 μmol NH3 g-1으로 더 적은 값을 갖는 이유는 γ-알루미나의 상전이에 의해 형성된 θ-알루미나를 촉매의 지지체로 사용하였기 때문이다. θ-알루미나의 제조 시 Pt와 Sn을 함침한 후 2번의 소성과정을 600 ℃ 및 500 ℃에서 실시하였지만 Figure 1에 나타낸 X-선 회절분석결과에서 보면 알 수 있듯이, Pt와 Sn을 담지한 후 소성과정을 거치더라도 θ-알루미나의 결정상은 변하지 않았다. 또한 Pt와 Sn에 관련된 X-선 회절 피크가 관찰되지 않은 점으로 보아 촉매를 구성하는 Pt와 Sn의 함량이 알루미나에 비해 극미량이거나 Pt와 Sn의 입자사이즈가 3 nm 이하므로 고르게 분산되어 있기 때문에 X-선 회절분석으로 검출되지 않은 것으로 여겨진다. θ-알루미나(SBET = 110 m2 g-1, total pore volume = 0.519 cm3 g-1)를 지지체로 한 Pt-Sn/θ-Al2O3의 질소흡착 분석결과를 Figure 2와 Table 1에 나타내었다. 제조된 Pt-Sn/θ-Al2O3 의 비표면적, 총 기공부피 및 기공크기는 Pt와 Sn이 담지된 후
에 약간 감소하였다. Figure 2에 나타낸 흡착 등온선을 보면 히스테리시스가 나타났으며, 메조기공을 갖는 물질의 전형적인 Type IV의 흡착등온선을 나타냈다. BJH 식을 이용한 기공 분포도를 보면 기공크기가 18 nm인 영역에 분포하는 것으로 나타났으며, Pt-Sn/θ-Al2O3 촉매가 메조기공 크기 영역의 기공을 갖는다는 결과와 일치한다. 수소 화학흡착으로부터 측정한 Pt의 분산도를 측정한 결과 Pt/θ-Al2O3와 Pt-Sn/θ-Al2O3 촉매 상에서 Pt의 분산도 29.4%와 15.2%로 Pt-Sn이 존재하는 경우 상대적으로 분산도 값이 낮게 나타났다. 알루미나 지지체를 사용한 Pt촉매의 경우 H/Pt 또는 CO/Pt의 화학흡착양론계수가 1인 반면 Sn이 첨가됨으로 인해 화학흡착양론계수 H/Pt 또는 CO/Pt 비율이 2.4~3.0로 증가 또는 감소될 수도 있다고 보고된 바 있다[19-21]. 본 연구에서는 H/Pt 화학흡착양론계수를 1로 가정하여 분산도를 계산하였기 때문에 Pt-Sn/θ-Al2O3의 분산도가 더 작은 값을 갖는 것으로 사료된다. 하지만, Pt의 분산도 값이 절대적으로 Pt 입자크기가 커지는 것을 의미하진 않는다. 종래 연구에서 Pt-Sn촉매의 분산도와 투과전자현미경 분석을 통해 Pt 입자의 크기가 절대적으로 Pt 입자크기와 상관관계를 갖지 않았다[22]. Sn 첨가에 따른 Pt 분산도의 변화는 Sn이 증진제로써 촉매 내에 존재할 경우 금속들 사이의 상호작용과 더불어 지지체와의 상호작용에 의해 Pt의 전자적 또는 입체 기하학적 구조의 변화를 생기게 하며, Pt-H의 화학결합 성질이 달라지게 한다.
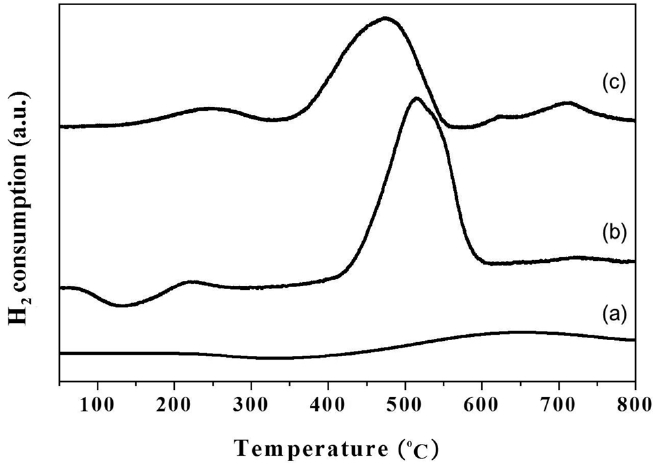
Pt-Sn/θ-Al2O3 촉매의 환원거동과 더불어 Pt와 Sn 금속 사이의 상호작용, 그리고 지지체와 금속사이의 상호작용을 알아보기 위해 실시한 H2-TPR 분석 결과를 Figure 3에 나타냈다. θ-Al2O3의 온도에 따른 수소 소모 정도를 관찰하여, Pt/θ-Al2O3 및 Pt-Sn/θ-Al2O3의 H2-TPR 결과 해석에 있어 기준선으로 사용하였다. Pt/θ-Al2O3 촉매의 경우 2개의 수소 소모 정도를 나타나는 것을 확인할 수 있었다. 150~280 ℃에서 나타나는 작은 피크는 PtIV가 PtII로 환원됨에 따라 수소가 소모되는 피크 또는 지지체와의 약한 상호작용을 Pt 종의 환원 피크이다. 400~
600 ℃ 영역에서 나타는 큰 피크는 PtII에서 Pt0 금속으로 환원되는 피크 또는 지지체와 강한 상호작용을 하는 Pt종의 환원피크이다[24]. 두 개의 피크의 크기를 비교해 보았을 때, 고온영역에서 나타나는 수소의 소모피크가 저온영역에서 나타나는 피크에 비해 훨씬 큰 것을 알 수 있다. 이는 θ-알루미나 지지체 위에 담지된 Pt종의 대부분이 알루미나 지지체와 강한 상호작용을 하기 때문이다. Pt/θ-Al2O3의 수소 소모 정도를 보면 Pt/θ-Al2O3 촉매와 다르게 나타나는 것을 확인할 수 있다. Sn이 첨가됨으로써 150~280 ℃ 온도 영역에서 나타나는 Pt종의 환원 피크가 고온영역으로 이동하였으며, 수소 소모의 온도의 분포영역이 넓어진 것을 확인할 수 있다. 반면, 400~600 ℃ 영역에서 관찰된 피크는 더 낮은 온도영역으로 이동하였으며, 피크의 온도분포가 넓어졌다. 수소의 환원피크의 온도 범위가 넓어짐과 동시에 환원봉우리의 최대 온도가 이동하는 이유는 증진제로 사용된 Sn이 Pt 산화종과 상호작용함을 의미한다. Sn의 증진작용에 의해 Pt 종에 화학흡착한 수소가 인접한 Sn 산화종으로 쉽게 스필오버 현상이 일어나며[24], 스필오버수소에 의해 Pt와 인접한 Sn은 300~400 ℃ 이하의 저온영역에서도 Sn0 상태로 환원된다는 보고가 되어있다. 따라서, 촉매상에서 Sn 산화종의 일부는 Pt금속과 함께 동시에 환원되며 PtSn 합금을 형성할 수 있다[25]. 또한 Sn이 첨가됨에 따라 Pt/θ-Al2O3의 H2-승온환원 곡선에서 관찰되지 않았던 피크가 600~750 ℃ 영역에서 나타나는 피크는 Pt와 상호작용하지 않고 오직 지지체와 상호작용하는 단독 Sn종의 환원피크로 여겨진다. H2-승온환원 결과와 더불어 수소 화학흡착 결과로부터 Pt/θ-Al2O3 존재하는 Sn에 의해 촉매내에 존재하는 Pt의 물리ㆍ화학적 성질이 달라진다는 것을 확인할 수 있다.
3.2.1. 전처리 조건에 따른 영향
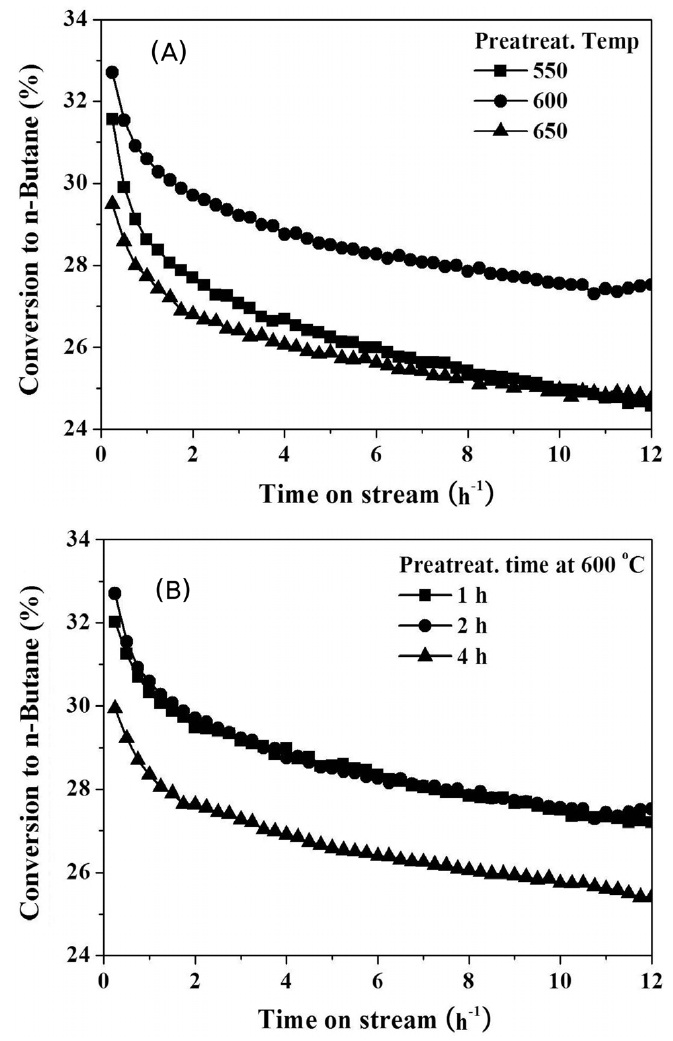
촉매의 활성과 환원 전처리 조건에 따른 탈수소화 반응에 대한 영향을 관찰하기 위해서 전처리 온도와 전처리 시간을
변수로 하여 탈수소반응에 대한 촉매성능 평가를 실시하였다(Figure 4). 실험 결과로부터 촉매의 전처리 온도의 변화에 따라 촉매의 성능이 달라지는 것을 확인할 수 있다. 모든 전처리 조건하에서 반응 시간에 따라서 촉매의 비활성화가 관찰되었다. 촉매의 주된 비활성화의 원인은 Pt 활성점에 탄소가 침적되기 때문이다. 12시간 동안 수행한 탈수소화 반응에 대한 온도 영향에 있어서 전환률 및 비활성화율에 있어 600 ℃에서 1시간 또는 2시간 동안 전처리한 조건일 경우 촉매가 높은 전환률과 수명을 보여주었다. H2-승온환원 실험에서 알 수 있듯이 촉매의 환원 온도 및 시간에 따라 형성되는 Pt 또는 Sn의 환원 정도가 다를 것이며, PtSn 합금이 형성되었을 경우 온도에 따라 서로 다른 몰비의 PtSnx 합금이 형성되기 때문이다[24]. 따라서 다양한 형태로 상호작용하는 PtSn 종이 환원 조건에 따라 다르게 형성됨으로 탈수소화 반응의 활성에 차이를 나타냈다. 탈수소화 반응의 주요 생성물인 1-부텐, 트랜스-
2-부텐, 시스-2-부텐의 선택도는 모든 전처리 조건에서 30, 37, 28%의 비슷한 값을 나타내었다. 빠른 비활성화에도 불구하고, 부텐에 대한 선택도는 약 95% 수준으로 높은 선택도를 나타냈다.
3.2.2. 반응온도에 따른 영향
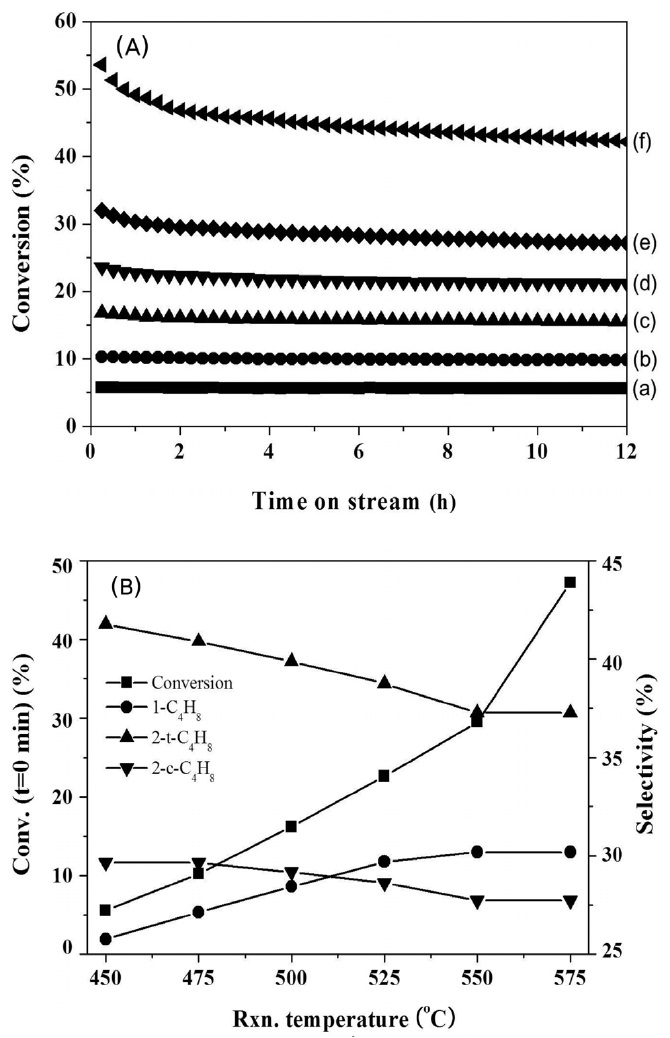
Figure 5는 탈수소반응의 반응온도 변화에 따른 부탄의 전환율 및 선택도 변화를 나타낸 것이다. 알칸화합물의 탈수소반응은 평형전환율이 존재하는 흡열반응으로 반응온도를 증가시켜줌으로써 전환률을 상승시킬 수 있다. 하지만, 반응온도가 너무 높게 되면 촉매의 산점에 의해 탄소의 침적속도와 탄화수소의 분해반응속도 또한 빨라진다. 더불어 고온에서 Pt의 소결현상에 의해 Pt의 입자크기가 커지게 됨으로써 활성점의 수가 줄어들게 되고 촉매의 활성을 감소시키는 원인이 된다. 또한 상대적으로 큰 입자크기의 Pt에서 수소화분해반응이 촉진되기 때문에 부생성물의 양이 증가된다[25,26]. 촉매의 성능은 고온조건에서 장기적인 반응안정성과 더불어 높은 선택성을 가져야 한다.
본 연구에서 수행한 450~575 ℃의 반응온도 범위에서 탈수소반응을 실시한 결과 각 온도에서 부탄의 초기 전환율은 5~55% 범위였으며, 특히 550에서 575 ℃로 반응온도가 상승함에 따라 전환률이 21% 상승하였다(Figure 5(A)). 부텐의 선택도는 95~98% 범위 내에서 변화 폭이 거의 없으나, 온도가 증감함에 따라 크레킹, 수소화 분해반응에 의한 부생성물의 양이 미량 증가하였다. Figure 5(B)에 나타낸 온도에 따른 부텐의 선택도 변화에 대한 결과로부터 온도가 상승함에 따라 1-부텐의 선택도가 상승하는 반면, 2-부텐의 선택도는 일정하게 감소
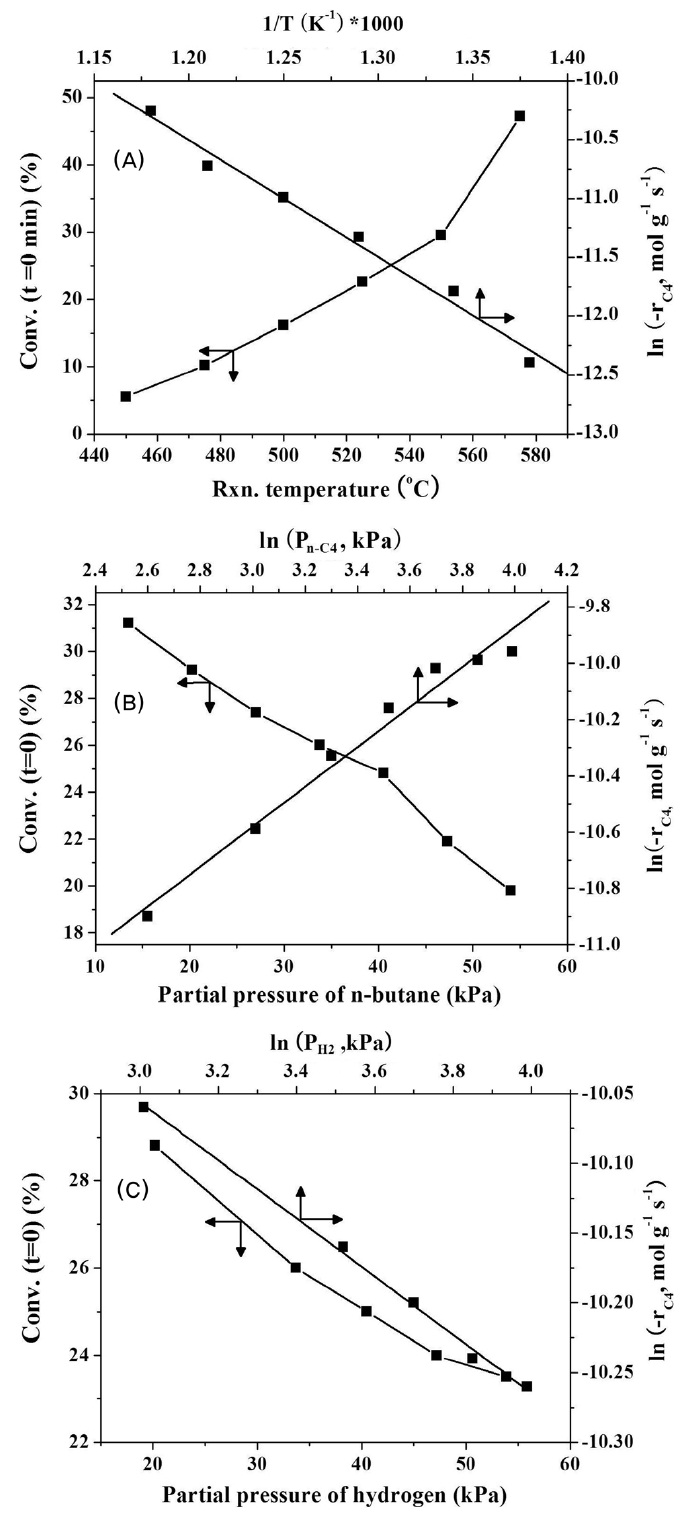
하는 것을 알 수 있다. 반응온도가 575 ℃일 경우 초기 부탄 전환율이 55%임에도 불구하고 12시간 반응 후의 부탄 전환율은 47%로 급격히 감소하였다. Figure 8(A)에는 450~575 ℃ 온도 범위 내에서 부탄의 반응속도를 측정하여 아레니우스식으로부터 활성화에너지를 계산한 것으로 부탄 탈수소화 반응에 대한 활성화에너지는 82.4 kJ mol-1이었다.
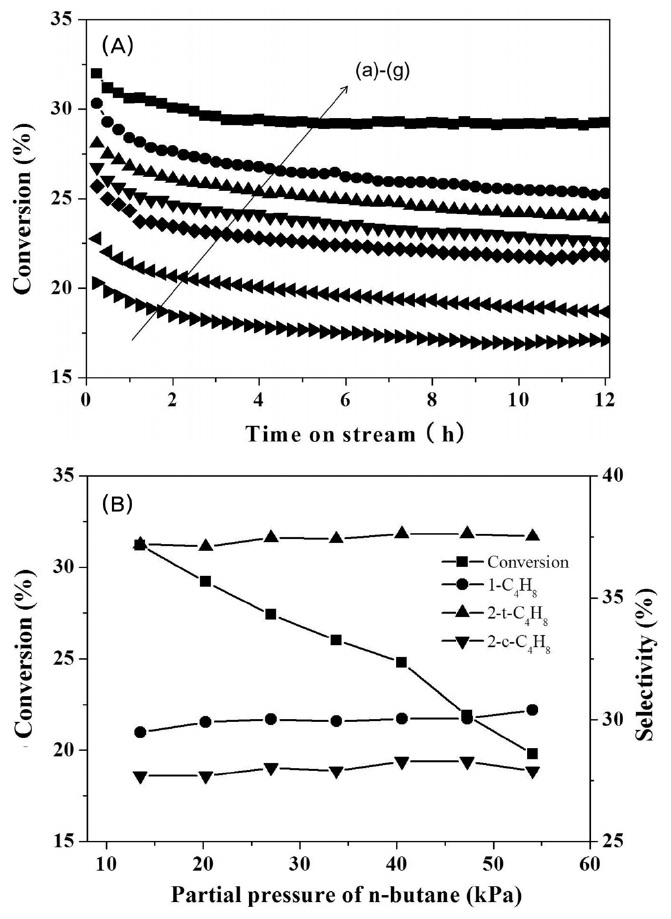
3.2.3. n-부탄의 농도에 따른 영향
Figure 6은 탈수소반응의 부탄의 부분압 변화(13.5~54.1 kPa)에 따른 부탄의 전환율 및 선택도 변화를 나타낸 것이다. 탈수소화 반응은 평행 반응으로 부피가 증가하는 반응이다. 하지만, 열역학적 평형이 존재하므로 평형 전환율이 존재하며, 다양한 변수에 의해 전환율이 달라진다. 본 연구결과에서 반응가스의 조성중 부탄의 부분압이 증가함에 따라서 부탄의 전
환율이 감소하였다. 하지만, 실제적인 반응속도는 부탄의 부분압 증가에 따라 증가한다. 하지만 전체적인 부텐의 선택도 변화는 95% 정도로 반응 온도 변화에 따른 변화 정도로 미미하였다. 부탄 전환율을 부탄의 반응속도로 계산하여 Figure 8(B)에 나타냈다. 멱함수를 이용하여 얻은 부탄의 부분압에 따른 반응차수는 0.70차로 나타났다. Pt-Sn/Al2O3 촉매상에서의 탈수소화 반응의 속도 결정단계는 C-H 결합의 해리와 표면에 생성된 부텐의 탈착이 반응속도를 결정하는 단계로 여겨진다[26]. 향 후 반응 변수의 좀 더 구체적인 변화 추세를 살피기 위하여 Lagmuir-Hinshelwood 기구를 이용한 방법이 수행되어 질 것이다.
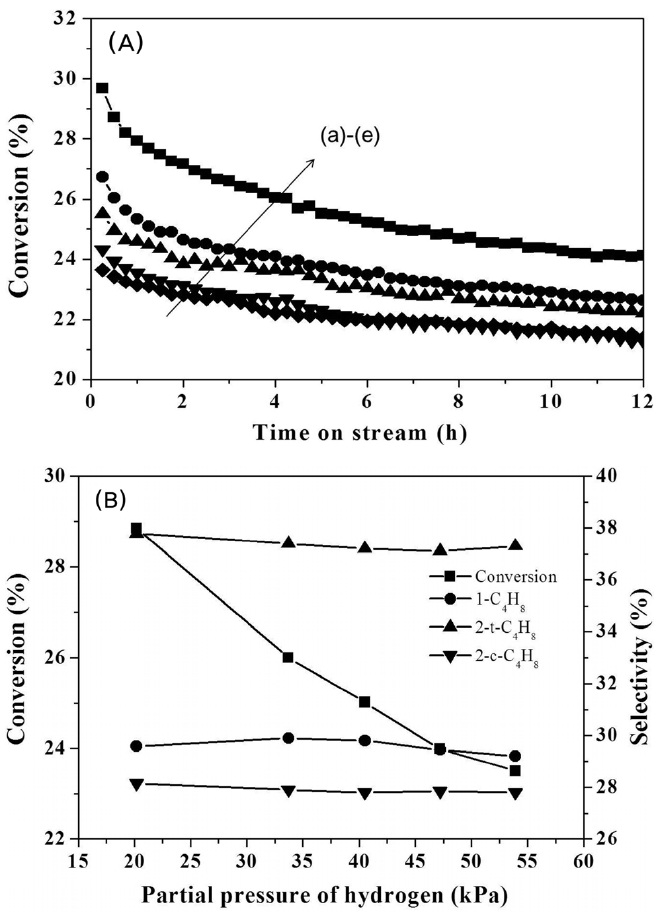
3.2.4. 수소 농도에 따른 영향
Figure 7은 탈수소반응의 수소의 부분압 변화(20.3~54.1 kPa)에 따른 부탄의 전환율 및 선택도 변화를 나타낸 것이다. 수소의 부분압 증가에 따른 부탄의 전환율의 감소는 Pt 활성점에 부텐과 수소가 경쟁 흡착함으로써 부탄의 접촉 빈도를 감소 시키기 때문이다. 또한 수소의 부분압의 증가는 촉매의 활성저하 속도를 감소시켰다. 이는 수소가 탄소침적을 방지하는 역할을 하기 때문이다. 수소 부분압 변화에 따른 부텐의 선택도 변화를 관찰한 결과 95% 정도로 반응 온도 변화 및 부탄의 부분압에 따른 변화 정도로 미미하였다. 부탄 전환율로부터 부탄의 반응속도를 계산하여 Figure 8(C)에 나타냈다. 멱함수를 이용하여 얻은 수소의 부분압에 따른 반응차수는 -0.20차로 나타났다.
함침법을 이용하여 제조된 Pt-Sn/θ-Al2O3 촉매상에서