Mesoporous anatase TiO2 nanoparticles have been synthesized by a hydrothermal method using a tri-block copolymer as a soft template. The resulting TiO2 materials have a high specific surface area of 230 m2/g, a predominant pore size of 6.8 nm and a pore volume of 0.404 mL/g. The electrochemical properties of mesoporous anatase TiO2 for lithium ion battery (LIB) anode materials have been investigated by typical coin cell tests. The initial discharge capacity of these materials is 240 mAh/g, significantly higher than the theoretical capacity (175 mAh/g) of LTO (Li4Ti5O12). Although the discharge capacity decreases with the C-rate increase, the mesoporous TiO2 is very promising for LIB anode because the surface for the Li insertion is presented significantly with mesopores. Nitrogen doping has a certain effect to control the capacity decrease by improving the electron transport in TiO2 framework.
Tri-block copolymer를 유연 템플레이트로 사용한 수열합성법에 의해 메조다공성 아나타제상 TiO2 나노입자를 합성하였다. 합성된 TiO2 재료는 230 m2/g의 매우 큰 표면적을 가졌으며 6.8 nm의 기공크기와 0.404 mL/g의 기공부피를 보였다. 리튬이 온전지 음극재로서의 가능성을 확인하기 위해 코인셀 테스트를 실시하였는데 0.1 C에서 240 mAh/g의 방전 용량을 얻었으며 이는 LTO (Li4Ti5O12)의 이론 방전 용량인 175 mAh/g 보다 훨씬 큰 값이었다. 비록 C-rate가 증가함에 따라 용량이 감소하는 모습을 보였으나 메조다공성 TiO2 재료는 리튬 이온이 침투할 수 있는 큰 표면적을 제공할 수 있다는 면에서 여전히 리튬이온전지의 음극재로서 가능성이 있다. 추가적으로 질소를 도핑하여 TiO2 framework 내의 전자 이동을 향상시킴으로써 C-rate 증가에 따른 용량 감소를 일부 제어할 수 있음을 확인하였다.
최근에 광학적 특성이 우수한 TiO2 나노입자는 광촉매[1], 염료감응형 태양전지[2] 등의 다양한 분야에서 많은 연구가 진행되고 있다. 한편 지구온난화가 이슈화됨에 따라 하이브리드 전기자동차(Hybrid Electric Vehicle, HEV) 대한 관심이 어느 때보다도 집중되고 있고 따라서 자동차의 엔진을 대체하는 리튬이온전지(Lithium Ion Battery, LIB)팩에 대한 연구가 활발하게 진행되고 있다[3,4]. 이에 무엇보다도 안전성(safety)의 확보라는 측면에서 기존 흑연(graphite) 음극을 대체할 수 있는 물질의 개발이 요구되고 있다. Table 1은 PHEV (Plug-in HEV)에 적용될 수 있는 전지 시스템을 정리하였다[5]. 표에서도 알 수 있듯이 MS-TiO2 시스템은 비록 용량이 떨어지는 단점이 있으나 흑연 음극의 고질적인 망간(Mn) 용출에 의한 안전성 이슈를 해결할 수 있어 현재 Figure 1과 같이 EnerDel/Argonne Advanced High-Power Lithium-Ion Battery (MS-TiO2 system)가 토요타 Prius에 적용되는 등 개발 단계에 있다.
음극으로 사용되는 LTO는 spinel 층상 구조(Li4Ti5O12)로서 rock salt 구조(Li7Ti5O12)로 상전이가 일어나며 리튬 이온이 충전되는데 이론 용량이 1.5 V에서 175 mAh/g으로 Table 1에서 보듯이 흑연에 비해 약 절반 정도에 해당한다. 따라서 안정한 TiO2 구조를 유지하면서 용량을 증가시키려는 연구가 진행되고 있다[6,7]. TiO2 다형체(아나타제, 루타일, TiO2(B))의 경우 이론 용량이 335 mAh/g으로 흑연의 용량보다도 큰 값을 가지지만 조밀한 구조 내로 리튬 이온이 침투하는데 속도론적 제약이 존재한다[8]. 이에 메조다공성 아나타제(anatase) 및 루타
[Table 1.] Selected lithium-ion battery systems for PHEV[5]
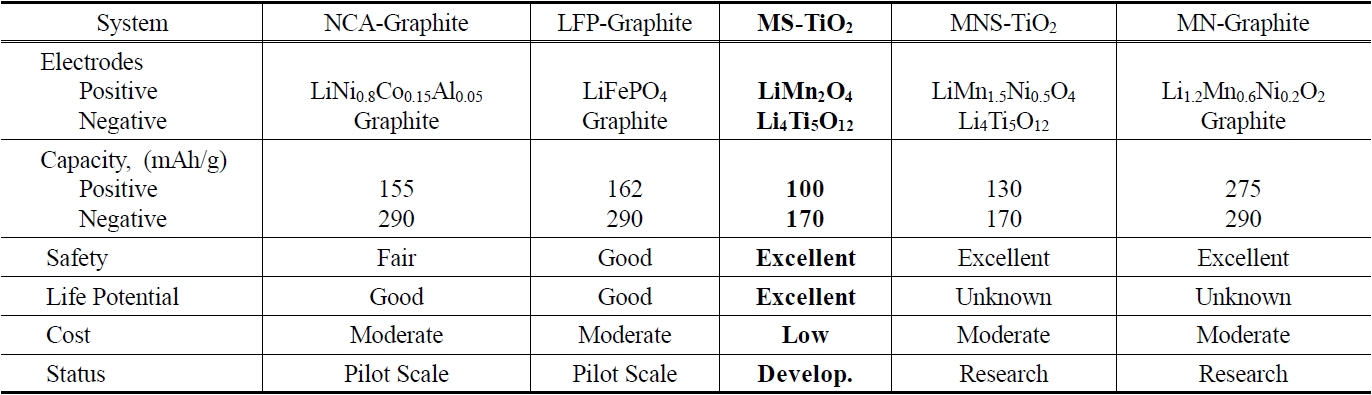
Selected lithium-ion battery systems for PHEV[5]
일(rutile) 나노입자를 합성하여 리튬 이온의 침투가 가능한 표면적을 증가시켜 용량을 향상시킬 수 있음이 보고되어 있다[6,7]. 또한 도핑을 통하여 TiO2 구조 내의 전자 이동을 향상시켜 C-rate 특성을 향상시킬 수 있다[9].
본 연구에서는 tri-block copolymer를 템플레이트로 한 수열합성법[2]를 이용하여 표면적인 큰 메조다공성 아나타제상 TiO2 나노입자를 합성하고 이를 리튬이온전지의 음극재로 적용, 코인셀 테스트를 통해 기존 LTO (Li4Ti5O12)와 비교하여 용량이 어떻게 달라지는지를 살펴보고자 한다. 여기에 기존의 메조다공성 아나타제상을 그대로 유지하며 질소가 도핑된 TiO2 나노입자를 추가로 합성하고 도핑으로 인해 향상된 TiO2 구조 내의 전자 이동이 C-rate 특성에 미치는 영향도 고려하고자 한다.
2.1. 질소가 도핑된 메조다공성 산화티타늄 나노입자의 합성
실험에 사용된 모든 시약들은 별도의 정제과정 없이 구입된 상태로 사용되었으며 질소가 도핑된 메조다공성 산화티타늄(TiO2) 나노입자의 합성방법은 다음과 같다. 사염화티타늄(TiCl4)을 ice-water bath에서 증류수에 0.2 mol/L의 농도로 용해시킨다. 위 수용액을 90 ℃ 항온조에서 질소도핑을 위해 암모니아수를 연속적으로 교반하면서 혼합한다. 이때, 티타늄과 질소의 몰비는 Ti : N = 1 : 9가 되도록 한다. 이렇게 하여 만들어진 혼합물을 상온까지 냉각시키고 P-123 [poly-(ethylene oxide) poly-(propylene oxide) poly-(ethylene oxide) EO20-PO70-EO20]를 교반하면서 천천히 첨가한다. 추가적으로 두 시간 정도 교반 후 tetramethylammonium hydroxide (TMAOH)을 첨가하여 pH값이 약 4.0이 되도록 조절한다. TiCl4와 P-123, 물의 몰비는 TiCl4 : P-123 : H2O = 1:0.036:370였으며 마지막으로 50 ℃에서 48시간 동안 반응을 유지한다. 침전물을 원심분리기에서 두 번 증류수로 세척하고 여과한 후 80 ℃에서 overnight 건조하여 파우더를 회수한다. 회수된 파우더는 400 ℃에서 6시간 공기를 흘려주며 소성하면 아나타제 상을 형성하는데 이렇게하여 얻어진 질소가 도핑된 메조다공성 산화티타늄 시료를 NMP-TiO2 (N-doped mesoporous TiO2)로 표기하기로 한다. 대조군으로 질소가 도핑되지 않은 순수한 메조다공성 산화티타늄 나노입자는 MP-TiO2로 표기하며 합성방법은 암모니아수를 첨가하는 부분을 제외하고는 동일하다.
2.2. 질소가 도핑된 메조다공성 산화티타늄 시료의 분석
제조된 메조다공성 TiO2 나노입자의 결정구조 분석을 위해 X-ray 회절분석기(X-ray diffraction, PANalytical X’pert PRO MRD diffractometer with graphite monochromatized Cu-Kα1 radiation (λ = 15.406 nm) operated at a tube current of 25 mA and a voltage of 40 kV)를 이용하였다. 데이터는 20°에서 80°의 2 θ 범위에서 1.1×10-3 °/s의 스캔속도로 수집되었다. 시료의 기공구조 분석은 Quantachrome QUADRASORB SI 흡착 장비를 이용하여 얻어진 질소의 흡탈착 등온선(at 77 K)을 이용하였다. 분석에 앞서 시료는 200 ℃에서 2시간 동안 진공 탈가스(degassing)를 하였으며 비표면적과 평균 기공크기를 각각 BET (Brunauer-Emmett-Teller)와 BJH (Barrett-Joyner-Halenda) 방법에 의해서 결정하였다. 질소 도핑을 확인하기 위하여 X-ray 광전자 분광법(X-ray photoelectron spectroscopy, Thermo Fisher Scientific Multilab-2000 equipped with Mg Kα excitation)을 사용하였으며 탄소의 1s 피크(284.6 eV)를 기준으로 결합에너지를 산정하였다. 이 밖에 메조다공성 TiO2 나노입자의 광학 특성을 확인하기 위해 UV-vis 분광법(UV-vis diffuse reflectance spectroscopy, Varian Cary 100 UV-vis-NIR spectrophotometer equipped with an integrating sphere assembly and using BaSO4 as reference)을 이용하였다.
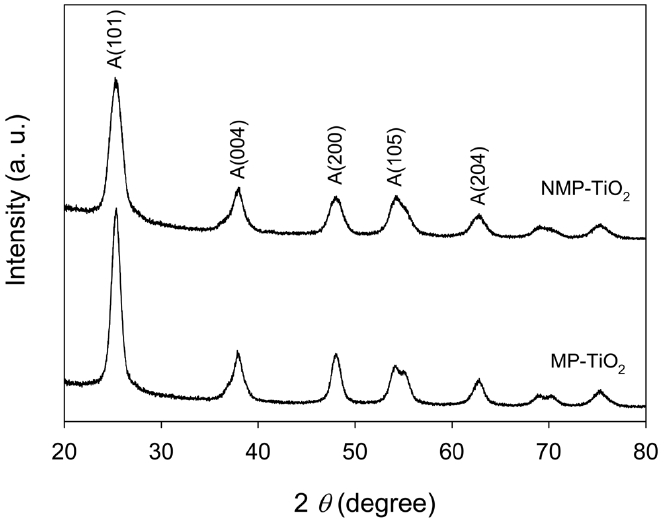
제조된 시료의 결정상과 결정립 크기를 분석하기 위해 파우더 XRD를 이용하였다. Figure 2는 MP-TiO2와 NMP-TiO2 시료의 XRD 패턴을 보여주고 있다. 모든 시료는 TiO2의 아나타제 상에 일치하는 패턴을 가지고 있으며 루타일 상이나 브루카이트(brookite) 상, 혹은 불순물로 볼 수 있는 어떠한 피크도 보이지 않음을 알 수 있다. 또한 질소 도핑 이후에도 동일하게 순수한 아나타제 상이 얻어졌다.
[Table 2.] Measured physical properties of MP-TiO2 and NMP-TiO2
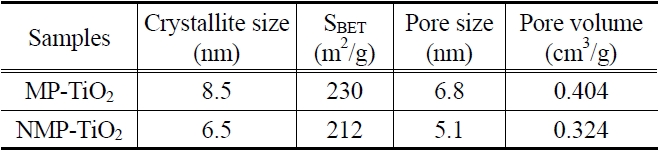
Measured physical properties of MP-TiO2 and NMP-TiO2
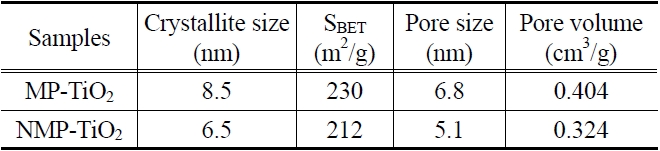
시료의 평균 결정립 크기는 아나타제(101) 회절 피크에 대하여 아래의 Debye-Scherrer 식 (1)을 적용하여 계산하였다.
L은 nm 단위의 결정립의 크기이며 K는 0.89로 동일하게 적용하였고 λ는 X-ray의 Cu Kα-radiation 파장인 0.15406 nm였다. β는 기기의 broadening을 뺀 보정된 band broadening이고 θ는 회절각이다. 결정립 값들은 다른 물리적 특성들과 함께 Table 2에 정리하였다.
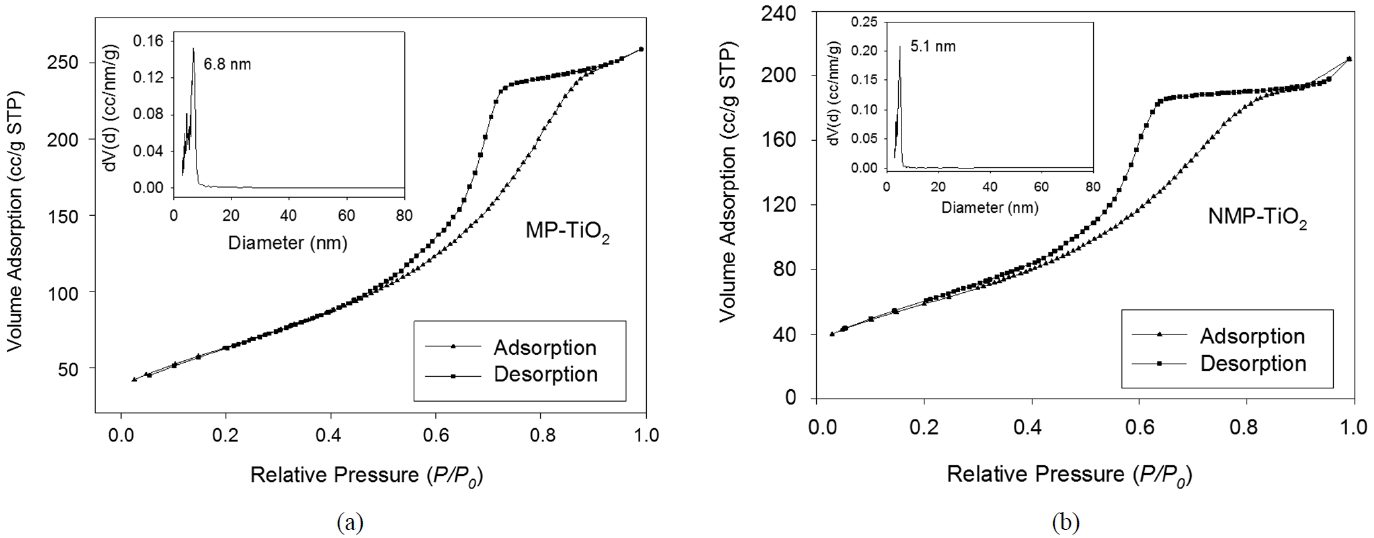
합성된 TiO2 시료의 질소 흡탈착 등온선과 BJH 기공 크기 분포 결과가 Figure 3에 나와 있다. 보여지는 바와 같이 H2 hysteresis loop를 가지는 타입 IV의 등온선은 메조다공성 구조의 특징으로 탈착 branch가 상대압력
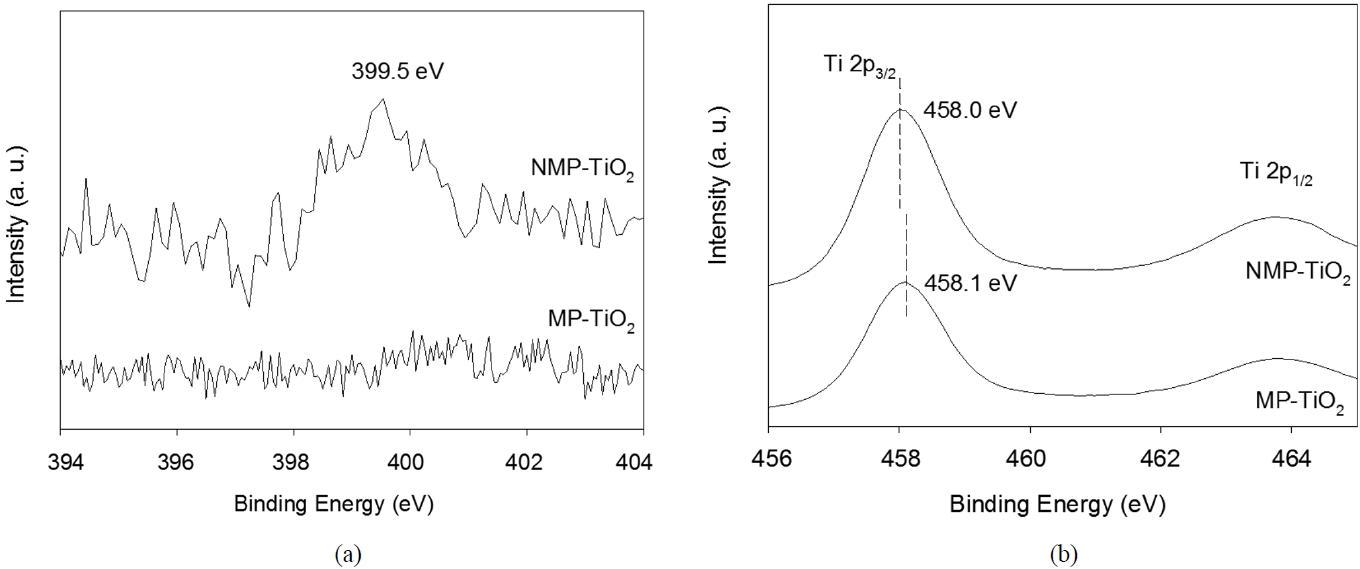
TiO2 구조 내에 도핑된 질소 원소를 확인하기 위해 XPS 분석을 진행하였다. Figure 4(a)은 MP-TiO2와 NMP-TiO2 시료의 N 1s XPS 피크가 존재할 수 있는 구간을 보여주고 있는데 NMP-TiO2의 경우에만 399.5 eV에서 피크가 존재함을 알 수 있다. 이 피크는 질소가 도핑된 TiO2 시료에 대해 396-404 eV
범위에서 전형적으로 나타나는 피크들과 상응된다[12-15]. 비록 질소가 도핑된 TiO2의 질소의 정확한 XPS 피크 위치에 대해서 논란이 계속되고 있지만 일반적으로 396-397 eV 범위에서 나타나는 피크는 TiO2의 격자 구조 내에 산소가 질소로 치환된 것을 의미한다[12]. 하지만 Figure 4(a)에는 396-397 eV 범위에 N 1s 피크가 존재하지 않으며[14,16] 대신에 399.5 eV에서 피크가 관찰되는데 이는 Ti-O-N linkage에 기인하는 것으로 판단된다[12,13]. TiO2 내에 도핑된 질소는 산소보다 전기음성도가 작으며 따라서 전자 밀도가 감소하게 된다. 따라서 399.5 eV의 N 1s 피크는 TiO2 격자 구조 내에 산소가 질소로 치환되어 Ti-O-N linkage에 의해 이동(shift)된 것으로 설명하는 것이 합리적이다. 이는 Ti 2p XPS 피크 구간(Figure 4(b)) 에 대한 관찰로 추가 설명이 가능한데 Ti 2p3/2 core level 피크가 MP-TiO2와 NMP-TiO2에 대해 각각 458.1 eV와 458.0 eV에 나타나고 있다. 질소가 도핑되면 Ti 2p의 결합에너지는 다소 감소할 것이며 Ti와 주변 음이온(anion)들과의 전기적인 상호 작용이 변하게 될 것이다. 질소가 산소보다 전기음성도가 작기 때문에 질소에서 Ti 쪽으로 전자가 이동하게 되어 Ti 주변의 전자 밀도는 증가한다[17]. 위와 같은 XPS 분석 결과는 질소가 TiO2 격자 구조 내에 성공적으로 도핑된 것을 보여준다고 할 수 있다.
3.4. UV-vis diffuse reflectance spectra
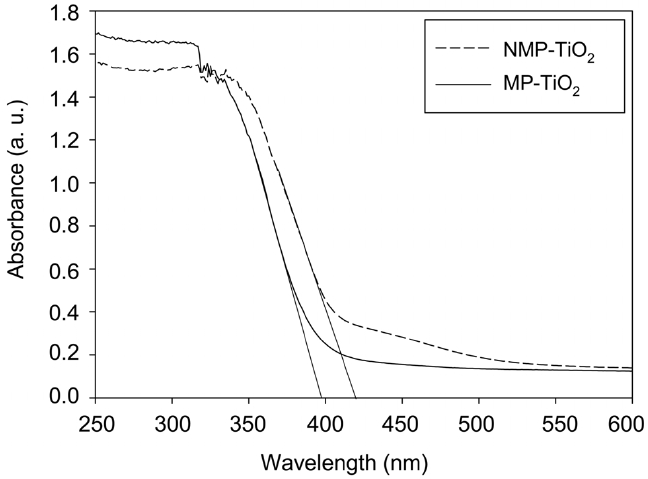
UV-visible 흡광법은 가시광선에 반응하는 TiO2 재료의 광학 성질을 연구하는 데 가장 일반적으로 채택되는 방법이다. 대부분의 연구가 질소가 도핑된 TiO2는 400-600 nm 범위에서 흡수능이 향상됨을 보여주었다[18]. Figure 5는 MP-TiO2와 NMP-TiO2 시료의 UV-vis diffuse reflectance spectra를 보여주는데
NMP-TiO2의 흡수단이 MP-TiO2와 비교하여 낮은 에너지 쪽으로 이동됨을 알 수 있다. 또한 질소 도핑 후에 400~530 nm 범위의 흡수가 매우 크게 강해짐을 보여주고 있다. XPS 결과와 마찬가지로 TiO2에 질소가 성공적으로 도핑되었음을 확인해 주고 있다. 시료의 밴드갭 에너지(band gap energy)는 아래의 식으로부터 결정될 수 있는데[19],
여기서 Eg는 밴드갭 에너지(eV), λg는 스펙트럼의 흡수단의 파장(nm)을 의미한다. MP-TiO2와 NMP-TiO2 시료의 밴드갭 흡수시작점(absorption onset)은 각각 398 nm와 420 nm이며 이는 밴드갭 에너지 3.12 eV와 2.95 eV에 해당한다.
코인 셀 테스트를 위해 합성된 메조다공성 TiO2를 이용하여 다음과 같이 활전극(working electrode)을 형성하였다. 유기용제인 N-Methyl-2-pyrrolidone (NMP)에 바인더 물질인 poly (vinylidene fluoride) (PVDF)을 약 2시간 정도 선분산하여 용해한다. 여기에 도전재인 super P carbon black을 투입하여 Thinky mixer(공전/자전 믹서)로 3~5분 잘 혼합하고 다시 대조군인 LTO (Li4Ti5O12) 및 합성된 MP-TiO2, NMP-TiO2 분말을 투입하여 5분정도 Thinky mixer로 혼합 및 분산을 거쳐 슬러리를 만들고 알루미늄 극판 위에 닥터블레이딩(doctor-blading)으로
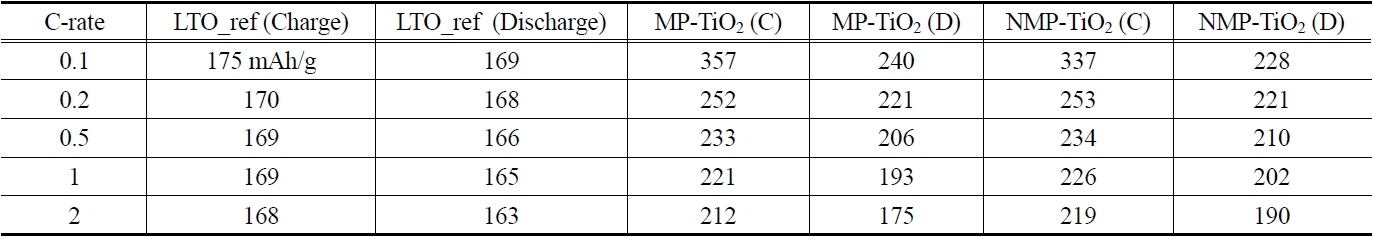
[Table 3.] Capacity vs. C-rate of of MP-TiO2 and NMP-TiO2
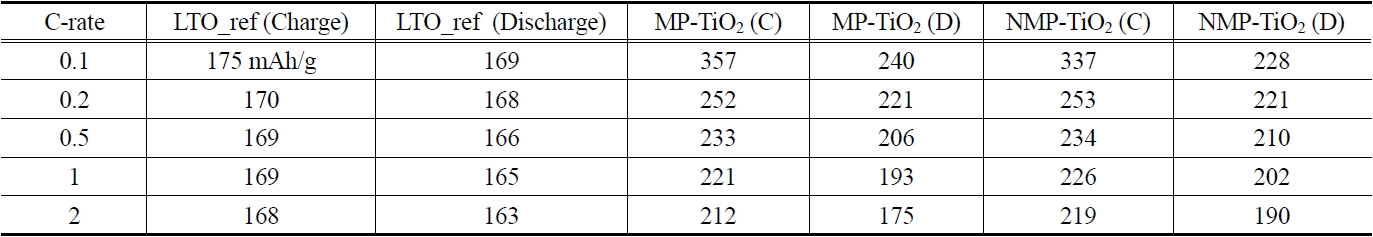
Capacity vs. C-rate of of MP-TiO2 and NMP-TiO2
코팅하여 활전극을 완성한다.
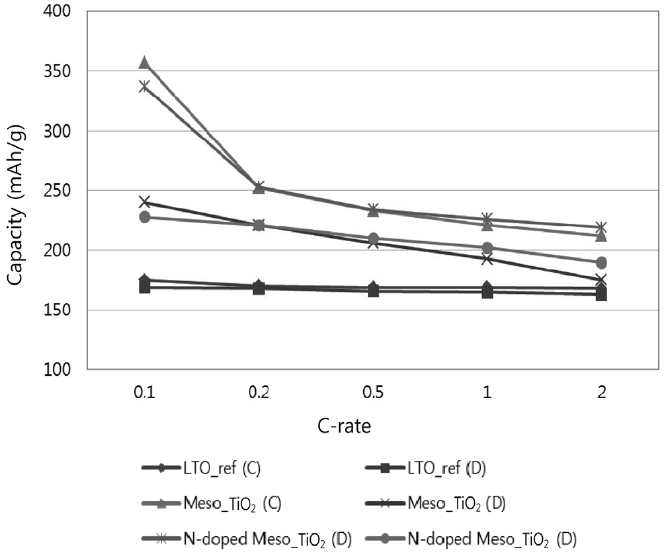
C-rate(예로 C/5는 one lithium per formula unit in 5 hours임)별로 초기 용량을 구하여 Table 3에 정리하였으며 Figure 6은 이를 보기 편하게 그래프로 보여주고 있다. 먼저 대조군인 LTO (Li4Ti5O12)의 경우 C-rate에 영향을 크게 받지 않고 이론적 방전 용량인 175 mAh/g의 95% 수준에서 용량이 얻어졌다. 반면 메조다공성 TiO2의 경우 0.1 C에서 MP-TiO2가 240 mAh/g, NMP-TiO2가 228 mAh/g로 LTO의 이론적 방전 용량인 175 mAh/g 보다 훨씬 높은 방전 용량을 얻었다. 이는 서론에서도 언급했듯이 메조다공성 구조는 표면적이 일반 TiO2 분말에 비해 매우 크고 비록 층상구조를 가지는 LTO 보다 리튬 이온의 아나타제상 TiO2로의 침투가 느리지만 침투 표면적의 증가가 이를 넘어서서 최종 용량의 증가를 가져오는 것으로 판단된다. 다만 C-rate가 증가할수록 이러한 효과가 많이 감소하는데 이는 메조기공 내 리튬 이온의 확산에 더 많은 저항이 걸리기 때문이다. 반면 질소 도핑이 TiO2 구조 내의 전자 이동을 향상시켜 C-rate 증가에 따른 용량의 감소를 일부 제어해 줄 수 있음을 확인하였다.
이 코인셀 테스트는 활전극의 제작 과정의 최적화가 이루어지지 않은 초기 결과이며 기공의 크기와 부피를 제어하여 메조다공성 TiO2의 음극으로서의 용량을 향상시키고 C-rate에 따른 용량의 감소 문제를 해결하려는 노력과 최종 사이클(cycle) 테스트까지 지속적인 연구가 필요하다.
Tri-block copolymer를 유연 템플레이트로 사용한 수열합성법를 이용하여 메조다공성 아나타제상 TiO2 나노입자를 합성하였으며 여기에 아나타제상을 유지하며 질소를 성공적으로 도핑하였다. 메조다공성 구조는 리튬 이온이 침투할 수 있는 큰 표면적을 제공할 수 있는데 비록 코인셀 초기 테스트 결과이지만 0.1 C에서 기존 LTO (Li4Ti5O12)의 이론적 방전 용량인 175 mAh/g 보다 훨씬 높은 240 mAh/g의 용량을 얻었다. 다만 C-rate가 증가할수록 기공 내 리튬 이온의 확산에 대한 저항이 커지기 때문에 용량이 C-rate 증가에 따라 감소하는 모습을 보였다. 질소 도핑이 이러한 용량의 감소를 일부 제어할 수 있음을 또한 확인하였다.
![Selected lithium-ion battery systems for PHEV[5]](http://oak.go.kr/repository/journal/11690/CJGSB2_2012_v18n2_177_t001.jpg)