분말활성탄과 제올라이트가 담지된 폴리우레탄 담체를 충진한 파일롯 규모의 바이오필터를 이용하여 암모니아와 황화수소의 처리 성능을 평가하였다. 약 10개월간 하수처리장 슬러지 농축조에서 발생하는 악취를 대상으로 바이오필터 유입 암모니아 농도는 0.1~1.5 ppmv, 황화수소 농도는 2~20 ppmv 범위에서 운전되었다. 바이오필터의 공탑체류시간 3.6~5초 범위에서 초기 순응기간을 제외하고는 거의 모든 경우 100%에 가까운 악취 제거율을 보여주었다. 바이오필터에서의 기체흐름에 의한 압력손실도 매우 낮아 10개월 동안 최대 31 mm H2O 정도의 차압이 발생하였다. 이것은 본 연구에 이용된 바이오필터의 막힘이나 담체의 압착 현상이 거의 일어나지 않아 장기간의 운전에도 안정성을 확인할 수 있었다. 담체에 부착하여 서식하는 미생물군집은 바이오필터의 처리 성능에 중요한 영향을 미치는데 특히 암모니아나 황화수소를 제거하기 위한 암모니아 산화균과 황산화균의 분포가 중요하다. FISH (Fluorescence in Situ Hybridization) 방법으로 확인한 결과 질산화를 주관하는 암모니아 산화균인
각종 환경기초시설 및 산업시설에서 발생하는 악취와 휘발성 유기화합물(VOC) 등은 심각한 사회문제로 인식되고 있으며, 특히 국민들이 인체에 유해한 악취 등의 대기오염물질에 대해서는 높은 관심도를 보이고 있다. 환경기초시설이나 산업시설이 주거지역과 근접한 경우가 많아짐에 따라 발생하는 악취는 인접지역의 주요 민원이 되고 있다. 따라서 정부는 1995년 대기환경보전법상에 “휘발성 유기화합물질 규제”규정을 신설하였고 1996년에 시화, 반월, 여천 지역 등을, 1997년에는 울산, 미포, 온산 지역 등을 “환경오염으로 인한 특별 대책지역”으로 지정하였다. 또한 1999년 대기환경보전법상에 “악취물질에 대한 규제” 규정을 신설하였고 현재는 대기환경보전법에 따른 대기오염 관리차원에서 관리하고 있던 악취를 그 특성에 맞도록 체계적으로 관리하기 위해 “악취방지법”을 2005년 2월부터 시행함으로써 보다 체계적인 악취관리 제도를 정립하게 되었다. 주요 내용으로는 지정악취물질을 암모니아, 메틸멀캅탄, 황화수소 등 기존의 8개 항목에서 2010년 까지 22개 항목으로 점차 확대하였으며, 동 물질에 대한 배출 허용기준 및 시ㆍ도지사가 조례로 정할 수 있는 엄격한 배출 허용기준 설정범위를 공업지역과 기타지역으로 구분하여 구체적으로 정하도록 하였다. 또한 악취를 유발하는 악취배출 시설을 석유정제품 제조시설, 기초 유기화합물 제조시설, 축산시설, 도축ㆍ고기 가공 및 저장처리시설 등 48개 시설로 정하였다.
이같이 악취관련 법규의 강화와 더불어 악취 및 VOC 처리를 위한 다양한 탈취기술의 개발이 진행되었다. 현재 많이 이용되는 탈취기술은 활성탄 흡착법, 약액 세정법, 오존 산화법, 연소탈취(소각)법 등의 물리ㆍ화학적인 처리방법과 바이오필터, 토양미생물 처리법, 포기조 탈취법 등의 생물학적 처리방법이 주로 이용되고 있다[1-4]. 바이오필터 기술은 경제적이고 효과적인 처리효율 및 2차 오염이 발생되지 않는 이유 등으로 인해 그 사용이 점차로 증가되고 있는 추세이다[4]. 바이오필터의 안정적인 처리와 경제적인 운전을 위해서는 담체의 선정이 무엇보다 중요하다. 초기에 사용된 바이오필터용 유기 담체는 담체 자체의 분해 및 압밀, 편류현상 등이 문제로 지적되었다[2]. 또한 세라믹 담체와 같은 무기 담체는 다량의 용수 소비, 생물막 형성에 필요한 영양원의 공급, 폐수 발생, 담체 자체의 하중 등이 문제가 되었다. 따라서 최근에는 단위 무게 당 미생물의 활성이 높고 유지관리가 용이하며 수분 함유율이 높은 바이오필터용 담체의 개발을 위해 합성물질을 미생물의 특성에 맞게 물리, 화학적으로 가공한 다공성 발포 고분자 담체가 많이 이용되고 있다[3]. 하지만 기존의 발포성 고분자 담체는 그 자체로는 비표면적이 크지 않고 흡착능력이 거의 없어 오염물 부하가 과도하게 유입될 때 완충작용을 거의하지 못하는 단점이 있다. 또한 암모니아나 황화수소 등을 제거하는 암모니아 산화균이나 황산화균은 성장속도가 느린 독립영양미생물로서 담체에 신속히 부착하여 성장하는 것이 용이하지 않는 단점이 있다. 이러한 단점을 보완하고자 고분자 스폰지 또는 인공물에 점토성 물질을 코팅하거나 미분 활성탄 등을 코팅하는 기술이 개발되었으나 오히려 접착제 등에 의해 비표면적이 축소되거나 활성탄 분말 등이 떨어져 나가는 문제점이 발생하기도 하였다. 따라서 현재까지의 문제점들을 보완하기 위해 활성탄 분말이나 제올라이트 분말 등이 혼합 발포된 합성고분자 담체의 개발이 활발히 진행 중에 있다[5,6]. 이와 같은 활성탄, 제올라이트 혼합 발포 고분자 담체는 합성 고분자 발포 담체의 장점과 활성탄에 의한 높은 흡착력, 제올라이트에 의한 암모니아와 같은 양이온성 악취 물질의 이온 교환에 의한 제거 효율 증가 등의 장점 등이 결합되어 종래의 합성고분자 담체의 단점을 보완한 우수한 담체로 평가받고 있다[7]. 암모니아와 황화수소는 가장 대표적인 악취물질로서 모든 하수처리장에서 발생하는 성분으로서 대부분 이 물질을 표준물질로 이용하여 악취제거 성능을 평가한다[8-11]. 암모니아는 단백질 등의 가수분해에 의해 많이 발생하고, 황화수소는 황산화물이 혐기 조건에서 환원에 의해 주로 발생된다. Ho, et al.[12]은 Denaturing Gradient Gel Electrophoresis (DGGE) 기법을 이용하여 바이오필터에 분포하는 미생물 군집의 변화를 조사하였으나 접종한 미생물의 분포만 확인하여 다른 악취제거 미생물의 분포는 확인하지 못하였다.
본 연구에서는 바이오필터용 담체로써 분말활성탄 및 제올라이트를 폴리우레탄과 혼합하여 동시 발포한 다공성 폴리우레탄 담체를 파일롯 규모의 바이오필터에 적용하여 하수처리장 농축조에서 발생되는 악취의 처리 성능을 조사하였다. 또한 담체에 분포하는 악취제거에 관여하는 미생물의 종류와 분포를 조사하고자 하였다. 본 연구에서는 담체에 부착하여 분포하며 악취 제거에 관여하는 미생물들의 군집구조를 FISH (Fluorescence
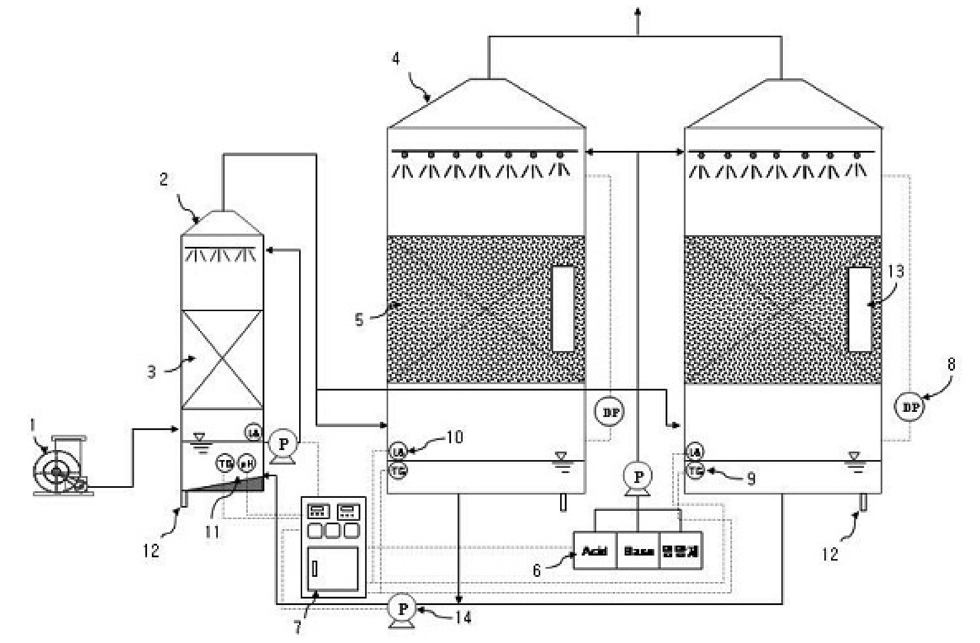
강원도 C시 하수종말처리장 내 슬러지 농축조에서 발생하는 악취제거를 위해 폴리우레탄을 기저물질로 하여 분말활성탄 및 제올라이트 동시 발포한 담체로 충진된 파일롯 규모의 바이오필터를 설치 운전하여 처리성능을 조사하였다. 바이오필터는 폭과 길이 각 1 m, 높이 2 m 크기 2개로 구성되어 있고 담체층 높이는 60 cm이다. 유입 가스의 풍량은 하수종말처리시설 기계설비공사 설계지침에 기준하여 산정하였다[12]. 그 기준에 의하여 풍량은 수면적 부하와 안전계수를 적용하여 15~20 m3/min으로 운전하였고 체류시간을 길게 할 경우에는 거기에 맞추어 유량을 감소시켜 운전하였다. 바이오필터는 악취 가스를 흡입하여 처리 시설로 운반하는 송풍기, 가습 및 세정을 위한 전처리 시설(scrubber), 호기성 탈취 미생물이 담체에 부착성장하면서 유입되는 악취가스를 제거하는 탈취설비, 배출설비, 현장제어반, 약품설비 등으로 구성하였다(Figure 1). 악취가 포함된 가스는 먼저 상향류로 scrubber에 도입되어 가스에 포함된 분진을 제거하고 수분을 공급하여 습도를 유지하
도록 한다. 악취가 함유된 가스는 담체가 충진된 바이오필터에 상향류로 유입되어 처리되며 배출된다. 이때 바이오필터에서 담체에 부착된 미생물의 성장과 활성 유지를 위해 바이오필터 바닥의 수용액을 담체층으로 살수하며 수용액의 pH는 pH제어장치를 이용하여 7 ± 0.5로 유지하였다. 바이오필터의 차압은 마노미터를 이용하여 측정하였다.
실험에 사용한 담체(EcocarboliteTM)는 분말활성탄(야자계, 중량기준 4%, 300 mesh 이하) 및 제올라이트(50~100 μm, 중량기준 2~3%)와 폴리우레탄을 동시에 발포시켜 제조한 것으로써 크기는 1.5 cm × 1.5 cm × 1.5 cm이고 밀도는 0.1 g/cm3 가량의 경량 담체이며 비표면적은 500~600 m2/g, 공극률은 95%에 달하였다(Figure 2). 담체에 담지된 활성탄 및 제올라이트에 의해 담체에 물리적 흡착과 암모니아와 같은 악취 물질의 이온교환 능력도 가지고 있어 단순히 미생물의 부착 표면적을 제공하는 일반 담체와는 차별된다[7]. 즉, 암모니움 등 이온성 물질이 과다하게 유입되는 경우 본 담체는 생물학적 처리만을 기대하는 일반 담체와는 달리 본 담체는 생물학적 처
리와 더불어 제올라이트에서 이를 우선적으로 흡착하는 방법으로 완충역할을 할 수 있어 부하변동에 능동적으로 대처할 수 있는 차별성이 있다. 미생물 접종을 위해 하수처리장 포기조 미생물을 채취하여 눈금 1 mm 체로 거른 뒤 바이오필터 담체층에 주입하여 접종하였다.
바이오필터의 담체층 부피를 기준으로 한 공탑체류시간(EBRT)은 운전 초기 34일 동안은 5초로 운전하였으며(기간 1), 한계 공탑체류시간 실험을 위해 35일부터 59일까지는 3.6초로 운전하였다(기간 2). 기간 3(60~240일)에서는 11월로 접어들면서 외부 온도의 하강으로 인한 바이오필터의 안정적인 운전을 위해 공탑체류시간을 다시 4.2초로 증가시켜 운전을 수행하였다. 241~300일의 60일 동안은 다시 공탑체류시간을 3.6초로 짧게 운전하여 외기 온도 및 유입 악취가스의 부하 증가에 따른 바이오필터의 처리 성능을 검토하였다(기간 4). 대표적인 악취가스로는 황화수소와 암모니아를 선택하여 이들의 처리 특성을 분석하였다.
하수처리장 농축조에 발생되는 악취분석을 위해 바이오필터 전처리 시설 앞단과 탈취시설을 거쳐 처리된 가스가 배출되는 곳에 샘플링 port를 설치하여 유입 및 유출 가스를 분석하였다. 암모니아는 붕산용액을 포집용액으로 하여 시료를 채취한 후 페놀펜타시아노니트로실 철(III)산 나트륨 용액을 가하여 섞은 후 차아염소산나트륨 용액을 혼합하여 25~30 ℃에서 1시간 방치 후 분광광도계(Shimadzu 1201, Japan)를 이용하여 640 nm에서 흡광도를 측정하였다. 황 화합물 분석을 위해서는 표준과학연구원에서 ppm 농도로 제조된 표준가스를 사용하였다. 분석은 gas chromatography (HP6890, USA)에 의해 수
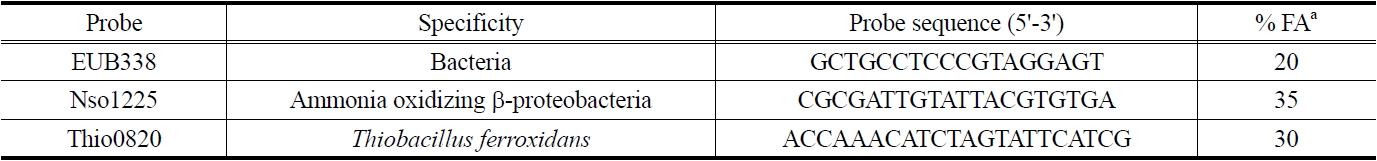
[Table 1.] 16S and 23S rRNA-targeted oligonucleotide probes
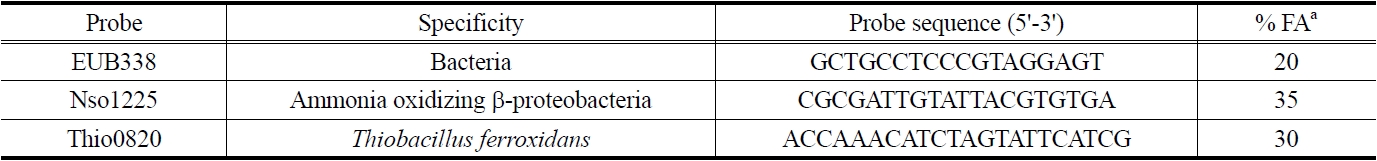
16S and 23S rRNA-targeted oligonucleotide probes
행되었으며, 불꽃광검출기(FPD: Flame Photometric Detector)로 분석하였다.
2.3. FISH방법에 의한 담체에 부착된 미생물의 관찰
파일롯 규모의 바이오필터 운전 기간 동안 바이오필터 담체에 주로 존재하는 미생물의 종류, 분포 등을 관찰하기 위하여 분자생물학적 기술인 rRNA oligonucleotide probe와 결합된 FISH (Fluorescence
3.1. 파일롯 규모의 바이오필터에 의한 황화수소 및 암모니아 제거
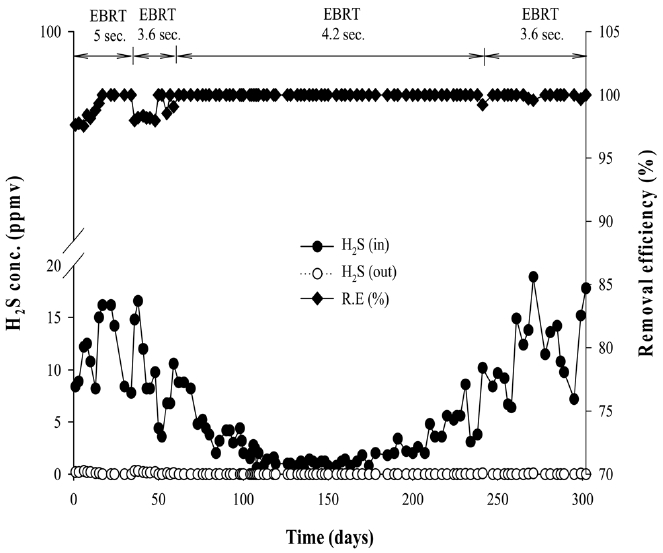
하수처리장 농축조에서 발생하는 악취를 처리하는 파일롯 플랜트의 운전은 9월부터 이듬해 6월에 걸쳐 총 10개월간 수행하였다. Figure 3은 10개월 동안의 바이오필터의 황화수소 처리 성능을 보여주고 있다. 운전 초기인 기간 1은 9월로 평균 주간 외기 온도는 26.9 ℃를 보였으며 실험방법에 설명한 바와 같이 공탑체류시간은 5초로 유지한 채로 운전하였다. 이때 유입 황화수소 평균 농도는 11.9 ppmv, 평균 유출 농도는 0.11 ppmv로 평균 제거율이 98.7%를 나타내었다. 초기 미생물 순응 기간 약 20여 일 동안 황화수소 제거율은 96%부터 서서히 증가하여 100%에 이르렀다. 순응기간 이후로는 유출부에서 황화수소는 거의 검출되지 않았으며 기간 1의 잔여기간 동안 100%에 가까운 처리효율을 나타내었다.
공탑체류시간을 3.6초로 낮추어 운전한 기간 2의 경우 체류시간을 줄인 후 5일 동안 유출되는 황화수소의 농도가 0.3 ppmv
까지 나타났으며 제거율은 97% 정도로 유지되었다. 그러나 그 뒤로 다시 제거율이 안정되어 100%의 제거효율을 보였다.
기간 3에서는 평균 주간 외기온도가 10 ℃ 이하로 낮아졌으며 바이오필터의 보온설비(단열 및 가열장치)를 설치하여 유입 온도를 최소 15 ℃가 되도록 유지하였다. 그럼에도 불구하고 유입가스의 낮은 온도로 인한 미생물의 활성저하를 고려하여 공탑체류시간을 4.2초로 증가시켜주었다. 기간 3의 초기 한달간 유입 황화수소의 평균 농도는 5.3 ppmv를 나타내었다. 동절기에 해당하는 운전 100~200일 기간 동안 농축조에서 발생하는 황화수소의 농도는 2 ppmv 미만으로 매우 낮아졌고 이는 낮아진 수온과 기온으로 인해 하수처리장에서 황환원 미생물의 활성이 낮아진 결과로 보이며 다른 처리장에서도 하절기에 비해 동절기에 황화수소의 발생 농도가 낮게 나타난다.
기간 4에서는 주간의 평균 외기 온도가 18 ℃를 보여 체류 시간을 3.6초로 다시 감소시켜 운전하였다. 기간 4 동안 슬러지 농축조에서 발생되는 황화수의 평균 농도는 11.7 ppmv로 발생되어 온도 상승에 따라 악취 가스의 발생량이 증가하였다. 그럼에도 불구하고 장기간 안정된 운전 및 온도 상승에 따른 탈취 미생물들의 활성 증가로 기간 4에서 바이오필터를 통과한 황화수소는 대부분 처리되어 100%에 가까운 처리 효율을 보였다.
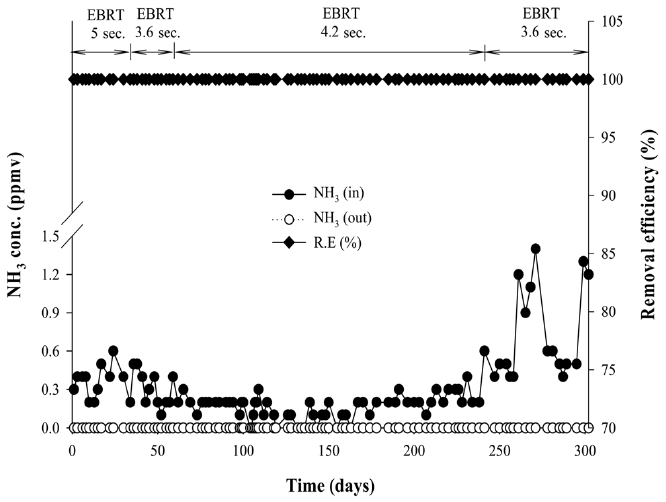
Figure 4는 같은 기간 바이오필터에서의 암모니아 처리 성능을 보여주고 있다. 공탑체류시간을 5초로 유지한 기간 1은 초기 미생물 순응 기간이었으며 이때 유입 가스의 평균 암모니아
농도는 약 0.4 ppmv로 운전되었다. 이때 유출되는 암모니아는 거의 검출되지 않아 제거율이 100%에 이르렀으며 황화수소와는 달리 처음부터 높은 제거율을 보였다. 그 이유는 슬러지 농축조에는 암모니아 농도가 매우 낮게 유지되었고 이는 하수처리 과정에서 유입수에 포함된 암모니아의 대부분이 질산화 되거나 탈질된 때문으로 판단된다. 따라서 이미 슬러지 자체에 상당량의 질산화 미생물이 분포하고 있어 별도의 순응기간 없이 바로 높은 제거율을 나타낸 것으로 보인다. 기간 1~4 전 구간을 통해서 기상의 암모니아의 제거율이 거의 100%에 달하는 것으로도 확인할 수 있다.
Chung, et al.[11]의 연구에서 고농도 암모니아(100 ppmv)와 황화수소(30 ppmv)의 경우 체류시간이 60초 이상 유지되어야 적절히 제거된다고 보고된 경우도 있다. Malhautier, et al.[8]은 체류시간 20초 정도에서 암모니아 농도 70~140 mg/m3에서 70% 이상의 제거율을 보였고, 황화수소 농도 70~280 mg/m3에서 90% 이상의 제거율을 보였다. 이들이 사용한 농도 범위가 본 연구에 이용된 농도에 비해서는 높아서 긴 체류시간에도 불구하고 제거율이 그다지 높지 않은 것으로 보인다.
기간 3에서 동절기에 접어들면서 기온은 낮아졌지만 유입되는 암모니아의 농도가 더욱 낮아졌고 공탑체류시간도 4.2초로 짧아지고 바이오필터에 보온설비를 하면서 암모니아 제거율은 여전히 100%로 나타났다. 기간 4에서 유입가스의 암모니아가 때에 따라 1 ppmv 이상 높아지기도 했지만 제거율은 100%를 유지하여 안정된 처리성능을 보였다.
이와 같은 황화수소와 암모니아의 안정된 처리효율은 바이오필터 내부에 충진된 담체가 탈취 미생물들의 성장이 유리한 생육환경 즉, 다공성의 넓은 비표면적을 가지며, 공기 전달 효율이 우수하고 무엇보다 악취 가스 유입 시 활성탄 및 제올라이트에 의한 흡착 및 탈취 미생물들에 의한 생분해 과정이 연속적으로 이루어짐으로써, 빈부하 또는 과부하시에도 안정적인 처리가 이루어지기 때문이라 사료된다.
3.2. 파일롯 규모의 바이오필터 운전에 따른 차압 변화
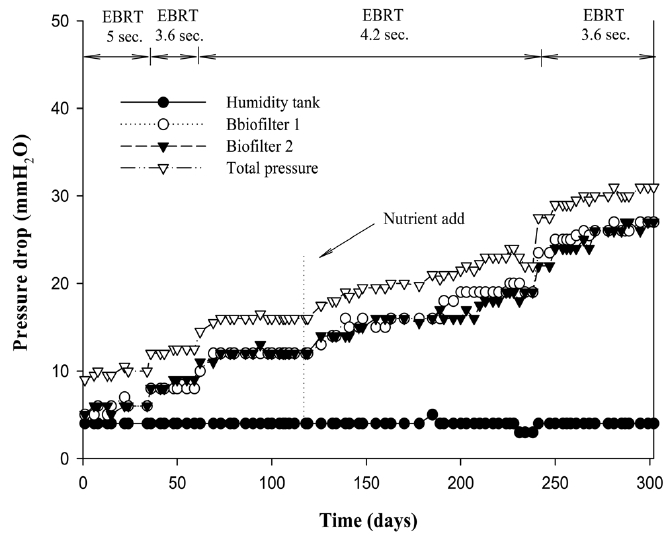
바이오필터 운전에 있어서 필터 충진층 간의 차압은 운전에 매우 중요한 영향을 미치게 된다. 차압이 생기는 이유는 바이오필터 층간에 미생물의 과잉번식에 의한 것과, 유입 기체에 포함된 분진 등 입자성 물질의 축적, 그리고 담체의 물리, 화학적 변화에 기인한 압착 등이 주요 원인이다. 운전시간이 경과하면서 서서히 차압이 증가하고 그것으로 인해 바이오필터 통과 기체 유량이 감소하거나 한쪽으로만 통과하는 채널링 현상이 발생할 수 있어 처리 성능을 저하시키는 주요 원인이 된다. 따라서 안정된 바이오필터 운전과 성능을 위해서는 급격한 차압 증가는 바람직하지 않다. 따라서 본 연구에서는 바이오필터를 운전하는 300일 동안의 차압 변화를 관찰하고 이로부터 바이오필터와 담체의 안정성을 검토하였다.
Figure 5는 바이오필터 운전기간 동안 가습탱크와 바이오필터 담체층의 차압 변화를 나타내었다. 가습탱크의 차압은 운전기간 내내 4 mm H2O 이내를 나타내었으며 공탑체류시간이 5초인 기간 1에서는 병렬로 구성된 바이오필터 1과 2의 차압은 약간의 차이를 보였으나 평균 5~6 mm H2O를 나타내 총 차압(가습탱크 + 바이오필터 담체층 차압)은 10 mm H2O를 보였다. 유입풍량을 15 m3/min에서 20 m3/min으로 증가시켜 공탑체류시간을 3.6초로 짧게 유지한 기간 2에서는 바이오필터에 차압이 9 mm H2O까지 상승하여 가습탱크의 차압을 포함할 경우 총 차압은 12.5 mm H2O이었다. 공탑체류시간을 4.2초로 늘려 운전한 기간 3에서는 탈취 미생물들이 점차 증식함에 따라 총 차압이 17.5 mm H2O까지 상승하였으며 영양제를 보충한 126일 후부터는 241일까지 총 차압이 약 25 mm H2O까지 증가하였다. 체류시간을 다시 3.6초로 낮춘 기간 4에서 일시적으로 빠르게 차입이 증가하여 최종적으로 31 mm H2O까지 증가하였다. 즉 유입 풍량의 증가에 따른 공탑체류시간의 감소와 인산염 등 미네랄 성분이 포함된 영양제 보충 등으로 인한 미생물량의 증가는 압력 상승을 가져왔으나 운전기간 300일 동안 그 변화는 35 mm H2O으로써 담체로 충진된 파일롯 규모의 악취제거 바이오필터의 운전 결과 장기간 운전에도 압착, 미생
물 증식 등에 의한 차압변화가 비교적 낮아 안정적인 운전이 가능함을 확인하였다.
3.3. 파일롯 규모의 악취제거용 바이오필터 내 미생물 군집구조 분석
C시 하수종말처리장 내 농축조에서 발생되는 악취제거를 위한 파일롯 규모의 바이오필터를 운전하는 동안 바이오필터 담체 높이와 운전기간에 따른 미생물의 분포를 분자생물학적 기법인 Fluorescence
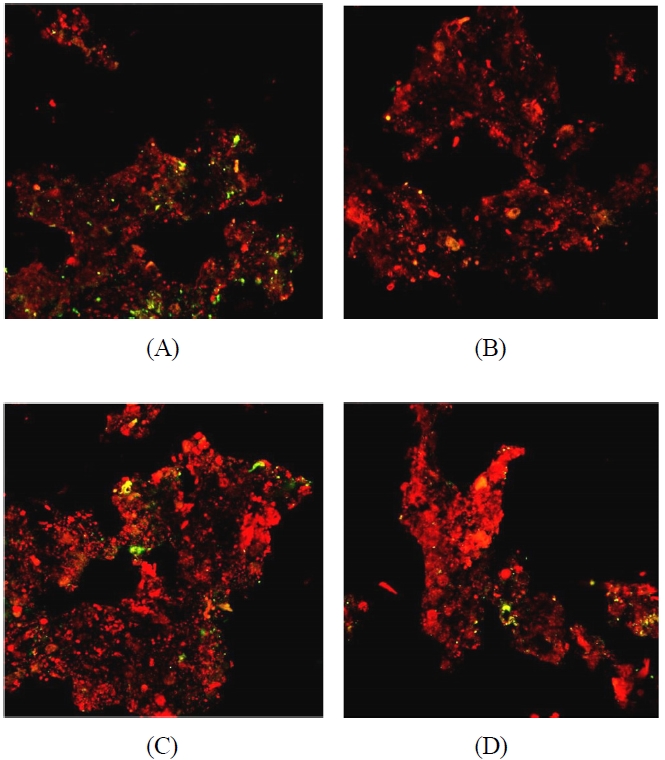
Figure 6은 바이오필터 담체에 분포하는 대표적인 질산화 미생물인 암모니아 산화균(Nso1225)을 조사한 FISH 결과이다. (A)와 (B)는 바이오필터 운전 30일 후, (C)와 (D)는 운전 150일 후에 채취한 담체 시료이다. 그리고 (A)와 (C)는 바이오
필터 담체층 상부에서 10 cm 지점에서, (C)와 (D)는 바이오필터 담체층 하부에서 10 cm 지점에서 각각 채취한 담체 시료를 이용한 것이다.
하향류식 바이오필터에서 악취가스가 유입되는 담체층 상부 10 cm(A)에서 probe EUB338과 결합된 전체 미생물은 담체층 상부에서 깊이 50 cm에 위치한 하부 10 cm(B)에 위치한 담체 내 미생물에 비해 33% 더 많이 존재하였으며 질산화 미생물은 상부 10 cm(A)에서 13.8%가 관찰된데 반해 하부 10 cm에서는 3.6%(B)가 관찰되어 10% 이상 더 존재함을 확인할 수 있었다. 또한 (C)와 (D)는 운전 150일 경과 후 각각 담체층 상부와 하부의 담체를 채취하여 FISH 실험을 수행한 결과이다. 운전 기간이 증가함에 따라 담체에 부착 성장하는 미생물들이 증가하고 또한 운전 120일 후에 영양제를 공급하여 운전 30일에 분석한 미생물들에 비해 EUB338 기준 전반적으로 38% 이상의 미생물이 증가됨을 관찰하였다. 하지만 질산화 미생물의 경우 운전 30일 후 관찰한 것과 비교하여 담체층 별로 약간 감소한 결과를 보였는데 이는 유입 암모니아 농도가 평균 0.2 ppmv로 황화수소에 비해 매우 낮았기 때문에 질산화 미생물의 개체수는 감소한 것으로 판단된다((C), (D)).
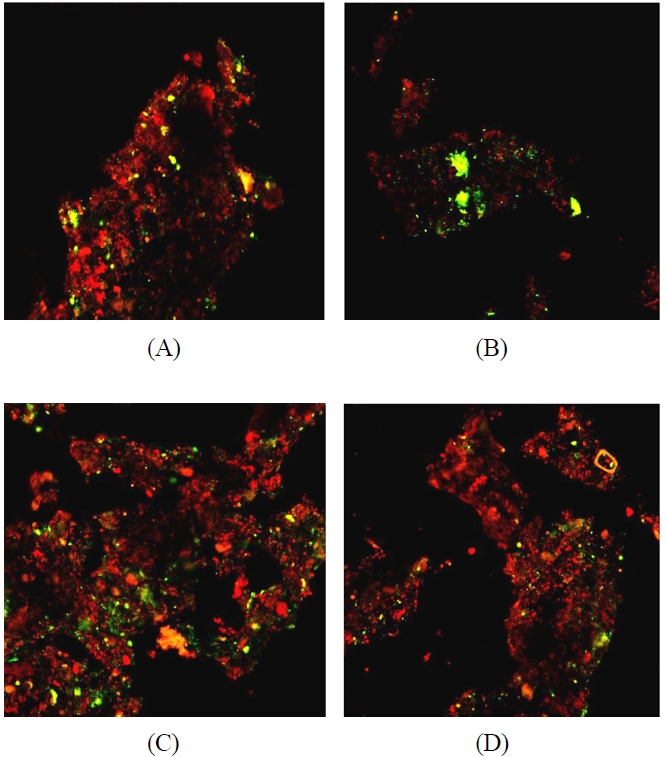
Figure 7은 바이오필터 담체에 분포하는 황산화 미생물을
조사한 FISH 결과이다. 바이오필터 운전 30일 후 황산화 미생물은 질산화 미생물의 경우와 마찬가지로 담체층 상부에서 채취한 담체에서 18.4%가 관찰된데 반해 하부 담체에서는 10.7%가 관찰되어 상부에서 더 많이 관찰되었다((A), (B)). 이는 유입되는 악취 성분들이 대부분 상부의 담체층에 부착된 미생물에 의해 제거되므로, 담체층 하부로 갈수록 미생물들이 이용할 수 있는 기질(악취)이 줄어들기 때문으로 판단된다. 반면 운전 150일 후 바이오필터 상부층에서 채취한 담체에서 전체 미생물 대비 24.8%의 황산화 미생물이 관찰되었고 하부층에서도 16.1%가 관찰되어 담체층 전반에 걸쳐 30일 운전 결과에 비해 황산화 미생물 분포가 증가한 것을 확인하였다((C), (D)). Ho 등은 DGGE 기법을 이용하여 초기에 접종한
분말활성탄과 제올라이트가 담지된 폴리우레탄 담체를 충진한 파일롯 규모의 바이오필터를 300일간 운전하며 슬러지 농축조에서 발생하는 악취를 처리한 결과 다음과 같은 결론을 도출하였다.
1) 공탑체류시간 3.6~5초의 범위에서 유입 황화수소의 농도가 2~20 ppmv에서 초기 순응기간을 제외하고는 거의 100%에 가까운 제거율을 보여주었다. 암모니아는 0.1~1.5 ppmv에서 거의 100%에 가까운 높은 제거율을 보여주었다.
2) 약 60 cm에 달하는 바이오필터 충진층 사이의 압력손실은 최종적으로 31 mm H2O로 매우 낮아 장기간의 운전에도 바이오필터의 막힘이나 담체의 압착 현상이 일어나지 않아 장치의 안정성을 확인할 수 있었다.
3) FISH 방법으로 확인한 결과 질산화를 주관하는 암모니아 산화균인