본 연구의 목적은 30 L의 촉매가 장착된 파일롯 규모의 반응 시스템에서 상업용 촉매(Co/ZrO2-Al2O3)의 PFC 분해 성능을 검증하는 것이다. 공간 속도(GHSV) 1,800 h-1의 조건에서 SF6의 농도를 증가시키면 T95가 증가하였는데 SF6의 농도가 1,000~10,000 ppm일 때 T95가 580~610 ℃ 범위로 나타났으며, 열 소각을 했을 때의 T95인 1600 ℃보다 매우 낮은 온도임을 알 수 있다. 650 ℃의 반응 온도 하에서 72시간 동안에 99% 이상의 SF6의 전환율이 유지되어 촉매의 안정성이 확보되었다. 또한 SF6 전환율을 99% 이상 유지하기 위해서는 GHSV를 2,000 h-1 이하인 조건에서 운전해야 함을 알 수 있었다. CF4의 분해 반응의 경우 T95 온도가 710 ℃이었으며, SF6의 T95 온도보다 높은 온도가 필요함을 알 수 있었다.
SF6, CF4 및 C2F6 등을 포함한 과불화화합물(Per Fluoro Compounds; PFC)들은 주로 반도체소자의 생산에 사용된다[1]. 반도체 공정 외에 PFC는 종래에 사용되던 클로로플루오로카본(chloro-fluorocarbon; CFC)을 대체하여 세정제, 에칭제, 용매, 반응원료 등의 목적으로 사용하거나 제조하는 공정 및 작업장에서 배출되는 폐가스에도 포함될 수 있다. 과불화탄소의 사용 효율이 15 내지 60% 정도임을 감안할 때 나머지 과불화탄소는 그대로 대기 중에 방출되고 있는 실정이다. 사용 후 남은 과불화탄소를 극저온법으로 회수하여 재사용할 수 있으나, 고순도의 과불화탄소를 회수하기 위해서는 다른 성분들을 제거하기 위한 배출가스의 전처리가 요구되므로 다른 과불화탄소 분해처리 방법보다 회수 비용이 많이 든다는 단점이 있다[2].
과불화화합물(PFC)들이 배출되는 총 질량이 다른 온실가스에 비해 작을지라도 지구온난화 지수(Global Warning Potential; GWP)는 무시할 수 없다[3,4]. 과불화탄소는 화학적으로 매우 안정하고 거의 독성이 없는 물질이지만 지구 온난화를 일으키는 주요 온실 가스로서, 대기 중에서 무려 10,000 내지 50,000년 동안 체류하면서 지표면의 온도를 상승시킨다. 과불화탄소의 지구온난화 지수는 이산화탄소 보다 6,000 내지 25,000배 정도이다. 따라서, PFC를 대기 중으로의 배출하는 것은 환경 보호를 위해 규제의 대상이 되고 있고 앞으로도 그 규제가 더욱 강화될 전망이다.
반도체 공정이나 PFC를 다루는 공정 및 작업장에서 배출되는 폐가스에 포함된 PFC를 처리하기 위하여 직접 연소 및 열분해법, 플라즈마 분해법, 회수법, 촉매 분해법 등 여러 가지 제거방법들이 알려져 있으며, 각각의 기술마다 문제점을 갖고 있어 아직은 상업적 적용에 애로가 따르고 있는 실정이다[4,5]. 공업적으로는 연소 및 열분해 방법이 가장 선호되는 방법이지만 과불화탄소를 분해 처리하려면 1,000 ℃ 이상의 고온을 요구하여 많은 양의 에너지를 필요로 하므로 운전 비용이 많이 들고 분해산물에 HF, HCl 및 NOx, SOx 등과 같은 유해물질이 포함되어 있어 후처리 공정을 거쳐야 한다는 단점이 있다. 플라즈마 분해법은 PFC를 포함하는 폐가스를 플라즈마 영역을 통과시켜 분해하는 기술로서, PFC 분해에는 효과적이나 높은 에너지 상태의 플라즈마를 사용하기 때문에 PFC의 무차별 분해에 의해 생성된 라디칼들의 이차 반응으로 다양한 종류의 부산물이 생성되는 문제점이 있다. 또한, 플라즈마를 안정적으로 장시간 발생시키기 위한 플라즈마 발생장치의 내구성 및 경제성에 있어서도 문제가 많다[4]. 회수법은 폐가스에 포함된 PFC 성분을 pressure swing adsorption 또는 분리막 등을 사용하여 분리한 다음 회수하는 방법으로서, PFC의 재활용이 가능하다는 측면에서 바람직하지만 반도체 공정에서와 같이 불규칙적으로 소량 배출되는 PFC를 처리하는 경우에 있어서는 경제성이 낮은 방법이다.
한편, 촉매분해법은 과불화탄소를 고체 촉매와 접촉시켜, 연소 및 열분해하는 것보다 낮은 온도에서 분해시키는 방법으로서, 분해 산물로서 HF와 이산화탄소만 배출되기 때문에 후처리 공정에서는 간단한 습식처리법으로 HF를 제거하면 되기 때문에 단기적인 관점에서는 과불화탄소 배출을 저감하는 기술로는 매우 바람직한 방법으로 알려져 있다[2]. 촉매 분해법은 촉매 및 수증기를 사용하여 PFC 분해가 500~800 ℃의 저온에서 일어나게 유도함으로서 thermal NOx의 발생 및 장치 부식을 크게 낮출 수 있기 때문에 직접 분해법 및 플라즈마 분해법의 대안으로 널리 연구되어 왔다[6-10]. 그러나 500~800 ℃의 운전조건은 촉매가 물리적 또는 화학적인 변화 없이 장시간 활성을 유지하기에는 여전히 높은 온도조건으로서 촉매의 내구성 확보가 가장 큰 걸림돌이 되고 있다. 즉, 부산물로 생성되는 HF와 수증기가 동시에 존재하는 500~800 ℃의 반응 분위기 하에서 지속적으로 내구성을 갖는 촉매개발이 상업화의 관건이 되고 있다[4].
본 연구의 목적은 배출가스 처리 용량이 1 m3/min인 파일럿 규모의 반응 시스템에서 난분해성인 PFC를 촉매를 사용하여 800 ℃ 이하의 낮은 온도에서 분해하기 위한 상업용 촉매의 성능을 검증하는 것이다. 본 연구에서는 PFC 가스 중에서 SF6의 촉매 분해 반응에 대하여 반응물의 농도, 반응 온도, 및 공간 속도 등의 운전 조건이 분해 효율에 미치는 영향을 고찰하고, 장기 운전을 수행했다. 또한 CF4의 촉매 분해 성능을 고찰하였다.
본 연구에 사용한 촉매는 상업용 촉매이며 제조 절차는 다음과 같이 문헌에 나타나 있다[11]. 먼저 19 L 반응기에 증류수 10 L를 추가하였다. Pseudoboehmite 3.0 kg을 반응기에 서서히 가하면서 교반기로 잘 섞어주었다. Zirconium oxynitrate 용액(20 wt% ZrO2) 0.788 kg을 가하였다. 질산을 사용하여 슬러리의 pH가 3.3을 유지하도록 조절하면서 4시간 동안 교반하였다. 그 후, 48시간 동안 숙성하였다. 생성된 젤을 110 ℃의 오븐에서 건조시키고, 535 ℃의 소성로에서 3시간 동안 소성시켰다. 이렇게 제조한 7.5% ZrO2-Al2O3의 BET 표면적은 195 m2/g이었다.
10% Co/7.5% ZrO2-Al2O3는 함침법에 의해 다음과 같이 제조되었다. 500 g의 7.5% ZrO2-Al2O3를 6/12 mesh 크기의 입자로 만들어서 사용하였다. 284 ml의 증류수에 210 g의 cobalt acetate와 130 g의 triethanolamine을 녹인 용액을 만들어서 ZrO2-Al2O3에 분사하였다. 건조 과정을 거친 후에 500 ℃에서 2시간 동안 소성하여 Co 산화물로 전환하고, 700 ℃에서 2시간 동안 추가로 소성하였다.
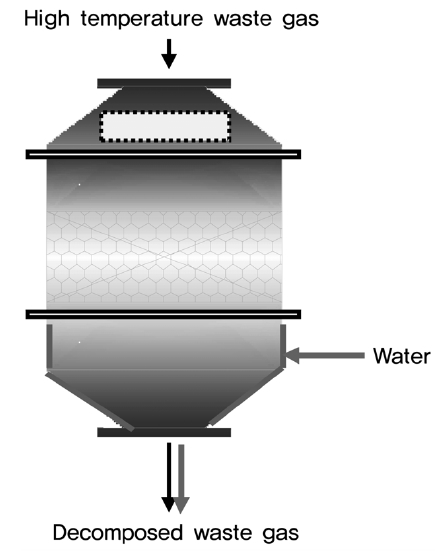
Figure 1은 PFC 분해반응 파일롯 장치를 나타낸다. 반응물 도입부분은 반응물인 과불화화합물 및 산소를 공급할 수 있는 mass flow controller와 H2O를 공급할 수 있는 펌프로 구성되어 있다. 반응기로는 Hastelloy C 재질로 제작된 vertical cylinder 형태의 고정층 반응기를 사용하였다. 촉매 반응 후 반응기가 고온에서 부식될 가능성이 높기 때문에 반응기 하단에 냉각수를 Swirl 기법으로 도입하였다. 반응기에 8 × 16 mm
크기의 촉매를 30 L 충진하였으며, 반응 온도는 약 650 ℃이고 과불화화합물의 공간속도(Gas Hourly Space Velocity ; GHSV)는 1,500~2,000 h-1이었다.
반응기로부터 배출되는 분해 폐가스의 과불화화합물 농도는 FT-IR을 사용하였으며, 전환율(conversion)은 아래와 같은 식에 의해 계산하였다.
Conversion (%) = [(Inlet 농도 × Inlet 유량) - (Outlet 농도 × Outlet 유량)] / (Inlet 유량 × Inlet 농도) × 100
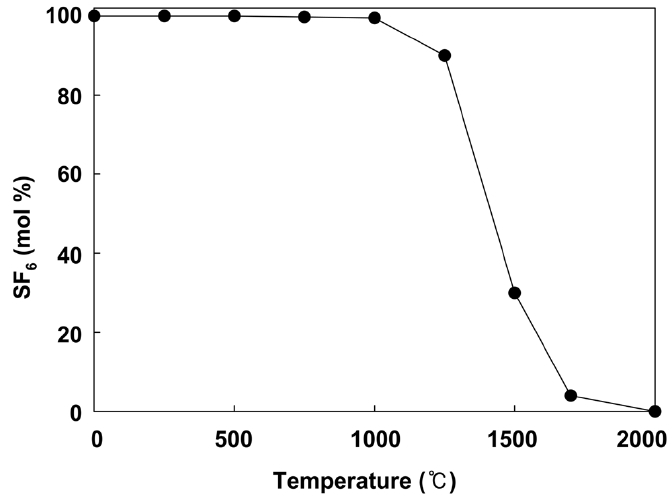
Figure 2는 SF6를 촉매를 사용하지 않고 공기의 존재 하에서 열 소각하였을 때의 실험 결과이다. 분해온도를 상승시키면서 SF6의 농도를 측정한 결과, 약 1000 ℃ 이하에서는 분해가 거의 진행되지 않음을 알 수 있었다. 1000 ℃ 이상에서 서서히 분해가 일어나기 시작하고 1300~1500 ℃ 구간에서 급격하게 분해가 진행된다. 95% 분해가 진행되는 온도(T95)는 약 1600 ℃이고, 2000 ℃가 되어야 완전히 분해가 된다.
3.2.1. SF6 농도의 영향
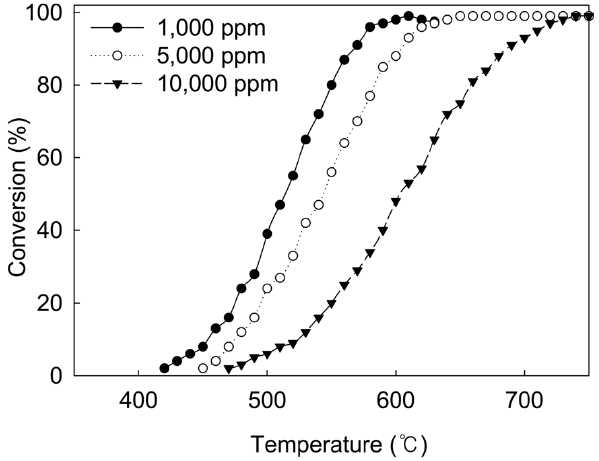
Light-off curve는 반응온도의 함수로서의 제거 효율을 나타내며, 일반적으로 반응기 내에서 촉매층의 조작 온도 결정을 위해 사용된다. 공정의 조작온도를 결정하기 위해 light-off curve를 사용할 때의 주의점은 프로세스와 해당되는 조건과 동일한 조건에서의 light-off curve를 사용해야 한다. T95는 95% 이상의 제거율을 달성하기 위해 요구되는 반응 온도를 나타낸다. 주어진 PFC에 대하여, T95는 농도와 체류 시간의 함수이다. 반응물의 체류시간이 증가하면(즉, 촉매의 사용량이 더 많으면) T95가 감소하며, 반면에 PFC의 농도가 증가하면 일반
적으로 T95가 증가한다. Figure 3은 촉매(직경 8 × 길이 16 mm) 30 L를 반응기에 충진하고, H2O 농도 6.1%, 공간 속도(GHSV) 1,800 h-1의 조건에서 SF6의 농도가 light-off curve에 미치는 영향을 나타낸 것이다. SF6의 농도가 1,000 ppm일 때, 반응 온도를 증가시키면서 SF6의 전환율을 측정한 결과 T95는 580 ℃로 나타났다. SF6의 농도를 증가시키면 T95가 증가하였는데 SF6의 농도가 5,000 ppm인 경우는 620 ℃가 되고, SF6의 농도가 10,000 ppm인 경우는 T95가 710 ℃로 증가하였다. 즉, 촉매를 사용한 파일롯 테스트에서 SF6의 농도가 1,000~10,000 ppm일 때 T95가 580~710 ℃ 범위로 나타났는데 이 온도 범위는 촉매를 사용하지 않고 열 소각을 했을 때의 T95인 1,600 ℃보다 매우 낮은 온도임을 알 수 있다.
3.2.2. 촉매 분해 성능 재현성 실험 결과
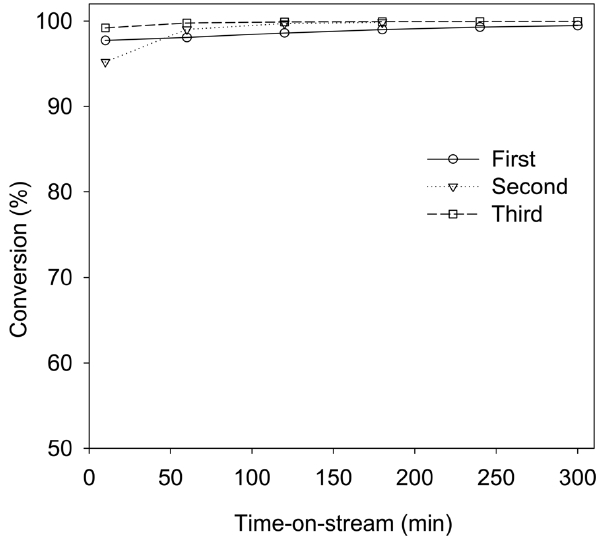
Figure 4는 SF6 촉매 제거 효율의 재현성을 확인하기 위한
실험 결과이다. SF6의 농도가 1,500 ppm, GHSV는 2,000 h-1, time-on-stream 5 h인 조건에서 650 ℃ 이상에서 99% 이상의 SF6 전환율을 얻을 수 있었으며, 이 결과는 3 차례의 반복 실험을 통해서도 동일하게 나타났다. 따라서 본 연구의 파일롯 규모에서의 촉매의 SF6 촉매 제거 효율에 대한 재현성이 확보되었음을 알 수 있었다.
3.2.3. 촉매 안정성 실험 결과
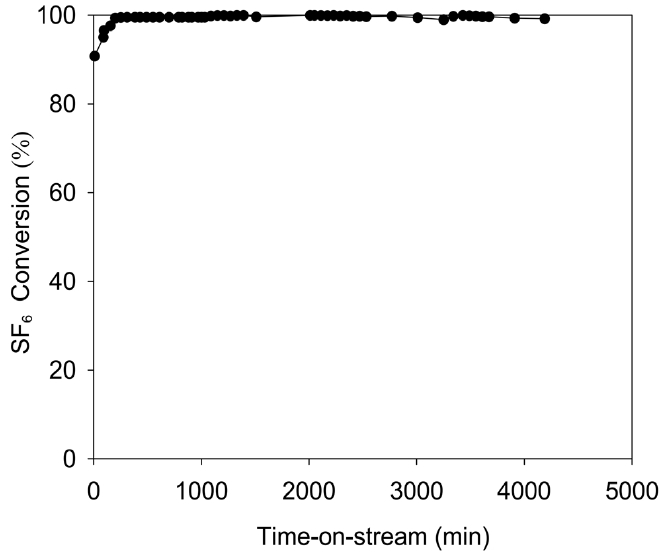
과불화화합물 제거 공정용 촉매의 선정에서, 촉매의 안정성과 피독 저항은 매우 중요한 인자이다. 촉매의 안정성은 오랜 기간 동안 높은 파괴 효율을 유지할 수 있는 촉매의 능력에 의존한다. SF6 농도가 1,500 ppm이고 수증기를 6.1% 함유한 feed를 1 m3/min의 유속(GHSV: 2,000 h-1)으로 투입하면서 650 ℃의 반응 온도 하에 장시간 동안 촉매의 성능을 분석한 결과를 Figure 5에 나타냈다. 72시간의 연속 운전 결과, 99% 이상의 SF6 전환율이 유지됨을 알 수 있었다. 즉, 이 시간 동안에 촉매의 피독이 거의 발생하지 않으며 안정성이 확보되었음을 알 수 있었다.
3.2.4. 공간 속도의 영향
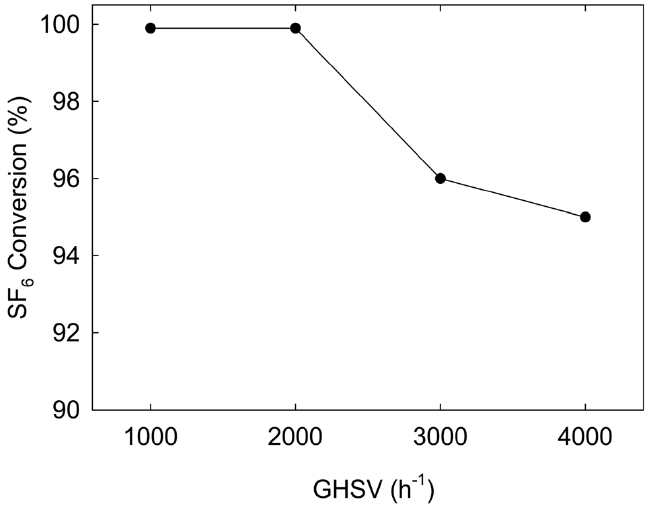
반응기에 촉매를 30 L 장착하고, 반응온도 650 ℃에서 SF6 농도가 1,500 ppm이고 수증기를 6.1% 함유한 feed의 유량을 변화시키면서 TOS 5 h의 조건에서 SF6 전환율을 측정현 결과를 Figure 6에 나타냈다. GHSV가 2,000 h-1 이하인 조건에서는 SF6 전환율이 99.9% 이상이었지만, GHSV가 3,000 h-1 및 4,000 h-1인 조건에서는 SF6 전환율이 각각 96.0% 및 95.0%로 감소함을 알 수 있었다. 따라서 650 ℃의 반응 온도에서 SF6 전환율을 99.9% 이상 유지하기 위해서는 GHSV를 2,000 h-1 이하인 조건에서 운전해야 함을 알 수 있었다.
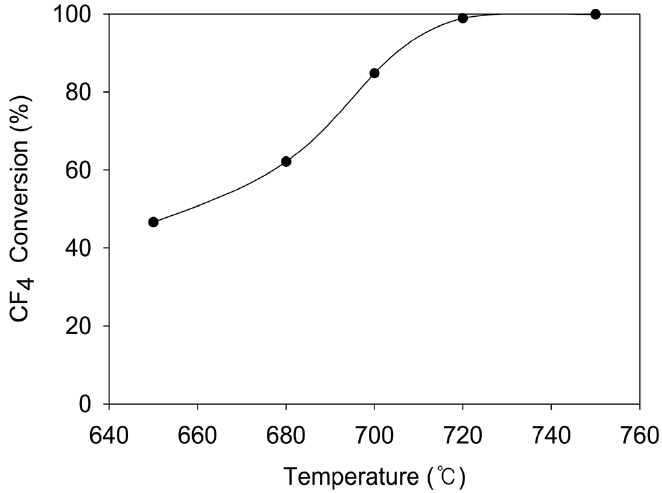
본 연구에서 사용한 촉매의 과불화화합물 분해 성능을 파악하기 위하여 SF6와 더불어서 반응온도가 CF4 분해활성에 미치는 영향을 확인하였다. Figure 7은 Feed 유속 1 m3/min, CF4 concentration 2,500 ppm, H2O 6.1%, TOS 30 min, GHSV = 2,000 h-1의 조건에서 반응온도가 CF4 분해활성에 미치는 영향을 조사한 결과이다. 주입된 CF4의 95%가 전환되는 점인 T95 온도는 710 ℃ 부근에서 나타났으며, 완전히 전환되는 온도는 730 ℃ 부근에서 나타났다. SF6의 경우는 유사한 조건에서의 T95 온도가 580~600 ℃ 범위로 나타나서, CF4의 T95 온도가 SF6의 T95 온도보다 약 110~130 ℃ 정도 높은 것을 알 수 있다. Brown 등의 결과에 의하면 CF4의 T95 온도가 SF6의 T95 온도보다 140 ℃ 정도 높게 나타났으며, 본 연구의 결과와 잘 부합함을 알 수 있다[3].
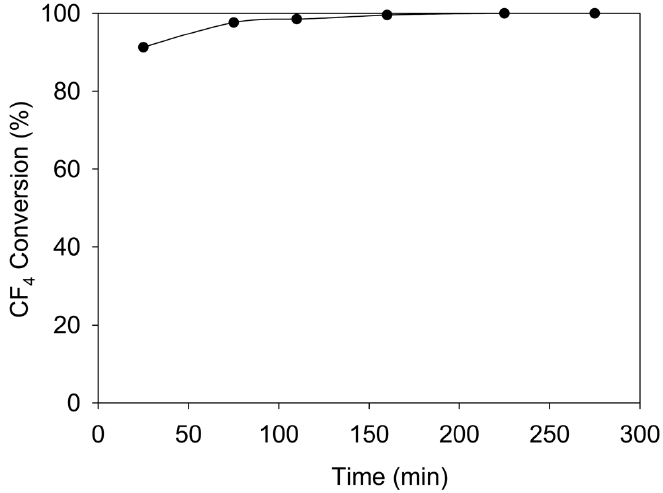
Figure 8에 Feed 유속 1 m3/min, CF4 concentration 2,500 ppm, H2O 6.1%, Temp.: 720 ℃, GHSV = 2,000 h-1의 조건에서 5시간의 연속 운전 결과를 나타냈다. 5시간 동안 99.5% 이상의 CF4 전환율이 유지되었으며, 이 시간 동안에 촉매의 피독이 거의 발생하지 않았고 안정성이 유지됨을 알 수 있었다.
배출가스 1 m3/min를 처리할 수 있는 용량의 파일롯 규모 반응기(촉매 양 30 L)를 사용하여 상업용 촉매를 사용하여 과불화화합물의 촉매 분해 성능을 분석한 결과, 다음과 같은 결과를 얻을 수 있었다.
첫째, H2O 농도 6.1%, 공간 속도(GHSV) 1,800 h-1의 조건에서 SF6의 농도를 증가시키면 T95가 증가하였는데 SF6의 농도가 1,000~10,000 ppm일 때 T95가 580~610 ℃ 범위로 나타났으며, 열 소각을 했을 때의 T95인 1600 ℃보다 매우 낮은 온도 임을 알 수 있다. 둘째, 650 ℃의 반응 온도 하에서 72시간 동안에 99% 이상의 SF6의 전환율이 유지되어 촉매의 안정성이 확보되었다. 또한 SF6 전환율을 99.9% 이상 유지하기 위해서는 GHSV를 2,000 h-1 이하인 조건에서 운전해야 함을 알 수 있었다. 셋째, CF4의 분해 반응의 경우 T95 온도가 710 ℃이었으며, SF6의 T95 온도보다 약 110~130 ℃ 정도 높은 것을 알 수 있다.