뇌혈관 질환은 유병률이나 사망률에 있어서 가장 중요한 신경학적 질환이라 할 수 있다. 대부분의 구미 각국에서 뇌혈관질환은 심장질환과 암에 이어 3번째 사인이 되고 있고1), 우리나라에서도 2009년 통계청 자료에 따르면 악성신생물(암)에 이어서 한국인 사망원인의 2위를 차지하고 있을 뿐만 아니라2) 발병 후 신체적, 정신적 후유증과 개인적, 사회적 손실이 크기에 사회적으로 연구와 관심이 집중되고 있는 질환이다.
이러한 뇌혈관 질환이나 척수마비와 같은 중추신경계의 손상이 발생되면 신경세포의 괴사에 이은 공동이 생기게 된다. 그 후 신경아교세포의 증식이 일어나서 공동부위를 신경교세포가 감싸는 교세포 반흔(glial scar) 형성이 일반적으로 나타나게 된다. 이는 매우 치밀하고 단단한 구조를 지니고 있어 신경세포나 축삭의 재생에 물리적인 장벽이 되기도 하며, 반흔을 이루고 있는 성상교세포가 축삭의 재생을 억제하는 물질을 생성하여 신경재생을 방해 한다3-5).
중추신경계가 손상 후 재생되지 못하는 원인으로 교세포 반흔형성과 수초(myelin)내의 억제인자의 활동으로 보고 된다. 뇌혈관장애나 척수마비와 같은 중추신경계의 손상이 일어나면 그 결과 세포증식 및 교세포 반흔 형성이 나타나게 되는데 중추신경계 손상의 마지막 단계에서 나타나는 교세포화(gliosis)는 GFAP 양성으로 나타나는 성상세포(astrocyte)의 성장이며 이는 신경 재생의 물리적 분자학적 장벽으로 작용한다. 아울러 GFAP와 같은 양상으로 CD81의 발현 증가가 동반 된다3,5). 이중에서 CD81은 뇌, 척수, 망막 등의 중추신경계에 존재하는 표면단백질(transmembrane protein)로 중추신경계에 손상이 가면 급격히 발현이 증가하여 세포의 증식과 이동, 재생들에 관여를 하는 것으로 밝혀지고 있다6-9).
當歸는 ?形科(Umbelliferae) 참당귀(Angelica gigas Nakai)(Oliv.) Diels 의 根을 乾燥한 것이며, 性味는 甘, 辛, 溫하며 肝 脾에 歸經한다. 主成分은 精油, 子宮興奮成分, 蔗糖, vitamin E등으로 구성되어 있으며10), 『神農本草經』11) 中品에 처음 기록된 이래 補血和血, 活血祛瘀의 효능이 뛰어나 임상에서 “血病의 要藥” 으로 널리 사용되고 있다12-13).
당귀에 관한 연구로 염색체법을 이용한 실험적 보고14), 허혈성 뇌손상 억제반응 및 뇌신경세포의 보호 작용에 관한 실험15), 당귀약침의 허혈성 뇌손상에 미치는 영향에 대한 보고16), 당귀가 저산소로 손상된 성상세포의 gliosis에 미치는 영향에 대한 보고17)에서 뇌손상 억제작용 있다고 규명되었다. 이에 저자는 당귀가 MCAO 모델의 흰쥐에서 교세포화 억제에 대한 영향을 줄 수 있으리라 사료되어 한의학적으로 活血去瘀, 腦神營養의 效能이 있는 당귀를 이용하여 MCAO 모델 흰쥐에서 교세포화 억제에 미치는 영향을 관찰하여 다음과 같은 결과를 얻었기에 보고하는 바이다.
실험동물은 6주령의 200-300 g의 웅성 Sprague-Dawley 흰쥐(샘타코, 한국)를 구입하여 일주일 정도 실험실 환경에 적응시킨 후 실험에 사용하였다. 실험동물은 cage 당 3-4 마리씩 넣어두었으며 물과 사료를 자유로이 섭취하도록 하였다. 아울러 모든 실험은 NIH 동물실험 윤리규정에 따라 진행하였다. 동물은 조작을 가하지 않고 물과 식이를 공급한 정상군, 일과성 뇌허혈 유발을 위한 수술을 실시하고 생리식염수를 공급한 대조군(허혈군), 그리고 뇌허혈 유발 후 당귀를 투여한 실험군(실험군)으로 구분하였다. 각 군당 동물의 수는 세 마리로 하였다.
본 실험에 사용된 당귀는 한방병원에서 구입한 후 정선하여 사용하였다. 검액의 조제를 위하여 당귀 250 g에 증류수 1,000 ml를 넣고 3시간 동안 끓인 다음 고속원심분리기로 원심분리하여 상등액을 취하였다. 상등액은 여과지로 여과한 다음 다시 감압 농축하였으며 농축된 검액을 동결건조기로 건조시켜 최종적으로 얻은 분말을 실험에 사용하였다. 최종 분말의 수율은 약 12.82%였다.
당귀 추출물을 0.9% 생리식염수에 녹여 0.25 ㎛ 필터로 여과한 다음 100 mg/kg의 용량을 미정맥으로 1일 2회 투여하였다. 약물의 농도는 검액 제조시 얻어진 수율과 임상에서 인체에 최대로 투여할 수 있는 용량인 1일 60 g을 역으로 계산하고 약 1/10에 해당하는 용량으로 결정하였다. 약물은 수술 1시간 전과 수술 1 시간에 투여하였으며 수술 다음 날부터는 1일 2회 오전 9시와 오후 5시에 7 일간 투여하였다. 대조군에는 동량의 생리식염수를 투여하였다.
일시적인 국소 뇌허혈은 Longa 등18)의 방법에 따라 중대뇌동맥을 폐색시켜 만들었다. 실험동물을 70% N2O, 30% O2가 혼합된 5% isoflurane을 이용하여 흡입마취를 유도한 후 2% isoflurane으로 마취상태를 계속 유지시켰다.
중대뇌동맥을 폐색하기 위하여 경부 정중선을 따라 피부를 절개하고 흉골혀근과 흉골저작근 사이의 총경동맥을 노출시킨 후 총경동맥을 결찰하여 폐쇄시키고 내경동맥과 외경동맥 분지 사이에 27 G 주사침을 이용하여 작은 구멍을 낸 다음 내경동맥내로 치과 인상제(Durelon, Germany)가 발라진 4-0 nylon의 intraluminal filament (직경 0.28 mm, rounded tip)을 18.5-19.0 mm 정도 삽입하여 그 끝이 중대뇌동맥의 기시부를 지나 전대뇌동맥의 근위부까지 도달하도록 하였다. 다음 총경동맥과 외경동맥은 결찰한 후 수술 부위를 봉합하였으며 혈류차단 2 시간이 지난 후 intraluminal filament를 제거하여 측부 순환을 통하여 재관류를 시켰다. 모든 수술조작기간 및 마취회복기간에는 동물의 직장온도를 37±0.5 ℃로 유지하였다. 실험 동물은 상처를 봉합한 다음 백열 전등을 비춘 다음 heating pad 에서 두어 회복하도록 하였다. 중대뇌동맥 폐색 후 실험동물이 마취에서 깨어나면 신경학적 검사를 하여 동맥폐쇄를 확인하였다.
약물을 정맥주사 한 7일 후 흰쥐를 ketamine (50 mg/kg)과 xylazine (10 mg/kg)을 섞은 마취액을 복강으로 주사하여 마취를 유도한 다음 흉벽을 제거하고 왼쪽 심실에서 대동맥 방향으로 18게이지 주사바늘을 삽입하였다. 그 다음 오른쪽 심방귀를 가위로 절단한 뒤 50 mL/min의 속도로 연동펌프(peristaltic pump)를 이용하여 phosphate buffered saline (PBS)으로 관류시켜 혈액을 제거하였다. 그리고 4% paraformaldehyde용액 250-300 mL를 관류시켜 고정을 시행하였다. 적출한 뇌조직은 4 ℃에서 24 시간동안 4% paraformaldehyde 용액에 고정을 시행한 후 30% sucrose 용액에 4 ℃에서 하루 이상 보관하였다. 다음 적출한 대뇌의 정수리점(bregma)에서 뒤로 3.0 mm에서 4.5 mm 떨어진 곳에 해당하는 부위를 동결절편기를 이용하여 두께가 40 ㎛가 되게 관상으로 박절한 후, 조직 절편을 보존액(cryoprotectant solution)이 들어있는 24-well 배양기에 조직 절편을 매 절편마다 각 well에 순차적으로 반복하여 넣은 후 영하 20 ℃에서 보존하였다.
적출된 뇌조직의 관상절편을 만든 다음 0.05 M PBS으로 3회 세척하였다. 다음 절편을 xylen에 5분 100% alcohol에 2분 그리고 95% alcohol에 1분 담그고 다시 70% alcohol에 1분 담근 다음 증류수에 2분 세척하여 탈지와 탈수 과정을 거쳤다. 그리고 0.5% cresyl violet 용액으로 30분간 염색하였다. 염색이 끝난 조직은 광학현미경(Olympus, Japan)을 이용하여 관찰하였다.
재관류 후 48시간 후에 실험동물을 희생시킨 후 즉시 단두하여 2 mm간격으로 관상절편을 얻어 2% 2,3,5-triphenyltetrazolium chloride (Sigma Chemical Co. USA)용액에 2 0분간 담가 두어 염색하였고, 염색된 조직을 10 % 포르말린에서 고정한 후, 염색된 조직은 스캐너를 이용하여 전체 뇌반구 크기와 허혈 영역의 크기를 산출하였다. 이때 뇌허혈이 온 부위는 반대측의 정상 뇌반구의 넓이에서 허혈 손상 부위의 넓이를 뺀 크기로 하여 부종으로 인한 변화를 최소화하였다. 각 절편에서의 뇌허혈 손상의 넓이에 절편두께인 2 mm를 곱하여 전체 뇌허혈의 부피(mm3)를 산출하였다.
조직절편을 24-well 배양기에 5-10개씩 넣고, 0.05 M PBS 용액으로 10분씩 3회 교반기를 이용하여 세척하였다. 15-20분간 1.0% H2O2로 반응시키고 같은 방법으로 세척한 후 0.2% Triton X-100 용액에 20분 반응시키고 PBS 용액으로 세척하였다. 이어서 여기에 말 혈청과 정상 염소 혈청을 1:100으로 희석시킨 차단항체를 실온에서 0.5-1시간 반응시킨 후 PBS 용액으로 세척하고, 48시간 동안 4℃에서 일차항체(GFAP, CD81, c-Fos, ERK)를 가한 후 PBS 용액으로 세척하였다. 그리고 2시간 실온에서 이차항체 (horse anti-mouse IgG, goat anti-rabbit IgG, 1:100)를 가한 후 PBS 용액으로 세척하였다. Avidin-biotin peroxidase complex와 실온에서 1시간 반응시키고 PBS 용액으로 세척한 후 0.05% 3,3′-diaminobenzidine tetrahydrochloride (Sigma Chemical Co. USA)로 발색시켰다. 그 다음 조직 절편을 30분 전에 꺼내놓은 gelatin coated slide에 올린 후 실온에서 두 시간 말렸다. 이어서 슬라이드를 증류수에 10분 동안 담근 후 alcohol로 탈수 시키고 xylene으로 투명화한 후 캐나다 발삼으로 봉입시키고 광학현미경으로 관찰하였다.
염색된 조직은 슬라이드에 부착하였으며 광학현미경(Olympus, Japan)을 이용하여 해마의 피라미드세포수를 CA1의 내측과 외측 두 부위, CA2 한 부위를 400배 배율로 양측에서 각각 측정하여 평균치를 이용하였다.
본 연구의 결과는 MEAN±SEM으로 표시하였다. 각 그룹 간의 차이는 t-test와 one-way ANOVA를 시행하였으며 통계학적으로 p값이 0.05 이하이면 의미가 있는 것으로 간주하였다.
1. 당귀의 정맥주사가 뇌허혈 부위의 감소에 미치는 영향
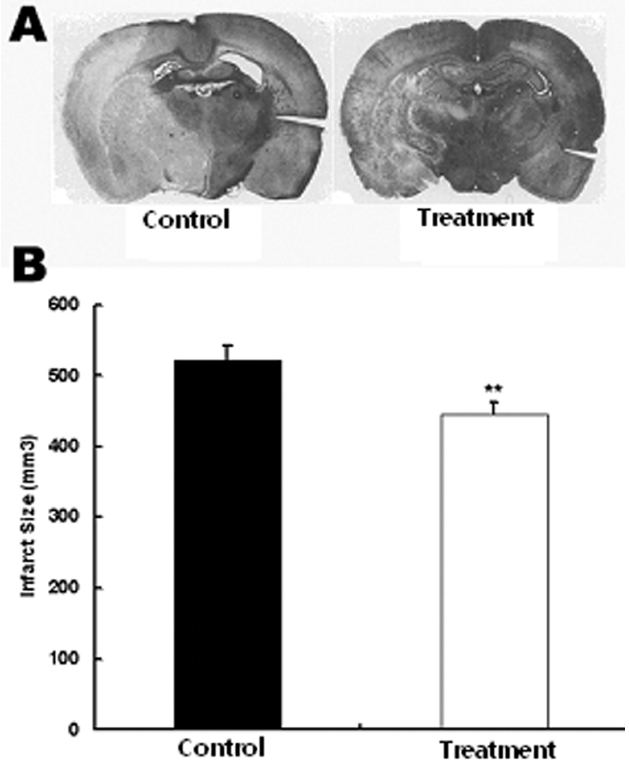
중대뇌동맥 폐쇄에 의한 일시적 뇌허혈 유발 흰쥐에서 당귀 정맥주사가 뇌허혈 부위의 감소에 미치는 영향을 관찰하기 위하여 당귀 정맥주사 후 뇌조직을 적출하여 뇌허혈 부위의 크기를 관찰하였다. 생리식염수만 투여한 대조군에서 뇌허혈 손상 부위가 521±21.5 mm3로 전체 뇌 단면의 28%가 손상되었으나 실험군에서는 뇌허혈 손상 부위가 445±16.1 mm3, 전체뇌단면의 24%가 손상되어 대조군에 비하여 실험군에서 뇌허혈 손상이 유의하게 감소하였다(Fig. 1).
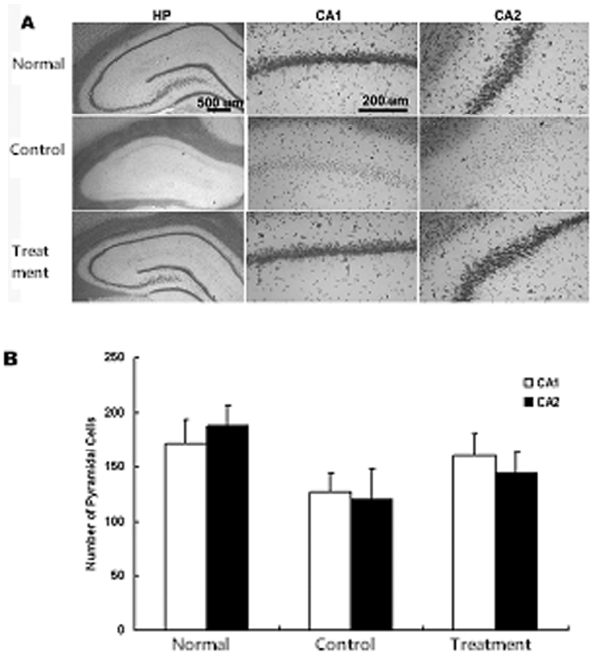
일시적 뇌허혈 후 당귀의 정맥주사가 해마의 뇌세포사 보호에 미치는 효과를 관찰하기 위하여 피라미드세포의 사멸을 관찰하였다. 일시적 뇌허혈 손상 후 7일에서는 CA1의 내측에서 피라미드세포핵의 신경세포가 대조군, 실험군에서 감소되었음을 볼 수 있었다. 양측 해마의 CA1에서 고배율(×400)로 측정한 평균 피라미드세포 수는 정상군에서는 172±6.1이었으며 대조군에서는 127±7.6으로 유의하게 감소되었다. 그러나 실험군에서는 160±7.2로 대조군에 비하여 감소가 적었다. 그리고 CA2에서 평균 피라미드세포 수는 정상군, 대조군, 실험군에서 각각 189±8.1, 120±8.7, 144±9.6 으로 대조군에 비하여 실험군에서 감소가 적었다. 이상의 결과로 당귀 투여 후 CA1에서 대조군에 비하여 19 %의 신경세포사가 감소되었으며 CA2에서 당귀 투여로 대조군에 비하여 13 %의 신경세포사가 감소됨을 관찰할 수 있었으나 유의성은 없었다(Fig. 2).
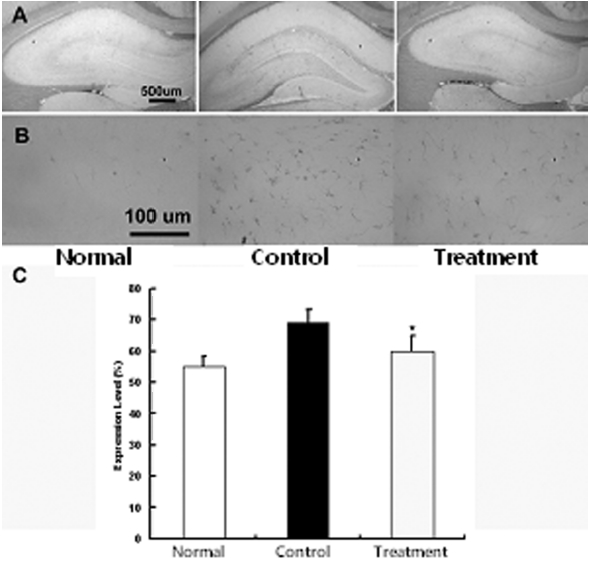
뇌허혈 손상 후 중추신경계에 발생하는 gliosis의 억제에 미치는 영향을 관찰하기 위하여 적출된 뇌조직을 세척한 다음 GFAP로 염색을 실시하여 GFAP의 발현여부를 관찰하였다. GFAP 면역염색에 의하여 성상세포질이 갈색으로 염색이 되었으며 특히 정상군에 비하여 대조군에서 GFAP는 발현의 증가가 뚜렷하였으나 실험군에서는 대조군에 비하여 발현의 감소가 관찰되었다. 즉 정상군에서 발현 정도는 43±2.3%, 대조군 67±5.3%, 실험군 53±2.4%로 실험군에서 대조군에 비하여 유의하게 감소하였다(p<0.05) (Fig. 3).
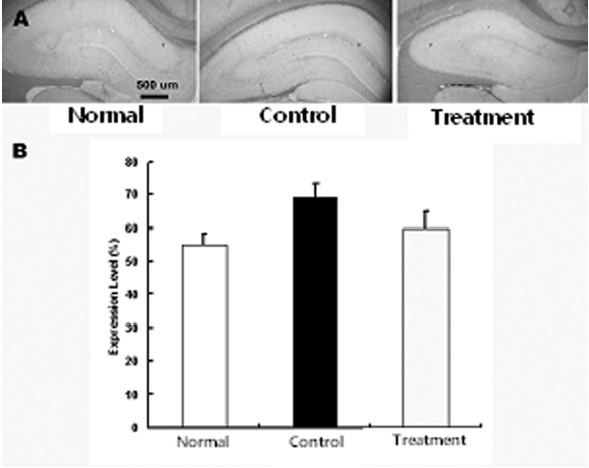
뇌허혈 손상 후 나타나는 교세포화 과정에서 GFAP의 발현 증가와 더불어 동반되는 CD81의 발현 증가 억제 현상을 관찰하기 위하여 적출된 뇌조직을 세척한 다음 CD81으로 염색을 실시하여 CD81의 발현여부를 관찰하였다. 그 결과 정상군에 비하여 대조군, 실험군에서 CD81의 발현이 증가하였으나, 실험군은 대조군에 비하여 CD81의 발현이 감소하였다. 즉 정상군, 대조군, 실험군은 각각 55±2.3, 69±4.5, 60±5.1%로 실험군은 대조군에 비하여 CD81의 발현 감소하였으나 유의성은 없었다(Fig. 4).
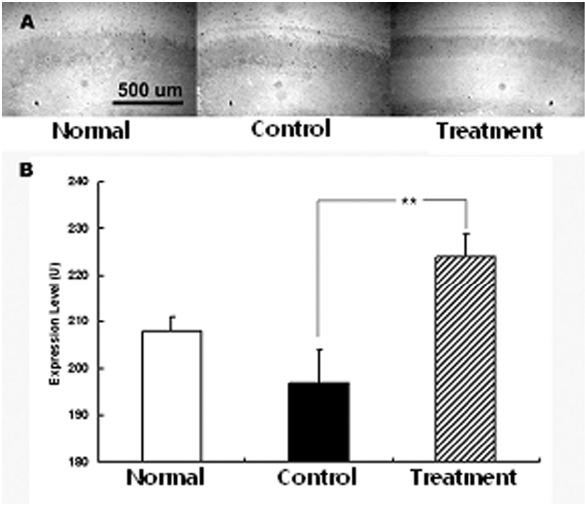
당귀 정맥주사가 허혈성손상에 미치는 영향을 관찰하기 위하여 적출된 뇌조직에서 c-Fos의 발현을 관찰하였다. 그 결과 c-Fos는 정상군에서 208±3 U이었고, 대조군에서 197±7 U이었으나 실험군에서 224±5 U로 대조군에 비하여 유의한 증가를 보였다(Fig. 5).
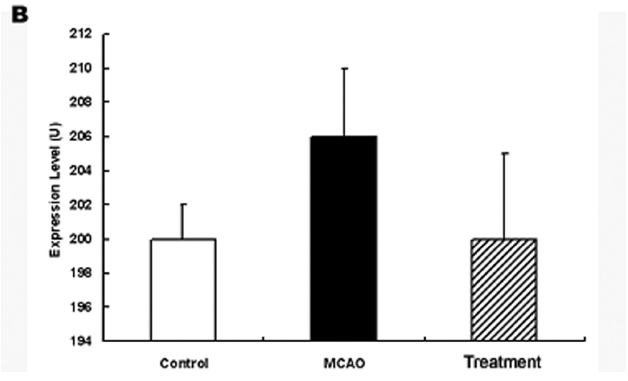
허혈 손상 후 당귀 정맥주사가 어떠한 경로를 통하여 작용을 발현하는 가를 규명하기 위하여 적출된 뇌조직에서 ERK 발현을 관찰하였다. 그 결과 ERK의 발현은 정상군에서 200±2 U이었고 대조군에서 206±4 U였으나 실험군에서는 200±5 U로 발현이 대조군에 비하여 감소하여 정상군과 유사한 양상을 보였으나 유의성은 없었다(Fig. 6).
當歸는 ?形科(Umbeliferae)에 속한 다년생 초목인 참당귀(Angelica gigas Nakai)의 뿌리를 가을에 채취하여 건조한 것으로 補血和血, 活血祛瘀, 潤燥滑腸, 腦神營養, 調經止痛의 효능이 뛰어나 임상에서 ‘血病의 要藥’으로 널리 사용되고 있다12,13). 『東醫寶鑑』에서는 ‘治一切血, 能和血, 行血, 養血’이라하였고11), 『本草疏證』에서는 그 성미가 甘辛溫大溫하여 ‘主?逆上氣, 溫虐寒熱, 洗洗在皮膚中 婦人漏下 絶子 諸惡瘡瘍 金瘡 煮飮之. 溫中止痛, 除客血內塞中風?汗 不出濕痺中惡 客氣虛冷 補五臟生肌肉’이라 하였다19).
당귀에 포함된 주요 성분은 정유 및 coumarin계 유도체인 decursin, decusinol, β-sitosterol,nodakenetin, nodakenin 등을 함유하며 정유의 주요성분은 butulidene phtalide, N-valerophenonone-O-carboxilic acid, Vitamin B12, Vitamin A 성분이 함유되어 있다10).
당귀는 약리적으로 자궁에 대한 수축 장용 및 억제작용, 물질 대사 및 내분비에 대한 영향으로 전신 대사를 높여 간장조직의 glutamic acid와 cysterine을 강화시켜주며, 심박출량 증가 및 심근의 산소 소모를 저하시킨다. 또한 여러 가지 세균에 대한 항균 작용과 중추신경 계통에 경미한 억제작용이 있다. 또한 각종 허혈성 중풍과 심장 박동 이상을 조절하며, 약침 제제들은 허혈성 중풍 치료에 혈류변화를 주며 뇌동맥 경화에도 치료율을 높인 임상 보고도 있었으며, 면역증강, 조혈, 항염, 혈전 용해작용 등에 대한 실험적 보고20-26)도 있었다.
허혈성 뇌손상 질환은 한방으로 中風, 風?, 偏枯 등의 범위에 속하며 血虛風乘證, 風陽阻絡證, 痰熱腑實證, 風痰阻絡證, 氣虛血瘀證, 腎虛精虧證 등으로 분류되며27) 현재 血虛로 辨證되는 허혈성 뇌손상 질환에 당귀가 임상에서 널리 사용되고 있다. 이에 본 연구에서 活血去瘀, 腦神營養의 效能이 있는 血病의 要藥인 당귀를 이용하여 MCAO 모델 흰쥐에서 교세포화에 미치는 영향에 대하여 관찰하였다.
말초신경계는 세포체가 손상되지 않는 경우 신경자극을 전달하는 축삭(axon)이 재생되지만 중추신경계에서는 축삭의 재생이 거의 일어나지 않는다. 말초신경계에서 축삭이 손상되면 손상 원위부의 축삭에서 부종과 함께 축삭과 수초의 분절현상이 나타나고 파괴된 축삭과 수초의 잔해들이 대식세포에 의해 포식되게 되면서 손상 부위를 슈반세포(Schwann cell)이 채우게 되고 손상 근위부 축삭에서 성장 돌기(axon sprout)가 손상 원위부 쪽으로 성장하면서 재생이 일어나게 된다. 반면에 중추신경계에서는 손상된 축삭과 수초의 포식이 말초신경계에서보다 더 느리게 일어나며 교세포화가 야기되는데 이는 교세포가 증식으로 교세포 반흔을 형성하는 것이다. 교세포 반흔의 생성으로 축삭 성장 돌기의 성장이 방해되고 교세포 반흔 자체가 구조적 장벽을 형성하여 성장 억제 요인으로 작용하게 된다. 교세포은 손상받지 않은 조직을 격리시켜 더 이상의 손상을 방지하여주고 정상적인 세포의 환경을 유지시켜주는 역할을 하지만 한편 물리적 장벽으로 신경의 재생을 방해하는 결과를 초래하게 된다. 다른 환경적 조건과 자극에 반응하여 성장 촉진 요인 또는 성장 억제 요인으로 작용하게 되고 중추신경계 손상 시 주위 세포의 물질들과 치밀하게 결합하여 교세포화를 생성하고 결과적으로 신경재생이 억제된다3,28). 또한 중추신경계의 수초를 형성하는 회돌기세포에서도 Nogo, Omgp(oligodendrocyte-myelin glycoprotein), MAG(myelin-associated glycoprotein) 등과 같은 축삭 재생을 방해하는 분자물질을 생성하며, 이미 형성된 교세포 반흔에서도 tenascin-R, keratin, CSPGs(choldroitin sulphate proteoglycans)와 같은 신경제생 억제 물질이 생성된다.
이런 배경에서 중추 신경계의 재생을 촉진하는 실험적 방법으로 교세포 반흔의 형성을 억제하거나29-32), 성상세포의 교세포화 반응을 억제하기 위한 protease를 사용하거나33), 방사선을 이용하여 교세포을 제거하는 방법 등이 사용되었다34). 또는 hydroxycholesterol유도체를 실험적으로 사용하기도 하였으며35), 소염제나 cytokine을 사용하거나36), pyrogen을 이용하는 방법37)을 사용하였다.
교세포화에 관여하는 단백질인 GFAP는 8-9nm, 55kDa 정도의 크기로 type Ⅲ intermediate filament로 성상세포의 glial filament의 주성분이다. 또한 cytoskeletal protein에 속하는 단백질로 성상세포의 성장에 구조적 안정화를 제공함으로 성상세포의 운동성과 형태를 조절하는데 중요한 역할을 할 것으로 여겨진다. 실제로 중추신경계에서 직접적인 외상, 질환, 유전장애 혹은 화학적 손상 후에 성상세포는 astrogliosis라는 전형적인 방식으로 반응한다. astrogliosis에서 특징적으로 GFAP의 빠른 합성이 나타나고, GFAP antisera는 주로 CNS에서 성상세포를 확인하는데 일반적으로 사용되고 있다38). 또한 포유동물의 각막에 있는 Muller cell에는 일반적으로 아주 소량의 GFAP만이 존재하거나 없지만, photorecepter의 퇴화, 허혈 혹은 외상에 대한 반응으로 상승 된다39).
GFAP의 축삭 재생에 대한 연구에서 GFAP를 제거한 성상세포에서 신경의 성장 및 재생이 촉진된 결과도 보고 되었고40), GFAP knock out 흰쥐에서 뇌에 외상을 관찰한 결과 교세포화가 지연되어 교세포 반흔의 생성이 억제되었다는 보고가 있었다41). 본 연구에서 GFAP의 발현을 관찰한 결과 정상군 43±2.3 %, 대조군 67±5.3 %, 실험군 53±2.4 %로 실험군에서 대조군에 비하여 GFAP의 발현이 감소하였다. GFAP의 발현 증가은 성상세포의 활성화를 의미하며 활성화된 성상세포는 교세포화를 촉진하기 때문에 GFAP의 증가는 중추신경계 회복을 저해한다. 실험군에서 GFAP의 발현이 감소되었으므로 성상세포 활성화를 저하시켜 결과적으로 중추신경계 회복을 증가시킬 것으로 볼 수 있다42,43).
CD81은 tetraspanin계에 속하는 표면단백질 (transmembrane protein)이다6,8,9). 이들 tetraspanin은 세포막에서 molecular complex를 형성하여 다른 cell adhesion molecules과 같은 molecule들과 관계를 형성한다6). 이러한 complexes는 세포의 바같 표면에서 일어나는 second messenger system에 연결을 통해40,44-46) 이주 그리고 증식 등과 같은 세포의 행동을 조절하는 것으로 보인다8). CD81은 원래 TAPA (Target of the antiproliferative antibody)라고도 불렸으며47). 이 용어가 암시하는 것과 같이 세포표면에 있는 CD81의 epitope에 대응하는 antiproliferative antibody가 세포주기의 진행을 억제 한다47-50). CD81이 세포성장에 대한 조절을 한다는 보다 확실한 증거는 CD81이 결여된 생쥐의 뇌가 보통 생쥐의 뇌보다 더 크며 성상세포와 microglial cell을 유의하게 많이 포함하고 있다는 연구에 기인한다48).
최근 보고된 연구에서 척수에 손상을 가하고 손상부위에 CD81 항체를 지속적으로 주입하여 기능회복과 조직손상을 보호하였다는 보고가 있었으며51), 망막색소상피 손상 모델 흰쥐 연구에서 CD81에 대한 항체를 처리하였을 경우 세포 증식이 억제되었다는 보고가 있으며50). 본 연구에서 실험군에서는 대조군에 비하여 CD81 발현이 감소하였다. 실험군에서의 CD81 발현의 감소는 교세포 증식을 억제시켜 결과적으로 신경 조직 손상을 보호하고 신경세포의 재생을 촉진시킨다고 볼 수 있다.
당귀의 정맥주사 후 뇌허혈 손상 부위는 대조군에 비하여 감소하였다. 해마에서 CA1의 세포수도 실험군이 대조군에 비하여 증가하였으며, CA2의 세포수도 실험군에서는 대조군에 비하여 증가하였다. 따라서 이러한 결과는 당귀의 투여가 중추신경계 손상 후 발현되는 GFAP 및 CD81과 관련된 교세포화를 조절할 수 있으며 뇌손상 부위 크기 감소와 피라미드 세포의 사멸 보호 등의 효과를 보여 향후 뇌조직 손상을 방지하는 유용한 약물로서의 활용이 가능함을 시사한다.
아울러 c-Fos는 신경세포의 사망과 증식에 영향을 미치는 단백질로 성장인자 등의 다양한 자극에 의하여 발현이 증가된다52). 또한 신경 활동의 증가에 의하여 c-Fos는 발현이 증가하는 것으로 알려져 있다. 특히 c-Fos는 뇌조직 손상 후 6-12 시간에 최대로 발현이 증가하다가 72 시간 까지 발현이 지속되는 것으로 나타났으며 허혈성 뇌손상에서도 같은 양상으로 c-Fos가 발현 된다53).
본 실험에서 c-Fos는 정상군에 비하여 대조군에서는 발현이 감소되었고 다시 당귀 추출물 정맥주사 후 발현이 증가하였다. 이는 약물 투여 후 다양한 기전에 의하여 신경 세포 활동이 증가하면서 c-Fos의 발현이 증가한 것으로 생각 된다. 특히 대조군에서 발현이 감소된 것은 MCAO에 의한 허혈성 뇌손상을 가한 후 7일 후에 뇌조직을 적출하였으므로 c-Fos가 최대로 발현 되는 시간을 지난 것에서 나타난 현상으로 이해된다. 아울러 허혈성 뇌손상 후에 나타나는 산소자유기의 활성은 c-Fos의 발현을 억제한다는 보고54)에 비추어 보면 당귀투여 후 산소자유기의 활성이 억제되었을 수도 있음을 간접적으로 제시한다 하겠다.
ERK는 protein kinase의 세포내 신호전달계로 감수분열, 유사분열 및 유사분열 후 기능에 영향을 미친다. 아울러 성장인자나 사이토카인 및 바이러스 감염 등 다양한 자극에 의하여 활성화 되는 것으로 알려져 있다. 특히 ERK는 교세포화와 관련되는 것으로 알려져 있으며 항산화제 투여시 활성화 되고 뇌세포 손상 후 회복기 발현이 조절되는 것으로 알려져 있다55).
본 실험에서 ERK의 발현이 대조군에서 증가하였으며 실험군에서 정상군과 유사한 수준으로 감소하였다. 따라서 당귀 추출물 정맥주사는 ERK 발현과 관련되어 교세포화와 관계하는 것으로 사료되나 앞으로 정확한 작용 경로 기전에 대한 계속적인 연구가 필요할 것으로 생각된다.
이미 알려진 당귀에 관한 연구인 염색체법을 이용한 실험적 보고14), 허혈성 뇌손상 억제반응 및 뇌신경세포의 보호 작용에 관한 실험15), 당귀약침의 허혈성 뇌손상에 미치는 영향에 대한 보고16)에서 당귀가 뇌세포의 손상의 억제, 뇌경색 면적의 감소 및 뇌허혈 상태 개선 효과가 있는 것으로 보고하고 있다. 특히 최근 보고인 당귀가 저산소로 손상된 성상세포의 교세포화에 미치는 영향에 대한 보고17)에서는 당귀가 허혈성 뇌 질환을 조절하며 교세포화를 유도하는 GFAP, CD81를 감소시켰고. 저산소증으로 유발된 환경에서 당귀 추출액은 세포막, 핵의 파괴를 감소시켰으며 더불어 GFAP, CD81을 감소시켜 교세포화는 억제되었다.위의 보고와 함께 이번 연구 결과로 당귀는 허혈성 뇌손상 회복에 영향을 줄 수 있어 앞으로 뇌손상 질환 연구 및 임상에 다용될 수 있으리라 사료된다.
또한 허혈성뇌질환에 대하여 당귀는 동맥경화증억제, 혈관 확장 및 미세순환 개선, 항응고효과, 소염효과, 항산화효과 등에 의하여 나타나며, 이런 효능은 경구 투여 또는 복강내 주사 및 정맥 주사 등 투여 방법을 달리한 경우에서도 공통적으로 나타난다 하였다56).
Chen 등57)은 당귀추출액을 백회 및 대추혈에 혈위 주사한 결과 경색 부위에서의 재관류로 인한 Bcl-2의 발현의 증가의 조절 및 Bax의 발현을 증가 억제로 허혈성 뇌질환의 증상을 개선시킨다고 보고하였다. 이런 효능이 발현되는 용량에 대하여도 Yang58) 등은 정맥주사의 경우 실제 임상에서 25% 당귀 주사제를 250ml/일로 투여하므로 흰쥐를 대상으로 하는 동물실험에서 15ml/kg으로 효능이 발현되었다고 보고하였고, Liao 등59)은 복막 투여의 경우 당귀 5g/kg의 용량으로 뇌혈류개선 효과가 있었다고 보고하여, 정맥주사의 유효 농도가 경구투여보다 낮은 것으로 보고하고 있다.
한편 투여별 약물의 대사에 관한 연구에서 글루코사민의 경우 동일한 용량을 투여하였을 때 정맥주사는 최대유효농도가 147ug/ml이었고, 복막투여는 184ug/ml이었으며60), 경구 투여시에는 15.0 ug/ml이라 하여 정맥주사 투여시의 농도가 경구투여 보다 높다고 보고하였다. 또 Choi 등61)은 약물의 생체 이용률의 경우 정맥주사가 100%일 때, 경구투여는 40.8%, 복막 투여는 79.4%, 직장내투여는 38.7%에 이른다고 하였다.
하지만 당귀의 약력학에 대한 연구62)에서 당귀는 경구로 200mg/kg 투여시 1 시간 정도 후에 최대 혈중농도를 보였으며 주성분 중의 하나인 decrusinol의 농도는 1,278.26 ug/ml이었으나, 2mg/kg의 농도로 정맥투여시 최대 혈중농도는 14.99 ug/ml로 나타났고 반감기는 약 56-58시간 정도라고 하였다. 따라서 이런 계산을 적용하면 일부 성분만을 대상으로 한 경우 당귀의 혈중 농도는 정맥 투여가 경구투여보다 같은 용량에서 낮게 나타남을 보고하고 있어서, 향후 효과적인 투여 용량 및 방법에 대한 연구가 필요할 것으로 사료된다.
일시적 뇌허혈 후 회복에 미치는 영향을 규명하기 위하여 중대뇌동맥폐쇄를 유발시킨 흰쥐에 당귀를 정맥주사하고 뇌경색 부위의 크기 감소, 피라미드 세포의 수 그리고 GFAP 및 CD81의 발현 변화를 관찰한 결과 다음과 같은 결론을 얻었다.
1. 당귀 추출물 정맥주사는 MCAO 모델 흰쥐의 뇌허혈 부위의 크기를 감소시켰다.
2. 당귀 추출물 정맥주사는 해마의 세포사를 억제하였다.
3. 당귀 추출물 정맥주사는 GFAP 발현을 감소시켰다.
4. 당귀 추출물 정맥주사는 CD81 발현을 감소시켰다.
5. 당귀 추출물 정맥주사는 c-Fos 발현을 증가시켰다.
6. 당귀 추출물 정맥주사는 ERK 발현을 감소시켰다.
따라서 당귀 추출물 정맥주사로 뇌허혈 손상으로 발생하는 경색부위의 감소, 세포사 억제, GFAP발현 감소, CD81의 발현 감소, c-Fos 발현 증가와 ERK 발현 감소 등이 나타나 교세포화 억제가 있음을 관찰하였으며 향후 뇌혈관질환의 치료에 유용하게 활용할 수 있을 것으로 사료된다.