2Reactive Oxygen Species(ROS) are continuously produced at a high rate as a by- product of aerobic metabolism. Since tissue damage by free radical increases with age, the reactive oxygen species(ROS) such as hydrogen peroxide(H2O2), nitric oxide(NO). Several lines of evidence provided that ROS appears to cause to develop aging-related various diseases such as cancer, arthritis, cardiovascular disease.
Our reserch objective was to examine the in vitro biological activity of Scolopendrid Pharmacopuncture, including the total poly-phenol content, DPPH radical scavenging, ABTS radical scavenging, Superoxide dismutase(SOD)-like activity, Nitrite scavenging ability.
The total poly-phenol contents of Scolopendrid Pharmacopuncture was 35.859mg/L. Elctron donation ability on DPPH was 36.82%. The 2,2'-azinobis-3-ehtlbezothiazoline-6- sulfonic acid radical decolorization (ABTS) was 84.7%. The superoxide dismutase (SOD)-like activities of Scolopendrid Pharmacopuncture was 44.33%. The nitrite scavenging effects were pH dependent, and were highest at pH 1.5(45.2%) and lowest at pH 6.0(11.3%). We conclude that Scolopendrid Pharmacopuncture may be useful as potential sources of antioxidant.
오공(Scolopendra subspinipes mutilans)은 왕지네과에 속하는 지네류의 전충을 말린 것을 말하며, 천룡, 낭저, 무가천 및 백족 등 많은 이명을 가지고 있는 동물성 한약이다1).
오공은 그 형상이 마치 사람의 척추처럼 마디마디 이어져 있고, 그 움직임이 신속하여 예로부터 민간요법의 하나로 관절질환으로 인한 통증에 가루를 내어 먹거나 술에 타 먹음으로써 널리 이용하였다2). 신농본초경에 최초로 기록된 이래, 본초강목에서는 소아의 견풍, 전간, 경련, 단독, 독창, 나력, 충사교상 등을 치료한다고 하였다3,4).
오공의 진정효과는 중추신경의 흥분상태를 완화함으로써 나타나는 것으로 알려져 있다. 본 생약에는 2종의 유독성분 즉, histamine류 물질 및 용혈성 단백질이 함유되어 있으며 tyrosine, leucine, formic acid, 지방유, cholesterol 등도 함유한다5,6,7).
한의학에서 전해 내려오는 치료방법 중에서 사람들이 쉽게 떠올릴 수 있는 것은 침과 약 두 가지이다. 그러나 현대 기술 장비의 발전에 힘입어 침과 약의 형태에도 변화가 이루어지고 있으며 이에 약침도 변화되어 나타난 치료방 법 중의 한 가지이다8). 또한 약침의 약리학적 작용으로는 항종양, 진정작용, 항진균 작용이 있으며 결핵병의 치료, 백일해의 치료, 암증상의 치료에 관한 임상결과를 보고하였다8)
약침요법은 경락이론에 입각한 침구요법과 기미론에 입각한 약물요법이 혼합된 치료법으로 한 번의 시술로써 침과 약의 두 가지 효과를 거둘 수 있고 더 나아가 상승효과를 기대할 수 있는 치료법이다. 또한, 소화관을 통과하지 않기 때문에 약효가 신속히 나타나고 경구 투여로는 효과를 볼 수 없는 약에도 사용할 수 있으며 의식이 분명치 않아 약을 복용할 수 없는 환자에게도 효과적인 치료방법이 될 수 있다는 장점이 있다9).
오공약침은 2002년에 김성철교수가 왕지네에서 독성이 있는 두족미를 제거하고 개발하여 요추간판탈출증 치료용 조성물로 특허를 획득한 약침으로 현재까지 임상연구결과에서는 요추간판탈출증 치료에 관련하여 고10) 등과 최11) 등이, 항경련 효과에 관련하여 송12) 등의 임상적인 연구보고만 있을 뿐 항산화작용에 관한 생리활성에 관련하여서는 연구가 미흡한 실정이다.
따라서 본 연구는 수순추출법으로 조제한 오공 약침액의 항산화 효과와 관련한 생리 활성에 관한 실험연구를 하여 유효한 결과를 얻었기에 이에 발표하고자 한다.
본 연구는 水醇추출법(水提-Alcohol浸法)으로 대한약침학회에서 제조한 오공 약침액을 사용하였다.
1) 재료
오공약침제조를 위하여 수순추출법으로 제조한 오공약침액을 사용하였다. 우선 頭足尾를 제거한 국산 오공분말 128.6g 건조중량을 측정하여 시료를 준비하였다. 시료를 비커에 넣고 증류수 1000㎖를 부어 Electronic magnetic stirrer(Tost MS 300, KOREA)를 이용하여 3시간 정도 교반한다. 냉장고에 그대로 두어 가라앉은 재료가 손실되지 않게 윗물을 따라서 병에 넣고 남은 찌꺼기에 다시 증류수를 부어 Electronic magnetic stirrer로 교반한다. 위와 같은 작업을 반복하여 다시 증류수를 부어 증류수 3차 추출을 한다. 105℃~107℃, 5-6시간 전탕하여 추출물을 얻는다. 이 추출용액을 와트만 여과지 2번 8㎛으로 걸러 그 여액을 Rotary Vacuum evaporator(EYELA, JAPAN)로 70℃에서 3시간감압 농축한다. 농축된 량을 측정하여 90% 알코올로 조정한뒤 1시간 교반하여 와트만여과지 2번 8㎛으로 거르고 그 여액을 Rotary Vacuum evaporator로 농축한다. 농축된 량을측정하여 80% 알코올로 조정한 뒤 1시간 교반하여 와트만 여과지 2번 8㎛으로 거르고 그 여액을 Rotary Vacuum evaporator로 농축한다. 또다시 농축된 량을 측정하여 70% 알코올로 조정한 뒤 1시간 교반하여 와트만 여과지 2번 8㎛으로 거르고 그 여액을 Rotary Vacuum evaporator로 농축한다. 이 때 알코올을 완벽하게 다 제거하기 위해서 증류수를 약간더 넣어 Rotary Vacuum evaporator로 재감압 농축한다. 전량을 최소 200㎖에서 최대 300㎖로 하여 와트만 여과지 2번 와트만 여과지 0.45㎛ム, 와트만 여과지 0.1㎛로 여과하여 예비동결후 Freezing dryer(일신 KOREA)로 200시간 동안 동결건조하여 오공건조 분말 9.88g(수율 7.68%)을 얻었다.
2) 시약
Sodium carbonate, Gallic acid, Folin-Ciocalteu's phenol reagent, Potassium persulfate, 1,1-diphenyl- 2-picrylhydrazyl(DPPH), 2,2‘-azino-bis-3- ethylbenzothiazoline-6-sulphonic acid(ABTS), Trolox, Pyrogallol, Ascorbic acid, Sodium nitrite, Citrate buffer, Acetic acid, Naphtylamine, Trisbase, Dimethyl sulfoxide(DMSO) 등은 Sigma(St. Louis, MO, USA)에서 구입하였고, Sulfanilic acid는 1급 시약 '(Kanto chemical, Japan)을 사용하였다.
오공 약침액의 총 폴리페놀 함량은 Dewanto13)의 방법에 따라 Folin-ciacalteu rearent가 시료의 폴리페놀 화합물에 의해 환원된 결과 몰리브덴 청색으로 발색하는 것을 원리로 분석하였다. 오공 약침액 200㎕에 Folin-Ciocalteau's phenol regent 200㎕을 넣고 혼합하여 실온에서 3분간 정치한 뒤 2% Na2CO3 용액 200㎕을 가하여 혼합 한후 실온에서 1시간 방치시키고 750nm에서 흡광도를 측정하였다. 총 페놀함량을 정량분석하기 위해 표준물질인 Gallic acid를 증류수에 녹여 일정한 농도별로 조제하고 시료와 동일한 방법으로 실험하여 검량선을 작성하고 시료의 총 페놀 함량을 측정하였다.
DPPH assay는 Dietz등14)의 실험법을 따랐다. 오공 약침액과 0.2mM DPPH 시약을 20분간 반응시킨 뒤 Spectrophotometer를 사용하여 520nm에서 흡광도를 측정하여 DPPH의 환원에 의한 흡광도 감소를 조사하였다. 무처리구와 처리구의 값을 비교하여 free radical 소거활성을 결정하였다. 이때 기존의 항산화제인 Ascorbic acid를 대조구로 사용하였다.
DPPH radical 소거능은 다음과 같이 구하였다.
DPPH scavenging ability (%) = 시료 처리구 흡광도 / 무처리구 흡광도 × 100
4. Superoxide dismutase(SOD) 유사활성 측정
SOD 유사활성 반응에서 pyrogallol은 물에 존재하는 Superoxide radical에 의해 자동 산화가 일어나 갈색물질을 형성하여 이를 분광광도계로 분석하고, Superoxide 포착활성이 있는 물질이 존재 시 pyrogallol의 산화속도가 낮아지는 원리를 이용하여 Superoxide 포착활성을 간접적으로 측정할 수 있다15,16).
SOD 유사활성은 Markund17)등의 방법에 따라 측정하였다. 오공 약침액 0.2㎖에 pH 8.5로 보정한 Tris-HCl buffer(50mM tris amino-methane과 10mM EDTA) 2.6㎖과 7.2mM 0.2㎖을 첨가하여 25℃에서 10분간 반응 시킨 후 1N HCl을 0.1㎖ 가하여 반응을 정지시켰다. 반응액 중 산화된 pyrogallol의 양은 420nm에서 흡광도를 측정하였다.
SOD 유사활성 측정은 다음과 같은 식으로 계산하였다.
SOD-like activity (%) = {'1-(시료 처리구 흡광도 / 무 처리구 흡광도)} × 100
ABTS radical을 이용한 항산화능의 측정은 potassium persulfate와의 반응에 의해 생성되는 ABTS free radical이 샘플 내의 항산화 물질에 의해 제거되어 radical 특유의 색인 청록색이 탈색되는 것을 이용한 방법으로 Van den Berg18)등의 방법을 변형하여 측정하였다. 7mM 2.2-azino-bis(3-rthylbenzthiazoline-6-sulfonic acid)(ABTS)와 2.45mM potassium persulfate를 최종농도로 혼합하여 실온인 암소에서 24시간 동안 방치하여 ABTS+..을 형성시킨 후 732nm에서 흡광도 값이 0.9(±'0.1)이 되게 증류수로 희석하였다. 희석된 ABTS radical 용액 950㎕에 농도별 오공 약침액 50㎕를 가하여 혼합 후 흡광도의 변화를 위해 10분 후에 측정하였으며 표준물질로서 Trolox를 동량 첨가하였다.
ABTS scavenging ability (%) = 1 - (시료 처리구 흡 광도 / 무처리구 흡광도) × 100
아질산염 소거작용은 Griess 시약인 sulfanilamide와 N-1-naphylethylenediamine dihydrochloride가 NO2 와 반응하여 azo 화합물을 형성하고 이 azo화합물의 흡광도가 520nm에서 최대값을 나타내므로 이를 이용하여 측정할 수 있다. 각 시료의 아질산염 소거작용은 Kato 등19)의 방법에 의하여 다음과 같이 측정하였다. 1mM NaNO2 용액 2㎖에 오공 약침액 1㎖을 가하고 0.1N HCl, 0.2M 구연산 완충용액을 이용하여 pH를 각각 1.5, 3.0, 6.0으로 조절하여 반응용액을 10㎖로 하였다. 이 용액을 37℃에서 1시간 반응시킨 후 각 반응액을 1㎖씩 취하여 2% 초산용액 5㎖와 Griess 시약(30% HCl로 제조한 1% naphthylamine과 1% sulfanilic acid의 1 : 1혼액) 0.4㎖를 가하여 잘 혼합한 후 실온에서 15분간 방치시킨 후 생성되는 azo화합물의 흡광도를 520nm에서 microplate reader로 측정하여 잔존하는 아질산염량을 비교하였다. 대조구로는 Griess 시약 대신 증류수를 0.4㎖ 가하여 위와 같은 방법으로 실시하였으며, 아질산염 소거작용은 화합물을 첨가한 경우와 첨가하지 않은 경우의 흡광도 차이에 의한 백분율로 나타내었다.
아질산염 소거작용은 다음과 같이 구하였다. Nitrite scavenging ability (%) = [1-{(A-'C)/'B}] × 100
A : NaNO2 용액에 시료와 Griess를 첨가한 흡광도
B : NaNO2 용액에 Griess를 첨가한 흡광도
C : NaNO2 용액에 시료와 증류수를 첨가한 흡광도
페놀성 화합물은 식물계에 널리 분포되어 있는 2차 대사산물의 하나로 다양한 분자량을 가진다. 이들은 phenol hydroxyl을 가지기 때문에 단백질 및 거대분자들과 결합하는 성질을 가지며, 항산화효과 및 항균활성 등의 다양한 생리활성을 나타낸다. 일반적으로 항산화 활성을 나타내는 것은 페놀성 화합물이 작용하는 것으로 알려져 있으며 20,21,22)항산화 활성이 증가함에 따라 총 페놀성 함량도 증가 한다.
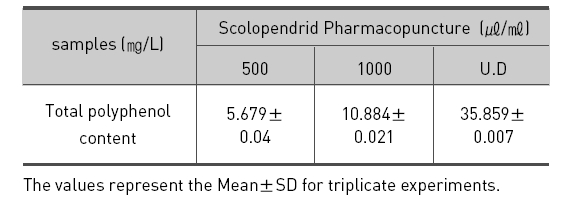
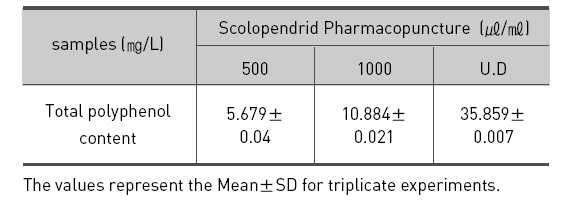
오공 약침액의 총 페놀 함량을 측정한 바는 Table.1과 같다. 오공 약침액의 폴리페놀 함량은 농도별인 500㎕/ ㎖, 1㎖/㎖, 오공 약침액 원액 순으로 5.679㎎/L, 10.884㎎/L, 35.859㎎/L로 나타났다. 이는 폴리페놀 함량을 조사한 Lim 등23)의 석창포 32.05 곽향 23.76, 택사 4.22, 서 등40)의 자하거 24.641과 비교하면 오공 약침액에서의 페놀성 물질의 함량이 높은 것으로 분석된다.
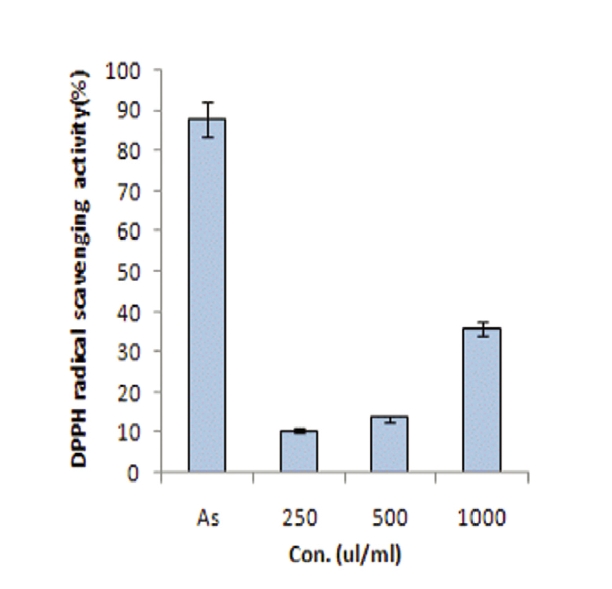
인체내의 free radical은 지질, 단백질 등과 결합하여 생체의 노화를 일으키는 물질이며, free radical을 제거할 수 있는 천연물에 대한 연구가 끊임없이 이루어지고 있다. 특히, DPPH(1,1-diphenyl-2-picrylh- ydrazyl) radical 소거법은 항산화 물질의 전자공여능으로 인해 방향족화합물 및 방향족 아민류에 의해 환원되어 짙은 자색이 탈색에 의해 나타내는 정도를 지표로 하여 항산화능을 측정하는 방법이다24).
오공 약침액의 DPPH radical 소거능을 측정한 바는 Fig.1과 같이 오공 약침액의 각각의 농도별 250㎕/㎖, 500㎕/㎖, 1㎖/㎖에서 10.43%, 13.60%, 36.82%로 나타났다. 이는 비교 대조군인 Ascorbic acid의 1mM의 87.69%와 이 등25)의 녹용 추출물의 DPPH에 대한 전자공여능은 시료 농도 100㎎/㎖ 조제하여 활성을 측정하였을때의 67.1%, 서 등40) 자하거 49.4%보다는 낮은 결과이지만 Moon 등26)이 보고한 약용식물의 메탄올 추출물인 지구자엽(26.58%), 박하(26.27%), 식방풍(5.58%)보다는 높은 전자공여능을 나타내었다.
3. Superoxide dismutase(SOD) 유사활성 측정
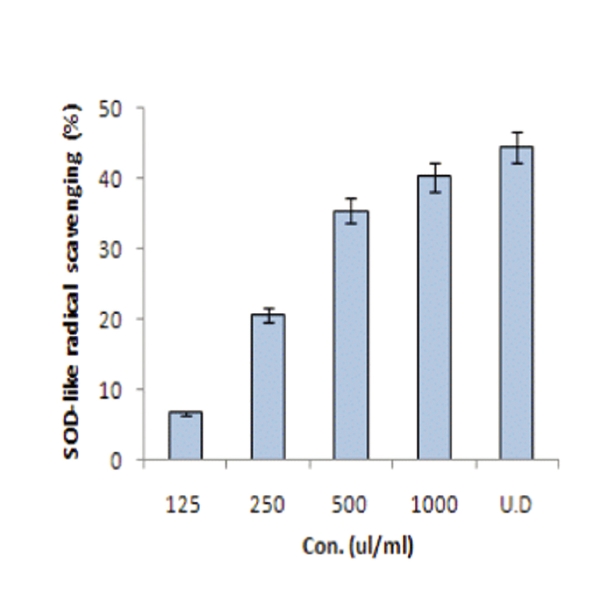
SOD는 superoxide(O2-)를 정상 상태의 산소로 환원 시킴으로써 superoxide가 관여하는 각종 질병이나 노화를 억제할 수 있는 효소이며, phytochamical은 SOD와 유사한 역할을 하는 저분자 물질로 superoxide의 반응성을 억제하고 superoxide로부터 생체를 보호하는 것으로 보고되고 있고, 이를 제거함으로써 산화적 장애를 방어하고 노화억제의 효과를 기대할 수 있을 것으로 보고되고 있 다27).
오공 약침액의 SOD 유사활성능을 측정한 결과는 Fig.2과 같이 농도별로 125㎕/㎖, 250㎕/㎖, 500㎕/㎖, 1㎖/㎖, 오공 약침액 원액에서 각각 6.66%, 20.55%, 35.42%, 40.16%, 44.33%로 나타났다. 이는 서 등40) 1㎖/㎖ 당 자하거 50.87%보다는 낮고 Na 등28)의 실험에서 감초가 물과 50% 에탄올 추출물에서 각각 37.49%, 42.75%로 오공약침액과 유사한 결과를 나타냈으나, 정등29)의 연구보고에서 60여종의 약용작물에 대한 항산화검증결과 평균 34.77%이므로 오공 약침액이 보통의 약용식물보다 superoxide의 반응을 억제하고 superoxide로 부터 생체를 보호하는 효과가 높다고 평가된다.
ABTS 항산화 측정법은, DPPH와 같은 radical 소거법에 의한 항산화능 측정법이라는 점에서는 같지만 화학반응을 통해 free radical이 유발된 용액에 시료를 넣어 항산화를 측정한다는 점에서 다르다. 또한 free radical을 유발하여 용액을 준비할 때 시간이 소모되지만 항산화 측정 실험에서는 빠른결과를 볼 수 있는 장점이 있다. DPPH는 pH, 빛 그리고 온도에 영향을 받는 반면에 ABTS는 pH의 변화에 민감하게 작용하지 않는 장점이 있다30). ABTS법은 다른 간접적인 방법 중에서 가장 많이 사용되는 방법이다. 이 방법은 Miller31)등에 의해서 1993년에 처음으로 고안된 것으로 시료의 생리활성을 측정하기 위해 사용되었지만 이후 식품과 천연 수용성 페놀성 물질을 시험하기 위해 널리 응용되었다. 이 방법은 페놀성 화합물을 함유한 시료의 첨가로 인해 2,2‘-azinobis(3-ethyl-benzothiaziline-6-sulfonate, ABTS)가 산화되어 라디칼 양이온(radidal cation)인 ABTS.+가 생성되고 이것의 분해를 측정하여 항산화 활성을 계산하는 방법이다. ABTS는 600-750nm의 범위에서 강한 흡수를 보여주며 이로 인해 분광분석으로 쉽게 측정할 수 있다. 페놀성 화합물이 없을 경우 ABTS는 비교적 안정하지만, 페놀성 화합물과 같은 수소공여체(H-donor)와는 강렬하게 반응하여 무색의 ABTS로 변환된다. 따라서 항산화 활성은 페놀성 화합물을 함유한 시료와 반응하여 소비된 ABTS의 양을 측정한다.
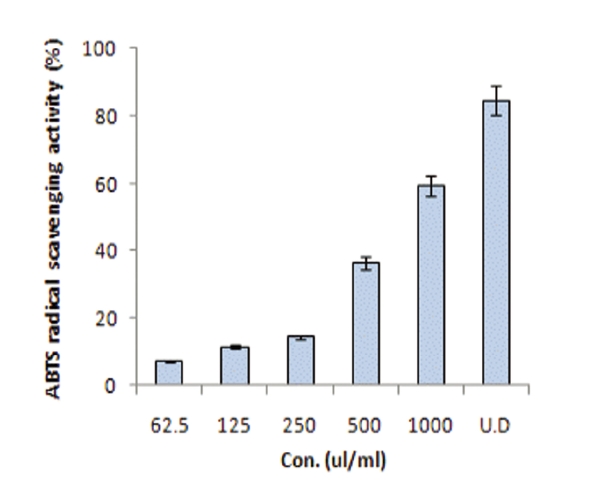
오공 약침액의 ABTS free radical 소거활성을 측정한 결과는 Fig.3과 같다.
ABTS free radical 소거활성 법에서 표준물질로 사용되는 trolox는 100㎕/㎖에서 90.2% 의 소거능을 보여 Rice-Evans 등32), Kim 등33)의 결과와 일치하였고, 오공약침액 농도별에 따른 소거 활성은 각각의 농도 62.5㎕/㎖, 125㎕/㎖, 250㎕/㎖, 500㎕/㎖, 1㎖/㎖, 오공 약침원액에서 7.3%, 11.7%, 14.6%, 36.6%, 59.3%, 84.7%로 농도 의존적으로 나타났다. 이는 Kim 등34)에서는 송이즙의 농도별로 1㎎/㎖, 10㎎/㎖, 50㎎/㎖에서 각각 7.0%, 81.7%, 91.8%의 소거능을 나타내어 오공 약침액의 84.7%와 유사한 항산화력을 나타내었으며 서 등40) 자하거 1㎖/㎖에서 50.87%보다 높은 결과를 나타내었다. 또한 오공 약침액의 농도가 증가할수록 항 산화력도 증가하는 경향을 보여 농도에 따라 유의한 차이를 나타내었다.
Nitric oxide는 생체내에서 NO synthase (NOS)라는 효소의 촉매작용을 통해 L-araginine로부터 생성되는 반응성이 강한 자유라디칼이다. NO는 생리적인 현상인 혈압조절과 신경전달 매개체와 작용하며, 면역반응에 중추적인 역할을 하고 있으며, 뼈를 형성하는 chonodrocyte와 synoviocyte 같은 세포에서도 발현되고 있다35). 발암에 관련된 물질로 알려진 nitrite는 독성을 가지고 있고, nitrate도 체내, 체외에서 효소작용에 의해 nitrite로 환원되기 때문에 일정농도 이상 섭취할 경우, 식품내의 amine 류와 반응하여 발암물질인 nitrosamine을 생성하고, 또한 혈액 중의 hemoglobin이 산화되어 methemoglobin을 형성하여 methemoglobin 증 등 각종 중독을 일으키는 것으로 알려져 있다36).
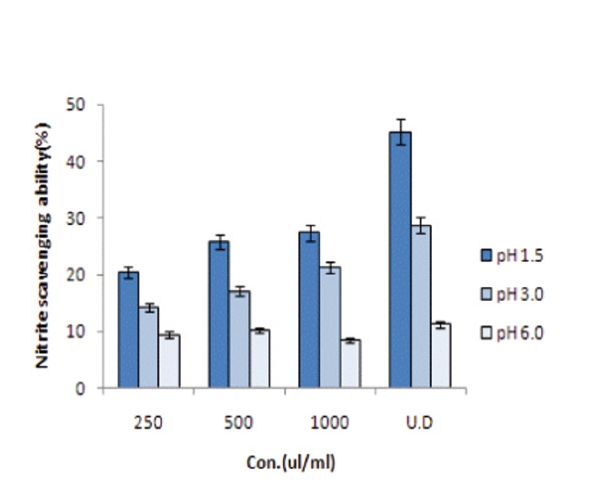
낮은 산성조건에서 쉽게 발암성 물질인 nitrosamine을 쉽게 생성하는 아질산염에 대하여 위장의 pH 조건과 유사한 pH 1.5, 3.0, 6.0의 조건으로 농도에 따른 오공 약침액의 아질산염 소거능을 측정하였다(Fig.4). pH 1.5에서 시료의 농도별에 따른 소거활성은 각각의 농도 250㎕/㎖, 500㎕/㎖, 1000㎕/㎖, 오공 약침액 원액에서 20.45%, 25.8%, 27.45%, 45.2%의 소거율을 나타냈으며 pH 3.0에서는 14.2%, 17.1%, 21.3%, 28.8%, pH 6.0에서는 9.5%, 10.2%, 8.5%, 11.3%로 나타나 강한 산성에서는 농도 의존적으로 일정한 활성을 나타냈다. 이는 이 등37)은 녹용 열수추출물 100㎎/㎖에서 pH 1.2, pH 6.0에서 각각 64.0%, 38.0%, 서 등40) 자하거 약침액에서는 PH 1.5에서 400∼1000㎍/㎖ 19.3%∼52.8%로 오공 약침액 보다 약간 높은 소거율을 나타냈고 이38)의 구릿대 잎의 에탄올 추출물 500~1000㎍/㎖, pH 1.2에서 17.24%∼ 44.24%로 오공 약침액의 아질산염 소거능과 유사한 효과를 나타냈다. 그러나 Kim 등39)의 팽이버섯, 하수오, 행인, 오미자 등이 20% 이하의 아질산염 소거능을 나타내었다는 결과와 비교하면 오공 약침액은 높은 소거능을 나타내는 것으로 사료된다.
수순추출법으로 제조한 오공의 항산화 효과에 대한 생리적 활성연구결과 다음과 같은 결론을 얻었다.
1. 오공 약침액의 폴리페놀 함량은 농도별인 500㎛/㎖, 1㎖/㎖, 오공 약침액 원액 순으로 5.679㎎/L, 10.88 4㎎/L, 35.859㎎/L로 나타났다.
2. 오공 약침액의 각각의 농도별 250㎛/㎖, 500㎛/㎖, 1㎖/㎖에서 10.43%, 13.60%, 36.82%로 나타났다.
3. 오공 약침액의 SOD 유사활성능을 측정한 결과 농 도별로 125㎛/㎖, 250㎛/㎖, 500㎛/㎖, 1㎖/㎖, 오공 약 침액 원액에서 각각 6.66%, 20.55%, 35.42%, 40.16%, 44.33%로 나타났다.
4. 오공 약침액 농도별에 따른 ABTS free radical 소거 활성은 각각의 농도인 62.5㎕/㎖, 125㎕/㎖, 250㎕/㎖, 500㎕/㎖, 1㎖/㎖, 오공 약침 원액에서 7.3%, 11.7 %, 14.6%, 36.6%, 59.3%, 84.7%로 농도 의존적으로 나타났다.
5. pH 1.5에서 시료의 농도별에 따른 아질산염 소거활성은 각각의 농도 250㎕/㎖, 500㎕/㎖, 1000㎕/㎖, 오공 약침액 원액에서 20.45%, 25.8%, 27.45%, 45.2%의 소거율을 나타냈으며 pH 3.0에서는 14.2%, 17.1%, 21.3%, 28.8%, pH 6.0에서는 9.5%, 10.2%, 8.5%, 11.3%로 나타나 강한 산성에서는 농도 의존적으로 일정한 활성을 나타냈다.
[Table 1.] Contents of total polyphenol by ScolopendridPharmacopuncture.
Contents of total polyphenol by ScolopendridPharmacopuncture.