굴은 양질의 단백질과 타우린, 미네랄 및 비타민을 많이 함유하고 있는 우수한 영양식품이다(Son et al., 2014). 그러나 굴의 조직은 다른 패류보다 연하여 소화분해되기 쉬운 특징을 가지고 있으며, 가공 및 유통 중 부적절한 온도조건으로 인하여 품질 저하가 빠르게 진행되는 단점을 가지고 있다(Park et al., 2006). 또한 생굴은 서식환경 주위에 부유하는 식물플랑크톤 등 먹이 생물을 여과 섭취하여 영양을 공급 받을 뿐만 아니라 인체에 유해한 세균이나 바이러스 등도 쉽게 축적할 수 있다(Potasman et al., 2002; Feldhusen, 2000; Cliver, 1997; Grimes, 1991). 이러한 굴의 위생안전성을 확보하기 위하여 자연정화 및 인공정화를 연구하기도 하였으며, 동결이나 첨가물을 이용하는 방법과 방사선 조사 및 각종 열처리, 초고압처리 등에 관한 연구가 보고되었다(Jeong et al., 2015; Park et al., 2008; Xiao et al., 2011; Oshima et al., 1993). 또한 굴을 50℃에서 10분동안 저온살균 처리하면 비브리오패혈증이 급격히 감소할 뿐만 아니라 가열처리에 의한 외관이나 향의 변화도 없다고 보고되었다(Cook and Rupple, 1992; Andrews et al., 2000).
일반적으로 식품산업에서는 식품의 품질 보존과 가치 향상을 위하여 다양한 가공 및 저장 조작을 행하게 되는데, 대부분의 상업적 가공식품 제조를 위한 공정에는 가온, 조리, 살균 등 열처리 공정(thermal processing)을 한 가지 이상 포함하게 된다(Chung et al., 2012). 수산물에 대한 각종 열처리는 boiling (Sablani et al., 1998), blanching, frying (Ou and Mittal, 2007; Southern et al., 2000; Zorrilla and Singh, 2000; Farkas et al., 1996), steam (Cheigh et al., 2011; Chen et al., 1993), microwave (Hu and Mallikarjunan, 2004), roasting (Chang et al., 1998) 등의 방법이 이용되고 있으며, 이들에 대한 열처리 모델 등이 연구되었다.
그러나 열처리는 미생물 활성을 억제시켜 저장성을 높이지만 단백질, 비타민, 조직감, 향기, 색 등 식품의 영양 및 관능적인 변화, 기능적 특성 변화 등의 부가적인 변화도 수반하게 된다(Tijskens et al., 1997; Arroqui et al., 2001).
따라서 본 연구에서는 생굴의 가공 및 위생안전성 확보를 위하여 이용될 수 있는 열처리가 영양성분 변화에 미치는 효과를 조사하여, 생굴을 이용한 새로운 가공식품 개발과 위생적인 처리조건 구명을 위한 기초자료로 활용하고자 하였다.
생굴은 통영일원 양식장에서 3월에 채취하여, 5℃ 이하 냉장 상태로 실험실로 운반하였다. 열처리에 의한 굴의 영양성분 변화를 조사하기 위하여, 85℃ 항온수조에서 5, 10, 15, 20분 동안 침지시켜 열처리를 실시하였으며, 100℃는 항온수조와 고압멸균기(HS 5020S, Hanshin Co. Ltd., Korea)를 이용하여 각각 5, 10, 15, 20분 동안 열처리를 실시하였다. 각 열처리 조건에 따라 사용된 굴은 25개체이며, 껍데기가 있는 각굴을 열처리한 후, 탈각하고 알굴을 균질화하여 시료로 사용하였다.
일반성분의 측정방법으로 수분은 105℃에서 상압가열 건조법, 조단백질은 semi-micro Kjeldahl법, 조지방은 Soxhlet 추출법, 조회분은 건식회화법으로 각각 측정하였다(AOAC, 1995).
Folch et al. (1957)의 방법에 의하여 시료의 5배량의 chloroform:methanol (2:1 v/v)용액으로 지질을 추출한 후, 14% BF3-methanol을 이용하여 지방산의 methyl ester하여, gas chromatography (GC 2010plus, Shimadzu, Japan)를 이용하여 분석하였다.
시료 0.2 g을 6 N HCl로써 110℃의 heating block에서 24시간 가수분해하였다. 시료용액을 감압 농축시킨 후, pH 2.2의 구연산 완충액으로 50 mL로 정용하여 0.20 μm membrane filter로 여과하여 아미노산 분석기(Sykam 4300, Sykam, Germany)을 이용하여 분석하였다.
비타민 A 함량은 Kwak et al. (2004)의 방법을 일부 수정하여 사용하였다. 시료 3 g을 갈색 메스플라스크에 취한 후 ethanol 30 mL, 60% KOH 용액 3 mL, 그리고 10% pyrogallol 1 mL를 첨가하여 이를 환류 냉각기에서 30분간 비누화시킨 후, 실온으로 냉각시켜 증류수 30 mL를 가해 갈색 분액깔때기로 옮겼다. 플라스크는 증류수와 petroleum ether로 헹군 후, 분액깔때기에 혼합하여 방치시킨 후 물 층을 별도의 갈색분액깔때기에 옮기고 petroleum ether 50 mL씩 가하여 2회 추출하였다. 추출된 petroleum ether 액을 증류수 10 mL씩 phenolphthalein 시약으로 정색이 되지 않을 때까지 수세하였고, petroleum ether 층을 sodium sulfate를 가해 탈수하고 갈색 플라스크에 옮겼다. Petroleum ether 추출액은 25℃ 에서 감압 농축하여 methanol 5 mL로 정용하고 0.25 μm membrane filter로 여과하였다. 이 시료액은 Develosil RP-Aqueous C30 (4.6×250 mm, 5 μm particle size, Phenomenex, Tokyo, Japan)칼럼을 이용하여 HPLC(Surveyor Plus HPLC system, Thermo, USA)로 분석하였다.
실험분석 결과는 SAS (SAS Institute, Cary, NC, USA)을 이용하여 각 실험군의 평균과 표준편차를 구하고, 시료간의 차이 검증은 일원배치 분산분석(ANOVA)을 사용하였으며, Duncan’s multiple range test에 따라
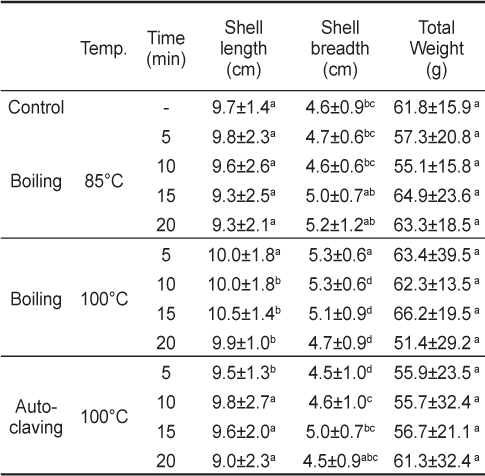
시료로 사용된 각굴의 평균 각장과 각고는 개체간의 차이가 있었으나 평균 무게는 유의적인 차이가 없었다(
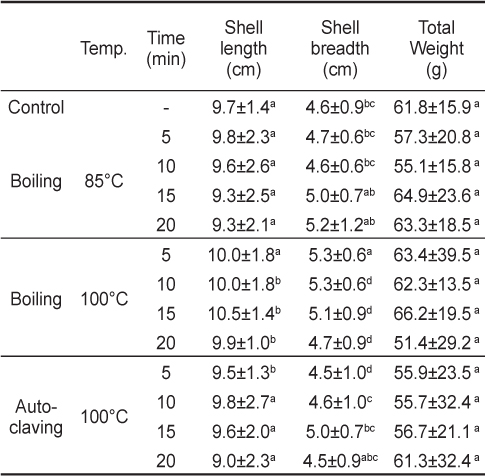
The profile of oyster Crassotrea gigas by various heat treatment at 85℃, 100℃ boiling water bath, and 100℃ autoclaving for 5, 10, 15, and 20 min
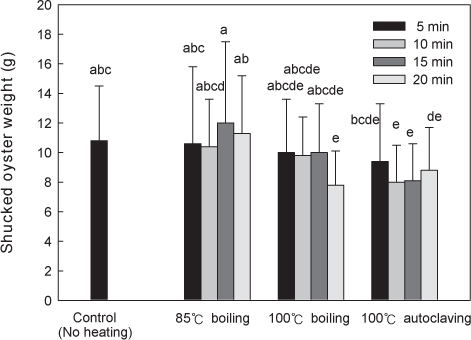
대조구 알굴의 평균무게는 10.8 g이었으며, 85℃에서 열처리한 알굴의 평균무게는 10.4-12.0 g으로 열처리 시간이 길어질수록 다소 증가하는 경향이었지만 열처리 시간에 따른 평균무게의 유의적인 차이는 없었다. 반면에 100℃ 항온수조에서 20분 열처리 후 굴의 평균 무게는 7.8-10.0 g으로 다른 열처리 시간에 비하여 변화가 큰 것으로 나타났다. 또한 100℃ 고압멸균기에서 열처리 후 굴의 평균무게는 열처리 시간에 따라 각각 9.4 g, 8.0 g, 8.1 g, 8.8 g이었다(Fig. 1). 대조구와 비교하여 열처리 후에 알굴의 무게 변화는 85℃ 열처리구는 2.3-3.6% 감량되었으며, 15분 이상에서는 대조구에 비하여 높아졌으며, 이는 개체차에 의한 것으로 사료된다. 100℃ 항온수조에서 15분이전까지 열처리 한 굴은 대조구에 비하여 7.6-9.5% 감량되었으며, 20분 동안 열처리한 굴은 27.8% 감량되었다. 100℃ 고압멸균기를 이용하여 열처리한 굴은 13.0-26.1% 감량되었으며, 10분 동안 열처리한 경우가 26.1%로 가장 감량 비율이 높았다(Fig. 1).
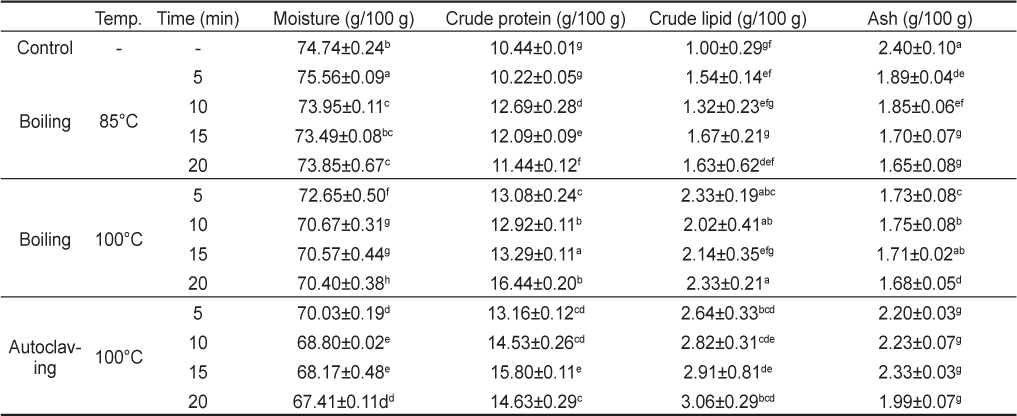
굴 열처리에 의한 수분함량은 대조구에 비하여 85℃에서 5분 동안 열처리한 굴을 제외하고는 다소 감소하였으며, 이에 반하여 조지방 함량은 열처리에 의하여 증가하였다. 특히 열처리가 길어질수록 조지방 함량은 증가하였으며, 85℃에서 열처리한 것보다 100℃에서 열처리한 굴의 조지방 함량이 더 높았다. 조단백질 함량도 조지방 함량 변화와 유사하여 열처리 온도와 시간이 증가할수록 상승하였다(Table 2).

The change of proximate composition of oyster Crassotrea gigas by various heat treatment at 85℃, 100℃ boiling water bath, and 100℃ autoclaving for 5, 10, 15, and 20 min
대조구의 조지방과 조단백질 함량은 각각 1 g/100 g 및 10.44 g/100 g이었으며, 85℃에서 열처리된 굴의 조지방 함량은 1.32-1.67 g/100 g이었으며, 조단백질 함량은 10.22-12.69 g/100 g이었다. 그리고 100℃ 항온수조에서 열처리한 굴의 조지방 및 조단백질 함량은 각각 2.02-2.33 g/100 g, 12.92-16.44 g/100 g이었으며, 특히 20분 동안 가열처리한 굴의 조단백질 함량은 16.44 g/100 g으로 가장 많이 증가하였다. 반면에, 100℃ 고압멸균기를 이용하여 열처리한 굴의 조지방 및 조단백질 함량은 각각 2.64-3.06 g/100 g, 13.16-15.80 g/100 g으로, 가열시간에 따른 함량의 차이가 있었다. 이러한 결과는 열처리에 의한 수분 함량의 감소로 인하여 상대적으로 조지방 및 조단백질 함량이 증가하였다. 55℃ 미만 온도에서 열처리된 굴의 수분함량의 변화는 적었으나 72℃, 8분 열처리시 수분 및 회분 함량이 감소한다는 보고와 본 연구결과가 유사하였다(Chei et al., 1991; Chai et al., 1984).
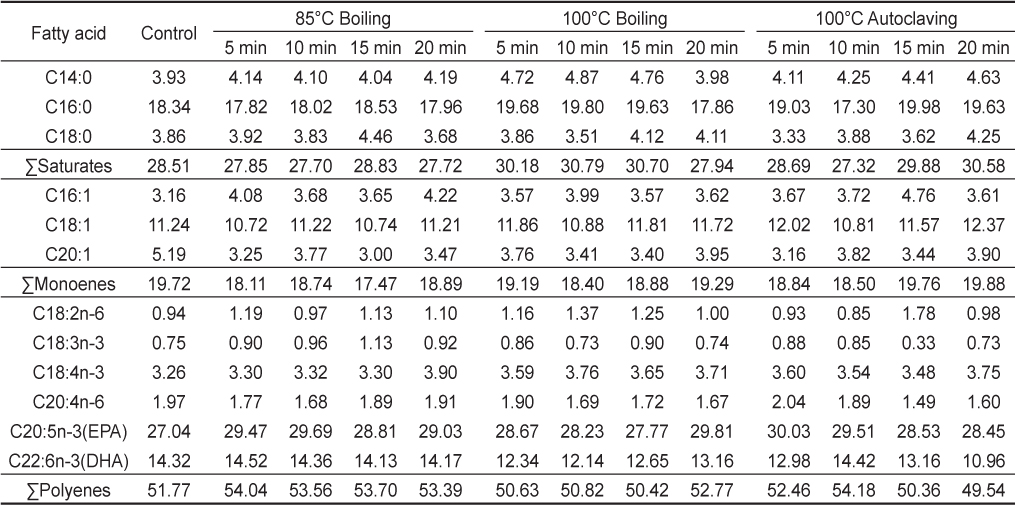
열처리에 의한 굴의 지방산 조성비 변화 중 주요지방산에 대한 결과를 Table 3에 나타내었다. 굴의 주요지방산은 palmitic acid (C16:0), oleic acid (C18:1), eicosapentaenoic acid (EPA) (C20....) (C20:5n-3), docosapentaenoic acid (DHA) (C22....) (C22:6n-3) 이다. 열처리하지 않은 굴의 C16:0은 18.34%이었으며, 85℃에서 열처리된 굴의 지방산 조성은 비슷한 수준이거나 다소 낮은 조성비이었다. 반면에 100℃ 항온수조에서 20분 열처리된 굴과 고압멸균기에서 10분 동안 열처리 한 굴을 제외하고는 대조구보다는 다소 높은 조성비이었다. Oleic acid (C18:1) 조성비는 대조구와 열처리구가 비슷한 수준이었으며, EPA 및 DHA 조성비도 비슷한 경향이었다. 특히 어류 종에 따라 차이는 있지만 DHA 조성비가 EPA 조성비보다 높은 것이 특징적인 반면에 굴은 DHA에 비하여 EPA 조성비가 매우 높은 것이 특징적이었다. 포화지방산, 모노엔산, 불포화지방산의 조성비 또한 비슷한 수순이었으며, 열처리에 의한 지방산 조성비의 변화는 미미하였다.

The comparison of fatty acid composition of oyster Crassotrea gigas by various heat treatment at 85℃, 100℃ boiling water bath, and 100℃ autoclaving for 5, 10, 15, and 20 min
고압가열처리에 의한 굴의 지방산 조성비는 처리하지 않은 대조구와 비교하여 유의적인 차이가 없는 것으로 보고되었다(Cruz et al., 2008). 또한 고온장시간 처리되는 수산물통조림은 살균과정 중 지질성분의 산화 및 열분해, 중합반응이 진행되고 장기간 저장에도 불구하고 지방산 조성이 원료 어패류들의 조성과 큰 차이가 없는 것은 지방산이 저급물질로 분해되거나 중합반응을 일으키는 것으로 추정하였다(Oh et al., 1989). 굴통조림의 경우는 고도불포화지방산 조성비가 자숙 굴은 생굴과 비슷한 수준이었으나 레토르트 내의 가열살균시에는 가열살균 시간이 증가할수록 감소한다고 보고하였다(Kong et al., 2002).
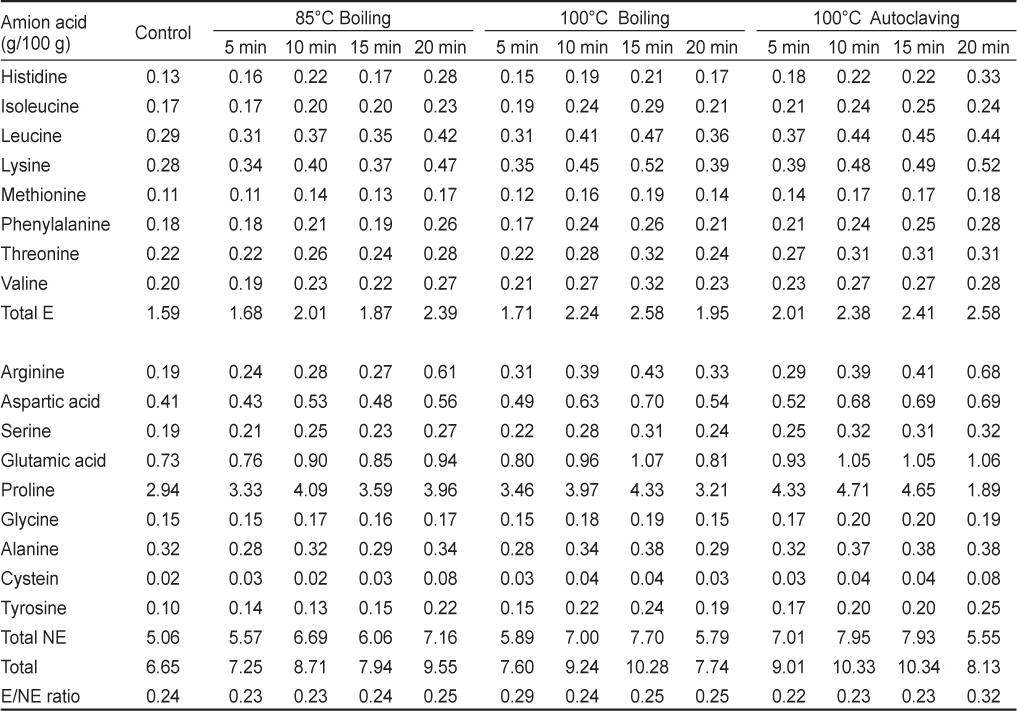
대조구의 총아미노산 함량은 6.65 g/100 g이며, 필수아미노산과 비필수아미노산 함량이 각각 1.59 및 5.06 g/100 g이었다. 또한 필수아미노산과 비필수아미노산의 비율이 0.24로 일반 어류의 0.7 이상의 값에 비하여 매우 낮은 값이었다. 특히 proline 함량이 2.94 g/100 g이며, 총 함량의 44.2%를 차지하고 있다. 열처리에 의하여 일부 아미노산은 증가하였으며, 필수아미노산 함량은 대조구보다 증가하여 85℃ 열처리한 굴은 1.68-2.39 g/100 g, 100℃에서 열처리한 굴은 각각 1.71-2.58 g/100 g 및 2.01-2.58 g/100 g이었다. 또한 100℃ 에서는 항온수조보다는 고압멸균기를 이용하여 열처리한 굴에서 다소 높은 함량이었다(Table 4).
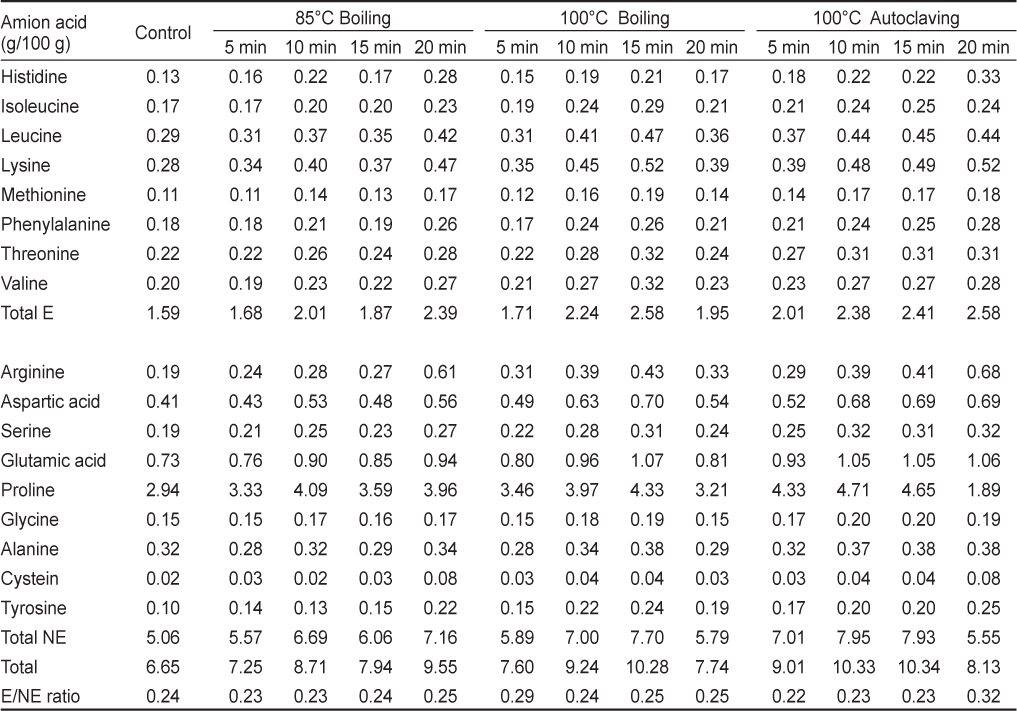
The change of total amino acid content of oyster Crassotrea gigas by various heat treatment at 85℃, 100℃ boiling water bath, and 100℃ autoclaving for 5, 10, 15, and 20 min
열처리에 의한 각각의 아미노산 함량은 다소 차이가 있었으나 그 차이는 미미하였다. 그러나 proline 함량은 열처리에 의하여 대조구에 비하여 다소 증가하였으며, 85℃ 열처리한 굴은 3.33-4.09 g/100 g이었으며, 100℃ 열처리한 굴은 각각 3.21-4.33 g/100 g, 1.89-4.71 g/100 g이었다. 그러나 100℃ 고압멸균기에서 20분 동안 열처리한 굴은 1.89 g/100 g으로 감소하였다. 또한 85℃ 열처리한 굴의 glutamic acid 함량도 0.76-0.94 g/100 g, 100℃ 열처리한 굴은 각각 0.80-1.07 g/100 g 및 0.93-1.06 g/100 g으로 증가하였다. 100℃ 20분 동안 열처리한 굴의 총아미노산은 다시 감소하여 가열처리에 의한 파괴로 사료된다. 수산물은 열처리에 의하여 총아미노산 함량이 변화하는 것으로 보고되었으며, 미꾸라지 등과 같은 수산물의 glutamic acid 함량도 끓이는 것이 찌는것보다 감소폭이 크다고 보고하였다(Mun et al., 1999; Steet et al., 1983; Tanaka and Kimura, 1988).
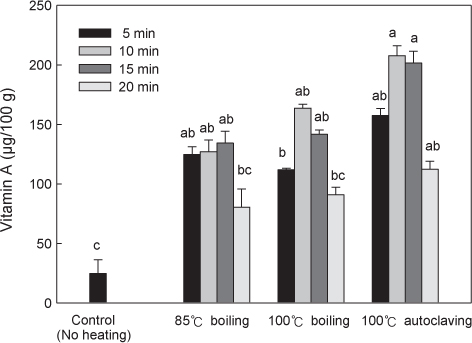
열처리에 의한 굴에 함유되어 있는 비타민 A 함량의 변화를 조사하였으며, 대조구의 비타민 A 함량은 24.74 μg/100 g이었다(Fig. 2). 85℃ 항온수조에서 열처리한 굴의 비타민 A 함량은 열처리시간에 따라 각각 124.76, 127.14, 134.28, 80.41 μg/100 g이었으며, 15분 가열까지는 함량이 증가하였으나, 20분 가열에서는 급격하게 감소하였다. 100℃ 항온수조에서 열처리한 굴은 열처리시간이 10분까지는 111.93-163.65 μg/100 g까지 증가하였으나 이후 141.67 μg/100 g (15분), 90.87 μg/100 g (20분)까지 감소하였다. 또한 100℃ 고압멸균기를 이용하여 열처리한 굴의 비타민 A 함량은 10분까지 157.47-207.73 μg/100 g까지 증가하였으나 마찬가지로 15분 가열처리 후에는 201.49 μg/100 g, 20분 가열처리 후에는 112.30 μg/100 g으로 감소하였다.
굴은 수용성 비타민인 thiamine, riboflavin, niacin, folic acid, 비타민 B6, 비타민 B12를 함유하고 있으며, 이러한 비타민은 열에 쉽게 파괴된다. 특히 비타민 C, folic acid, thiamine, 비타민 A는 열에 민감하다. 따라서 비타민 A 함량은 대조구에 비하여 열처리한 굴에서 높았으나 85℃에서 20분, 100℃에서 15분 이상 가열시 과도한 열처리로 인하여 생성된 비타민 A가 파괴되었다.
열처리에 의한 굴은 중량 변화가 일어났으며, 수분함량은 감소한 반면에 조지방 및 조단백질이 증가하였다. 또한 지방산조성은 EPA 조성비가 매우 높았으나 열처리에 의해서 큰 영향을 받지 않았다. 총아미노산 함량은 열처리에 의하여 필수아미노산 함량의 증가와 proline 및 glutamic acid 함량이 증가하였으나, 100℃에서 20분 동안 가열시에는 전체 함량이 감소하였다. 그리고 비타민 A 함량은 열처리에 의하여 증가하지만 과도한 열처리는 비타민을 파괴하는 것으로 확인되었다. 따라서 이러한 결과로 미루어볼 때, 열처리에 의하여 굴의 외관변화 및 중량 감소는 불가피하지만 100℃에서 20분 동안의 열처리 조건을 제외하고는 열처리에 의한 굴의 영양학적인 손실은 미미한 것으로 사료된다.