Textile industry is considered as one of the most polluting sectors in terms of effluent composition and volume of discharge. It is well known that the effluents from textile dying industry contain not only chromatic substances but also large amounts of organic compounds and insolubles. The azo dyes generate huge amount of pollutions among many types of pigments. In general, the electrochemical treatments, separating colors and organic materials by oxidation and reduction on electrode surfaces, are regarded as simpler and faster processes for removal of pollutants compared to other wastewater treatments. In this paper the electrochemical degradation characteristics of dye wastewater containing CI Direct Blue 15 were analyzed. The experiments were performed with various anode materials, such as RuO2/Ti, PtO2/Ti, IrO2/Ti and graphite, with stainless steel for cathode. The optimal anode material was located by changing operating conditions like electrolyte concentration, current density, reaction temperature and initial pH. The degradation efficiency of dye wastewater increased in proportion to the electrolyte concentration and the current density for all anode materials, while the temperature effect was dependent on the kind. The performance orders of anode materials were RuO2/Ti > PtO2/Ti > IrO2/Ti > graphite in acid condition and RuO2/Ti > IrO2/Ti > PtO2/Ti > graphite in neutral and basic conditions. As a result, RuO2/Ti demonstrated the best performance as an anode material for the electrochemical treatment of dye wastewater.
섬유산업에서 가장 많이 사용되는 염료는 아조(azo) 염료로 알려져 있고, 그 다음으로 anthraquinone, nitroso 등이 있다[1]. 염색 폐수 내 다량 포함된 이러한 염료들은 난분해성 유해 유기화합물들이 대부분이고, 인체와 생태계에 독성을 나타내며 환경 역시 크게 위협하고 있어 처리 필요성이 매우 높다. 현재 섬유폐수의 처리 및 수질오염 방지시설로는 물리적, 화학적, 생물화학적 처리기술들이 다양하게 개발되어 있다[2, 3]. 물리 화학적 방법에서는 폐수를 중화시키기 위해 산 또는 알칼리를 사용하고, 보통 응집제를 이용하여 응집, 침전을 거친 후 처리한다. 약품 첨가의 필요와 더불어 다량 생성된 불용성 슬러지의 후처리도 필요하다. 생물학적 처리법은 폐수 중에 미생물의 생장에 억제요소가 되는 독성물질 또는 난분해성 물질이 포함되어 있는 경우 생물학적 처리가 불가능하고 폐수의 pH 변화를 억제하여야 하며, 적당량의 영양분도 공급해야 하는 문제점을 가진다. 이 방법들 모두 그 장치비나 운영비가 많이 들뿐 아니라 산업폐수 중의 용존 유해물질 모두를 동시에 처리하기에는 사실상 상당한 어려움을 겪고 있다. 이에 반해서 전기화학적 처리방법은 전극의 산화·환원반응에 의해 색도와 유기물 등을 처리하고, 다른 폐수처리방법들에 비해 반응기가 작고 경제적이고 간단하며 오염물제거속도가 아주 빠르다. 또한 반응 후 생성되는 생성물은 CO2, N2 등의 안정한 화합물과 저분자 유기화합물이므로 대부분의 경우에서 슬러지가 전혀 생성되지 않거나 소량 생성되어 부가적인 2차 처리가 요구되지 않는다[4]. 전기화학적 처리를 통한 폐수의 처리에 대한 연구는 많이 보고되어 있으며, 염색폐수 처리의 예로는 Muthukumar et al. [5]의 전기 응집 및 산화를 통한 CI Acid Orange 10의 제거, Faouzi et al. [6]의 Alizarin Red S의 제거실험, CI Acid Orange 7을 제거한 Fernandes et al. [7]의 연구가 있다. 전기화학적 처리법의 연구는 활발히 진행되고 있으나 CI Direct Blue 15의 제거에 대한 연구는 다른 염료에 비해 많이 이루어지지 않고 있다. 다양한 분야에 사용되는 CI Direct Blue 15는 돌연변이와 기형 발생, 생식 독성을 가진다고 나타나 있으며, 특히 발암성을 갖는 위험물로 보고되고 있다[8]. Pazarlioglu et al. [9]과 Kumar et al. [10]이 CI Direct Blue 15를 생물학적 방법으로 제거하여 95-100%의 탈색 효과를 보였으나 제거에 장시간이 소요되는 단점을 가진다. 또한 Sun et al. [11]은 Fenton 산화를 이용하여 초기 pH와 반응 온도 등에 따른 탈색 효과를 연구하여 pH 4와 30 ℃의 최적조건을 도출해 보고하였다. 이와 같이 현재 알려져 있는 결과에서 CI Direct Blue 15의 제거에 대해서는 생물학적 처리법 등은 나와 있으나 전기분해를 이용한 제거 연구는 아직 이뤄지지 않고 있다.
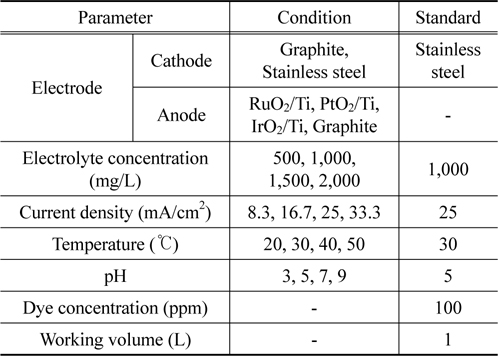
본 연구에서는 염료로 diazo 화합물인 CI Direct Blue 15를 사용하여 직접 조제한 폐수에 전기화학적 처리방법을 적용하였다. 전극 재질에 따른 조업 조건의 영향을 실험하였으며, 탈색 및 유기물질의 제거 효율을 향상시킬 수 있는 최적전극과 조업조건을 얻고자 하였다. 최적 전극 재질을 찾기 위해 현재 폐수의 전기화학적 처리에 많이 사용되고 있는 전극(양극과 음극) 재질에 따른 전해질 농도, 전류밀도, 반응온도, 초기 pH의 영향을 검토하였다. 음극은 graphite와 stainless steel 전극의 2종류를 사용하였고, 양극은 RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite의 4종류를 사용하여 조업조건에 따른 전극 성능 실험을 수행하였다.
실험에 사용된 염료는 CI Direct Blue 15로써 Sigma-Aldrich 사에서 구입하여 사용하였다. Figure 1에 CI Direct Blue 15의 구조식을 나타내었다. 전기에너지가 가해질 시 CI Direct Blue 15의 구조에서 가장 결합력이 약한 azo 고리가 먼저 깨지게 되고 충분히 많은 에너지를 가하면 SOx, NOx, COx 등과 H2O로 완전히 산화분해 될 수 있다.
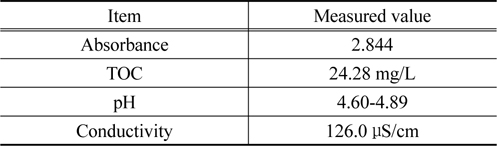
염료용액은 100 ppm의 농도로 제조하였다. 농도 100 ppm인 CI Direct Blue 15 용액의 흡광도와 총 유기탄소량 등의 특성을 Table 1에 나타내었다.
[Table 1.] Property of CI Direct Blue 15 solution (CI Direct blue 15 concentration: 100 ppm)
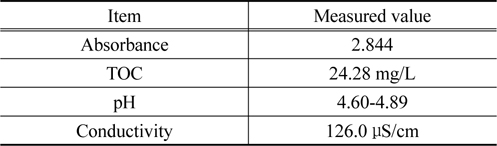
Property of CI Direct Blue 15 solution (CI Direct blue 15 concentration: 100 ppm)
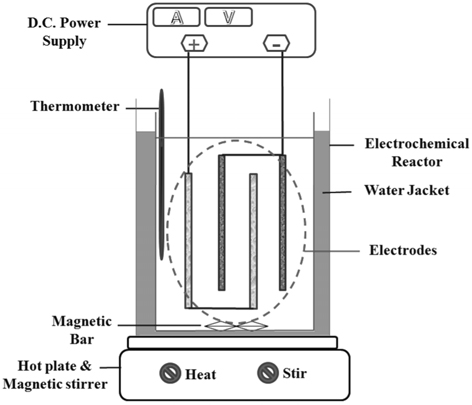
본 연구에서 사용된 실험장치의 개략도를 Figure 2에 나타내었다. 전기화학적 분해 실험을 위한 반응기는 두께 5 mm의 아크릴을 사용하여, 내부면적 85 × 85 mm2, 높이 195 mm로 제작하였다. 실험에 사용된 전극은 양극과 음극 각 2장씩으로 반응기 내에 수직으로 번갈아 평행하게 설치하였다. 양극은 재질이 RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite로 4종류를 사용하였으며, 크기는 30 × 100 × 1.5 mm3이다. 음극은 재질이 graphite와 stainless steel로 2종류를 사용하였으며, 크기는 40 × 100 × 1.5 mm3이다. 양극, 음극 모두 평판형의 전극을 사용하였으며, 전극사이 간격이 5 mm가 되도록 설치하였다. 직류전류의 공급은 전압계와 전류계가 부착된 DC power supply (GP-4305DU model, EZ Digital Co., Ltd.)를 사용하였다. 물질전달을 늘이고 전해질의 균일한 농도를 유지하기 위해서 자석 교반기를 이용해 용액을 1,500 rpm으로 교반하였다. 또한 물중탕을 이용하여 반응기의 온도를 조절하였다.
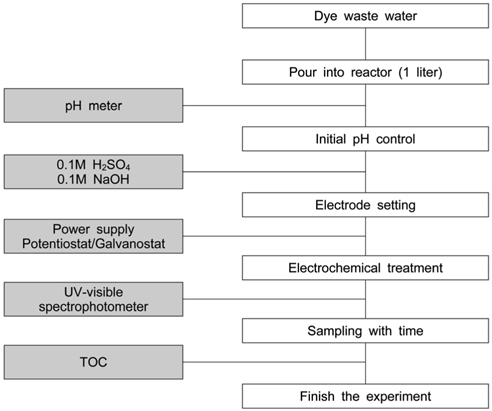
실험 방법은 Figure 3과 같은 순서로 시행하였다. 전기분해 전후 시료의 수질평가 비교를 위하여 Table 2와 같은 조건으로 각 항목별 실험을 수행하였다. 각 실험에 정해진 조건에서 실험을 수행함과 동시에 시간경과별로 시료를 채취하여 UV-visible spectrophotometer (GenesysTM 5, Spectronic Instruments, USA)를 사용하여 염료의 농도를 측정한 후 제거 효율을 계산하였다.
[Table 2] Conditions of experiments
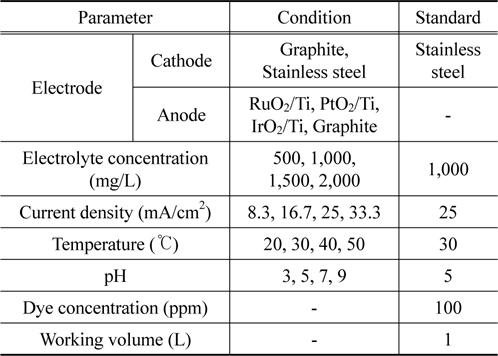
Conditions of experiments
여기서, A0 : 염색폐수의 초기 흡광도
At : 시간 t에서 폐수의 흡광도
2.3.1. 음극재질에 따른 염료제거 실험
음극(cathode)으로 graphite와 stainless steel 전극을 대상으로 전극성능 실험을 수행하였다. 이 경우에 양극의 재질로는 RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite 4종류를 사용하였다. 기타 운전조건들은 Table 2의 기준 항에서 명시한 바와 같이 전해질인 NaCl의 농도는 17.1 mM, 전류밀도는 25 mA/cm2, 초기 pH 5, 반응온도 30 ℃로 고정하였다.
2.3.2. 양극재질에 따른 염료제거 실험
양극으로 RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite의 4가지 재질에 대하여 전극성능을 실험하였다. 양극성능의 실험에서는 앞 절의 실험에서 음극재질의 성능 평가 결과 stainless steel이 graphite에 비하여 월등히 좋았으므로 음극으로 stainless steel을 사용하였다. 전해질로 사용된 NaCl의 농도, 전류밀도, 반응 온도와 초기 pH에 대하여 아래와 같은 추가적인 조건이 주어졌다.
NaCl 용액을 전해질로 사용하였으며, 전해질 농도의 영향을 살펴봄으로써, 염색 폐수의 전기분해에 있어 양극 재질에 대하여 최적의 전해질의 농도 조건을 찾고자 하였다. 60분에 걸친 전기분해반응 동안 회분식 반응기 내의 염료폐수의 색도 제거 효율에 대하여 조사하였다. NaCl은 실제 산업에 적용될 시 조작이 용이하도록 500, 1,000, 1,500, 2,000 mg을 첨가하여 실험하였으며, 이때의 농도는 8.56, 17.1, 25.7, 34.2 mM이다. 다른 운전조건들은 전류밀도는 25 mA/cm2, 초기 pH 5, 반응온도는 30 ℃으로 고정하였다.
전기분해에 사용되는 전류의 변화에 따른 제거 영향을 알아보고자 전류 값을 0.5 A, 1.0 A, 1.5 A, 2.0 A로 변화시켜 실험하였다. 이때의 전류밀도는 각각 8.3 mA/cm2, 16.7 mA/cm2, 25.0 mA/cm2, 33.3 mA/cm2이다. 전해질인 NaCl의 농도는 앞선 실험 결과에 따라 17.1 mM로 고정하였으며, 다른 조건은 초기 pH 5, 반응온도 30 ℃에서 실험하였다.
반응온도를 변화시켜 염료폐수의 전기분해에서 적정 반응온도를 알아보고자 하였다. 실제 염료폐수의 온도가 비교적 높음을 고려하여 반응온도는 20, 30, 40, 50 ℃에서 실험을 수행하였다. 반응초기 pH는 5로 맞추었으며, 다른 실험조건은 전류밀도는 25 mA/cm2, 전해질농도는 17.1 mM이다.
전기분해 반응의 초기 pH를 변화시켜 반응의 적정 초기 pH를 알아보고자 하였다. 염료용액의 초기 pH는 0.1 M H2SO4와 0.1 M NaOH를 이용하여 조절하여 pH 3, 5, 7, 9에서 실험하였다. 다른 운전조건들은 전해질농도는 17.1 mM, 전류밀도는 25 mA/cm2, 초기 pH 5, 반응온도는 30 ℃으로 고정하였다.
전기화학적 방법을 이용한 염료용액의 전기분해 후 용액 내의 유기물의 농도를 분석하여 양극 재질별 유기물 제거 효율을 알아보았다. 운전조건들은 Table 2의 기준 항에서 명시한 바와 같이 음극은 stainless steel을 사용하였고, 전해질 농도는 17.1 mM, 전류밀도는 25 mA/cm2, 초기 pH는 5, 반응온도는 30 ℃로 고정하여 실험하였다.
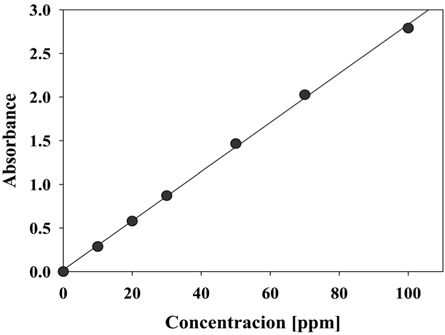
전기분해 전후에 채취한 시료의 UV-visible spectra는 UV-visible spectrophotometer (GenesysTM 5, Spectronic Instruments, USA)를 이용하여 측정하였다. Figure 4에서 나타낸 바와 같이 순수 CI Direct Blue 15 용액의 특징적인 피크는 598 nm에서 나타났다. 채취한 시료의 농도 측정을 위하여 먼저, 다수개의 표준농도 용액(0, 10, 20, 30, 50, 70, 100 ppm)을 제조하여 UV-visible spectrophotometer로 598 nm에서 흡광도를 측정하여 검량하였다.
각 전극별 반응시간에 따른 유기물 처리 효율을 알아보기 위해서 총 유기 탄소(TOC)를 TOC analyzer (TOC-Vcph, Shimadzu, JAPAN)로 분석하였다.
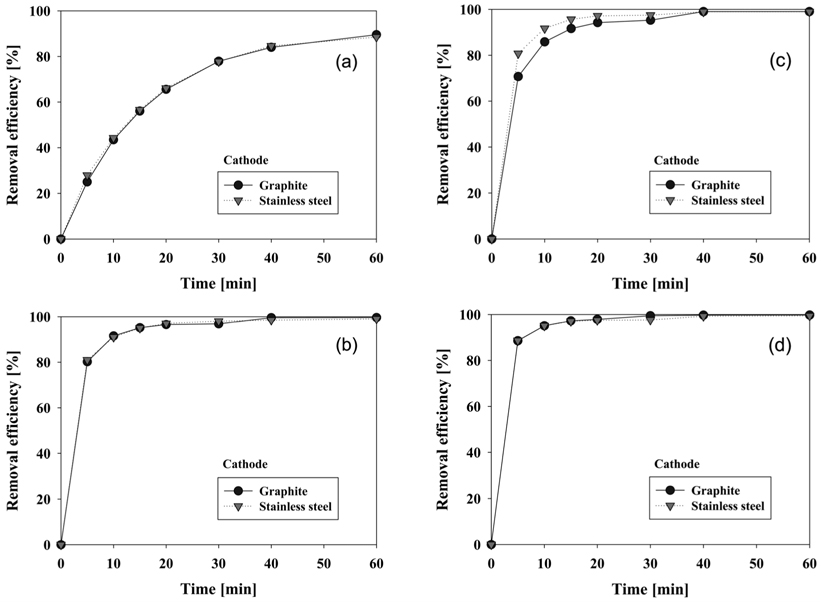
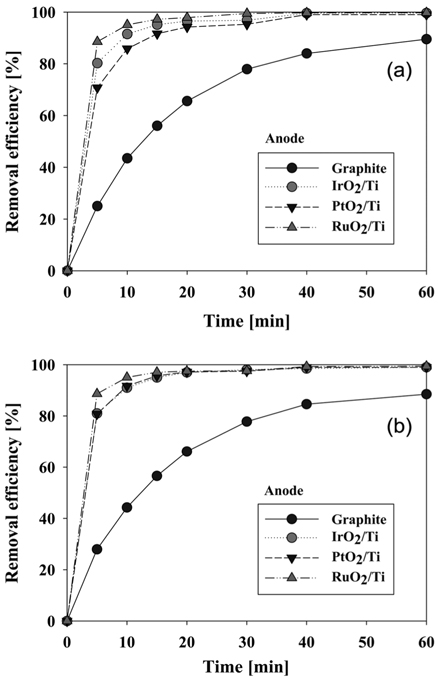
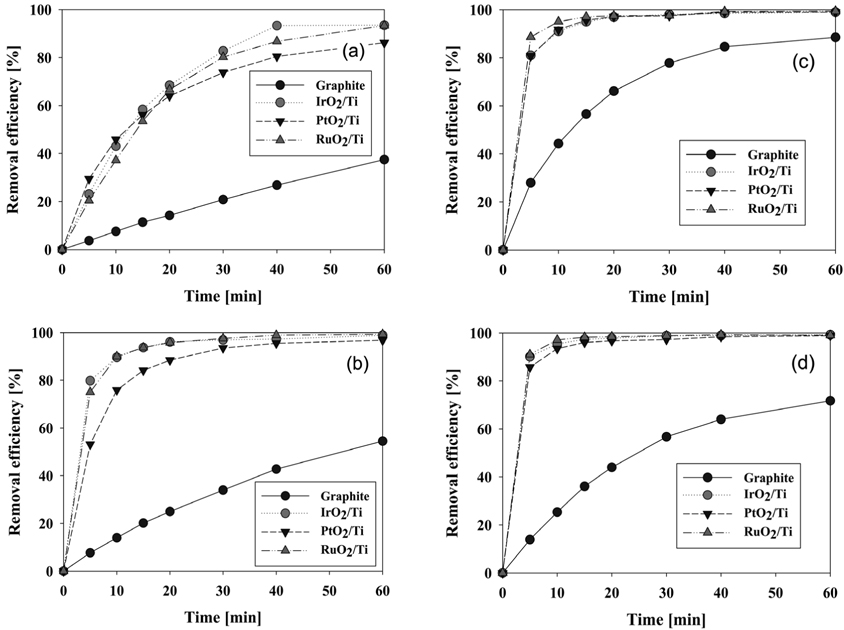
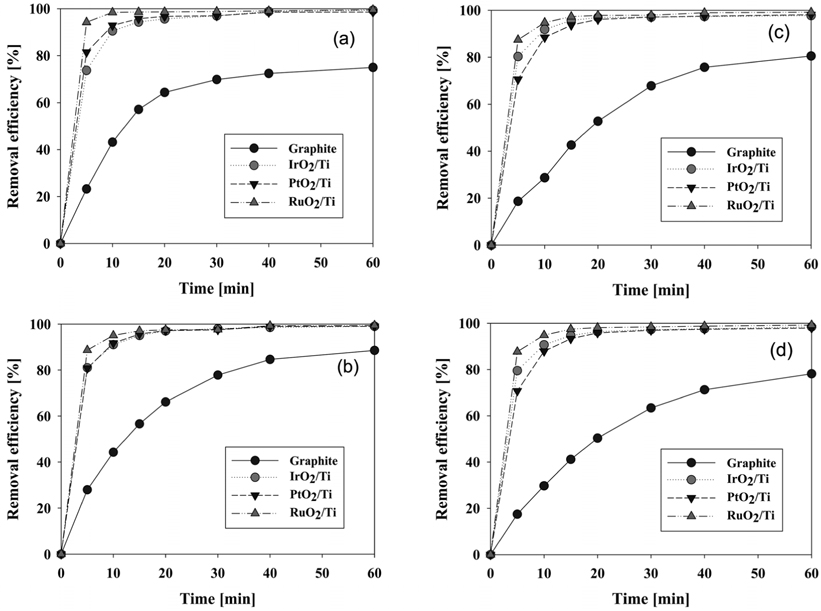
음극 재질로 graphite와 stainless steel을 사용하였을 때 CI Direct Blue 15의 제거 효율에 대하여 Figure 5에 나타내었다. 양극으로는 RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite로 4가지 재질을 적용하였다. CI Direct Blue 15의 제거 효율은 UV-visible spectrophotometer를 이용하여 분석하였는데 앞에서 언급한 바와 같이 반응시간에 따른 염료용액의 농도 측정을 위하여 먼저 CI Direct Blue 15 용액의 검량선을 작성하였다. 본 연구에서 구한 검량선은 Figure 4와 같으며, 염료 농도에 따라 흡광도가 비례하는 것을 알 수 있다. 따라서 이후 실험결과에서는 598 nm에서 흡광도를 측정하여 염료 농도와 제거 효율을 구하였다.
Figure 5의 (a), (b)와 (d)에서 보면 양극의 재질로 graphite, IrO2/Ti, RuO2/Ti를 사용할 경우에는 각각 음극의 재질에 상관없이 동일한 제거 효율을 보였다. 이 때 음극 재질에 따른 제거 효율의 차이는 전기분해 전 영역에서 3% 이내의 거의 유사한 결과를 보였다. 다만 Figure 5(c)에서 나타난 것처럼 양극으로 PtO2/Ti 전극을 사용할 경우에는 음극 재질로 stainless steel을 사용하였을 때에 더 우수한 제거 효율을 보여주었다. Stainless steel을 음극으로 사용할 경우에 graphite 전극을 사용할 때보다 반응시간 5분에서는 10% 이상, 10분에서는 5.8% 이상의 제거 효율 향상을 보였다. 이처럼 양극으로 PtO2/Ti 전극을 사용할 때를 제외하고는 음극 재질의 영향이 거의 없다고 볼 수 있으나, carbon으로 이루어진 전극은 낮은 기계적 강도 때문에 공업적인 효용이 떨어진다. 또한 초기 제거 속도에 있어서는 PtO2/Ti 전극이 반응개시 30분까지 음극 재질별 차이를 보이긴 했으나, 나머지 3종류의 전극은 음극 재질과 관계없이 동일한 특성을 보였다. 이러한 결과들로 이후 실험에서 음극은 모두 stainless steel 전극으로 고정하였다. 같은 결과를 양극 재질 사이의 제거 효율이 비교 가능하도록 Figure 1S (supplementary information)에 재구성하였는데, 양극으로 RuO2/Ti 전극을 사용할 때가 가장 제거가 잘됨을 알 수 있었다. 음극으로 graphite를 사용할 경우에는 RuO2/Ti 전극 다음으로 제거 효율이 좋은 양극은 IrO2/Ti 전극이었다. 그리고 음극으로 stainless steel 재질을 사용할 경우에는 양극으로 IrO2/Ti, PtO2/Ti 전극이 거의 비슷한 성능을 나타내었다. 양극 재질 중 가장 제거 효율이 나빴던 graphite 전극은 Figure 1S에서 보는 바와 같이 Ti로 이루어진 전극들과 현저한 성능 차이를 보여주었다. 적게는 9.5%에서 많게는 64%의 차이를 보여 제거 효율이 현저히 떨어짐을 알 수 있었다. 따라서 음극 재질별 양극 재질의 CI Direct Blue 15 분해 성능은 다음과 같이 정리할 수 있다.
- RuO2/Ti > IrO2/Ti > PtO2/Ti > graphite : graphite 음극 사용 시 - RuO2/Ti > IrO2/Ti ≈ PtO2/Ti > graphite : stainless steel 음극 사용 시
3.2.1. 전해질 농도의 영향
염색폐수의 전기분해에서 NaCl을 전해질로 사용하면 아래의 반응식에 의하여 NaOCl과 HOCl이 생성된다[12].
2NaCl + 2H2O → 2NaOH + Cl2 + H2 2NaOH + 2H2O → NaOCl + NaCl + H2O Cl2 + H2O → HOCl + H+ + Cl−
이 때 생성된 NaOCl은 Na+와 OCl−의 이온으로 해리되며 OCl−이 폐수 중에 존재하는 유기물을 분해시킬 수 있다.
organics + NaOCl → CO2 + H2O + intermediate organics + HOCl → oxidized organics + Cl2↑
전기분해에 의한 염색폐수의 처리에서 NaCl 전해질은 위의 반응에 따라 NaOCl과 HOCl을 생성시켜 유기물을 산화시킨다. 전기분해가 일어나는 동안 직접적인 양극 산화반응뿐만 아니라 전해질 내 hypochlorite 이온에 의한 간접적인 산화반응 효과를 향상시키게 된다.
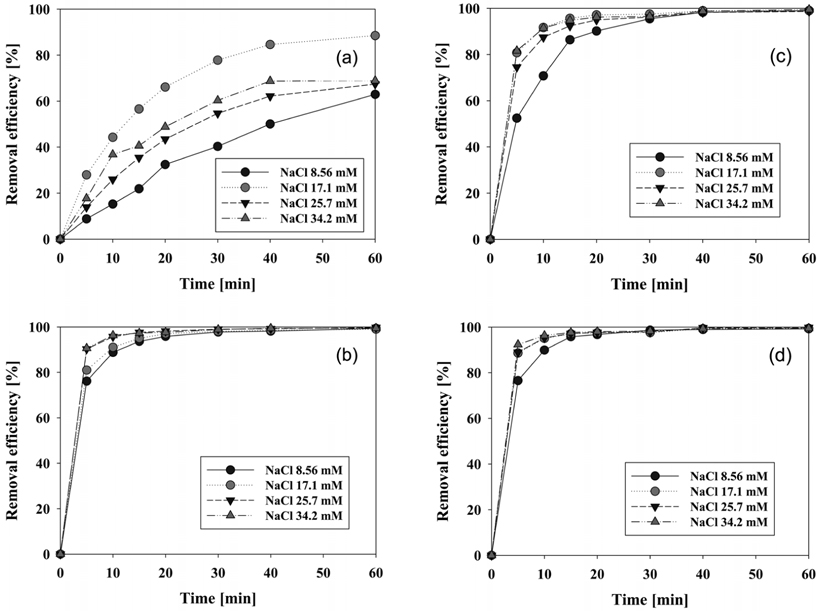
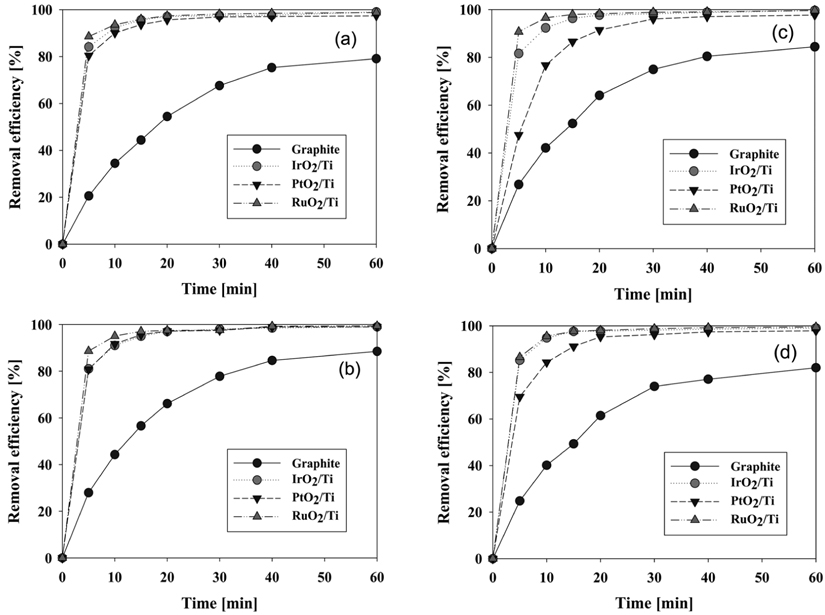
전해질 농도에 따른 각 양극 재질별 염료 제거 효율에 대한 실험결과를 Figure 7에 나타내었다. 먼저 양극으로 graphite 전극을 사용하였을 경우의 결과 중에서는(Figure 6(a)), 17.1 mM의 NaCl 용액을 전해질로 사용하였을 때 제거 효율이 가장 우수함을 알 수 있었다. Graphite 전극을 양극으로 사용하였을 경우에는 전극의 재질이 불용성이 아니라 가용성이어서 계속하여 전해질에 녹아버리게 된다. 이후 실험에서 수용액상으로 전극이 녹아나오면서 전극의 제거 효율 역시 떨어졌다. 나머지 전해질 농도에서는 17.1 mM의 NaCl을 사용했을 때보다는 모두 낮은 효율이었으나, NaCl 34.2 mM > 25.7 mM > 8.56 mM 순으로 제거 효율은 반비례하여 나타났다.
IrO2/Ti와 RuO2/Ti 전극을 양극으로 사용하였을 경우에는 (Figure 6(b), (d)) 전해질 농도에 따라 제거 효율이 조금씩 증가하는 경향을 볼 수 있다. 일반적으로 전해질의 농도에 비례해서 물질의 분해반응이 증가한다. 이는 전해질로 사용된 NaCl의 농도가 증가하여 Cl− 이온이 증가하고, Cl2 과전압을 양극에서 낮게 하여 hypochlorite의 생성을 촉진하기 때문이다[13]. 이에 따라 염료제거에 강한 산화제로 작용하는 hypochlorite와 free chlorine의 생성이 증가하여 염료의 제거속도 역시 빨라진다고 볼 수 있다.
Figure 6(c)와 6(d)를 보면 양극으로 PtO2/Ti와 RuO2/Ti를 사용하였을 때, 각각의 전극에서 전해질의 농도가 8.56 mM일때와 17.1 mM 이상일 경우에 제거 효율차이가 나타나는 것을 알 수 있다. PtO2/Ti 전극을 사용하였을 때에는 17.1 mM 이상의 전해질 농도에서 10분 이내에 87% 이상의 제거 효율을 보였으며 전해질 농도 8.56 mM일 때와 최대 21%의 차이를 보였다. 또한 NaCl 농도 17.1 mM 이상에서는 20분 이내에 95% 이상의 제거 효율이 나타났다. 양극으로 RuO2/Ti 전극을 사용하였을 때에는 전체적인 제거 효율이 다른 양극 재질들보다 우수하였다. 17.1 mM 이상의 전해질 농도에서는 5분 이내에 88% 이상, 10분 이내에 95% 이내의 제거 효율을 가지며, 8.56 mM 일 때와 비교하여 각각 최대 16%, 6%의 차이를 나타내었다.
또한 10분 이내에 90% 이상의 CI Direct Blue 15를 제거하기 위해서는 적어도 17.1 mM 이상의 NaCl 농도가 필요하다는 것을 알 수 있다. 이렇게 초기 제거 속도에 있어서는 전해질 농도에 따른 차이를 보였으나, 60분 반응을 기준으로 제거 효율을 보았을 경우에는 모든 양극에서 전해질 농도에 따른 제거 효율의 차이는 크게 나타나지 않았다.
각 전해질 농도에서 양극의 재질에 따른 제거 효율 차이를 보기 위하여 같은 결과를 Figure 2S (supplementary information)에 재구성하였다. 그림에서 보는 바와 같이 17.1 mM의 NaCl 농도에서는 RuO2/Ti 전극이 가장 우수하게 나타났으며, 나머지 전해질 농도에서 IrO2/Ti와 RuO2/Ti 전극이 비슷하게 우수한 제거 효율을 보였다. Graphite 전극의 경우 실험을 거듭할수록 전극의 용해는 계속되었으며 Figure 2S(a)와 Figure 2S(d)에서처럼 상당히 큰 제거 효율의 감소를 보이기도 하였다.
3.2.2. 전류밀도의 영향
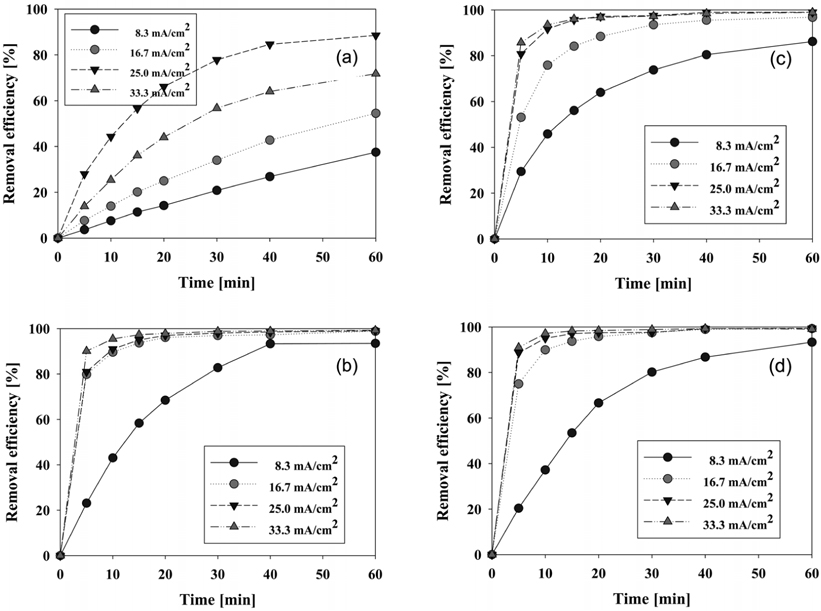
전기분해반응에서 전극과 전해질 용액에 가해지는 전류의 세기인 전류밀도의 영향을 알아보고 양극 재질에 대한 최적 전류밀도를 구하기 위한 실험을 수행하였으며 그 결과를 Figure 7에 나타내었다.
먼저 graphite를 양극으로 사용한 경우를 보면(Figure 7(a)), 전류밀도에 따라 제거 효율이 증가한다. 그러나 33.3 mA/cm2에서 갑자기 감소하는 것을 볼 수 있는데 이는 graphite 전극 자체가 실험 내내 용해되면서 전극표면의 상태가 변하고 연속적인 전극의 용해에 따라 전극의 크기 및 표면적도 감소하게 되는 현상에서 그 이유를 찾을 수 있다. 따라서 graphite 전극의 경우 최고 제거 효율도 88%에 밖에 미치지 못하였다.
Graphite 전극을 제외한 다른 전극에서는 일반적으로 전류 밀도가 증가할수록 폐수의 제거 효율이 증가하는데, 이는 높은 전류에서 유리염소의 증가에 따른 간접산화효과가 증가하는 것에 원인이 있다고 볼 수 있다[14, 15]. 티타늄을 기반으로 하는 전극들의 전류밀도에 따른 제거 효율을 표시한 Figure 7(b)-7(d)에서 보면 전류밀도 8.3 mA/cm2일 경우의 제거 효율곡선과 전류밀도 16.7 mA/cm2이상인 경우의 제거 효율 차이가 큼을 알 수 있다. 특히 전류밀도 16.7 mA/cm2이상의 경우에는 반응초기 10분 이내에 75-90%의 높은 제거 효율을 보여주지만 전류밀도 8.3 mA/cm2에서는 모두 46% 이하의 낮은 제거 효율을 보여준다. 다른 실험에서 가장 우수한 제거 효율을 보이며 10분 이내에 최소 90% 이상의 제거 효율을 보였던 RuO2/Ti 전극도 8.3 mA/cm2의 전류밀도에서는 10분 반응 후 제거 효율이 37%에 불과하였다.
동일 조건에서 RuO2/Ti 전극은 반응 후 60분이 되어서야 93%의 제거 효율을 보였으며 다른 실험에서와 6% 이상의 차이를 나타낸다. 이는 약한 전류로 인하여 간접산화를 통한 염료의 제거에 필요한 hypochlorite나 free chlorine의 생성이 적었기 때문이라 생각되며, 8.3 mA/cm2 이하의 전류밀도는 CI Direct Blue 15의 산화에 충분한 조건이 안 된다고 할 수 있다.
Graphite 전극을 제외한 Ti로 이루어진 전극들을 사용할 경우 60분 반응할 경우에 100 ppm의 CI Direct Blue 15를 95% 이상 제거하기 위해서는 적어도 16.7 mA/cm2 이상의 전류밀도가 필요하였으며, 최소 97% 이상의 제거 효율을 보였다. 또한 PtO2/Ti와 RuO2/Ti 전극을 양극으로 사용할 경우에는 높은 전류밀도에서 큰 차이를 보이지 않았다.
각 전류밀도 별 양극재질의 성능 비교를 위해 실험결과를 Figure 3S (supplementary information)에 재구성하였다. 전류밀도 8.3 mA/cm2과 16.7 mA/cm2에서 IrO2/Ti 전극을 양극으로 사용할 경우에 가장 우수한 제거 효율을 보였으며, 전류밀도 25.0 mA/cm2과 33.3 mA/cm2에서 양극으로 RuO2/Ti 전극을 사용할 경우에 가장 우수한 제거 효율은 나타내었다.
전해반응 공정의 공업적인 적용을 고려하면 반응시간은 10분 내지 20분 이내에 이루어져야 한다[16, 17]. 반응시간 10분을 기준으로 양극 재질 및 전류밀도별 제거 효율을 살펴보면 전류밀도 16.7 mA/cm2에서는 IrO2/Ti와 RuO2/Ti 전극의 제거효율이 높고, 전류밀도 25.0 mA/cm2에서는 티타늄 재질의 세가지 전극 모두 우수한 성능을 나타냄을 알 수 있다. 특히 RuO2/Ti 전극은 반응시간 10분에서 제거 효율 97%로 IrO2/Ti 나 PtO2/Ti 전극에 비해서도 높은 성능을 보여주었다.
3.2.3. 반응 온도의 영향
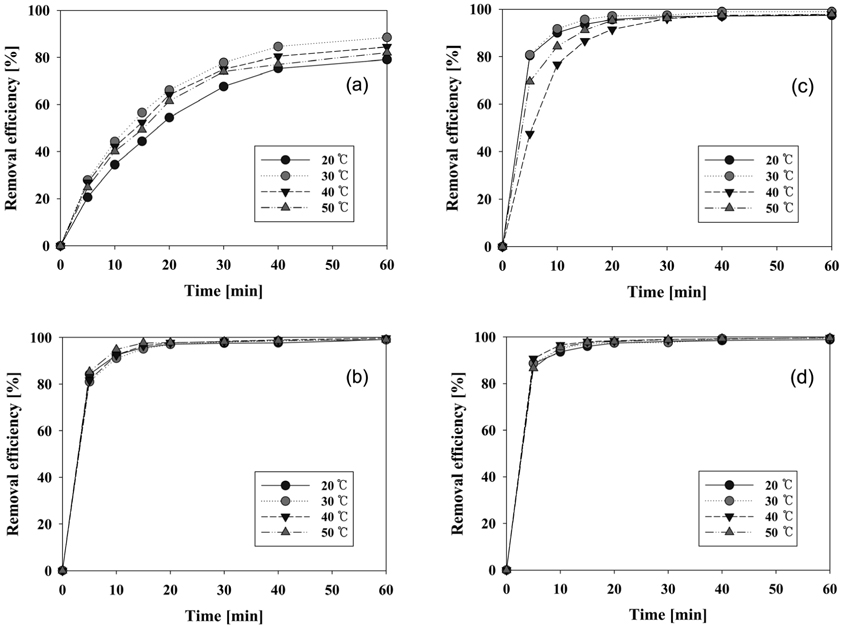
염료폐수의 온도가 비교적 높은 편이므로 전기분해 반응이 일어나는 동안 반응온도의 영향을 알아보기 위해서 반응 온도를 20, 30, 40 및 50 ℃로 유지하여 실험을 수행하였다. 각 온도조건에서의 색도 제거 효율 변화를 Figure 8에 나타내었다. 일반적인 화학반응에서 반응온도의 증가와 함께 반응 속도는 증가한다. 본 실험에서는 Figure 8의 (a)와 (c)에 나타난 바와 같이 graphite와 PtO2/Ti 전극을 양극으로 사용했을 경우에 20 ℃보다 30 ℃에서 색도 제거 효율이 높게 나타났다. 하지만 40 ℃와 50 ℃에서는 30 ℃에서보다 제거 효율이 오히려 감소하는 경향을 보여 온도의 증가에 비례하는 색도 제거 효율 변화는 나타나지 않았다. Graphite 전극은 30 ℃에서 제거 효율이 가장 우수하게 나타났으나, 60분 반응 후 제거 효율은 88.5%에 불과했고, 40 ℃와 50 ℃에서 반응이 84, 82%로 각각 나타났다. PtO2/Ti 전극의 경우 역시 반응온도가 30 ℃ 이상으로 증가할수록 오히려 제거 효율이 감소하는 경향을 보였고, 제거 효율이 가장 저조한 40 ℃에서는 5분 반응에서 48%, 10분 반응에서는 제거율이 77%에 불과하였다. 그리고 graphite와는 다르게 20 ℃에서 제거 효율이 30 ℃와 유사한 결과를 보였다.
양극으로 IrO2/Ti와 RuO2/Ti 전극을 사용할 경우에는 (Figure 8(b)와 (d)) 반응온도의 변화에 상관없이 거의 비슷한 제거 효율을 보였다. 또한 60분 반응을 기준으로 볼 때, graphite 전극을 제외한 티타늄 재질 양극들의 제거 효율은 모두 97% 이상으로 나타났다.
일반적으로 염색 폐수는 30-50 ℃의 온도로 배출된다. 앞의 실험결과와 연관하여 검토해보면, 비교적 높은 온도로 배출되는 염료 폐수를 30 ℃ 이하로 냉각할 필요는 없을 것이라 예상되며, 냉각에 소요되는 경비 역시 절감할 수 있을 것이라 기대된다[18, 19].
각각의 반응온도에서 양극재질의 염색 폐수 처리 성능에 대하여 살펴보기 위해서 실험결과를 Figure 4S (supplementary information)와 같이 재구성하였다. 그림에서 알 수 있듯이 모든 반응온도에서 RuO2/Ti 전극의 초기제거 효율이 가장 우수했으며, 60분 반응할 경우에 제거 효율 또한 미세한 차이로 가장 우수하게 나타났다. 그 다음으로는 IrO2/Ti 전극이 우수하였으며, 50 ℃에서는 RuO2/Ti 전극과 거의 비슷한 결과를 보였다. PtO2/Ti 전극은 40, 50 ℃의 반응온도에서는 상위 두 전극에 비해 많이 저조한 제거 효율을 보였으며, 40 ℃에서는 초기 5분 반응에서 RuO2/Ti 전극과 비교하여 52% 밖에 제거되지 않았다. 따라서 RuO2/Ti와 IrO2/Ti 전극이 반응온도별 특성에서도 우수한 성능을 보여주었다.
3.2.4. 초기 pH의 영향
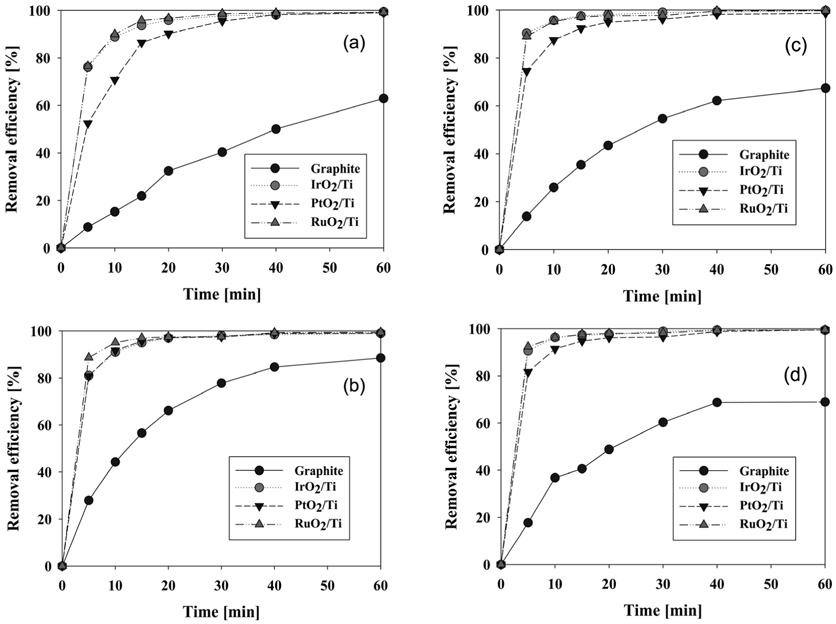
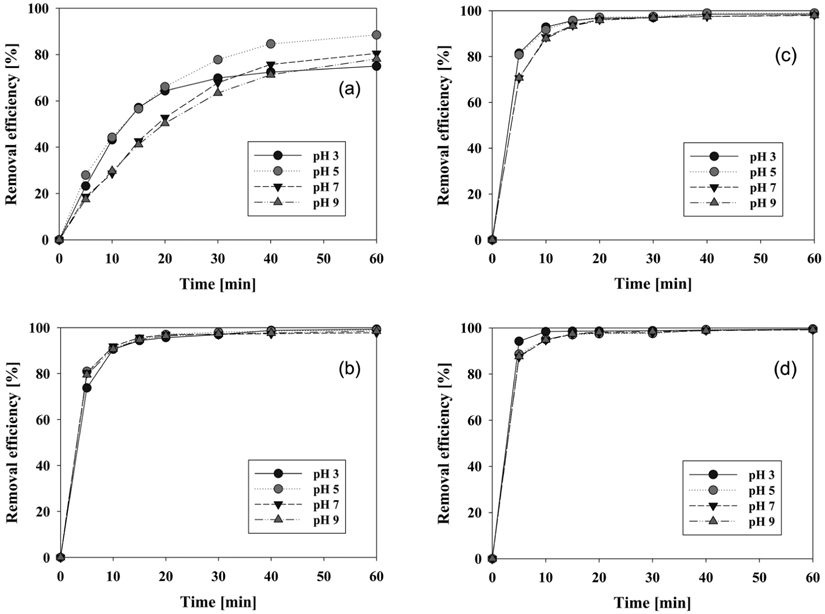
염료폐수의 초기 pH가 색도 제거 효율에 미치는 영향을 조사하고 최적의 초기 pH 값을 알기 위하여 초기 pH를 3, 5, 7, 9로 산성에서 중성, 염기성까지 변화시켜가며 실험을 수행하여 Figure 9의 결과를 얻었다.
Figure 9의 실험 결과에서 알 수 있듯이 graphite를 제외한 Ti로 이루어진 세 전극은 pH에 크게 좌우되지 않고 유사한 결과를 보였다. 굳이 분류를 하자면 염료폐수의 초기 pH가 PtO2/Ti와 RuO2/Ti 전극을 양극으로 사용할 경우에는 pH 3에서, graphite와 IrO2/Ti는 pH 5에서 색도 제거 효율이 더 높게 나타났다. 이와 같이 전극의 재질 종류에 따른 약간의 차이는 있으나 초기 pH가 산성조건에서의 염료 폐수의 제거가 염기성 조건에 비하여 더 높게 일어났다는 것을 알 수 있다. 이는 다음 식의 HOCl과 pH의 관계로부터 설명된다.
NaOCl + H2O → HOCl + Na+ + OH− [Low pH] HOCl → H+ + OCl− [High pH]
용액 내에서 산화제로 작용하는 물질들 중 OCl−보다 산화력이 약 80배 더 강한 HOCl은 pH가 높아질수록 OCl−로 전환되기 때문에 낮은 pH 일수록 HOCl의 몰분율이 더 높게 유지되어 높은 폐수 처리능력을 나타낸다[14, 20].
전기화학적 처리를 60분 동안 행할 경우의 제거 효율은 Figure 9에서 보다시피 graphite 전극을 제외한 세 양극의 모든 pH에서 97% 이상 제거되었다. Graphite 전극은 60분 반응 후 75-88%밖에 제거되지 않았다.
각각의 pH에서 서로 다른 양극재질들의 성능을 비교해보기 위하여 Figure 5S (supplementary information)에 결과를 재 구성하였다. 그림에서 보는 것과 같이 모든 pH 조건하에서 RuO2/Ti 전극의 초기제거 속도가 가장 빨랐으며, 10분 이내에 95% 이상의 제거 효율을 보였다. 그 다음 순으로 초기 pH 3과 5의 산성 조건에서는 PtO2/Ti 전극이, pH 7과 pH 9에서는 IrO2/Ti 전극이 더 우수하였다. 양극 재질의 성능을 초기 pH 별 염색폐수 색도 처리 효율에 대하여 나타내면 다음과 같다.
- RuO2/Ti > PtO2/Ti > IrO2/Ti > graphite : Acidic condition - RuO2/Ti > IrO2/Ti > PtO2/Ti > graphite : Neutral or alkaline condition
Figure 9의 (a)-(d)에서 보는 바와 같이 초기 pH에 따라 제거 효율의 차이는 있었으나 대부분 반응 초기 20분 이내에서 발생하였고 20분 이후에는 차이가 없었다. 염색폐수의 전기 분해처리 공정에서 초기 pH와 무관하게 반응의 진행에 따라서 pH 7-8 사이의 중성으로 진행된다. 따라서 반응초기에 산성 또는 염기성을 띠어도 반응이 진행되며 중성으로 수렴하므로 큰 영향을 주지는 못한다고 볼 수 있다. 그러나 전해처리 공정을 실용화하여 짧은 시간에 분해해야 하는 경우에는 폐수가 산성일 경우 약간 더 유리함을 알 수 있다.
3.2.5. 유기물 제거 효율
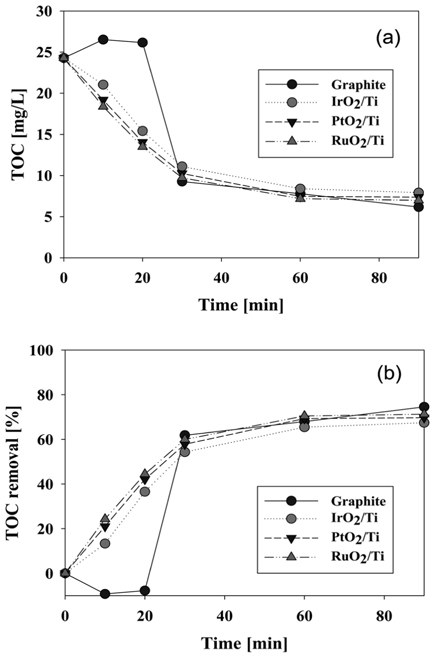
양극 재질 별 시간에 따른 유기물 제거 효율을 조사하기 위하여 TOC 분석을 하였으며 결과를 Figure 10에 나타내었다.
Figure 10(a)에서 보는 바와 같이 graphite를 제외한 전극들에서 대체적으로 시간에 따라 TOC가 감소하고 있다. 이는 앞서 실험한 바와 같이 전기화학 반응으로 염료의 제거가 잘 되고 있음을 말해준다. 세 가지 재질의 전극들은 RuO2/Ti > PtO2/Ti > IrO2/Ti 순으로 TOC 제거 효율이 나타나지만, 분석 오차를 감안하면 거의 비슷한 제거 효율을 보인다 할 수 있다. TOC 제거 효율은 60분 후 약 68%이었으며, 90분 반응 후에는 약 71%로 색도 제거 효율보다는 낮았다. 이는 전기분해 과정에서 염료의 발색단이 깨어지기 때문에 색도는 거의 완전히 제거되지만 깨어진 염료성분의 일부는 유기물질로 폐수내에 존재하기 때문인 것으로 생각된다. 따라서 이와 같이 전기분해 과정에서 잔존하는 유기물질을 완전히 분해시키기 위해서는 추가적인 후속 처리나 다른 분해 방법이 필요할 것으로 사료된다.
Figure 10(a)에서 보이듯이 graphite 전극의 경우에는 전기 분해 과정의 초기에 TOC 농도가 다소 증가하는 경향을 보였다. Hwang and Chu [4]가 수행한 아조염료폐수의 전기화학적 처리에서도 초기에 COD가 증가하는 유사한 경향을 보였다. 이는 반응 초기에 단위 아조기가 분해되어 몇 개의 유기물로 분해되어 나타나기 때문이라 판단된다.
염료폐수의 색도 및 유기물의 제거를 위하여 전기화학적 처리를 적용하였으며, 다양한 음극 재질(graphite, stainless steel)과 양극 재질(RuO2/Ti, PtO2/Ti, IrO2/Ti, graphite)의 사용에 최적조건을 찾기 위한 본 연구의 결론은 다음과 같다.
모든 양극 조건에서 음극의 재질변화는 염색폐수 내 염료의 색도 제거 효율에 크게 영향을 주지 않는 것으로 나타났다.
전해질 농도와 전류밀도가 증가함에 따라 염료의 색도 제거 효율은 증가하였고, 반응온도의 영향은 각 전극마다 다르게 나타났다. 초기 pH를 달리한 경우에 양극의 색도 제거 성능은 산성 조건에서는 RuO2/Ti > PtO2/Ti > IrO2/Ti > graphite 순으로, 중성 및 염기성조건에서는 RuO2/Ti > IrO2/Ti > PtO2/Ti > graphite 순으로 나타났다. 그러나 유기물 제거 효율은 양극의 종류에 크게 영향을 받지 않았다.
RuO2/Ti와 IrO2/Ti 전극을 양극으로 사용할 경우에 색도의 제거 효율이 가장 우수하였으며, 초기 pH 및 온도변화에는 거의 영향을 받지 않았다.