



In this studies, SCR reaction activity and SO2 durability enhancement study on manufacturing conditions of the V/TiO2 catalyst was carried out for the removal of nitrogen oxides generated in the combustion furnace. The catalysts are characterized by XPS, Raman, H2-TPR and SO2-TPD. When the vanadium was contained of 2 wt%, it showed excellent SO2 durability and catalytic activity. and When the tungsten is added as a promotor, the enhancement of reducing ability at a low temperature and reduction of SO2 adsorption capacity improved the reaction activity and SO2 durability. V/W/TiO2 are prepared by the lower pH of vanadium solution, vanadium was highly dispersed on the surface and inhibited the formation of crystalline V2O5. in addition, it was confirmed that this catalyst can be used as excellent resistance to high concentration of CO in the combustion furnace.
대기오염을 유발하는 연소가스 중에 대표적인 오염물질로 황산화물(SOx), 일산화탄소(CO), 질소산화물(NOx) 등이 있다. 이 중 질소산화물은 산업계, 발전설비 등의 고정원과 자동차등의 이동원에 의해서 배출된다. 이러한 NOx는 광화학스모그, 오존층 파괴, 온난화 및 산성비를 유발하여 이에 대한 처리 기술이 요구된다[1]. 질소산화물을 제어하는 방법 중에 선택적 촉매환원법(selective catalytic reduction, SCR)은 환원제로 NH3를 이용하여 NOx를 촉매상에서 무해한 N2와 H2O로 분해하는 반응으로, NOx를 90% 이상 제거할 수 있는 기술로써, NOx 제거에 있어서 최적방지기술(best available control technology, BACT)이다[2]. SCR 반응은 다음과 같이 나타낼 수 있다.
현재 상업적으로 가장 많이 사용하고 있는 SCR 촉매는 V/TiO2 계 촉매이며, 이러한 바나듐 계열의 촉매는 300 ~ 400 ℃의 온도 범위에서 우수한 효율을 나타내고, SO2에 대한 저항성이 우수하지만[2], 이들 촉매 역시 300 ℃ 이하의 낮은 온도에서는 활성저하와 SO2 피독 등의 문제가 발생한다[3].
LNG를 제외한 대부분의 화석연료에는 황성분이 포함되어 있으며, 이들 연료의 연소 후 배기가스 내에 상당량의 이산화황(이하 SO2)이 포함되어 있다. SO2에 의한 활성저하는 촉매상에서 SO2가 촉매와 반응하여 SO3로 산화되고 SO4−의 형태로 흡착되는 일련의 과정을 거치면서 SO4−의 강한 결합에 의해 촉매독으로 활성점이 사용을 억제하여 활성이 저하되거나, 또는 촉매 표면에 형성된 SO42−가 NH4+와 결합하여 염을 생성하여 물리적으로 촉매를 덮어 활성이 저하된다. 또한, 촉매 표면 및 기공에서 NH4HSO4 (Ammonium Bisulfate, ABS)의 응축에 의하여 촉매에 침적되고 ABS 침적에 의하여 활성저하가 발생된다[4].
낮은 온도에서 우수한 효율을 위해 높은 바나듐 함량이 요구되나 바나듐 함량의 증가는 SO2를 SO3로 다량 산화시킴에 따라 ABS 생성속도를 증진시키는 문제점을 가지고 있으므로, 고농도의 바나듐이 담지된 촉매는 사용되기 어렵다[5]. 따라서 저온에서 적은 바나듐 함량에서도 우수한 효율을 갖는 촉매기술이 필요하다. 이러한 문제점을 고려하여 많은 연구자들은 금속원소를 promotor로 하는 바나듐 계열의 촉매에 대한 연구를 수행하였으며, promotor를 이용한 바나듐계 촉매로는 V-Sb/TiO2 [4], V-Fe/TiO2 [6], V-W/TiO2 [7], V-Mo/TiO2 [8] 및 V/TiO2-SiO2 [9] 등이 연구되었다. 이 중 promotor첨가 및 제조조건 조절을 통한 반응활성과 SO2 내구성 두 가지 측면 모두를 고찰한 연구는 부족한 실정이다. 또한 연소로에서는 고농도의 CO가 발생하며[10], SCR 촉매에 deactivation의 원인으로 작용할 수 있으므로 CO에 대한 내구성확인도 필요하다.
이에 본 연구에서는 저온(250 ℃) SCR 설비에서 적용 가능하고, 낮은 바나듐 함량의 V2O5/TiO2 촉매에 다양한 promotor를 첨가하여 250 ℃ 온도에서 우수한 탈질효율 및 SO2 내구성을 가지며, CO에 대한 내구성을 가진 촉매 제조방법에 관한 연구를 수행하고자 한다.
본 연구에 사용된 V/TiO2 계 촉매 제조 방법은 습윤함침법(wet impregnation method)을 이용하여 제조하였으며, 제조방법은 다음과 같다. V/TiO2 촉매의 경우 TiO2에 대한 바나듐의 함량을 원하는 조성비에 따라 계산하고, 계산된 양만큼의 바나듐 전구체를 60 ℃로 가열된 증류수에 녹인다. 이때 바나듐 전구체는 ammonium metavanadate를 사용한다. 이 바나듐 전구체는 용해도가 매우 작기 때문에 용해도 증가를 위하여 oxalic acid를 조금씩 저어가며 혼합하여 pH 값을 조절해준다. 이 때 용액에 계산된 TiO2를 조금씩 저어가며 혼합한다. 이렇게 만든 슬러리(slurry) 상태의 혼합용액을 1시간 이상 교반한 후, 회전진공증발기(rotary vacuum evaporator)를 이용하여 70 ℃로 유지하며 수분을 배제시킨다. 수분을 배제시키고 나서 시료의 추가 건조를 위하여 110 ℃의 건조로에서 24시간 건조시킨 후 10 ℃ min−1의 승온속도로 관형로(tubular furnace)에서 400 ℃에서 4시간 공기 분위기에서 소성하여 V[x]/TiO2 촉매를 제조하였다. vanadium의 함량은 0.5 ~ 3 wt%로 하였다.
또한 본 연구에 사용된 V/Me[x]/TiO2 촉매는 TiO2에 대한 Me의 함량을 원하는 조성비에 따라 계산하고, 계산된 양만큼의 Me 전구체를 60 ℃로 가열된 증류수에 녹인다. 이때 텅스텐 전구체는 ammonium metatungstate를 사용한다. 텅스텐의 함량은 1 ~ 7 wt%로 하였다. 이후 용액에 계산된 TiO2를 조금씩 저어가며 혼합한다. 이렇게 만든 슬러리(slurry) 상태의 혼합용액을 1시간 이상 교반한 후, 회전진공증발기(rotary vacuum evaporator)를 이용하여 70 ℃로 유지하며 수분을 배제시킨다. 수분을 배제시키고 나서 시료의 추가 건조를 위하여 110 ℃의 건조로에서 24시간 건조시킨 후 10 ℃ min−1의 승온속도로 관형로에서 600 ℃에서 8시간 공기 분위기에서 소성하여 W[x]/TiO2를 제조하였다. 이렇게 제조된 W[x]/TiO2에 대하여 바나듐을 첨가하여 제조하는 과정은 상기와 동일하다.
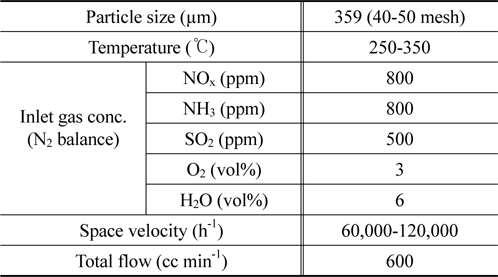
반응기는 연속 흐름형 고정층 반응장치로서 내경 8 mm, 높이 600 mm인 석영관으로 제작하였으며, 촉매층을 고정하기 위해 quartz wool을 사용하였다. 탈질반응 특성과 온도 및 농도의 영향에 관한 실험 등은 실험실 규모의 고정층 반응기에서 실시하였다. 이 실험 장치는 크게 가스주입부분, 반응기부분, 그리고 반응가스 분석부분으로 구성되어 있다. 반응기에 공급되는 가스는 N2, O2, NH3, NO, SO2의 각 실린더로부터 mass flow controller (MFC, MKS Co.)를 사용하여 유량이 조절된다. 또한, 수분의 공급은 N2가 버블러(bubbler)를 통하여 수분을 함유하고 있다. 가스공급관은 전체에 걸쳐 스테인레스관(SUS316L)으로 하였으며 NO와 NH3가 반응하여 생기는 염의 생성을 방지하고 반응가스 중의 수분이 응축되지 않기 위하여 150 ℃로 일정하게 유지한다. 반응물과 생성물의 농도를 측정하기 위하여 NO는 비분산적외선가스분석기(ZKJ-2, Fuji Electric Co.)를 사용하였으며, SO2는 화학발광분석기(43CHL, Thermo Ins.)를 사용하였다. 모든 가스는 분석기로 유입되기 전에 수분은 냉각기 내의 수분 트랩에서 제거시킨 후 유입하였다. 촉매의 균일성을 유지하기 위하여 제조된 촉매를 유압프레스를 이용하여 5,000 lb의 힘을 가한 후 300 ~ 425 µm 크기의 촉매를 sieving 하여 얻었다. 정상상태의 탈질 실험에 관한 실험변수는 Table 1에 나타내었다. NOx 전환율은 다음과 같은 식으로 계산하였다.
[Table 1.] Experimental condition

Experimental condition
SO2 주입 시 촉매활성이 감소함을 나타내는 SO2 deactivation (k/ko)은 다음과 같이 나타내었다.
ko : Catalyst activity with fresh catalyst
k : Catalyst activity at a given time in the deactivation cycle
2.3.1. XPS (X-ray photoelectron spectroscopy)
촉매 표면의 원소분석 및 산화상태를 조사하기 위한 XPS 분석은 VG Scientific사의 ESCALAB 210을 사용하였으며, excitation source로써 Al Kα monochromatic (1486.6 eV)를 사용하였다. 진공도를 10 ~ 12 mmHg로 유지하기 위하여 표면 sputtering 및 etching을 하지 않고, 시료 내에 존재하는 원소는 wide scanning spectrum으로 분석하여 binding energy와 intensity를 측정하였다.
2.3.2. Raman
Nd : YAG laser가 채택된 Horiba co.의 LabRam ARAMIS를 이용하였다. Detector는 multichannel thermal electric cooled (−70 ℃) CCD를 사용하였으며, laser source는 He-Ne laser (Red 633 nm)을 laser power는 5 mW이고, scan 회수는 100이고, Raman shift range는 700 ~ 1,200 cm−1이며, resolution은 1.7 ~ 2 cm−1로 하여 분석하였다.
2.3.3. H2-TPR
분석은 Micromeritics Co. AutoChem II 2920을 사용하였다. H2-TPR은 100 mg의 촉매를 충전 후 우선 30 cc min−1의 air를 흘리며 400 ℃까지 10 ℃ min−1으로 승온한 후 30분간 유지하여 촉매표면의 수분을 제거하고 또한 촉매를 활성화하였다. 시료는 300 ℃로 하강하여 30 cc min−1의 N2를 흘리며 흡착산소를 제거하고 상온(약 30 ℃)로 하강한 후 5.03% H2/Ar 30 cc min−1을 흘리며 촉매표면의 흡/탈착을 안정화 이후 5.03% H2/Ar 30 cc min−1을 지속적으로 흘리며 10 ℃ min−1의 속도로 600 ℃까지 승온하며 TCD를 H2의 농도를 monitoring 하였고, TCD의 reference gas는 Ar을 사용하였다.
2.3.4. SO2-TPD
분석은 Micromeritics Co. AutoChem II 2920와 quadrupole mass spectrometer는 Balzers OmniStar의 QMS 200를 사용하였다.
SO2-TPD는 100 mg의 촉매를 충전 후 우선 3% O2/N2 200 cc min−1를 흘리며 400 ℃까지 10 ℃ min−1으로 승온한 후 30분간 유지하여 촉매를 활성화시켰다. 이 후 상온(약 30 ℃)로 하강한 후 5,000 ppm SO2 + 3% O2/Ar 50 cc min−1으로 30분간 촉매에 NH3를 흡착시킨 후 200 cc min−1 N2로 purging하며, 이 후 200 cc min−1 N2를 흘리며 10 ℃ min−1의 속도로 600 ℃까지 승온하며 quadrupole mass를 이용하여 SO2 (m/z = 64)의 농도를 측정하였다.
3.1. 바나듐 함량에 따른 탈질효율 및 SO2 내구성 실험
본 연구에서는 우수한 탈질효율과 SO2 내구성을 가지는 최적의 바나듐 함량을 알아보기 위하여 바나듐 함량별(0.5 ~ 3.0 wt%)로 V[x]/TiO2 촉매를 제조하였다. 제조된 촉매에 대하여 공간속도 60,000 h−1으로 하고 반응온도 범위는 250 ~ 350 ℃의 온도로 선정하여 반응활성 실험을 수행하였다. SO2 내구성 실험은 반응온도를 250 ℃에서 SO2 500 ppm을 주입하고, 다른 조건은 반응활성실험 조건과 동일하게 실시하였으며, 그 결과를 Figure 1과 2에 나타내었다.
Figure 1의 실험결과, 바나듐 함량이 증가할수록 탈질효율이 증가됨을 확인할 수 있으며, 270 ℃ 이하의 저온에서 그 차이는 더욱 명확하게 나타났다. 이와 관련하여, Giakoumelou et al. [13]은 결정성 V2O5가 형성되지 않는 내에서 바나듐 함량이 증가함에 따라 단일층 표면밀도(monolayer surface density)가 증가하여 바나듐원자 1개당 제거되는 NO의 원자수를 계산한 값인 전환빈도(turnover frequency)가 증가한다고 언급하였으며, 이에 바나듐 함량이 증가할 경우 저온에서의 반응활성이 증가한 것으로 판단된다.
또한 Figure 2의 SO2 내구성 실험결과, 바나듐 함량이 증가할수록 SO2에 대한 내구성은 감소하는 경향을 보였다. 이와 관련하여 Dunn et al. [5]은 바나듐의 함량이 증가할수록 SO2의 SO3로의 전환율이 증가한다고 언급하였으며, 이로 인한 산화된 SO3가 NH3 및 H2O와 반응하여 생성된 ABS에 의한 촉매의 deactivation이라 판단된다. 반응활성 측면에서 적정 바나듐 함량은 1.5 wt% 이상이 요구되며 3.0 wt% 이상일 경우 SO2에 대한 내구성이 상대적으로 급격히 감소하므로 3.0 wt% 미만에서 바나듐 함량을 정하는 것이 적정하며, SO2 내구성과 반응활성 측면에서 모두 우수한 2 wt%로 선정하였다.
3.2. W 첨가에 따른 반응특성 및 SO2 내구성 평가
앞 절에서 바나듐 함량에 대한 최적화 연구를 수행하였지만, 250 ℃에서 반응활성이 낮은 문제점을 가지고 있다. 이에 따라 저온 SCR 활성을 증진시키기 위한 연구를 수행하였다. Amiridis et al. [11]은, V2O5/TiO2 촉매에 다양한 금속 산화물을 첨가하여 반응성을 비교한 연구를 수행하였으며, 금속산화물에 따라 각기 다른 반응활성을 나타내었다고 하였다. 이 중 텅스텐의 경우 V/TiO2 촉매의 반응활성을 증진시켜 temperature window를 넓힌다고 알려져 있다[7].
이에 따라 본 연구에서는 V[2]/TiO2 촉매에 텅스텐을 함량별로 제조하였고, 반응활성 차이를 더욱 명확히 확인하기 위하여 공간속도 120,000 h−1 조건에서 250 ℃에서의 반응활성을 확인하였으며, 그 결과를 Figure 3에 나타내었다.
텅스텐의 함량이 5 wt%까지 증가할수록 반응활성이 증진되었으며, 그 이상 함량인 7 wt%가 첨가되었을 때에는 반응활성이 감소하는 것을 확인할 수 있었다. 따라서 최적 텅스텐 첨가 함량은 5 wt%로 선정되었다.
NH3-SCR 반응에서 촉매에 암모니아가 흡착되면 촉매의 환원이 일어나며, 이러한 촉매의 redox 특성은 매우 중요하다[11]. 이에 본 연구에서는 V[2]/TiO2, V[2]/W[5]/TiO2 촉매에 대해 H2-TPR 실험을 수행하여 촉매의 환원능력을 확인하였으며, 그 결과를 Figure 4에 나타내었다.
그 결과, 저온에서 반응활성이 더 우수한 V[2]/W[5]/TiO2 촉매의 경우 V[2]/TiO2 촉매보다 H2 소모 peak의 위치가 저온에서 나타났다. 이는 H2-TPR에서 환원 peak이 나타나는 온도가 촉매의 redox 능력과 관련이 있으며, 낮은 온도대에서 peak가 나타날 때 촉매가 저온 SCR 반응에서 NO에 대한 활성이 더 높은 것으로 보아 H2-TPR에서 발견되는 환원력과 활성이 관계가 있음을 알 수 있다[10]. 따라서 텅스텐이 첨가됨으로서 V/TiO2 촉매의 저온에서의 환원능력이 증진됨에 따라 반응활성이 증진된 것이라 판단된다.
또한 W이 SO2 내구성에 미치는 영향을 확인하기 위하여 V[2]/W[5]/TiO2 촉매와 비교 촉매로서 V[2]/TiO2 촉매에 대해 반응온도를 250 ℃, SO2 500 ppm을 주입하는 조건에서 SO2 내구성 실험을 수행하였고, 그 결과를 Figure 5에 나타내었다.
그 결과, V[2]/TiO2 촉매의 경우, SO2를 주입하고 2시간 이 후 반응활성의 감소가 시작되며, 주입 후 25시간 이후에는 SO2 내구성의 척도인 k/ko 값이 0.86을 나타내었다. 반면 V[2]/W[5]/TiO2 촉매의 경우, SO2 주입 10시간 이후 반응활성 감소가 시작되었으며, 같은 주입시간인 25시간에는 k/ko 값이 0.91로 매우 높게 나타났다. SO2에 의한 V/TiO2 촉매의 활성저하는 이슬점 이하의 온도에 첨가된 바나듐에서 산화된 SO3와 NH3 그리고 H2O가 반응하여 형성된 NH4HSO4가 촉매의 기공 및 표면을 막아 활성이 저하되는 것으로 알려져 있다[4].
두 촉매의 SO2 내구성의 차이를 좀 더 명확하게 이해하기 위하여, 250 ℃에서 1시간 동안 5,000 ppm SO2 + 3% O2/Ar에 노출시킨 후 SO2-TPD 실험을 수행하였고, Figure 6에 나타내었다.
실험 결과, V[2]/TiO2 촉매의 경우, 658, 851 ℃에 각각 1개의 peak과 shoulder peak가 관찰되었다. 저온 peak는 촉매 표면에 흡착된 SO2를 의미하며, 고온 peak는 촉매의 불순물로서 존재하는 impurity로부터 기인한 것과 또는 촉매의 bulk 내에 흡착된 SO2에 의한 것으로 판단된다[19]. V[2]/W[5]/TiO2 촉매의 경우, 576, 726 ℃에서 peak이 나타났으며, 저온과 고온 peak 모두 V[2]/TiO2 촉매보다 저온으로 이동한 것을 확인할 수 있었다. 또한 SO2 탈착 peak area 또한 감소한 것을 확인할 수 있다. 이는 텅스텐이 표면에 존재함으로써 반응된 SO2가 흡착되지 않을 수 있는 요소에 의한 것이며, 이에 따라 텅스텐이 첨가됨으로서 SO2 내구성이 증진된 것이라 판단된다.
3.3. 바나듐 용액의 pH 조절에 따른 촉매의 탈질효율과 표면 vanadium 분산도의 상관관계
촉매 제조방법 중 하나인 함침법에서는 활성물질 용액을 지지체와 접촉시켜 담지 시키기 때문에 지지체의 표면성질에 따라 활성물질의 담지 상태가 달라진다. 고체를 수용액에 담그면 고체와 액체 경계면에 양전하나 음전하를 띄고 있다. 이러한 고체 표면의 전하 분포는 접촉하고 있는 수용액의 pH에 따라서 달라지기 때문에 활성물질 수용액의 pH 조절은 촉매 제조에서 중요한 인자이다[12].
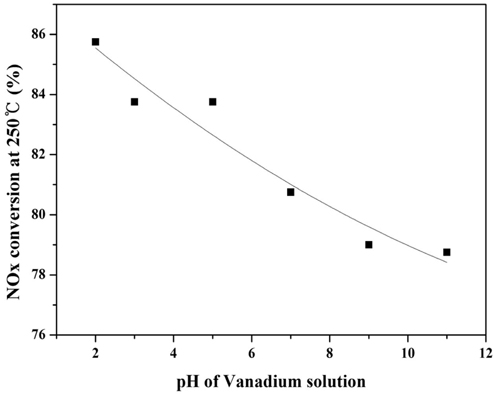
이에 따라 본 연구에서도 바나듐 용액의 pH에 따라 촉매를 제조하여, 반응활성실험을 수행하였으며, 그 결과를 Figure 7에 나타내었다.
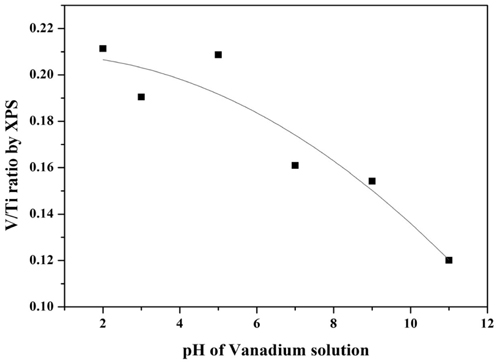
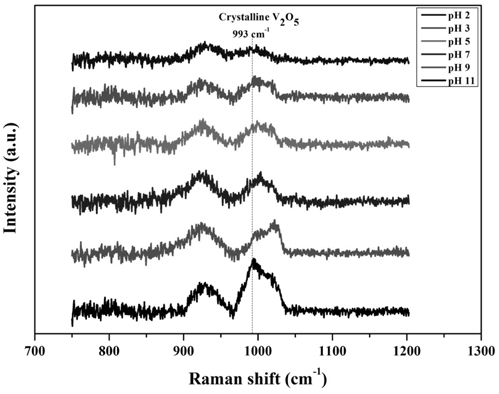
실험 결과, 바나듐 용액의 pH에 따라 반응활성이 변화하는 것을 확인할 수 있었으며. 최적 pH는 2로 선정되었다. 이는 촉매 제조 시 담지되는 금속산화물의 이온과 담체인 TiO2의 정전력(electrostatic forces)에 의하여 분산성이 달라지며, 정전력은 담지되는 용액의 pH와 TiO2의 제타전위(Zeta potential)에 영향을 받아 표면에 형성되는 금속 산화물의 형태가 달라지기 때문인 것으로 판단된다[13-16]. 또한 Wach et al. [17]은 VOx/TiO2의 활성물질인 바나듐은 일정량 이상으로 첨가될 경우 촉매 표면에 형성된 바나듐의 원자간의 거리가 매우 가까워지며 촉매제조 시 열처리로 인해서 바나듐의 뭉침 현상이 발생되며, 이 결과로 crystalline VOx가 형성된다고 언급하였으며, 이러한 crystalline VOx는 촉매의 환원 능력을 억제시켜 탈질효율을 감소시킨다[10]. 따라서 본 연구에서는 바나듐 용액의 pH에 의하여 표면에 형성되는 바나듐의 분산성과 표면 바나듐의 형태가 반응활성과 상관관계가 있는지를 확인하기 위한 분석을 수행하였다. 이에 대해 XPS 분석을 통하여 바나듐 용액의 pH에 따른 촉매 표면에 바나듐과 티타니아의 intensity 비와의 상관관계를 Figure 8에 나타내었고, 또한 Raman 분석을 수행하여 Figure 9에 그 결과를 나타내었다.
Figure 8의 XPS 분석 결과, 바나듐 용액의 pH가 낮을수록 표면에 노출된 바나듐과 티타니아의 비를 나타낸 지표인 V/Ti ratio 가 증가하는 것을 확인할 수 있었다. 이는 같은 함량의 바나듐이 첨가되어도 바나듐 용액의 pH가 낮을수록 표면에 형성되는 바나듐이 고분산 된 것이라 판단된다.
또한 Figure 9의 Raman 분석결과, 모든 촉매에서 표면에 형성된 crystalline V2O5을 나타내는 993 cm−1 peak을 관찰하였으며[18], 바나듐 용액의 pH가 낮을수록 crystalline V2O5의 형성이 억제되는 것을 확인할 수 있었다.
따라서 본 연구에서 사용한 촉매 역시 pH 조절에 의한 촉매 표면 바나듐의 분산도 증진에 의한 crystalline V2O5 종의 형성이 억제되어 반응활성이 증진되었다고 판단된다.
SCR 설비를 이용하는 연소로 중에는 연소 시 고농도의 CO가 발생하며[10], 이에 따라 CO가 SCR 반응에 미치는 영향을 확인할 필요가 있다. 본 연구에서는 앞 절에서 연구한 V[2]/W[5]/TiO2 촉매의 고농도에서의 CO에 대한 내구성 실험을 수행하였으며, 실험조건은 반응온도 250 ℃, 공간속도 60,000 h−1인 반응활성 실험과 동일하게 주입해 주었으며, CO의 농도는 10,000 ppm으로 주입하였고 실험결과를 Figure 10에 나타내었다.
실험 결과, V[2]/W[5]/TiO2 촉매를 25시간 동안 10,000 ppm의 고농도의 CO를 주입해 주었음에도 반응활성 저하가 일어나지 않았다. 본 연구에서도 CO가 SCR 반응활성에 영향이 없음을 확인할 수 있었으며, CO가 SCR 반응활성을 감소시키지 않는다고 언급한 Bae [20]의 연구와 일치하였다.
본 연구에서는 250 ℃에서 우수한 반응활성 및 SO2 내구성을 가진 바나듐계 탈질촉매 개발 연구를 통해 다음과 같은 결과를 얻을 수 있었다.
촉매의 저온 SCR 반응활성 실험 결과 바나듐 함량에 따라 각기 다른 SCR 전환율과 SO2 내구성 결과를 나타내었다. 바나듐의 첨가함량이 증가할수록 저온에서의 SCR 반응활성은 증진되지만, SO2의 SO3 산화율이 증가함에 따라 내구성은 감소한다. 따라서 바나듐의 첨가 함량은 두 가지 측면 모두를 고려해야 하며, 본 연구에서는 최적 바나듐의 함량을 2 wt%로 선정하였다. V/TiO2 촉매에 텅스텐의 첨가로 저온에서의 촉매의 redox 특징이 증진되어 산소의 거동이 원활하게 됨에 따라 반응활성이 증진되는 것으로 나타났으며, SO2의 흡착량을 감소시킴에 따라 SO2 내구성이 증진되는 것으로 나타났다. 바나듐 용액의 pH 조절에 따라 표면의 바나듐을 고분산 시켜 crystalline V2O5 종의 형성이 억제되는 것으로 나타났으며, 이러한 결정금속의 고분산으로 인해 우수한 SCR 반응활성을 나타내었다. CO 내구성 실험 결과, 연소 시 발생되는 CO에 대한 SCR 촉매의 내구성은 우수한 것으로 판단된다.
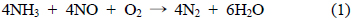
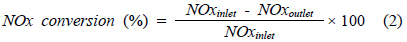
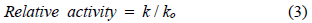
![Effect of vanadium contents of V[x]/TiO2 catalysts on NOx conversion (reaction conditions: NO: 748 ppm, NO2: 55 ppm, O2: 3%, H2O: 6%, NH3/NOx: 1.0, S.V: 60,000 h?1).](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f001.jpg)
![Relative activity in the present of SO2 for the SCR of NO by NH3 with V[x]/TiO2 catalysts (reaction conditions: reaction temperature: 250 ℃, NO: 748 ppm, NO2: 55 ppm, O2: 3%, H2O: 6%, SO2: 500 ppm, NH3/NOx: 1.0, S.V: 60,000 h?1).](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f002.jpg)
![Effect of W contents of V[2]/W[x]/TiO2 catalysts on NOx conversion (reaction conditions: reaction temperature: 250 ℃, NO: 748 ppm, NO2: 55 ppm, O2: 3%, H2O: 6%, NH3/NOx: 1.0, S.V: 120,000 h?1).](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f003.jpg)
![H2-TPR profile of V[2]/TiO2 and V[2]/W[5]/TiO2 catalysts.](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f004.jpg)
![Relative activity in the present of SO2 for the SCR of NO by NH3 with V[2]/TiO2 and V[2]/W[5]/TiO2 catalysts (reaction conditions: reaction temperature: 250 ℃, NO: 748 ppm, NO2: 55 ppm, O2: 3%, H2O: 6%, SO2: 500 ppm, NH3/NOx: 1.0, S.V: 60,000 h?1).](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f005.jpg)
![SO2-TPD pattern of V[2]/TiO2 and V[2]/W[5]/TiO2 catalysts.](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f006.jpg)
![Effect of high concentration CO with V[2]/W[5]/TiO2 on NOx conversion (reaction conditions: NO: 748 ppm, NO2: 55 ppm, O2: 3%, H2O: 6%, CO: 10,000 ppm, NH3/ NOx: 1.0, S.V: 60,000 h?1).](http://oak.go.kr/repository/journal/20566/CJGSB2_2016_v22n2_114_f010.jpg)