A photocatalyst which mixed by the commercialized P25-TiO2 and a synthesized AgxO was used in an appropriate weight ratio to effectively produce hydrogen gas in this study. The AgxOs were synthesized with the conventional sol-gel method, and tetramethylammonium hydroxides were added at the synthesis process in order to stabilize the solutions, and then the solutions were heat-treated at the temperatures of -5, 25, and 50 ℃, resulted to obtain the three types of silver oxides. Physicochemical properties of the synthesized AgxOs were identified through X-ray diffraction analysis (XRD), scanning emission microscopy (SEM), ultraviolet-visible spectroscopy, and X-ray photoelectron spectroscopy (XPS). In the photolysis results of water/methanol (weight ratio 1:1) solution, the mixture of P25-TiO2/AgxO exhibited a significantly higher hydrogen gases evolution, compared to that of pure P25-TiO2. Additionally, the addition of H2O2 as an supplement oxidant and in AgxO synthesized at 50 ℃ improved the hydrogen production efficiency. In particular, the emitted hydrogen gases reached to 13,000 μmol during 8 hours when a mixed catalyst, AgxO of 0.1 g and P25-TiO2 of 0.9 g, were used.
과학 기술의 발전으로 과거에 비해 매우 편리한 삶을 살게 되었으나, 화석연료 사용의 증가로 인한 이산화탄소 발생량이 함께 증가함에 따라 지구온난화가 점점 가속화되고 있다. 따라서 화석연료를 대체하거나 에너지를 생산하는 과정에서 온실가스를 배출하지 않는 기술 개발에 대한 연구가 전 세계적으로 주목을 받고 있다. 대체 에너지로는 태양열, 지열, 풍력, 바이오 에너지, 수소 에너지 등 자연에서 얻을 수 있는 원료를 이용하는 방법들이 연구되고 있다[1].
그 중 수소 에너지는 원료와 최종 생산물에서 온실가스가 발생하지 않는 청정에너지이며, 물, 저급 알코올, 또는 탄화수소 같은 유기물로 제조가 가능하기에 원료로 사용하기에 무리가 없다고 할 수 있다[2]. 또한 수소 에너지는 그 자체가 에너지 저장 매체로도 사용될 수 있어 많은 장점이 있다[3].
수소를 제조하는 방법은 여러 가지가 있으나, 현재는 물을 전기분해하는 방법보다는 탄화수소와 같은 화석연료의 개질[4]에 의한 생산이 경제적이고 생산량도 뛰어나다. 그러나 이 방법은 앞서 설명한 이산화탄소가 배출된다는 점과 한정적인자원이라는 부정적인 측면을 비껴나갈 수 없다.
본 연구에서는 광촉매를 사용하여 물/메탄올혼합용액을 분해하여 수소를 생산하고자 하였다. 광촉매에 흡수된 광 에너지는 가전자(valence band)에서 정공(hole)을, 전도대(conduction band)에서는 광전자(photoelectron)를 생성시킨다. 생성된 광전자와 정공은 광촉매 표면으로 이동하여 물과 만나 환원과 산화반응을 통하여 수소와 산소를 2:1로 발생시킨다. 이 반응은 높은 자유에너지를 수반하므로 태양광에너지를 효율적으로 물의 분해에 사용할 수 있는 광촉매를 필요로 한다. 현재까지 광촉매로는 ZnO, CdS, ZnS, TiO2 등의 반도체 소재들이 폭넓게 이용되고 있지만, 이 중에서 TiO2가 가격이 저렴하고 광 흡수력이 뛰어나며 광에 안정적으로 작용할 수 있어 가장 범용으로 사용되고 있다[5-8].
본 연구에서는 세 가지 형태의 산화은을 합성하였다. 특히 P25-TiO2와 합성한 AgxO의 혼합물을 촉매로 사용하여 물/메탄올 광분해에 의한 수소 제조 성능을 평가하였다. 특히 열처리 온도(-5, 25, 50 ℃)를 달리하여 합성한 산화은이 수소발생에 미치는 영향을 확인하였고, P25-TiO2와 AgxO의 질량비율(5, 10, 15, 20 wt%)에 따른 수소 제조성능을, 마지막으로 보조 산화제(H2O2, NaOH, KOH, CH3COOH) 첨가에 따른 수소 제조성능을 비교하였다.
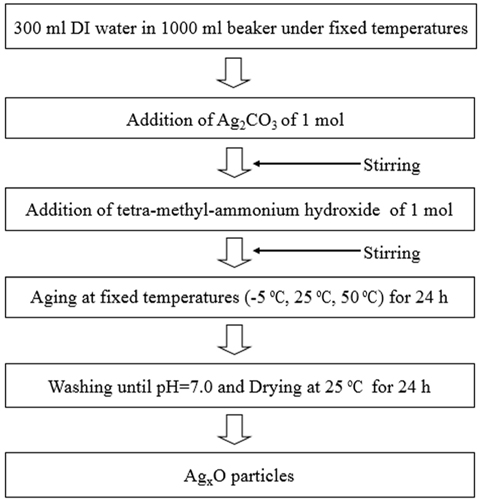
AgxO는 전형적인 솔-젤(sol-gel) 법[9]으로 합성하였으며, 제조과정을 Figure 1에 나타내었다. 산화은의 출발물질로 silver carbonate (99.9%, Ag2CO3, Junsei Chemical, Japan)가 사용되었는데, 300 mL의 증류수에 1.0 mol의 탄산은(Ag2CO3)을 첨가하여 가수분해에 의해서 산화은을 제조하였다. 이 때 은(Ag)의 급격한 산화를 막기 위해 용액 안정제로 100 mL의 tetramethylammonium hydroxide (99.9% TMEOH, Aldrich)가 첨가 되었다. 용액내 Ag2CO3의 가수분해를 위하여 -5, 25, 50 ℃에서 24시간 동안 방치하였고, 어두운 갈색의 침전을 얻었다. 생성된 침전물은 여과한 후 pH가 7이 될 때까지 세척하였으며, 세척 후 여과침진물은 상온에서 24시간 동안 건조시켰다. 숙성온도, -5, 25, 50 ℃에서 얻어진 세 가지 형태의 AgxO를 각각 K1, K2, K3로 명명하였다.
다양한 온도에서 열처리 된 AgxO입자의 결정성은 X-선 회절법(XRD, model PW 1830 from Philips)으로 분석하였으며, X-선 회절 패턴은 2 theta 5-70° 범위에서 10°/분의 스캔속도로 1초 간격으로 측정하였다.
합성된 AgxO의 모양은 주사전자현미경(SEM, model JEOLJSM35CF)으로 15 kV에서 관찰하였으며, 원자 조성은 EDAX로 측정하였다.
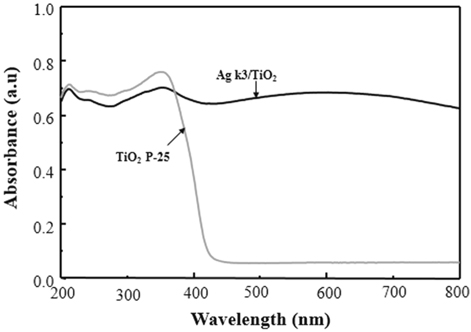
또한, 자외선-가시선 흡광 분석(NEOSIS-2000, SCINCO)은 200~800 nm 파장 범위에서 분석하였다.
Ag3d궤도에서 결합에너지는 X-선 광전자분광법(XPS, PHI 5700, PHI com.)으로 분석하였으며, 촉매를 5 mm 펠렛으로 만든 후, 진공 조건에서 24시간 동안 방치한 후 알루미늄(통과에너지 = 23.5 eV)을 X-선 광원으로 사용하여 350 W, 15 kV에서 측정하였다. 이때 압력은 측정하는 동안 2.7 × 10-6 Pa을 유지하였다.
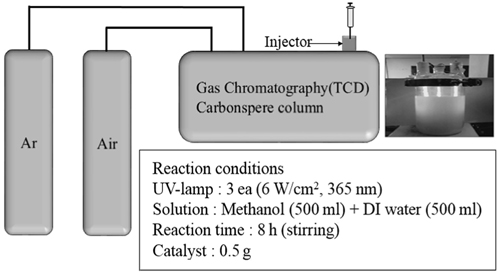
수소 제조성능은 Figure 2와 같이 제작한 액상 광 반응기를 이용하여 평가하였다. 광 촉매 분해반응을 위한 반응물로 메탄올 500 mL와 증류수 500 mL을 혼합한 용액 1.0 L를 2.0 L의 Pyrex 반응기에 넣었고, 촉매로 1.0 g의 AgxO와 P25-TiO2(Dagussa) 혼합물을 첨가하였다. 광원으로 365 nm 파장의 UV-lamp(6 × 3 W/cm2 = 18 W/cm2, 30 cm length × 2.0 diameter; Shinan, Sunchun, Korea)를 사용하였고, 광을 조사한 후부터 1시간 단위로 발생한 기체를 마이크로 실린지를 이용하여 분취해 열전도도 검출기(TCD)가 장착된 기체크로마토그래피(GC, model DS 6200; Donam Instruments Inc., Korea)에 주입하여 수소생성량을 측정하였다.
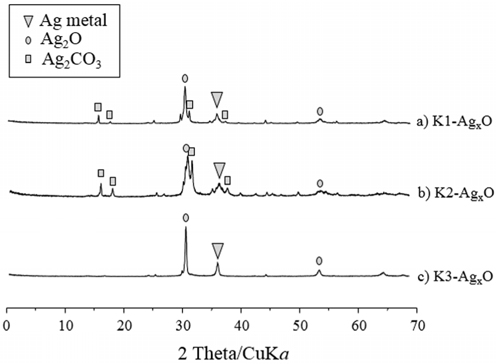
Figure 3은 다양한 온도에서 열처리된 AgxO (K1 = -5 ℃, K2 = 25 ℃, K3 = 50 ℃) 입자의 X-선 회절패턴을 나타낸 것이다. 합성과정 중 처리온도가 높아질수록 원래 출발물질로 사용한 Ag2CO3 피크는 사라지고 Ag2O 피크가 관찰되었다. 또한 숙성온도가 높아질수록 금속 은 의 피크세기가 증가하는 것으로 확인되었다. 상용 P25-TiO2의 X-선 회절패턴은 이미 잘 알려져 있으므로 본 논문에서는 나타내지 않았다[10].
Figure 4는 다양한 열처리 온도에 따라 합성된 K1, K2, K3 AgxO 입자 모양을 SEM으로 관찰한 사진이다. 상온에서 열처리된 K2 AgxO입자는 균일하면서 작은 입자의 크기를 나타냈고, 가장 높은 온도에서 열처리된 K3 AgxO는 결정이 크게 성장하여 균일하며 큰 결정들이 뭉쳐있는 형상이 관찰되었다. 반면 가장 낮은 온도에서 열처리된 K1 AgxO는 온도가 너무 낮아서 입자의 성장이 균일하지 못하여 여러 상이 혼합된 형성을 나타내었다.
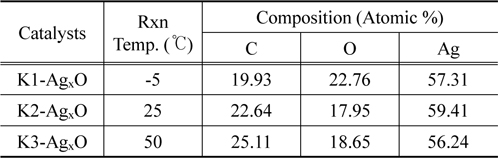
Table 1은 합성된 AgxO를 EDAX로 분석한 결과를 나타낸 것이다. 열처리 온도가 증가할수록 O의 비율은 줄어들고는 있지만, 전체적으로 Ag의 비율은 세 샘플에서 크게 변화가 없는 것으로 보인다. 그러나 XRD 결과에서와는 달리 K3에서 C의 양이 오히려 증가한 것처럼 보인다. 이것은 50 ℃에서 합성한 AgxO에도 씻겨나가지 못한 CO32- 이온이 남아 있는 것으로 판단된다.
[Table 1.] Atomic compositions over the AgxO estimated from the EDAX results
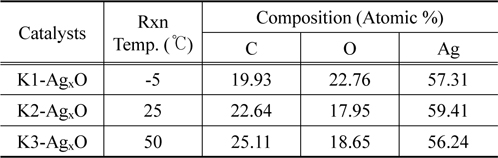
Atomic compositions over the AgxO estimated from the EDAX results
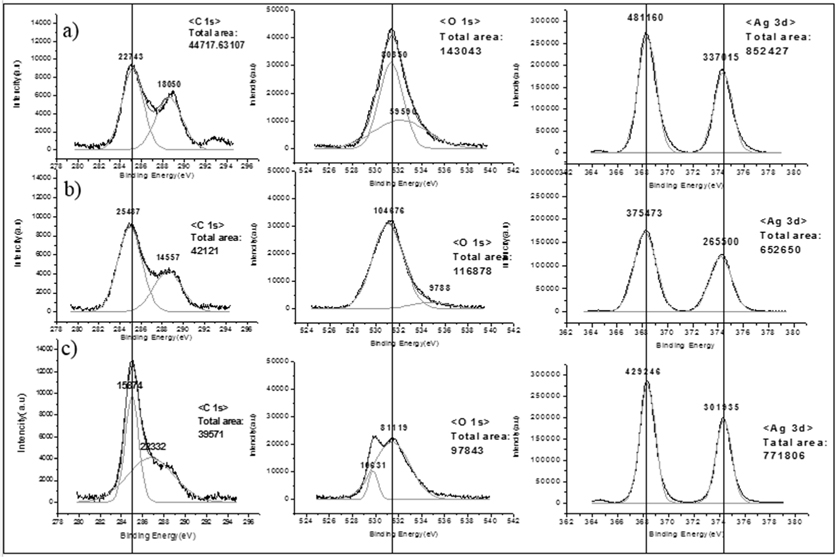
Figure 5에는 다양한 열처리 온도에 따른 AgxO의 XPS curve를 나타내었다. Ag3d5/2와 Ag3d3/2의 광전자가 분리되는 결합에너지는 각각 368.2 eV와 374.5 eV[11]이다. 이는 다른 연구자들의 문헌과 비교한 결과, 전형적인 Ag2O의 XPS 분석결과와 매우 유사하였다[12,13]. 반면, O1s 피크는 531.5 eV, 534.5 eV에서 두 개의 피크로 분리되어 나타나는데, 이는 각각 금속-O 결합[14]과 금속-OH 결합에너지를 나타낸다. 결과적으로 X-선 광전자 분광법은 각 샘플 내에 존재하는 은이 AgxO와 같은 금속-O형태로 존재함을 시사하고 있다. 일반적으로 C1s는 몇 개의 피크로 분리되어 나타나는데, 주요 피크로는 고립된 C (284.5-285.5 eV)[15], C-N (286.0-287.0 eV)[16], 그리고 C-O (287.0-290.0 eV)[17]가 나타난다. 본 연구에서 합성된 시료상에서는 C와 C-O 두 가지 피크가 관찰되었고, 전자가 후자보다 더 높은 세기의 피크가 나타났다. 결국 AgxO 안에는 제거되지 못한 C가 존재하고 있으며, 이것이 광반응 중전자나 산소 캐리어 역할을 하여 광촉매 활성에 영향을 줄 가능성도 있다.
3.2. AgxO/P25-TiO2 광촉매를 이용한 물/메탄올에서 수소 생산 성능 평가
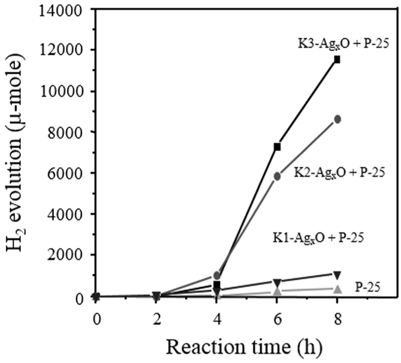
K1, K2, K3 AgxO와 P25-TiO2 혼합물을 사용하여 물/메탄올 광분해에 의한 수소 제조 성능 평가 결과를 Figure 7에 나타내었다. 이 실험은 물/메탄올 1.0 L (1:1비)에 1.0 g (P25-TiO2 0.95 g + AgxO 0.05 g)의 촉매를 첨가 한 조건에서 수행하였다. P25-TiO2를 촉매로 사용하여 8시간 반응한 후 발생된 수소 양을 GC로 확인한 결과, 300 μmol 정도의 수소가 발생한 것으로 확인되었다. 그러나 AgxO가 혼합된 AgxO/P25-TiO2광촉매에서는 현저한 수소 발생량 증가를 보였고, 특히 50 ℃에서 합성된 K3 촉매를 사용한 경우에 가장 높은 수소생성량을 나타내었는데, 광반응 후 8시간 동안 약 12,000 μmol의 수소가 제조되었다. 이 결과는 Figure 3 결과에서 보여준 AgxO의 형태에 그 영향이 있다고 볼 수 있다. 합성된 AgxO에는 금속 Ag, Ag2O, Ag2CO3의 세 가지 산화상태의 은이 존재하는데, 이온 상으로 존재하는 Ag2CO3는 광에 의해 안정한 형태로 결정이 변환되는 과정이 우선적으로 일어나므로 광반응에 적극적으로 참여하기 어렵다. 따라서 광반응이 활발히 일어나기 위해서는 Ag2CO3 보다 안정한 산화물 형태인 Ag2O 형태가 많이 존재해야 한다. 그러므로 K3가 혼합된 촉매상에서 가장 높은 수소 생성량을 얻을 수 있을 것으로 기대할 수 있다.
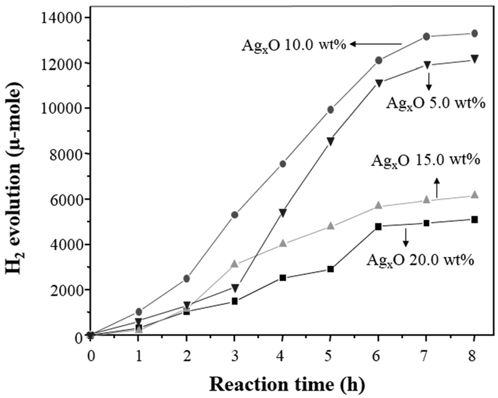
앞서 실험결과에서 가장 좋은 효율을 지닌 K3-AgxO를 사용하여 P25-TiO2와 상대적인 무게비율(5, 10, 15, 20 wt%)에 따라 혼합하여 광분해 활성을 비교하였으며, 그 결과를 Figure 8에서 나타내었다. 물/메탄올 광분해 반응을 8시간동안 실시한 결과 K3-AgxO/P25-TiO2 10 wt% 촉매에서 13,000 μmol로 가장 높은 수소 생산량을 나타내었다. 한편, AgxO는 어두운 갈색을 띠고 있어 광 산란을 막을 수 있다. 그러므로 10 wt%에서는 높은 수소 생산 효율을 나타내지만 더 많은 양의 AgxO가 첨가된 15 wt%부터는 오히려 수소 생산 효율이 떨어지는 것을 확인할 수 있었다. 이와 같은 결과는 갈색의 AgxO에 의한 빛의 차단으로 인해 P25-TiO2로 빛의 전달이 용이하지 못함에 그 원인이 있는 것으로 판단된다.
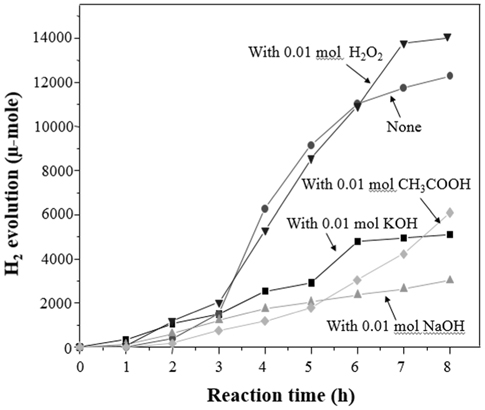
Figure 9에서는 K3-AgxO/P25-TiO2 10 wt% 촉매를 사용하여 물/메탄올 혼합용액에 보조 산화제나 환원제로 H2O2, KOH, NaOH, CH3COOH 4가지 첨가물을 넣었을 때 수소생산 효율을 비교하였다. 첨가물을 넣지 않았을 때의 효율은 12,000 μmol 정도의 수소 생산 능력을 보였다. 특히, H2O2를 첨가할 경우 가장 높은 14,000 μmol의 수소가 발생되었다. 첨가물을 첨가하지 않았을 때와 비교해서 약 16.6%정도 향상됨을 확인하였다.
이것은 H2O2가 광에 의해 스스로 분해하여 OH라디칼로 변환되고 결국 강력한 산화제인 OH라디칼이 메탄올을 산화 분해하여 수소발생을 크게 증가시킨 것으로 사료된다. 그러나 나머지 첨가제들은 오히려 성능 저하를 가져왔는데 이것은 H2O2와는 달리 강염기인 NaOH와 KOH는 Ag를 안정화시키고, 또한 남아있는 Ag2CO3와 결합하여 NaAgCO3 KAgCO3와 같은 복염을 이루는데 그 원인이 있다고 볼 수 있다. 또한 아세트산을 첨가한 경우에는 광촉매가 메탄올 뿐 만 아니라 아세테이트도 유기물로 간주하여 이를 분해하는데 사용되므로 물 분해에 역 효과를 일으키는 것으로 판단된다.
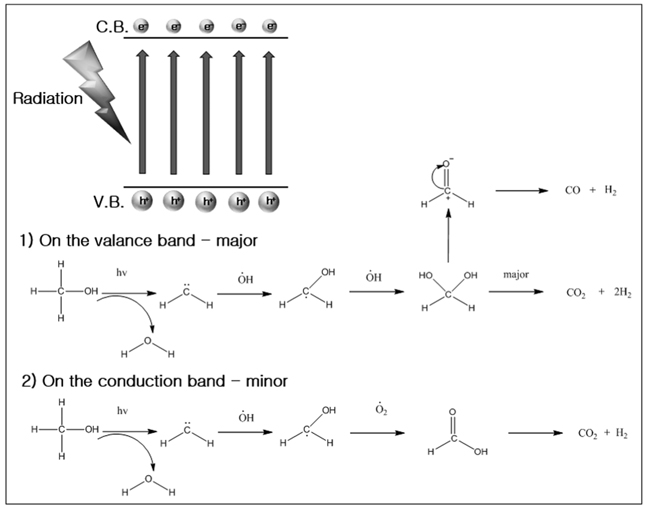
이상의 물성과 활성실험 결과를 기반으로 하여 물/메탄올 광분해 반응 메커니즘을 Figure 10에 제시하였다. 반도체로 알려진 P25-TiO2는 광자를 흡수하고 들떠서 가전자띠에서 전도띠로 전이하는데, 가전자띠에서 홀에서는 OH라디칼이 생성되어 강력한 산화제로 작용한다.
이것은 결국 메탄올과 물을 산화/분해하는데 쓰이게 된다. 본 연구에서는 P25-TiO2 광촉매에 환원전위가 강한 AgxO을 혼합하여 사용함으로써 전도띠로 전이한 전자와 홀 사이의 재결합을 감소시켜 홀에서의 OH라디칼 생성을 유지하는데 그 목적을 두었다. AgxO가 P25-TiO2 표면에 존재하면 P25-TiO2의 가전자띠에서 전도띠로 이동한 들뜬 전자들을 끌어당겨 홀과의 결합을 막을 수 있다. 이 때 은의 환원전위(E0 = 0.7993V)는 순수한 TiO2 환원전위보다 높으므로 전자는 자연스럽게 TiO2에서 AgxO로 흘러가서 Ag+는 Ag0로 환원된다. 결국 P25- TiO2 가전자대의 많은 홀들은 오랜 시간 동안 유지될 수 있어 많은 양의 OH라디칼을 생성하고 결론적으로 높은 광 활성을 나타낼 것으로 판단된다.
본 연구에서는 AgxO/P25-TiO2 혼합소재를 사용하여 물/메탄올로부터 광분해 반응을 통해 수소를 효율적으로 생산하고자 하였다. XRD분석 결과로부터 열처리 온도에 따른 AgxO의 산화상태가 다양함을 알 수 있었고, 특히 열처리 온도가 50 ℃일 때 AgxO의 양이 최대로 생성됨을 확인하였다. 물/메탄올 광분해에서 AgxO/P25-TiO2 혼합소재를 사용한 경우 현저하게 수소 제조량이 증가함을 알 수 있었다. 특히 K3-AgxO/P25-TiO2 10 wt% 사용 시 최대 13,000 μmol의 수소가 발생하였고, 보조 산화제로써 H2O2 0.01 mol을 첨가한 반응에서는 16.6% 더 많은 수소가 발생하였다. 본 연구에서는 AgxO/P25-TiO2 촉매를 사용할 경우 더 큰 환원전위를 갖는 AgxO가 P25-TiO2에서 발생한 전자를 용이하게 끌어당겨 P25-TiO2내의 전자와 홀 사이의 재결합을 억제시키고, 이 결과 물/메탄올의 광분해 성능이 증가되었다는 것을 알 수 있었다.