어류는 난에서 자어 및 치어 단계를 거쳐 성어로의 가입이 이루어지며, 이 시기 동안 매우 높은 사망률을 보인다. 특히 난황을 가진 전기자어기(pre-larval stage)보다는 외부섭식(exogenous feeding)을 시작하는 시기에 사망률이 매우 높다(Hjort, 1926). 생활사 초기에 적절한 외부섭식이 이루어지지 못하면 기아(starvation)에 의한 직접적인 사망과 낮은 성장률로 인한 부유 자어 기간이 길어지게 되어 다른 포식자에 의해 피식될 확률의 증가로 이어 질 수 있으며(Shepherd and Cushing, 1980), 결국 이러한 일련의 과정이 어류의 가입량에 영향을 미친다(May, 1974; Lasker, 1975). 어류 초기생활사에 있어서 먹이의 가용성(prey availability)과 섭식 성공은 생존에 있어서 가장 중요한 요소이며, 이를 파악하는 것은 동일 연령군(cohort)의 가입성공 여부와 어류 개체군들의 잠재적 연급군(year class) 강도를 평가하는데 중요한 초석이 된다(Cushing, 1990). 따라서 초기 생활사 단계에서 선호하는 먹이생물을 확인하는 것은 섭식조건과 먹이요건을 충족하는 자어의 기회를 평가하는데 중요한 요소이다(Robichaud-LeBlanc et al., 1997).
청어(
청어의 출현량은 주기에 따른 극심한 변동을 보이는데, 우리나라 청어 자원량의 출현 양상을 시대별로 살펴보면, 1910-20년대, 1960-70년대에 많은 출현량을 보였으며, 1970년대 이후부터 출현량이 급격히 감소하였다(Gong et al, 2009). 그러나 2000년대 후반부터 청어의 출현량은 매년 증가하고 있는 추세이며(KOSIS, 2015), 본 연구해역인 낙동강 하구역과 인근의 진해만에서도 겨울에서 봄 사이에 청어 자치어의 출현량이 매우 높은 특징을 보이고 있다(Huh et al., 2011; Choi, 2014).
청어에 관한 생태적 연구는 식성(Wailes, 1936; Choo, 2007), 난발생 및 부화자어 형태(Han et al., 2004), 초기생활사(Chimura et al., 2009)에 관한 연구 등이 있을 뿐이며, 자어의 식성에 관한 연구는 거의 이루어지지 않았다(Blaxter, 1965).
한국 남해안의 대표적인 어류 산란 및 성육장인 낙동강 하구역에 출현하는 어종의 초기생활사에 대한 종합적인 연구의 일환으로 중요한 상업성 어종 중 하나인 청어 자치어의 주먹이생물을 파악하고, 성장에 따른 먹이변화와 일주기 섭식생태(diel feeding pattern)를 파악하고자 한다.
식성 연구에 사용된 청어 자치어의 시료는 낙동강 하구둑에서 약 2 km 떨어진 하구역의 안쪽에 위치한 정점(35°05´N; 128°55´E)에서 2010년 12월부터 2011년 4월까지 매월 소조기의 낮 동안 3-4회 반복채집 하였다. 일주기 섭식생태 파악을 위한 시료는 2011년 2월에 동일한 정점에서 09:00부터 익일 06:00까지 3시간 간격으로 총 8회 채집한 시료를 이용하였다. 시료의 채집은 RN80 네트(망구, 80 cm; 망목, 330 μm)를 이용하여 수심 1-2 m에서 약 2.5 knots로 10분간 수평 채집을 실시하였고, 정량적 분석을 위하여 네트 입구에 유량계(Hydro-Bios Model 438 110)를 부착하였다.
채집된 표본은 5% 중성 포르말린으로 고정한 뒤, 실험실에서 청어 자치어를 분리한 후, 척색장(notochord length, NL)을 0.1 mm까지 측정하여 해부현미경(Olympus SZ40) 하에서 위장을 분리하였다. 장내용물은 쌍안실체현미경(Olympus CH2)을 이용하여 먹이 종류별로 구분하였고, 출현량이 많은 먹이생물은 가능한 속(genus)수준까지 동정하였으며, 그 외 먹이생물은 그 보다 상위 분류단계까지만 동정하였다. 먹이생물의 동정에는 Yamaji (1984), Cho (1993), Yoo (1995) 등을 참고하였다.
먹이생물은 종류별로 개체수를 계수한 뒤, 요각류 노플리우스 단계나 기타 소형 먹이생물은 17 μm, 요각류 성체나 기타 대형 먹이생물은 68 μm 단위로 먹이생물의 장축과 단축을 측정하였다. 그리고 먹이생물의 부피를 측정하기 위하여 먹이생물 종류에 관계없이 원기둥으로 가정한 뒤 장축은 높이, 단축은 밑면의 반지름을 구하는데 이용하였고, 원기둥 부피 식인 v=πr2*h 이용해 먹이 생물의 체적을 구하였다.
장내용물의 분석 결과는 각 먹이생물에 대한 출현빈도(frequency of occurrence), 먹이생물의 개체수비와 부피비로 나타내었으며, 출현빈도는 다음과 같이 구하였다.
%F = Ai / N × 100
여기서, Ai는 장내용물 중 해당 먹이생물이 발견된 청어 자치어의 개체수이고, N은 위장에 내용물이 있었던 청어 자치어의 개체수이다.
섭식된 먹이생물의 상대중요성지수(index of relative importance, IRI)는 Pinkas et al. (1971)의 식을 이용하여 다음과 같이 구하였으나, 먹이생물의 중량비(%W) 대신 부피비(%V)를 이용하였으며, 결과 값은 백분율로 환산하여 상대중요성지수비(%IRI)를 구하였다.
IRI = (%N + %V) × %F
성장에 따른 먹이생물의 변화를 알아보기 위하여 청어 자치어의 시료를 4 mm 간격으로 4개의 크기군(8-12 mm; 12-16 mm; 16-20 mm; >20 mm)으로 나누어 먹이조성을 조사하였고, 척색장과 섭식된 먹이생물 크기(단축) 사이의 관계는 선형회귀분석을 실시하였다. 그리고 성장에 따른 먹이섭식 특성 파악을 위하여 크기군별 개체 당 먹이의 평균 개수(mean number of preys per gut, mN/GUT)와 부피(mean volume of prey per gut, mV/GUT)를 구하였으며, 분산분석(analysis of variance, ANOVA)을 이용하여 유의성 검정을 실시하였다.
또한 먹이생물을 얼마나 다양하게 먹고 있는가를 파악하기 위하여 dietary breadth index (Bi)를 구하였다(Park et al., 2007; Huh et al., 2008).
Bi = (1/n−1) ∙ (1/∑Pij2−1)
여기서, Pij는 포식자 i의 장내용물 중 먹이생물 j가 차지하는 비율이고, n은 총 먹이생물의 종수이다. 이 지수는 0에서 1까지의 범위를 보이며, 1에 가까울수록 더 다양한 먹이생물을 섭식하는 종으로 볼 수 있다(Gibson and Ezzi, 1987; Park et al., 2007; Huh et al., 2008).
그리고 일주기에 따른 청어의 섭식특성 변화를 알아보기 위하여 2011년 2월에 출현한 청어 자치어를 대상으로 시간대별 섭식률과 평균 먹이생물 개체수를 분석하였다.
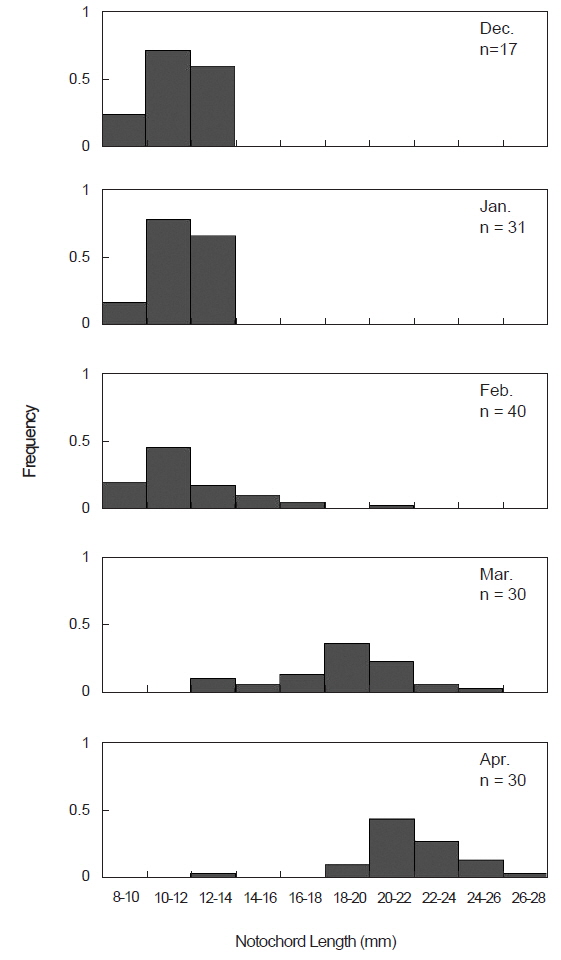
본 연구에서 청어 자치어의 먹이생물 분석을 위하여 사용된 시료는 총 148개체였고, 12월에 17개체로 가장 적었으며, 2월에 40개체로 가장 많았다. 청어 자치어의 척색장 분포를 살펴보면(Fig. 1), 12월에는 8.3-12.0 mm (avg.: 10.4±1.0), 1월에 9.1-12.2 mm (avg.: 10.6±0.8), 2월에 8.8-20.5 mm (avg.: 11.8±2.7)의 범위를 보였으며, 그 중 10-14 mm 개체의 빈도가 높았다. 한편 3월에서 4월로 갈수록 출현하는 자치어의 척색장 범위와 평균 척색장이 증가하여 3월에는 12.2-24.8 mm (avg.: 18.6±3.1), 4월에는 13.7-26.0 mm (avg.: 21.6±2.4)의 범위를 보였다.
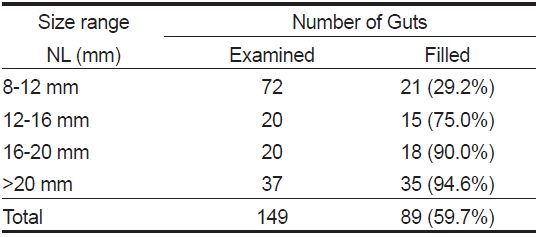
장내용물을 분석한 148개체 중 먹이를 섭식한 청어 자치어는 89마리로 섭식률은 60.1% 였다(Table 1). 척색장에 따른 섭식률은 섭식 초기인 8-12 mm에서 29.2%로 가장 낮았으며, 12-16 mm에서 75.0%로 급격히 증가하였다. 이후 점차 증가하여 가장 큰 >20 mm에서 섭식률은 94.6%로 척색장이 증가함에 따라 증가하였다
[Table 1.] Feeding incidence of Clupea pallasii collected in the Nakdong-River estuary
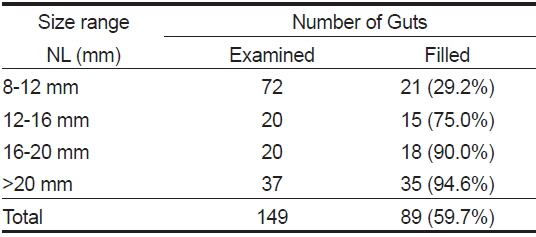
Feeding incidence of Clupea pallasii collected in the Nakdong-River estuary
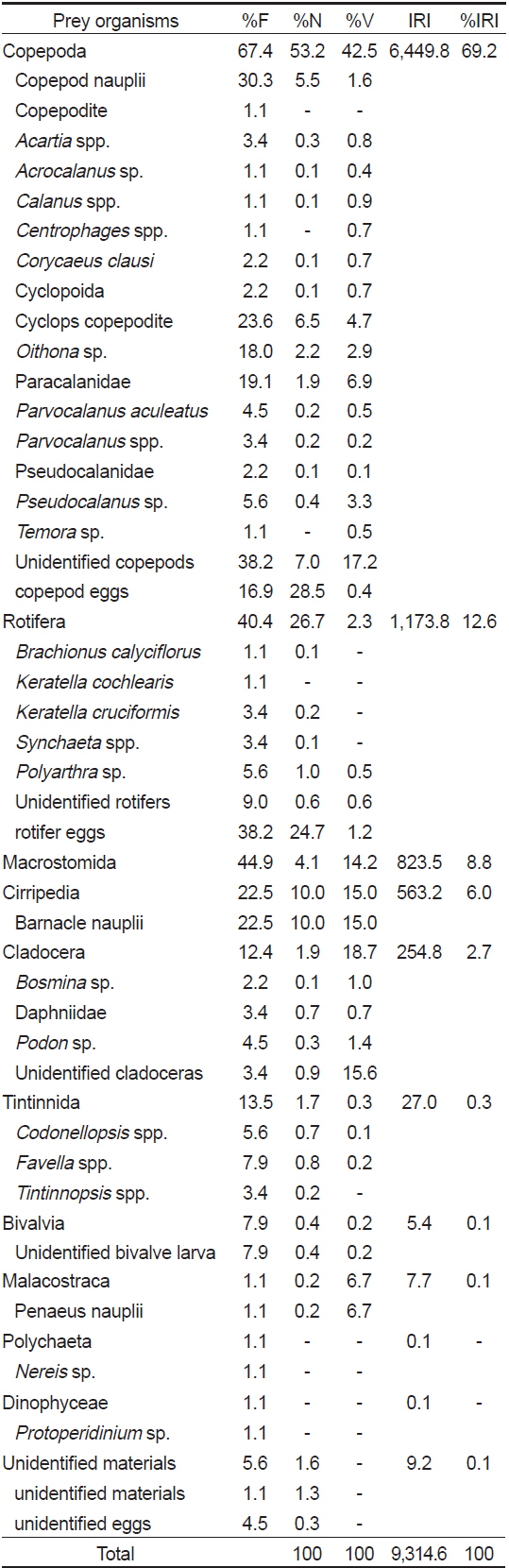
먹이를 섭식한 89개체의 장내용물 분석 결과(Table 2), 청어자치어의 가장 중요한 먹이생물은 출현빈도 67.4%, 개체수비 53.2%, 부피비 42.5%를 보여 상대중요성지수비 69.2%를 차지한 요각류(Copepoda)였다. 요각류는 총 18개의 분류군이 발견되었고, 요각류 중에서 미동정 요각류가 출현빈도 38.2% 개체수비 7.0%, 부피비 17.2%로 상대중요도지수 923.4로 가장 많이 섭식되었으며, 그 다음으로 요각류 난이 출현빈도 16.9%, 개체수비 28.5%, 부피비 0.4%로 상대중요성지수 486.9로 두 번째로 중요한 먹이생물이었다. 그 다음으로 cyclops 코페포디드 유생이 출현빈도 23.6%, 개체수비 6.5%, 부피비 4.7%로 263.7의 상대중요성지수를 보였고, 노플리우스 유생이 상대중요도지수 214.5로 비교적 중요한 먹이생물이었다. 그 외
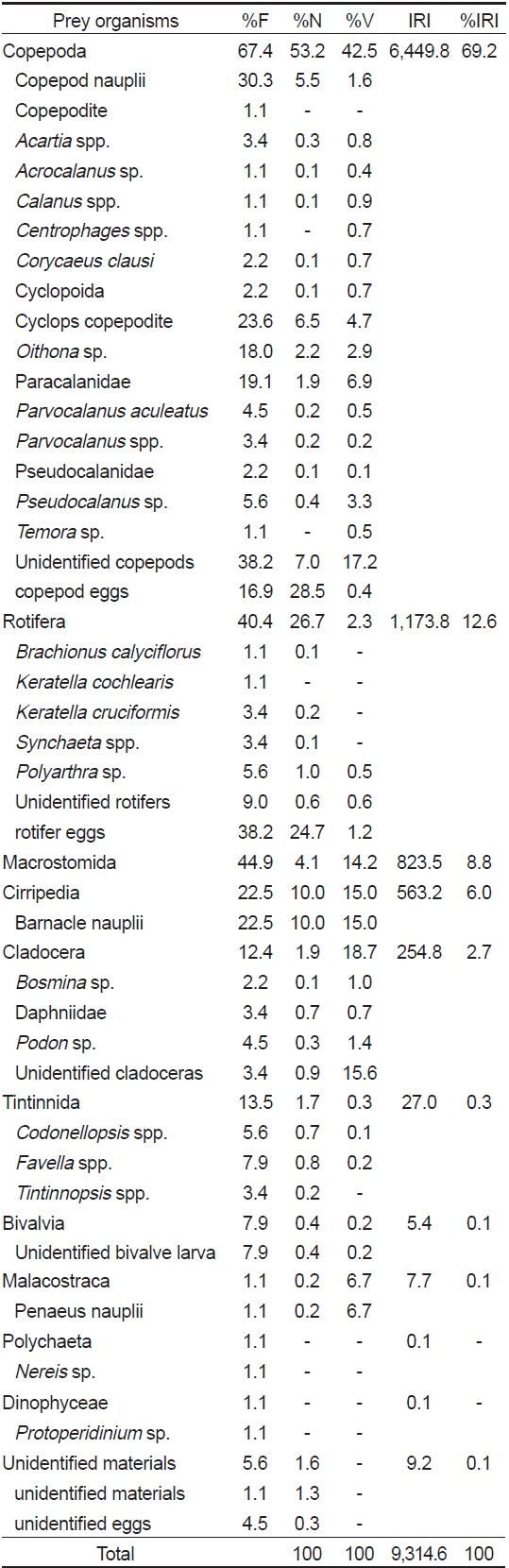
Composition of the gut contents of Clupea pallasii by frequency of occurrence, number, volume and index of relative importance (IRI)
요각류 다음으로 많이 섭식된 먹이생물은 출현빈도 40.4%, 개체수비 26.7%, 부피비 2.3%를 차지하여 상대중요성지수비 12.6%를 보인 윤충류(Rotifera)였다. 윤충류도 7개의 다양한 분류군이 섭식되었으며, 그 중에서 윤충류 알이 출현빈도 38.2%, 개체수비 24.7%, 부피비 1.2%를 보여 상대중요성지수 990.3으로 가장 중요한 먹이생물이었다. 그 다음으로 미동정 윤충류가 상대중요성지수 10.5로 많이 섭식되었다.
윤충류 다음으로 출현빈도 44.9%, 개체수비 4.1%, 부피비 14.2%로 상대중요성지수 8.8%를 보인 거구목(Macrostomida: phylum Tubellaria, class Platyhelminthes)이 많이 섭식되었다. 그 다음으로 개체수비 출현빈도 22.5%, 개체수비 10.0%, 부피비 15.0%로 상대중요성지수비 6.0%를 차지한 만각류(Cirripedia) 유생과 상대중요성지수비 2.7%를 보인 지각류(Cladocera)가 비교적 많이 섭식되었다.
유종섬모충류(Tintinnida), 이매패류(Bivalvia) 유생, 연갑류 (Malacostraca) 유생, 갯지렁이류(Polychaeta), 와편모조류(Dinophyceae), 미동정 먹이생물이 먹이생물 중 발견되었지만 그 양은 매우 적었다.
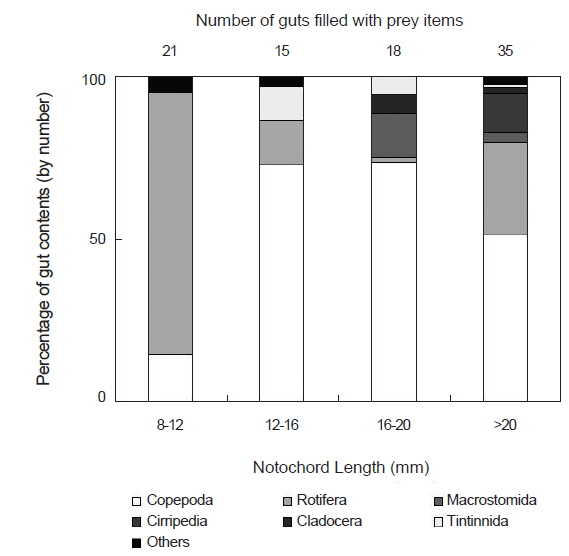
채집된 청어 자치어는 8-12 mm, 12-16 mm, 16-20 mm, >20 mm 4개의 크기군으로 나누어 먹이생물의 개체수를 기준으로 조성변화를 조사하였다(Fig. 2). 가장 작은 크기군인 8-12 mm에서는 윤충류가 전체 먹이생물 개체수의 80.7%를 차지하여 가장 중요한 먹이생물이었다. 그 다음으로 요각류가 14.5%로 많이 섭식되었고, 그 밖에 기타 먹이생물이 4.8%로 소량 섭식되었다. 12-16 mm 크기군에서는 윤충류가 크게 감소하여 전체 먹이생물 개체수의 13.9%를 차지하였다. 한편 요각류는 크게 증가하여 72.2%를 차지하였고, 이전 크기군에서 전혀 출현하지 않았던 유종섬모충류가 10.6%를 차지하였다. 그 외에 기타 먹이생물이 3.0%로 소량 섭식되었다. 16-20 mm 크기군에서는 요각류가 소량 증가하여 전체 먹이생물 개체수의 73.8%를 차지하여 가장 중요한 먹이생물이었다. 반면 윤충류는 개체수비 1.3%로 급격히 감소하는 경향을 보였다. 반면, 이전 크기군에서 출현하지 않았던 거구목과 지각류는 각각 13.8%, 5.8%로 비교적 많이 섭식되었다. 유종섬모충류는 5.4%로 감소하였다. >20 mm 크기군에서는 요각류가 감소하여 51.6%의 개체수비를 보였으며, 윤충류가 다시 증가하여 28.0%의 개체수비를 보였다. 그 다음으로 이전에 섭식되지 않았던 만각류가 12.1%로 비교적 많이 섭식되었다. 거구목은 개체수비 3.2%로 감소하였다. 그 외 지각류와 유종섬모충류도 감소하였다.
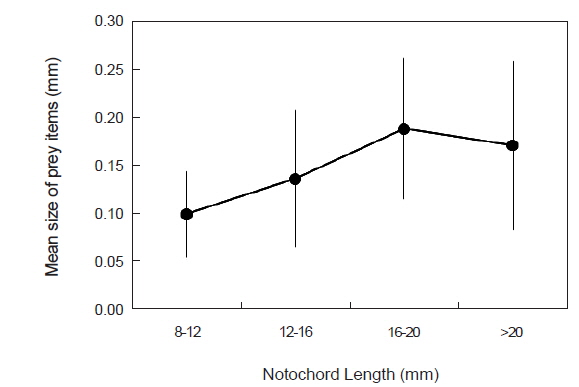
섭식된 먹이생물의 크기를 살펴보면(Fig. 3), 8-12 mm 크기군에서는 평균 먹이생물 크기가 0.10 mm이었으며, 12-16 mm 크기군에서는 0.14 mm, 16-20 mm 크기군에서는 0.19 mm, 가장 큰 크기군인 >20 mm에서는 0.17 mm로 소폭 감소하였으나, 자치어가 성장함에 따라 섭식된 먹이생물의 크기는 통계적으로 유의하게 증가하였다(F3,309=11.780,
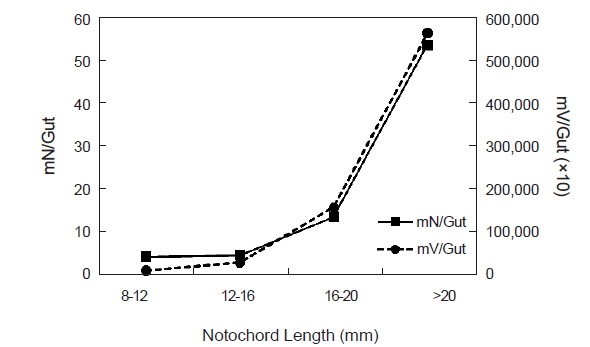
청어 자치어의 크기군별 개체 당 평균 먹이생물 개체수(mN/GUT)는 유의한 차이를 보였으며(ANOVA, F3,85=18.663,
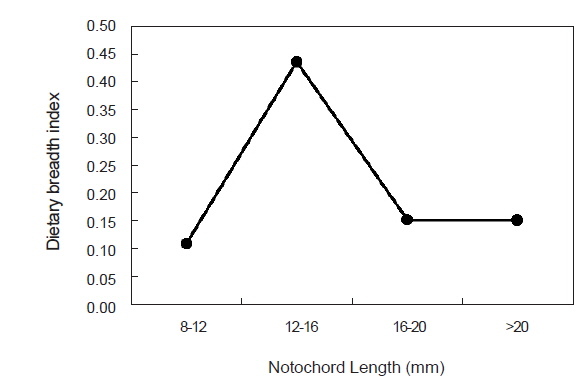
청어 자치어에 의해 섭식된 장내용물의 dietary breadth index는 0.11-0.43의 범위를 보였다(Fig. 5). 가장 작은 크기군인 8-12 mm 크기군에서는 가장 낮은 값인 0.11을 보였으며, 12-16 mm 크기군에서는 0.44로 가장 높았다. 이후 다시 감소하여 16-20 mm 크기군과 >20 mm 크기군에서는 0.15의 값을 보였다.
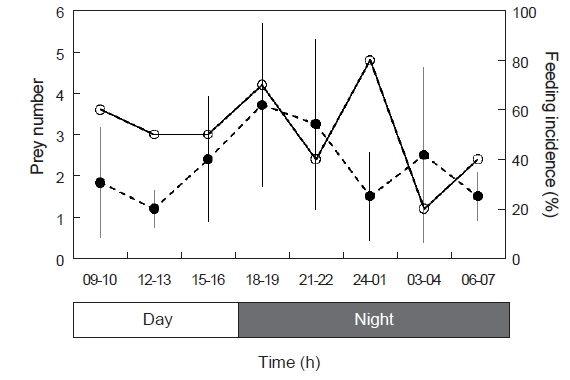
2011년 2월에 채집된 청어 자치어의 일주기 섭식특성을 살펴보면(Fig. 6), 섭식률의 경우 09-10 h에 60%였고, 12-13 h에는 약간 감소하여 50%였다. 15-16 h에는 50%로 변화가 없었으며, 이후 18-19 h에 섭식률이 70%로 다시 증가하였다. 21-22 h에는 40%까지 감소하였으나 24-01 h에 80%로 다시 증가하여 증감을 반복하였다. 03-04 h에는 섭식률이 20%로 가장 낮았으며, 06-07 h에는 다시 증가하는 경향을 보였다
한편 개체 당 평균 먹이생물 개수는 09-10 h에 1.83개체를 섭식하였고, 12-13 h에는 1.20개체로 감소하였다. 이후 점차 증가하여 18-19 h에 3.71개체로 가장 많은 개체를 섭식하여 섭식률과 유사한 패턴을 보였다. 한편 21-22 h 이후 평균 먹이생물 개체수는 급격히 감소하였다. 다만 03-04 h에 2.50개체로 약간의 증가를 보였고, 06-07 h에 다시 감소하였다. 따라서 청어 자치어의 전반적인 일주기 섭식특징은 낮과 늦은 밤 시간대 보다는 해가 진 직후인 18-19 h에 가장 활발한 섭식활동을 하는 특징을 보였다.
청어 자치어의 섭식 초기인 척색장 8-12 mm의 섭식률은 29.6%였으며, 자치어 기간 동안 전체 섭식률은 60.1%로 비교적 섭식률이 낮았다. 광양만에서 채집된 보구치(Cha and Park, 2001a)와 주둥치(Cha and Park, 2001b), 망둑어과의 자치어는 상대적으로 높은 섭식참여율을 나타내었다. 주둥치는 가장 작은 크기군이었던 1.6-1.8 mm에서 50%의 섭식률을 보였으며, 2.8 mm 이후부터 100%의 섭식률을 보였고, 전체 섭식률은 88.8%였다. 보구치는 2.0-3.0 mm 사이의 개체들이 채집되었으며, 100%의 섭식참여율을 보였고, 망둑어과 자치어는 91%의 높은 섭식률을 보였다.
한편 전어(Park et al., 1996)와 멸치 자치어(Park and Cha, 1995)의 경우, 최초 섭식 체장에서 각각 38.7%와 48.6%의 낮은 섭식률을 보였으며, 자치어 시기동안 각각 62.2%와 61.9%의 비교적 낮은 섭식률을 보여 본 연구의 청어와 유사하였다. 또한 본 연구와 동일한 해역에서 수행된 멸치와 웅어의 자치어 역시 각각 43.9%, 21.8%로 초기 섭식률이 낮았다(Choi, 2014). 이와 같이 청어를 비롯한 청어목 자치어들이 낮은 섭식률을 보이는 것은 섭식을 하지 않아서 이기 보다는 소화가 이루어졌거나(Ellertsen et al., 1981; Jenkins, 1987), 채집과 고정 과정 중에 직선형의 장을 가진 이 종들이 장내용물을 배설하였거나 토하였기 때문으로 판단된다(Hay, 1981; Yamashita, 1990). 반면 앞서 언급한 농어목 어류의 자치어들은 곡선형으로 꼬인 장의 형태를 가지고 있어 비교적 높은 섭식률을 보인 것으로 생각된다.
본 연구에서 요각류는 상대중요성지수비 69.2%를 차지하여 청어 자치어의 가장 중요한 먹이생물로 나타났다. 요각류는 전체 해양생물 생체량의 70-90%를 차지할 정도로 우점하는 동물플랑크톤으로, 대부분의 부유성 요각류는 식물플랑크톤을 먹이원으로 하기 때문에 생산자와 더 높은 영양단계에 있는 많은 다른 해양 생물들을 이어주는 중요한 역할을 하고 있다. 어류는 생활사의 일부 내지는 전 생활사 동안 요각류를 섭식하는 종들이 많이 있다. 특히 처음으로 외부섭식을 시작하는 생활사의 초기에 요각류 및 그 알과 유생은 다양한 종에 의해 이용된다(Young and Davis, 1990; Park and Cha, 1995; Park et al., 1996; Cha and Park, 2001a, 2001b; Cass-Calay, 2003; Østergaard et al., 2005; Reiss et al., 2005; Shoji et al., 2005; Fernández and González-Quirós, 2006; Landaeta et al., 2012). 본 연구에서도 요각류 노플리우스 및 코페포디드 유생 외에도, 전 세계의 기수역과 연안 해역을 중심으로 우점하고 있는 것으로 알려져 있는 곁노벌레과(Paracalanidae) 요각류를 많이 섭식하여 유사한 경향을 보였다(Kesarkar and Anil, 2010).
요각류 다음으로 많이 섭식된 먹이생물은 상대중요성지수비 12.6%를 보인 윤충류였다. 국내 자치어의 식성 연구에서 윤충류를 섭식하였다는 연구보고는 거의 없으며, 낙동강 하류에 서식하는 학공치(
청어 자치어의 먹이생물 중 윤충류 다음으로 많이 섭식된 먹이는 거구목(macrostomida)으로, 편형동물문(phylum Platyhelminthes) 와충강(class Tubellaria)에 속하는 중형저서생물(meiobenthos)이다. 와충강은 크기가 작고 납작하며 길쭉한 형태의 벌레모양 생물로 개체수가 매우 풍부하게 나타나는데, 낙동강 하구역에서 겨울철에 출현하였던 자치어의 먹이생물 중에서 비교적 많이 발견되었다(Choi, 2014). 편형동물은 다양한 생활사 형태를 보이지만, 거구목은 담수나 기수역, 그리고 해수의 퇴적물 사이에 서식하는 것으로 알려져 있다. 주로 퇴적물 속이나 표면에 서식하는 거구목을 청어 자치어가 섭식할 수 있었던 것은 본 연구해역의 수심이 비교적 얕고, 겨울철 파랑 작용(wave action)이 퇴적물 상층부의 모래나 펄을 재부유 시키는 과정에서 수층으로 유입되었기 때문인 것으로 생각된다.
어류가 성장함에 따라 먹이생물의 종조성이나 크기 및 개수가 변하는 것은 일반적인 현상으로, 성어(Park et al., 2007; Seo and Hong, 2007; Huh et al., 2007; Huh et al., 2008; Yoon et al., 2008)뿐만 아니라 자치어 시기에도 성장하면서 먹이생물의 조성과 크기가 변하였다(Lee and Huh, 1989; Young and Davis, 1990; Park et al., 1996; Park, 1999; Cha and Park, 2001a, b; Fernández and González-Quirós, 2006; Gning et al., 2008). 본 연구에서도 청어 자치어의 섭식 초기에는 윤충류를 주로 섭식하였으나, 성장함에 따라 요각류를 많이 섭식하였고, 가장 큰 크기군에서는 요각류, 만각류 외에 다양한 먹이생물을 섭식하였다.
한편 본 연구와 동일한 해역에서 채집된 다른 자치어들도 성장에 따른 먹이조성의 변화를 보였으며, 특히 여름철에 주로 출현한 망둑어과의 자치어와 정어리 자치어는 윤충류에서 요각류로 먹이가 전환되는 경향을 보여 청어와 유사하였다(Choi, 2014).
한편 British Columbia 남부 해역에서 채집된 청어도 성장에 따라 섭식되는 먹이의 종류가 달라지는 결과를 보였는데, 섭식 초기에는 다양한 종류의 동물플랑크톤 알과 규조류를 많이 섭식하다가 성장함에 따라 요각류와 만각류 유생을 선호하는 결과를 보여 본 연구와 유사하였다(Wailes, 1936).
어류의 섭식연구에 있어서 일주기(diel cycle) 변동을 포함한 시간에 따른 먹이조성의 변화는 흔히 관찰된다Huusko and Sutela, 1998; Amundsen et al., 1999. 본 연구에서 청어 자치어는 24-01 h에 최고 섭식률을 보였고, 18-19 h에 가장 많은 평균 먹이생물 개체수를 보여 낮과 새벽 시간대 보다는 해가 진 이후부터 자정까지 가장 활발한 섭식활동을 하였다.
낙동강 하구역에서 채집된 자치어들의 일주기 섭식특성을 살펴보면(Choi, 2014), 각 종의 출현시기와 상관없이 과(family)에 따라 유사한 일주기 특성을 보였다. 같은 청어과에 속하는 전어 자치어도 24-01 h에 최고 섭식률을 보였고, 18-19h에 가장 높은 평균 먹이생물 개체수를 보여 청어와 유사하였다.
하지만 Cantabrian 해에서 채집된 정어리는 이른 아침 시간에 평균 먹이생물 개체수가 가장 높아 Choi (2014)의 연구결과와는 차이를 보였는데(Fernández and González-Quirós, 2006), 이는 서식지의 환경 및 생물학적 요인의 차이에 의한 것으로 판단된다. 따라서 어류의 과별 일주기 섭식 패턴의 유사성에 대한 일반화는 다양한 환경에 서식하는 다양한 종의 일주기 섭식 패턴을 분석한 뒤 결정되어져야 할 것으로 생각된다.
한편 많은 어종이 자치어 시기에 시각에 의존하여 먹이를 섭 식하는 것을 고려하여 볼 때, 일몰 이후 이루어진 자치어의 섭식 은 흔하지 않은 현상이지만(Hunter, 1981; Blaxter, 1986), 빛이 전혀 없는 환경에서도 먹이를 섭식한다는 결과 보고가 다수 존 재한다(Amundsen et al., 1999; Rao, 2003; Reiss et al., 2005). 이중 Striped bass 자어의 일주기 섭식생태에 관한 연구는 비교적 많이 수행되었으며, 극히 미량의 빛 내지는 완전한 어둠에서도 먹이를 섭식한다고 보고되었다(McHugh and Heidinger, 1977; Eldridge et al., 1981; Chesney, 1989). 하지만 자어의 야간 섭식은 일몰 이전에 섭식된 먹이가 완전히 소화되지 못하여 야간에도 섭식이 이루어진 것과 같은 효과를 보였을 수도 있다(Watson and Davis, 1989). 이런 효과는 Vendace 자어를 이용한 실험 결과에서 잘 나타나 있다(Huusko and Sutela, 1998). 따라서 자어의 야간 섭식에 관한 현상을 설명하기 위해서는 섭식된 먹이생물의 소화 정도와 자어의 장배출율(gut evacuation rate)를 고려하여 종합적으로 판단하는 것이 필요할 것으로 생각되며, 본 연구에서 청어 자치어의 먹이생물 소화 정도를 보았을 때 주간과 큰 차이가 없었던 것으로 보아, 야간에도 섭식이 이루어지는 것으로 판단된다.