In this study, two kinds of polymer (PPQX-2hdPTZ (P1), POPQX-2hdPTZ (P2)) were synthesised by Suzuki coupling reaction based on phenothiazine derivative as electron-donor and quinoxaline derivative as electron-acceptor. Microwave synthesis workstation was used to shorten the polymerization time and increase the degree of polymerization. The physical, thermal stability, optical and electrochemical properties of the synthesized polymer were confirmed. The thermal stability of two polymers was outstanding as the initial decomposition temperature was 323-328℃. And additional substituted alkoxy chain on P2 showed higher degree of polymerization. An analysis of electrochemical properties, all polymer had similar HOMO energy level values. Device was fabricated by ITO/PEDOT:PSS/active layer/BaF2/Al structure and photovoltaic properties were confirmed. Each device has a different film thickness and the resulting change in PCE was confirmed. As a result the thinner thickness of the film showed a high efficiency (PCEmax: P1 = 1.0%, P2 = 1.1%).
최근 에너지 수요의 증가에 따른 기존 에너지 자원의 고갈과 환경오염에 대한 문제성이 심각한 상황에 놓여 있다[1]. Polymer solar cells (PSCs)은 재생 가능하고 환경문제를 유발하지 않는 태양에너지를 이용하는 차세대 기술이다. 특히 제작단가가 저렴하고, 넓은 면적에 유연성있게 제작가능하며 가벼운 무게와 대량생산의 용이성을 바탕으로 한 충분한 경쟁조건을 가지고 있어 차세대 에너지로서 큰 관심을 받고 있다[3-5]. 현재 상용화 되어 있는 P3HT (poly[3-hexylthiophene])는 4-5%대의 효율이 보고되었지만 넓은 밴드갭(band gap)을 가지고 있어 많은 태양광 흡수에 한계가 있다[6,7]. 이러한 효율은 기존 실리콘태양전지에 비해 매우 낮은 수준이며 상업적으로 성공하기 위해선 최소 10%대 이상의 효율을 나타내어야 하는 것으로 보고되고 있다[8-11]. 이에 따라 높은 광전변환효율과 안정성을 확보하기 위해 전자주개 물질로 공액 고분자와 전자받개 물질로 fullerene의 유도체인 PCBM을 혼합한 이종접합형태(bulkheterojunction, BHJ)구조에 대한 개발이 활발히 진행 중이며, 8-10%대의 고효율의 구조도 보고되고 있다[12-14].
Phenothiazine (PTZ)은 전자가 풍부한 황과 질소원소를 포함하고 있기 때문에 전자받개/전자주개 구조의 공액 고분자에서 좋은 전자주개 물질의 역할을 할 수 있으며, 태양전지(photovoltaic cells)와 발광다이오드, 박막트렌지스터(thin film transistor, TFT)와 같은 분야에서 널리 이용되고 있다[16,17]. PTZ는 황과 질소원소로 인해 바닥상태에서 나비모양의 비평면 구조를[17,18] 나타내지만 π-delocalization이 될 때 평면 구조가 되는 것으로 알려져 있다[19,20]. 또한 PTZ는 -5.1에서 -5.3 eV의 낮은 HOMO 에너지 레벨을 갖게 됨으로 높은 VOC 값을 기대할 수 있다[21-23]. 그러나 PTZ를 기반으로 한 push-pull구조의 PSCs는 넓은 밴드 갭, 낮은 용해성과 효율의 문제점을 가지고 있다.
Quinoxaline (QX)는 bithiazole과 같이 2개의 이민(imine)에 있는 질소가 좋은 전자 끌기(electron withdrawing)이기 때문에 우수한 전자결핍(electron deficient)이 될 수 있으며, 낮은 밴드 갭을 갖는 공액 고분자의 전자받개 물질로서 충분한 역할을 할 수 있다[24-27]. Thiophene은 고체상태에서 우수한 π-π stacking을 나타내기 때문에 높은 저공 이동도(hole mobility)를 갖게 됨에 따라 많은 공액 고분자에 사용되고 있다[28].
본 연구에서는 고분자의 공액 길이(conjugated length)를 증가시키기 위해 quinoxaline에 thiophene과 benzene 고리를 치환하였다. Rigid한 구조로 인해 저하되는 용해성을 개선하기 위해 phenothiazine에 가지형의 알킬 사슬을 치환하였다. 고분자 골격의 곁사슬(side-chain)로 인한 중합도 및 유기박막태양 전지로의 특성을 비교하기 위해 P2 골격에 추가로 octyloxy 사슬을 치환하여 그 차이를 비교하였다.
합성에 사용한 anhydrous toluene, benzil, carbon tetrabromide, hydrobromic acid, N-bromosuccinimide (NBS), tetrakis (triphenylphosphine)palladium(0) (Pd(PPh3)4), tetrabutylammonium bromide, tin(II)chloride, triethylamine, triphenylphosphine, zinc dust, 1-bromooctane, 1,2-dihydroxybenzene, 2-hexyl-1-decanol, 2-(tributylstannyl)thiophene은 Sigma-Aldrich사에서 구입하였고, 4,4'-dimethoxybenzil은 TCI에서 구입하였으며, bromine은 Junsei에서 구입하였다. Acetic acid, chloroform, dichloromethane (MC), dimethylformamide (DMF), ether, ethyl alcohol, hydrochloric acid, n-hexane, K2CO3, methyl alcohol, MgSO4, NaOH, nitric acid, tetrahydrofuran (THF), thionyl chloride와 같은 일반적인 유기용매들은 대정화금과 삼전화학에서 구입하였으며, 모든 시약들은 추가 정제 없이 사용하였다. 4,7-dibromo-5,6-bis (octyloxy)benzo[c][1,2,5]thiadiazole[29], 10-(2-hexyldecyl)-3,7-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-10H-phenothia zine[30]은 문헌에 따라 합성하였다. 고분자의 합성은 중합시간을 단축시키고 중합도를 높이기 위해 마이크로웨이브 합성 반응기(MAS-II, Shanghai Sineo Microwave Chemistry Technology Co., Ltd.)를 이용하였다. 합성한 단량체 및 고분자는 1H-NMR (Bruker, AVANCE 250 spectrometer)을 이용하여 구조를 확인하였으며 gas chromatography mass spectrometry (Agilent technologies, GC-MS)를 이용하여 순도를 확인하고, 고분자의 분자량은 gel permeation chromatography (Shimadzu GPC system) 로 측정하였다. GPC측정은 THF를 이동상으로 하고 기준을 polystyrene으로 하여 calibration하였다. Thermogravimetric analysis (TGA, Q50)을 이용하여 질소분위기에서 10 ℃/min의 속도로 승온시켜 Td (5% weight loss temperature)를 측정하여 열적 안정성을 확인하였다. 광학적 특성은 UV-Vis (Beckman Coulter DU 730)를 이용하여 용액 상태와 필름 상태에서 확인하였다. 전기화학적 특성을 확인하기 위해 cyclic voltammetry (ZAHNER IM6eX impedance analyzer)를 이용하였으며, 기준 전극 Ag/Ag+와 작업 전극 ITO, 상대전극 Pt wire, 전해질 용액으로는 tetrabutylammonium-tetra-fluoroborate를 acetonitrile에 녹여 50 mV/s의 scan rate로 측정하였다. Polymer solar cells (PSCs)로의 특성을 확인하기 위해 소자를 제작하였다. 소자의 구조는 ITO/PEDOT : PSS/active layer/BaF2/Ba/Al로 제작하였으며, active layer는 polymer와 PC70BM을 1 : 2의 weight ratio로 스핀 코팅하였다. 스핀 속도를 700, 1,500, 2,500, 4,000 rpm으로 조절하여 박막두께를 달리하여 측정하였다.
2.2.1. 3,6-dibromo-4,5-bis(octyloxy)cyclohexa-3,5-diene-1,2-diamine (1)
질소 분위기에서 250 mL 2구 플라스크에 4,7-dibromo-5, 6-bis(octyloxy)benzo[c][1,2,5]thiadiazole (3 g, 5.45 mmol)과 zinc dust (4.27 g, 65.4 mmol)을 넣어 acetic acid (84 mL)에 용해시켰다. 반응온도를 80 ℃로 설정하고 3 h 동안 환류시켰다. 반응 종결 시점은 chloroform을 eluent로 사용하여 TLC monitoring을 통해 결정하였다. 반응물을 상온으로 식힌 뒤 zinc dust를 제거하기 위해 감압 여과 후 여과액을 2 M NaOH와 MC로 추출하였다. MgSO4 넣어 수분을 제거하고, 용매는 감압증발로 제거하여 brown oil형태의 화합물을 얻었다(yield: 66.42%).
2.2.2. 5,8-dibromo-6,7-bis(octyloxy)-2,3-diphenyl-quinoxaline (2)
250 mL 2구 플라스크에 1번 화합물(1.9 g, 3.62 mmol)을 질소 분위기에서 넣고 acetic acid (90 mL)에 용해시킨 후, benzil (2.1 g, 10 mmol)을 넣어 60 ℃에서 24 h 동안 환류시켰다. TLC monitoring을 통해 반응을 종결시키고 상온으로 식힌 반응물을 chloroform과 증류수로 추출한 뒤 MgSO4를 첨가하여 수분을 제거하였다. 감압증발을 이용하여 용매를 제거하고 column chromatography (eluent: MC/n-hexane = 1/1)로 정제하였다. 화합물의 성상은 yellow solid형태로 얻어졌다. (yield: 59.43%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.87-0.93 (m, 6H), 1.26-1.43 (m, 16H), 1.51-1.84 (m, 4H), 1.86-1.96 (m, 4H), 4.18-4.23 (t, 4H), 7.31-7.40 (m, 6H), 7.61-7.64 (m, 4H).
2.2.3. 6,7-bis(octyloxy)-2,3-diphenyl-5,8-di(thiophen-2-yl)quinoxaline (3)
250 mL 2구 플라스크에 2번 화합물(1.50 g, 2.15 mmol)과 2-(tributlystannyl)thiophene (2.05 mL, 6.45 mmol)을 넣고 30 min 동안 진공상태로 유지키고, 다시 질소 분위기로 만들어 anhydrous toluene (60 mL)를 넣고 완전히 용해시켰다. Pd(PPh3)4 (0.27 g, 0.24 mmol)을 넣고 반응온도를 80 ℃로 설정하여 48 h 동안 환류시켰다. 반응 종결 시점은 TLC monitoring을 통해 확인한 뒤, 반응물을 상온으로 식혀 chloroform과 증류수로 추출하였다. MgSO4를 첨가하여 수분을 제거하고, 감압 증발시켜 용매를 제거한 뒤 column chromatography (eluent: MC/n-hexane = 1/2)로 정제하였다. 정제된 생성물은 green solid의 형태로 얻어졌다. (yield: 65.58%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.84-0.95 (m, 6H), 1.33-1.43 (m, 16H), 1.55-1.73 (m, 4H), 1.76-1.84 (m, 4H), 4.01-4.06 (t, 4H), 7.19-7.23 (m, 2H), 7.28-7.36 (m, 6H), 7.54-7.56 (t, 2H), 7.57-7.68 (m, 4H), 8.04 (s, 2H)
2.2.4. 5,8-bis(5-bromothiophen-2-yl)-6,7-bis(octyloxy)-2,3-diphenylquinoxaline (M1)
질소 분위기에서 250 mL 2구 플라스크에 3번 화합물(0.991 g, 1.41 mmol)을 THF (95 mL)에 넣어 완전히 용해시켰다. 빛을 차단하기 위해 플라스크를 호일로 감싸고, NBS (0.63 g, 3.53 mmol)를 portionwise로 넣어 상온에서 24 h 동안 교반시켰다. TLC monitoring을 통해 반응을 종결 시점을 확인한 뒤, 증류수를 넣어 quenching시켜 주었다. Chloroform과 증류수로 추출하고, 수분을 제거하기 위해 MgSO4를 첨가하였다. 용매를 감압증발 시켜 제거하고, column chromatography (eluent: MC/n-hexane = 2/3)로 정제하여 yellow solid 성상의 화합물을 얻었다. (yield: 65.10%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.83-0.94 (m, 6H), 1.29-1.48 (m, 16H), 1.55-1.67 (m, 4H), 1.73-1.84 (m, 4H), 3.99-4.02 (t, 4H), 6.83-6.87 (d, 4H), 7.18-7.22 (m, 2H), 7.53-7.55 (m, 2H), 7.61-7.64 (d, 4H), 8.03-8.04 (m, 2H).
2.2.5. 5,8-dibromo-6,7-bis(octyloxy)-2,3-bis(4-(octyloxy) phenyl)quinoxaline (4)
250 mL 2구 플라스크에 1번 화합물(0.95 g, 1.82 mmol)을 질소 분위기에서 넣고 acetic acid (50 mL)에 용해시켰다. 1,2-bis(4-(octyloxy)phenyl)ethane-1,2-dione (2.1 g, 4.55 mmol)을 넣고 반응온도를 60 ℃로 설정하여 완전히 용해시킨 후 24 h 동안 환류시켰다. MC를 eluent로 사용하여 TLC monitoring 을 통해 반응을 종결시키고 상온으로 식혔다. 반응물을 chloroform과 증류수로 추출한 뒤 MgSO4를 첨가하여 수분을 제거하였다. 감압증발을 이용하여 용매를 제거하고 column chromatography (eluent: MC/n-hexane = 1/1)로 정제하였으며, yellow oil형태의 화합물을 얻었다. (yield: 67.58%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.89-0.91 (t, 12H), 1.27-1.55 (m, 40H), 1.74-1.93 (m, 8H), 3.95-4.01 (t, 4H), 4.16-4.21 (t, 4H), 6.84-6.88 (t, 4H), 7.59-7.63 (m, 4H).
2.2.6. 6,7-bis(octyloxy)-2,3-bis(4-(octyloxy)phenyl)-5,8-di(thiophen-2-yl)quinoxaline (5)
100 mL 2구 플라스크에 4번 화합물(1.17 g, 1.23 mmol)과 2-(tributlystannyl)thiophene (1.17 mL, 3.69 mmol)을 넣어 30 min 동안 진공상태로 유지키고, 질소를 치환시켜 anhydrous toluene (30 mL)를 넣어 완전히 용해시켰다. Pd(PPh3)4 (0.16 g, 0.14 mmol)을 넣고 반응온도를 80 ℃로 설정하여 48 h 동안 환류시켰다. TLC monitoring을 통해 반응을 종결시킨 후 chloroform과 증류수로 추출하였다. MgSO4를 첨가하여 수분을 제거하고, 감압 증발시켜 용매를 제거한 뒤 column chromatography (eluent: MC/n-hexane = 1/1)로 정제하여 yellow oil 형태의 화합물을 얻었다. (yield: 90.24%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.90-0.92 (m, 12H), 1.30-1.54 (m, 40H), 1.70-1.94 (m, 8H), 4.04-4.09 (t, 8H), 7.13-7.15 (d, 2H), 7.36-7.38 (t, 6H), 7.62-7.65 (m, 4H), 7.96-7.98 (d, 2H).
2.2.7. 5,8-bis(5-bromothiophen-2-yl)-6,7-bis(octyloxy)-2,3-bis(4-(octyloxy)phenyl)quinoxaline (M2)
질소 분위기에서 250 mL 2구 플라스크에 5번 화합물(1.07 g, 1.11 mmol)을 THF (95 mL)에 넣어 완전히 용해시켰다. NBS (0.60 g, 3.34 mmol)을 portionwise로 넣고 호일로 플라스크를 감싸 빛을 차단시킨 후 상온에서 24 h 동안 교반시켰다. TLC monitoring을 통해 반응을 종결시키고, 증류수를 넣어 quenching시켜 주었다. Chloroform과 증류수로 추출하고, 수분을 제거하기 위해 MgSO4를 첨가하였다. 감압 증발로 용매를 제거하고, column chromatography (eluent: MC/n-hexane = 1/3)로 정제하여 yellow solid 성상의 화합물을 얻었다. (yield: 62.30%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.89-0.92 (m, 12H), 1.25-1.51 (m, 40H), 1.72-1.89 (m, 8H), 4.05-4.08 (t, 8H), 7.11- 7.13 (d, 2H), 7.25-7.43 (m, 4H), 7.58-7.71 (m, 4H), 7.81-7.92 (d, 2H).
2.2.8. 1,2-bis(4-hydroxyphenyl)ethane-1,2-dione (6)
250 mL 2구 플라스크에 4,4’-dimethoxybenzil (1.5 g, 5.5 mmol)을 질소분위기에서 넣고 acetic acid (15 mL)에 용해시켰다. HBr (60 mL, 48% aqueous)를 넣고 120 ℃에서 4 h 동안 환류시켰다. 상온으로 식혀 반응을 종료 시킨 후 증류수(200 mL)를 넣어 30 min 동안 교반시켰다. 반응물을 감압 여과 후 침전물을 증류수로 씻어주고, 진공에서 건조시켜 yellow powder 형태의 화합물을 얻었다. (yield: 83%) 1H NMR (250 MHz, acetone-d6): δ(ppm) 6.97-6.99 (t, 4H), 7.80- 7.82 (t, 4H), 9.60 (s, 1H).
2.2.9. 1,2-bis(4-(octyloxy)phenyl)ethane-1,2-dione (7)
질소 분위기에서 250 mL 2구 플라스크에 6번 화합물(2.31 g, 9.52 mmol)과 tetrabutylammonium bromide (1.52 g, 4.7 mmol)를 넣고 DMF (70 mL)에 완전히 용해시켰다. 1-bromooctane (3.63 mL, 20.94 mmol)을 넣고 반응온도를 120 ℃로 설정하여 2 h 동안 환류시켰다. 상온으로 식혀 반응을 종결시킨 뒤 brine과 ether로 추출하고, 마지막은 증류수로 씻어 주었다. MgSO4를 넣어 수분을 제거하고 용매를 감압 증발시켜 제거하여 column chromatography (eluent: ethyl acetate/n-hexane = 1/6)로 정제하였다. 생성물의 성상은 yellow powder였다. (yield: 85.28%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.87-0.92 (m, 6H), 1.27-1.53 (m, 20H), 1.68-1.85 (m, 4H), 3.99-4.07 (m, 4H), 6.91-6.98 (m, 4H), 7.89-7.96 (m, 4H).
2.2.10. 2-hexyldecylbromide (8)
100 mL 3구 플라스크에 질소 분위기에서 2-hexyl-1-decanol (4.1 mL, 14 mmol)과 carbon tetrabromide (6.04 g, 18.2 mmol) 을 넣고 MC (28 mL)에 완전히 용해 시켰다. 0 ℃로 냉각시킨 후, MC (7 mL)에 triphenylphosphine (5.14 g, 19.6 mmol)을 용해시켜 천천히 적가하였다. 적가 후 0 ℃에서 1 h 동안 교반시키고, 상온에서 1 h 동안 교반시켰다. 반응물을 ether (12 mL)와 n-hexane (48 mL)혼합 용액에 넣어 반응을 종결시키고, 1 h 동안 교반시켰다. Silica gel을 이용하여 감압 여과하고 n-hexane으로 씻어주어 모은 여과액을 감압 증발 시켜 yellow oil 형태의 화합물을 얻었다. (yield: 84.15%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.86-0.91 (t, 6H), 1.28 (s, 24H), 1.53-1.60 (t, 1H), 3.43-3.45 (d, 2H).
2.2.11. 10-(2-hexyldecyl)-3,7-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-10H-phenothiazine (M3)
발표된 문헌에서 제시한 방법으로[30] 2-hexyldecylbromide과 phenothiazine을 이용하여 합성하였다. 화합물은 dark yellow oil 형태를 나타냈다. (yield: 32%) 1H NMR (250 MHz, CDCl3): δ(ppm) 0.81-0.90 (m, 6H), 1.20-1.32 (t, 49H), 3.72-3.75 (d, 2H), 6.80-6.84 (d, 2H), 7.54-7.57 (t, 4H).
2.2.12. 3-(5-(6,7-bis(octyloxy)-2,3-diphenyl-8-(thiophen- 2-yl)quinoxalin-5-yl)thiophen-2-yl)-10-(2- hexyldecyl)-10H-phenothiazine (P1)
50 mL 2구 플라스크에 질소 분위기에서 M1 (0.61 g, 0.7 mmol)과 M3 (0.47 g, 0.7 mmol)를 넣고 30 min 동안 진공상태를 유지하였다. 다시 질소 분위기로 만들고, anhydrous toluene (25 mL)을 넣어 30 min 동안 교반시킨 후 Pd(PPh3)4 (0.016 g, 0.014 mmol)를 넣고 10 min 동안 교반시켰다. 2 M K2CO3 용액(25 mL)을 syringe를 이용하여 넣고, AliquatTM 336 (0.5 mL)를 적가 하였다. 플라스크를 마이크로웨이브 합성 반응기로 옮겨 90 ℃ 400 W의 조건으로 4 h 동안 환류시켰다. 반응이 종결되면 bromobenzene (0.5 mL)를 넣어 end-capping시킨 후 1 h 동안 교반시키고, 온도를 50 ℃로 낮춘 후 0.025 M HCl 용액을 넣어 냉각시켜 주었다. 반응용액을 methyl alcohol, acetone, chloroform의 순서로 Soxhlet 장치로 추출한 뒤 chloroform fraction을 모아 용매를 약간 제거하고, SPE tube (PL-THIOL MP)로 여과시켰다. 여과액을 모아 methyl alcohol 에 재침전 시킨 후, black solid 형태의 고분자를 얻었다(yield: 51.3%).
2.2.13. 3-(5-(6,7-bis(octyloxy)-2,3-bis(4-(octyloxy) phenyl)-8-(thiophen-2-yl)quinoxalin-5-yl) thiophen-2-yl)-10-(2-hexyldecyl)-10H-phenothiazine (P2)
M2 (0.67 g, 0.6 mmol)와 M3 (0.41 g, 0.6 mmol)를 사용하여 P1과 같은 방법으로 합성하였으며, dark red solid 형태의 고분자를 얻었다.(yield: 66.67%)
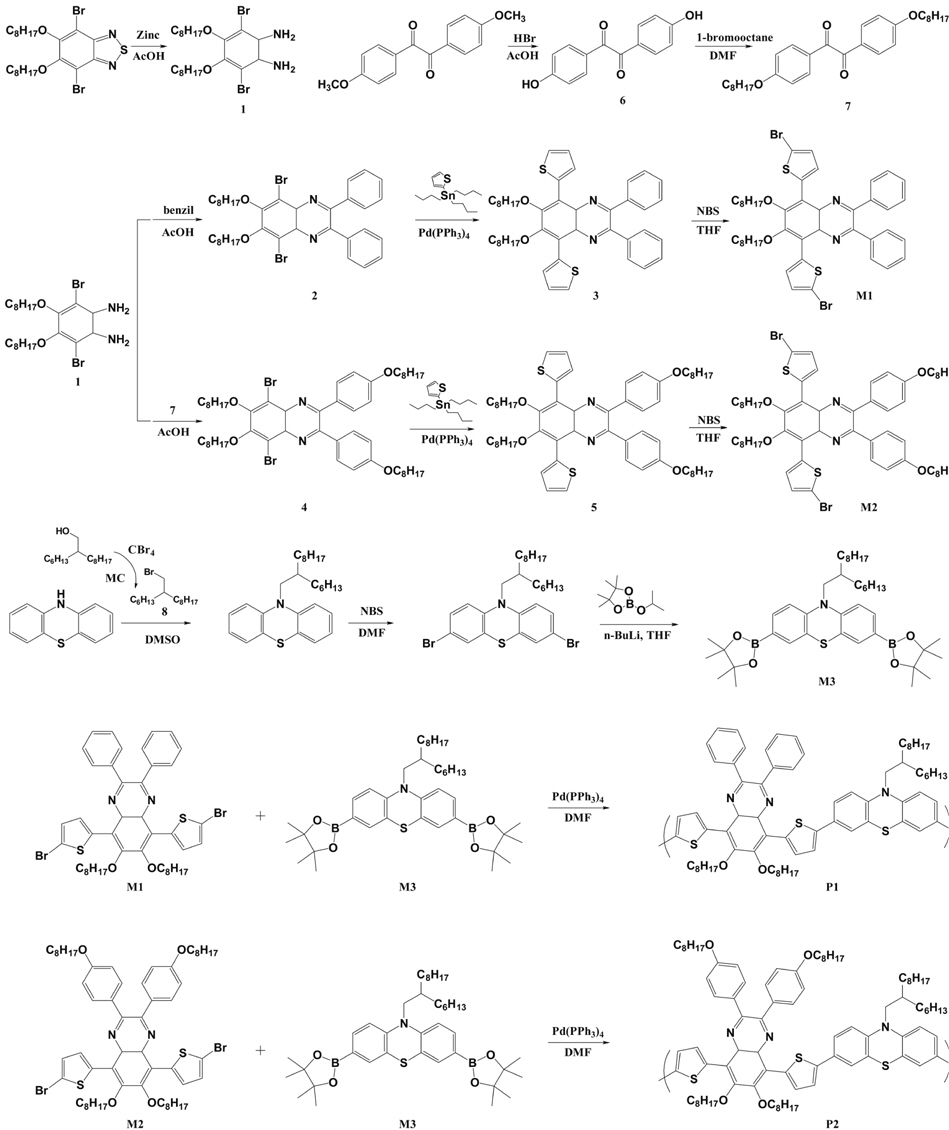
Quinoxaline과 phenothiazine의 합성 및 이를 기반으로 한 고분자의 합성경로는 Figure 1에 나타내었으며, 각 고분자의 이름은 PPQX-2hdPTZ (P1), POPQX-2hdPTZ (P2)으로 나타내었다. 합성된 중간 단량체의 구조와 순도는1H-NMR과 GC-MS로 확인하였다. 고분자는 palladium계 촉매 하에서 Suzuki coupling reaction으로 반응시켰으며, 마이크로웨이브 합성 반응기를 이용하여 중합시간을 단축시켰다. P1, P2 모두 고분자 골격에 치환된 긴 사슬로 인해 THF, chloroform,
[Table 1.] Molecular weights, PDI and Td of polymers
Molecular weights, PDI and Td of polymers
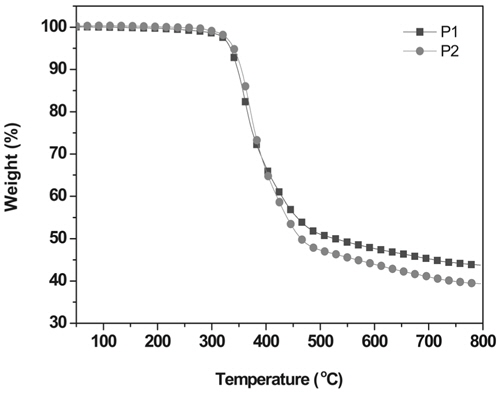
합성한 고분자의 열 안정성은 열분해온도를 측정하여 확인하였다. TGA를 이용하여 질소 분위기에서 10 ℃/min의 승온 속도로 측정 하였고 온도에 따른 질량 손실률을 Figure 2에 나타내었다. 그 결과 두 고분자 모두 300 ℃ 이상의 좋은 열 안정성을 나타내었다. 이는 제품으로 활용 시 고분자의 형태가 분해되는 것을 예방할 수 있으며, 성능이 오랫동안 유지 될 수 있어 유기박막태양전지로의 적용 가능성을 높여 준다[33].
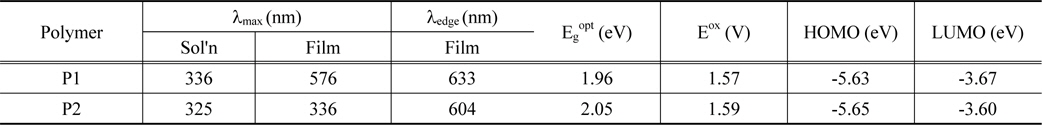
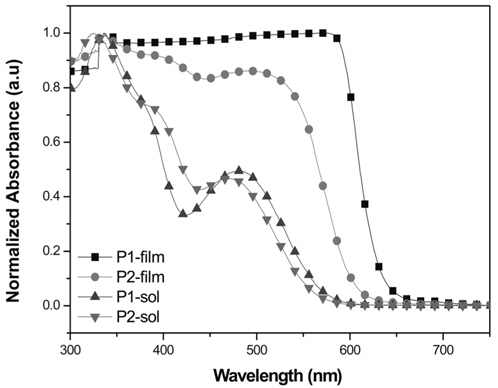
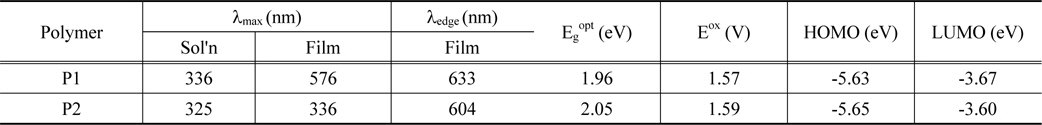
광학적 특성을 확인하기 위해 고분자를 chloroform에 녹인 용액 상태와 석영 판에 drop casting 하여 제작한 필름 상태에서의 UV-Vis 흡수 파장을 확인하였다. 측정된 값은 Table 2에 정리하였고, Figure 3에 스펙트럼으로 나타내었다. 두 고분자 모두 300-700 nm의 넓은 영역에서 흡수파장을 보였으며, 최대 흡수 파장(λmax)은 P1이 576 nm, P2가 336 nm로 측정되어 P1의 red shift가 크게 이루어진 것을 확인할 수 있었다. 두 고분자 모두 용액 상태보다 필름상태에서 red shift된 것을 확인할 수 있었다. 이는 용액 상태에서보다 고체 상태에서 고분자간 π-π stacking이 효과적으로 이루어 질 수 있기 때문에 π-stacked 형태를 형성하기가 유리하여 나타난 결과로 보인다[34]. 그리고 P2에 치환된 곁사슬로 인해 발생하는 입체장애로 고분자의 재배열이 잘 이루어지지 않아 P1이 P2보다 필름 상태에서 red shift가 잘 이루어진 것으로 사료된다[35]. 또한 300-400 nm와 450-650 nm에서 두 개의 피크가 관찰되었으며, 첫 번째 피크는 고분자의 긴 공액길이에 의한 π-π* transition 효과에 의한 것이고, 두 번째 피크는 고분자의 전자주개로 쓰인 phenothiazine과 전자받개로 사용된 quinoxailne의 강한 intramolecular charge transfer (ICT) 상호작용에 의해 나타난 것으로 판단된다[36-38]. 광학적 밴드 갭을 구하기 위해 λedge(P1 = 633 nm, P2 = 604 nm)를 이용하였으며 각각 1.96, 2.05 eV의 값을 나타내었다.
[Table 2.] Optical and electrochemical properties of polymers
Optical and electrochemical properties of polymers
Cyclic voltammetry (CV)를 이용하여 전기 화학적 특성을 측정하였고, cyclic voltammograms은 Figure 4에 나타내었다. 산화 onset 전위는 1.59, 1.58 eV으로 식을 이용하여 HOMO 에너지 레벨을 계산하였으며, 그 값은 각각 -5.63, -5.65 eV이었다(Table 2). P1이 P2보다 더 작은 HOMO 에너지 레벨을 가졌으며, 이러한 결과는 태양전지 특성에서 향상된 VOC 값을 기대할 수 있다. 또한 두 고분자 모두 air oxidation threshold (-5.2 eV)보다 낮은 산화 onset 전위를 가지고 있으므로, 공기 중에 산화되지 않을 것으로 판단된다[39,40]. LUMO 에너지 레벨은 환원 특성이 약해 전위가 측정되지 않아 광학적 밴드 갭과 HOMO 에너지 레벨과의 차이로 계산하였으며, 그 값은 -3.69, -3.59 eV이었다.
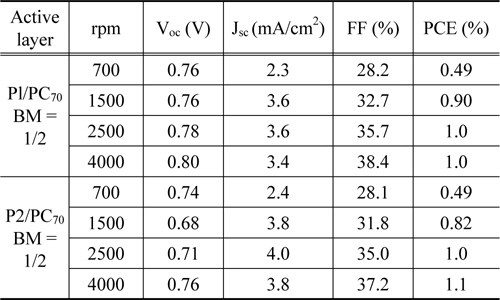
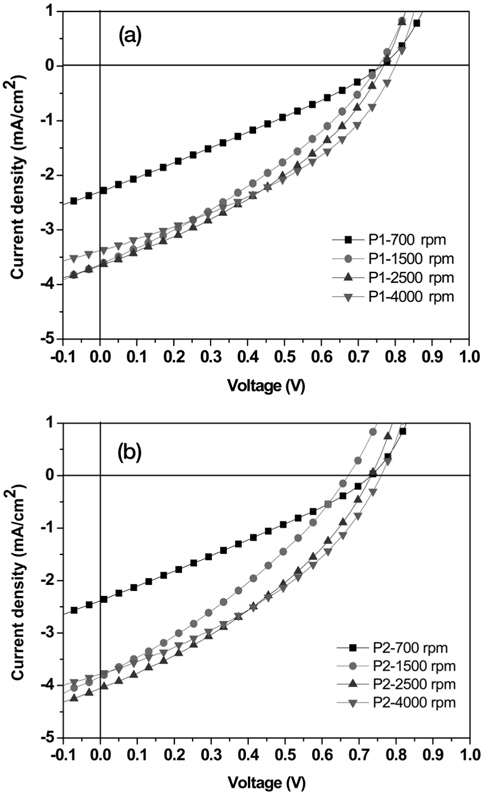
유기박막태양전지로의(organic photovoltaics, OPV) 적용 가능성을 알아보기 위해 ITO/PEDOT:PSS/active layer/BaF2/Al의 구조로 소자를 제작하여 특성을 분석하였다. 활성층은 합성한 고분자 P1과 P2를 ODCB에 녹여 PC70BM과 1 : 2의 질량비로 혼합한 후 스핀 코팅하여 제작하였다. 각 소자별로 스핀속도를 조절하여 박막 두께에 따른 특성을 solar simulator로 측정하여 Table 3에 값을 정리하였고, Figure 5에 J-V 그래프를 나타내었다. 스핀 속도는 700, 1,500, 2,500, 4,000 rpm으로 속도를 증가시킴에 따라 박막의 두께는 얇아진다. 측정 결과 두 고분자 모두 가장 얇은 박막 두께인 4,000 rpm으로 코팅한 소자에서 우수한 특성을 나타내었으며, 이때의 P1의 개방전압(VOC)은 0.80 V, 단락전류(JSC)는 3.4 mA/cm2, 충전율(FF)은 38.4%, 광전변환효율(PCE)은 1.0%로 측정되었고, P2는 VOC = 0.76 V, JSC = 3.8 mA/cm2, FF = 37.2% PCE = 1.1%로 측정되었다. 스핀 속도가 점차 증가함에 따라 두 고분자 모두 가장 좋은 특성을 나타낸 것으로 보아, 박막 두께가 얇을수록 엑시톤으로부터 분리된 정공과 전자가 양극으로의 이동이 원활한 것으로 판단된다[41]. VOC는 0.68-0.80 V의 값이 측정되었으며 두 고분자 모두 박막의 두께가 얇아짐에 따라 높아지는 경향을 보였다. VOC 값은 일반적으로 전자주개인 공액 고분자의 HOMO 에너지 레벨과 전자받개인 PCBM의 LUMO 에너지 레벨과 관계가 있으며, 고분자의 HOMO 에너지 레벨이 낮을수록 높은 VOC 값을 얻을 수 있다[42]. 이에 따라 낮은 HOMO 에너지 레벨을 갖는 P1 (-5.65 eV)이 P2 (-5.64 eV)보다 높은 VOC 값이 측정되었다. 낮은 밴드 갭을 갖는 고분자는 빛의 흡수량이 증가하여 JSC 값은 증가하지만, 산화 onset 전위의 감소로 HOMO 에너지 레벨이 증가함에 따라 VOC 값은 감소하는 경향을 보이는 것으로 알려져 있다[43]. 그러나 합성한 두 고분자의 밴드 갭 에너지는 P1 (1.96 eV)이 P2 (2.05 eV)보다 작은 값을 가짐에도 불구하고, 높은 VOC 값과 낮은 JSC 값을 나타내었다. 이는 CV 측정 시 환원 전위가 나타나지 않아 광학적 밴드 갭을 사용하여 나타난 결과로 사료된다. 또한 JSC 값은 박막의 코팅이 미세한 결로 집적 되어 많은 숫자의 carrier 재결합으로 인해 전류밀도가 낮아지는 것으로 알려져 있다.
[Table 3.] Summary of photovoltaic properties of polymers

Summary of photovoltaic properties of polymers
Rigid한 고분자의 경우 용해성을 향상시켜 분자량이 증가된 경우 박막상태에서의 결정성이 높아져 효율의 증가를 기대할 수 있다. 그러나 곁사슬을 추가로 치환한 P2의 경우 기대한 것과 달리 효율이 크게 향상하지 못 하였다. 이는 두 고분자 모두 골격에 충분한 곁사슬이 치환되어 있어 우수한 용해성을 가졌기 때문에 추가로 긴 사슬을 치환하는 것은 오히려 입체장애를 유발하여 PC70BM과 균일하게 혼합하지 못하므로 전자 이동도가 낮아진 것으로 판단된다. 최대외부양자효율(EQE)은 유기박막태양전지의 성능이 우수한 조건인 4,000 rpm에서 스핀 코팅한 소자를 측정하였으며 Figure 6에 나타내었다. P1은 380 nm에서 33.90%, P2는 400 nm에서 32.83%였고, 그래프는 UV-Vis 흡수 파장과 유사한 형태를 보였다.
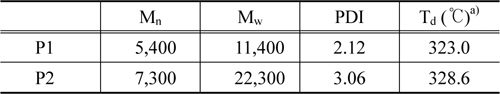
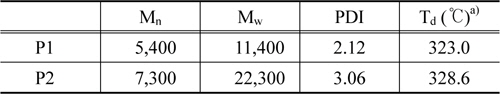
본 연구에서는 전자주개/전자받개의 반복되는 구조를 갖는 push-pull 구조의 공액 고분자 P1, P2를 Suzuki coupling reaction으로 마이크로웨이브 합성 반응기를 사용하여 합성하였다. 고분자의 수평균분자량(Mn)은 5,400, 7,300이고 중량평균분자량(Mw)은 11,400, 22,300으로 P2가 더 높게 측정되었다. 이는 P2의 골격에 치환된 octyloxy 사슬로 인해 용해성이 증가하여 반응과정에서 석출되지 않고 중합이 이루어져 중합도가 향상된 것으로 사료된다. 초기분해온도 Td는 각각 323.0, 328.6 ℃로 두 고분자 모두 열적으로 안정한 것으로 판단된다. UV-Vis 흡수 파장을 분석한 결과 두 고분자 모두 필름상태에서 red-shift된 것을 확인할 수 있었으며, 이는 고체상태에서 고분자간에 π-π stacking이 잘 이루어지기 때문에 π-stacked 형태를 이루기 쉽기 때문이다. 최대흡수파장(λmax)은 P1이 P2에 비해 200 nm 이상 red-shift된 것을 확인할 수 있었으며 이는 P2에 치환된 곁사슬로 인해 발생하는 입체장애의 영향인 것으로 보인다. 소자를 제작하여 유기박막태양전지로의 특성을 분석한 결과 두 고분자 모두 얇은 박막두께에서 가장 우수한 성능을 보였다. Rigid한 quinoxaline 유도체와 phenothiazine 유도체로 이루어진 공액 고분자의 골격에 치환된 곁사슬의 수가 많을수록 우수한 특성을 예상하였으나 차이는 크지 않았다. 이는 곁사슬이 치환될수록 고분자의 평면 특성이 감소하여 π-stacked 형태를 이루기가 힘들고, 입체장애 발생과 PCBM과의 혼합에 어려움을 주는 것으로 판단된다. 따라서 효율을 높이기 위해 여러 종류의 곁사슬을 도입하여 고분자의 밴드 갭을 조절하고, 작은 밴드 갭을 가지면서 넓은 영역의 빛을 흡수하여 JSC 값을 증가시키며, 또한 낮은 HOMO 에너지 레벨을 갖게 하여 큰 VOC 값을 갖는 고분자 설계에 대한 연구가 필요한 것으로 보인다.