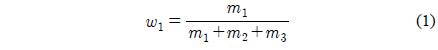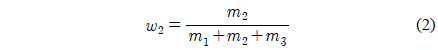Succinic acid is an important precursor in industries producing biopolymers, pharmaceutical and food additives and green solvents. However, due to the high price of petroleum and the global CO2 emission, the biological production of succinic acid from renewable biomass is a novel process due to the fixation of CO2 into succinate during fermentation. In this study, aqueous two phase systems based on imidazolium ionic liquids/K2HPO4 were used as an effective separation and concentration process for succinic acid. Experimental results show that aqueous two phase systems can be formed by adding appropriate amount of imidazolium ionic liquids to aqueous K2HPO4 solutions in the presence of succinic acid. It can be found that the ability of imidazolium ionic liquids for phase separation followed the order [HMIm][Br]≒[OMIm][Br]>[BMIm][Br]>[EMIm][Br]. The maximum value of extraction efficiency for succinic acid was about 90% and the amount of coextracted water into top phase is proportional to the chain length of cation in imidazolium ionic liquids. It was concluded that the aqueous two phase systems composed of imidazolium ionic liquids/K2HPO4 was effective for the selective extraction and concentration of succinic acid.
숙신산은 의약품, 식품 첨가물, 청정용매와 같은 종래의 응용이외에도 최근에는 생분해성 고분자의 중요한 전구 물질로 주목받고 있는 C4 디카르복실산이다. 숙신산의 잠재적인 시장규모는 화학적 플랫폼 기준 약 160만톤 규모로 알려져 있지만 향후 지속적인 성장이 기대되고 있다[1]. 지금까지 사용되고 있는 대부분의 숙신산은 n-부탄올을 원료로 한 석유화학 공정을 통해 합성되어 왔다. 그러나 석유화학 공정에 의한 숙신산 생산 공정은 높은 조업 온도와 압력에 따른 고비용과 그에 따른 환경오염이 문제점으로 지적되어 왔다[2]
숙신산의 화학적 생산이 갖는 문제점들을 해결함과 동시에 바이오플라스틱으로의 응용을 위해 1990년대 이후 발효에 의한 숙신산 생산에 대한 연구가 지속되어 왔다. 다른 생물분자 생산을 위한 발효공정과 비교했을 때 숙신산 발효는 이산화탄소 고정화에 장점이 있다. 즉, 숙신산을 생산하기위한 미생물 대사과정 중에서 이산화탄소를 소비하므로 발효 공정 자체가 탄소 중립적인 공정이 됨을 의미한다[3].
그러나 발효에 의한 숙신산 생산 공정이 여전히 상업화되지 못하고 있는 이유는 발효액내에 숙신산 외에 부산물로서 여러 유기산들이 생성될 뿐 아니라 발효액의 대부분을 차지하는 물을 제거하는데 많은 에너지가 요구되기 때문이다. 이에 따라 발효에 의한 숙신산 생산 비용 중 분리공정이 차지하는 비율은 50~60%에 이른다고 알려져 있다[4].
발효액에서 숙신산을 효과적으로 분리하기 위한 다양한 방법들이 제시되어 왔다. 숙신산을 포함한 카르복실산 회수를 위한 전형적인 방법은 재산화를 수반한 비용해성 칼슘염에 의한 선택적인 침전법[5], 이온교환막을 포함한 전기투석법[6], 에스테르화 반응을 이용한 반응증류법[7], 그리고 아민계 추출제를 이용한 반응추출법[8,9] 등이 있다.
최근 들어 청정용매로서 이온성 액체(ionic liquids, ILs)를 활용하기 위한 시도들이 이루어지고 있다. 이온성 액체는 양이온과 음이온 크기의 비대칭성에 의해 결정을 이루지 못하고 액체상으로 존재하는 전기적인 특징을 가진 물질을 말한다. 이온성 액체를 추출 용매로 활용함에 있어 장점은 이온성 액체를 구성하는 양이온과 음이온의 구조를 선택적으로 합성하여 추출 대상 물질과 시스템에 적합한 용매를 설계할 수 있다는 것이다. 또한 이온성 액체는 기존 추출용매에 비해 휘발성이 낮아 공정 증발에 의한 용매 손실이 없으며 열적 안정성이 우수하다. 또한 생물 적합성이 높아 생물공정으로의 응용 가능성이 큰 것으로 알려져 있다[10].
이온성 액체는 수상이성분계(aqueous two-phase systems, ATPS) 형성을 이용하여 숙신산 추출용매로 사용될 수 있다. 수상이성분계는 고분자/고분자, 고분자/염 또는 두 종류의 염으로 구성된 수용액이 적절한 농도와 온도에서 두 개의 상으로 분리됨에 따라 형성된다. 수상이성분계 추출은 이들 두 수용상 간의 낮은 계면장력으로 인해 pH조절이나 유기용매 사용에 따른 오염 없이 이온성 액체의 양이온과 음이온을 적절히 조합하여 대상물질에 대한 용해도 차이를 이용하여 분리시킬 수 있는 것으로 알려져 있다[11,12]. 과거 수상이성분계 형성을 위해 사용되던 고분자 물질은 회수 상의 어려움이 있어 수상이성분계에 이온성 액체를 사용할 경우 이온성 액체의 회수가 용이하므로 이와 같은 단점을 극복할 수 있다.
무기염 역시 수상이성분계 형성에 영향을 미치게 되는데 kosmotropic 이온을 갖고 있는 염들이 수상이성분계를 형성하며 chaotropic 이온들은 수상이성분계를 형성이 불가하다. 본 연구에서는 kosmotropic 이온 중 대표적인 HPO42−이온을 가진 K2HPO4를 수상이성분계 형성을 위한 무기염으로 사용하였다.
이온성 액체와 염으로 구성된 수상이성분계 추출공정은 분리 대상물질이 용해된 수용액에 염을 우선적으로 투입하고 여기에 수상이성분계를 형성할 정도의 이온성 액체를 투입하여 교반을 수행하고 이 후 상분리를 통해 이온성 액체가 대부분인 상부상에서 대상물질의 농축이 이루어진다. 이후 상부상은 분리 대상물질 및 이온성 액체 회수공정으로 보내지게 된다. 이때 사용되는 공정으로서는 역추출, 한외여과, 양이온 교환 크로마토그래피 등이 있다.
본 연구에서는 수용상에 용해되어 있는 숙신산을 분리하기 위해 이미다졸(imidazolium)계 이온성 액체와 K2HPO4로 구성된 수상이성분계를 이용하였다. 추출 공정으로의 적용을 위해 이미다졸계 이온성 액체 수용액의 점도와 밀도를 측정하였다. 양이온 사슬길이와 염의 농도에 따른 상평형 곡선의 특성 및 숙신산 추출 특성을 고찰하였다.
숙신산 수용액을 제조하기 위해 99% 순도를 가진 Sigma-aldrich사의 숙신산을 2차 증류수에 용해시켰다. 수상이성분계 형성에 따른 상평형 곡선을 구하기 위해 K2HPO4 (Sigma-Aldrich, 99.9%) 수용액과 다양한 양이온 사슬길이를 가지는 이미다졸계 이온성 액체를 조합하였다. 본 연구에서 사용된 이미다졸계 이온성 액체는 1-ethyl-3-methylimidazolium bromide ([EMIm][Br]), 1-butyl-3-methylimidazolium bromide ([BMIm][Br]), 1-hexyl-3-methylimidazolium bromide ([HMIm][Br]), 1-octyl-3-methylimidazolium([OMIm][Br])이며 (주)씨트리에서 구입하였다.
이온성 액체 수용액의 농도 및 온도에 따른 점도를 측정하기 위해 항온조가 부착된 디지털점도측정기(DV2T, Brookfield, USA)를 사용하였다. 밀도는 밀도계(DDM 2911, Rudolph Research Analytical, USA)를 사용하여 측정하였다
이미다졸계 ILs와 K2HPO4로 구성된 수상이성분계의 상태도를 얻기 위해 탁도 적정법(tubidity titration method)을 사용하였다. 탁도 적정법에 의한 상평형 측정은 본 연구진이 이전에 보고한 방법에 따라 이루어졌다[13]. 이미다졸계 ILs/염 수용액의 상분리가 일어나는 지점이 탁점이며 탁점에서의 이온성액체와 염의 농도는 아래 식을 사용하여 계산된다.
여기에서
수상이성분계를 이용한 수용액에서의 숙신산 추출과정은 다음과 같다. 우선 염이 포함된 10 mL의 모사수용액을 준비한 후 여기에 이온성 액체를 첨가한다. 이와 같이 준비된 수상혼합물을 약 30분간 강력히 교반한 후 상분리를 위해 10시간 이상 방치해 둔다.
추출 후 숙신산 농도는 액체 크로마토그래피(Waters 2487, UV 검출기)에 Supelcogel C-610H 칼럼(300 mm × 7.8 mm, Supelco)을 고정상으로, 0.1 wt%의 H3PO4수용액을 이동상으로 하여 측정하였다.
3.1. 이미다졸계 이온성 액체 농도 변화에 따른 밀도와 점도 측정
이온성 액체에 의한 수상이성분계에서 조성 및 온도에 따른 점도와 밀도는 추출공정의 설계에 있어 필수적이다 본 연구에서는 288 K에서 308 K 사이에서 이미다졸계 이온성 액체의 양이온의 사슬 길이별로 이들 값을 측정하였다.
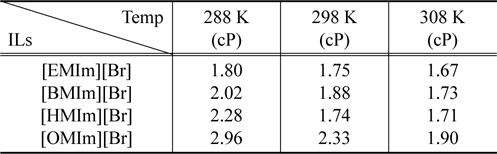
Table 1은 25 wt%의 이미다졸계 이온성 액체가 존재하는 수용상에서 양이온 종류 및 온도에 따른 이미다졸계 수용액의 점도를 보여주고 있다. 이온성 액체 rich상에서 점도는 알킬 사슬 길이에 따라 증가하며 온도에 따라서 감소하는 것으로 나타났다. 종래의 고분자/고분자 시스템에 의한 수상이성 분계에 있어 문제점 중의 하나는 고분자-rich 상의 높은 점도이다. 전형적인 폴리에틸렌글리콜(polyethylene glycol, PEG) rich 상의 경우 PEG의 조성에 따라 점도가 달라지기는 하나 대게 수십 cP에 달하는 반면 본 연구에서 적용된 이미다졸계 이온성 액체 rich상의 경우 점도가 대략 2 cP의 범위를 갖고 있으므로 이는 수상이성분계를 구성하는 상부상과 하부상 사이에서 용질의 물질전달에 장점이 될 수 있다.
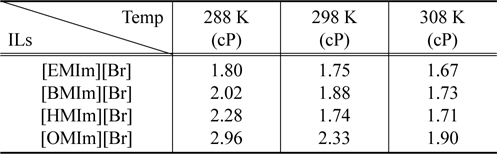
Experimental viscosity as a function of temperature and cation chain length for the IL-rich phase
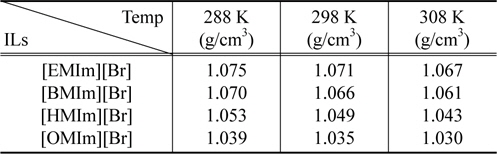
Table 2는 온도에 따른 이온성 액체 rich상의 밀도를 나타내고 있다. 밀도 역시 이온성 액체 내 양이온 사슬길이 및 온도에 따라 감소하고 있음을 알 수 있으나 그 변화폭은 크지 않은 것으로 나타났다.
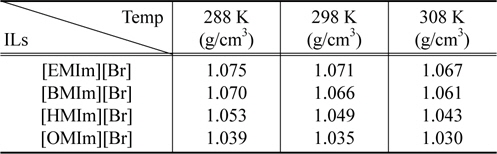
Experimental density as a function of temperature and cation chain length for the IL-rich phase
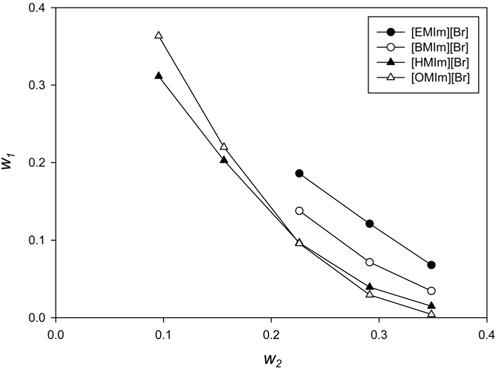
수상이성분계에서 상부상과 하부상 간의 상평형도는 두 상간의 숙신산 분배를 예측하기 위한 모델 수립을 위해 필요하다. Figure 1에서는 이미다졸계 이온성 액체와 염으로 구성된 수용액 상에서 형성된 바이노달 곡선(binodal curve)을 나타내고 있다. 숙신산의 존재 하에서 수상이성분계 형성을 위한 이미다졸계 이온성 액체의 성능은 [EMIm][Br] < [BMIm][Br] < [HMIm][Br] ≒ [OMIm][Br]의 경향을 보이고 있으며 이는 양이온 사슬길이에 따른 소수성 세기와 대략적으로 일치한다. PEG/염과 같은 고분자/염으로 구성된 수상이성분계의 경우 PEG의 분자량이 커질수록 바이노달 곡선이 원점에 가까워지는데 이는 분자량 증가에 따른 PEG의 소수성 증가에 따라 이성분 형성 성분간의 친화도가 낮아지기 때문이다. 그러나 본 연구에서와 같이 이온성 액체를 사용하는 경우에는 이온성 액체에서의 양이온 사슬길이 증가에 따른 이성분계 형성 능력이 정확히 일치하지 않으며 탄소수 6인 양이온을 가진 이온성 액체에서 최대 상분리 특성을 나타내었다. 이미다졸계 이온성 액체에 의한 수상이성분계에 대한 타 연구에서도 유사한 결과가 보고된 바 있다[13,14].
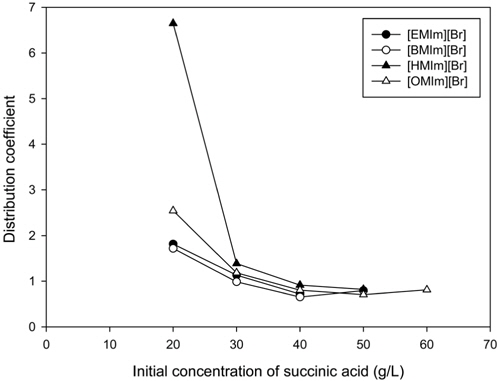
Figure 2는 숙신산의 초기 농도와 이온성 액체를 구성하는 양이온의 사슬길이에 따른 숙신산에 대한 분배계수를 보여주고 있다. 이미다졸계 이온성 액체를 구성하는 양이온의 사슬길이가 길어질수록 수상이성분계를 쉽게 형성할 뿐 아니라 분배계수 역시 증가함을 알 수 있다. 그림에서 보듯이 숙신산에 대한 이온성 액체의 분배계수는 [HMIm][Br] > [OMIm][Br] > [BMIm][Br] ≒ [EMIm][Br]의 순서를 나타낸다. 이미다졸계 이온성 액체에서 양이온 사슬길이의 증가는 숙신산에 대한 분배계수의 증가를 가져오다가 [HMIm][Br]에서 최대 값을 갖게 되고 이후는 감소하게 만드는 것으로 나타났다.
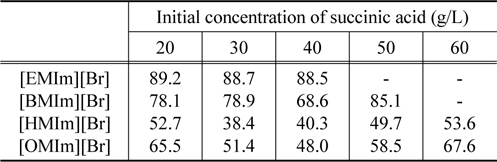
Table 3은 이미다졸계 이온성 액체의 양이온 사슬길이의 변화와 초기 숙신산의 농도에 따른 추출 효율의 변화를 보여주고 있다. 상부상으로의 추출 효율은 [EMIm][Br]이 가장 큰 것으로 나타났으며 [HMIm][Br]이 가장 낮은 것으로 나타났다. 그러나 추출 전후로 수용상과 용매상의 부피 변화가 없는 기존 용매추출에서의 추출효율과 본 연구와 같이 상부상과 하부상의 부피비가 이온성 액체의 물성 및 염의 농도에 따라 변화하는 이온성 액체/염으로 구성된 수상이성분계에서의 추출효율을 단순비교할 수는 없다. 즉, 이온성 액체와 염으로 이루어진 수상이성분계에서는 추출 성능을 평가함에 있어 상부상으로 전달되는 숙신산과 더불어 동반 추출되는 물의 부피를 반드시 고려해야 한다.
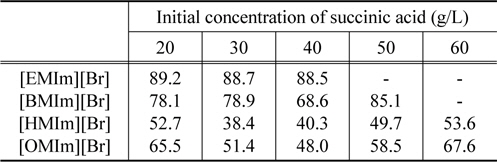
Extraction efficiencies for succinic acid in imidazolium cation based ionic liquids/K2HPO4 as a function of succinic acid concentration
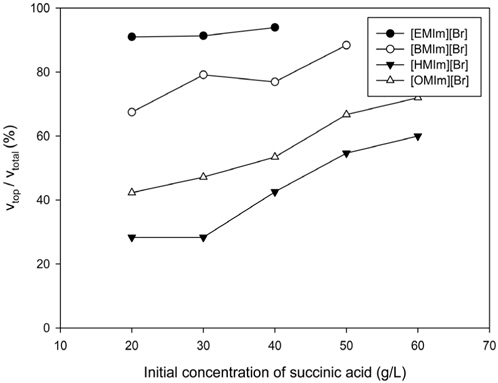
Figure 3은 추출 후 수상이성분계를 구성하는 전체 수용상의 부피에 대한 상부상의 부피비를 보여주고 있다. 이미다졸계 이온성 액체에서 양이온의 사슬길이가 길어질수록, 수용상에 존재하는 숙신산의 농도가 낮을수록 상부층으로 이동하는 물의 부피가 줄어드는 것으로 나타났다. 발효액으로부터 숙신산의 분리에 있어 발효액 내에 포함된 다량의 물을 제거하는 과정에서 상당량의 에너지가 요구된다는 점을 고려할 때 긴사슬 양이온을 가진 이미다졸계 이온성액체와 염으로 구성된 수상이성분계를 숙신산에 적용할 경우 1차 분리 단계에서 발효액 내에 포함된 숙신산의 농축이 가능함을 알 수 있다.
본 연구에서는 다양한 길이를 가진 알킬 사슬 양이온을 포함한 이미다졸계 이온성 액체와 K2HPO4으로 구성된 수상이성분계를 이용하여 수용액으로부터 숙신산을 추출하였다. 이미다졸계 이온성 액체에서 양이온의 사슬길이가 길어질수록 수상이성분계 형성에는 유리한 것으로 나타났다. 이온성 액체 rich상으로의 숙신산의 분배 역시 긴사슬 양이온을 가진 이미다졸계 이온성 액체가 높은 것으로 나타났다. 이는 이온성 액체 내의 양이온 사슬길이에 따른 자유부피와 표면장력 변화에 따른 숙신산의 용해도 증가 외에도 상부상으로 동반 추출되는 물의 양이 감소한 결과로 해석될 수 있다. 발효액으로부터 숙신산을 추출할 경우 물의 제거에 따른 에너지 비용이 과다함을 고려할 때 본 연구에서 사용된 이미다졸계 이온성 액체/K2HPO4 수상이성분계는 숙신산을 선택적으로 분리함과 동시에 숙신산을 농축하는데 효과적임을 알 수 있었다. 그러나 이온성 액체의 높은 가격은 여전히 단점이므로 보다 경제적인 합성 방법이 개발되거나 이온성 액체의 회수를 경제적으로 수행할 수 있는 공정 개발이 필요하다고 하겠다.