There is an increasing interest in the development of rechargeable batteries suitable for use in both hybrid electric vehicles and energy storage systems that require higher charge & discharge rates, bigger battery sizes and increased safety of the batteries. Spinel-type lithium titanium oxide (Li4Ti5O12) as a potential anode for lithium ion batteries has many advantages. It is a zero-strain materials and it experiences no structural change during the charge/discharge precess. Thus, it has long cycle life due to its structural integrity. It also offers a stable operation voltage of approximately 1.55 V versus Li+/Li, above the reduction potential of most organic electrolyte. In this study, Ru added Li4Ti5O12 composites were synthesized by solid state process. The characteristics of active material were investigated with TGA-DTA, XRD, SEM and charge/discharge test. The capacity was reduced when Ru was added, however, the polarization decreased. The capacity rate of Li4Ti5O12 with Ru (3%, 4%) addition was reduced during the charge/discharge precess with 10 C-rate as a high current density.
현재 우리 세계는 에너지자원의 고갈과 환경오염이 대두되고 있고, 이를 대처하는 하나의 방안으로 이차전지가 대두되고 있다. 리튬이온이차전지는 높은 에너지와 출력 밀도를 갖고 있고, 무게 및 부피당 밀도가 크기 때문에 전망적이다. 이차전지는 노트북, 휴대폰 등과 같은 소형기기에 많이 적용되고 있지만, 최근에는 하이브리드 자동차(hybrid electric vehicle, HEV)와 전력 저장 시스템(energy storage system, ESS)에 대한 이차전지의 적용에 큰 관심을 갖고 있다[1-5].
현재 리튬이차전지에 사용되는 음극소재로는 탄소계 물질이 널리 사용되고 있다. 탄소계 음극 활물질은 높은 용량을 갖는 장점이 있으며, 산화·환원 전위가 낮기 때문에 탄소계를 음극으로 사용하면 높은 전위를 갖는다. 그러나 대형화 하였을 때 안정성에 문제가 있을 수 있기 때문에 EV와 HEV같은 큰 규모의 적용에서 안전성, 긴 수명특성, 좋은 사이클 특성을 갖고 있는 Li4Ti5O12는 각광받고 있다[6].
카본계 음극은 리튬의 삽입·탈리 시 부피변화가 약 10%인데 반하여, Li4Ti5O12는 리튬의 삽입·탈리 시 격자의 부피변화가 1% 정도로 거의 변화가 없는 “zero-strain”물질로 알려져 있으며, 수명특성이 더 우수하다. 카본계 음극을 사용하였을 때, 유기 전해질의 경우 분해되는 전위가 0.8 V 정도로 낮기 때문에 첫 번째 충·방전 시 낮은 전위에서 전해질과 음극 사이에서의 반응으로 인한 SEI (solid electrolyte interface)가 형성되고 이는 비가역반응이기 때문에 전지의 효율을 감소시키므로 상대적으로 더 가격이 비싼 양극활물질의 리튬용량을 감소시킨다. 하지만 Li4Ti5O12의 경우에는 산화환원전위가 약 1.55 V로 높기 때문에 SEI를 형성하지 않기 때문에 효율적이다[7,8].
Li4Ti5O12는 긴 수명특성, 높은 출력특성 등을 갖고 있지만 가장 큰 단점은 산화물 특성상 전기전도성이 10−9 Scm−1로 낮기 때문에 초기 용량의 손실과 율특성이 좋지 않다는 것이다. 이를 극복하기 위해 많이 사용되는 방법으로는 첨가물(Mg, Cr, Fe, Ni, V, Mn, Ag)을 이용한 도핑, 입자 크기의 조절, 흑연을 이용한 코팅 등의 방법이 있다. 여러 금속첨가물을 이용하여 4가의 Ti의 자리를 3가나 2가의 원소로 치환하여 전자가 잘 이동할 수 있게 하여 전기전도성을 향상 시킬 수 있다. 또한, 입자의 크기나 모양에 따라서도 이차전지의 특성은 달라진다. 입자가 작을 수 록 표면적이 증가하기 때문에 전해질과 접촉하는 면적이 늘어나 리튬의 분산거리를 줄일 수 있고, 크기도 작기 때문에 리튬의 이동속도를 빠르게 할 수 있다[9-15].
본 연구에서는 위에서 언급한 수명특성, 출력특성, 평탄한 전위구간을 갖는 음극물질인 Li4Ti5O12를 고상법을 이용하여 합성하고자 한다. Li4Ti5O12의 가장 큰 문제점인 낮은 전기전도성을 향상 시켜보고자 일부를 금속 원소로 치환하는 방법을 선택하였으며, 선택한 금속 원소인 Ru을 Ti에 대하여 mol%로 1-5%까지 첨가하여 합성하였다. 만들어진 활물질을 반쪽 전지로 만들어서 테스트하였으며, 전기전도성이 향상되었는지를 알아보기 위해서 C-rate를 변화시키면서 충−방전 실험을 실시하였다.
Ru를 첨가한 Li4Ti5O12를 합성하기 위한 원료물질 Lithium carbonate (Li2CO3 ; 99%), Titanium(IV) oxide (TiO2 ; 99%, anatase)을 사용하였고 첨가한 물질의 원료물질로는 Ru(III) acetylacetonate (C15H21O6Ru)를 사용하였으며, 고상법을 통해 합성을 진행하였다. 원료물질인 Lithium carbonate와 Titanium oxide를 혼합하고 Ru acetylacetonate는 Ti대비 1, 2, 3, 4, 5 mol%를 첨가하여 혼합하고 분쇄하기 위해서 에탄올을 용매로 사용하여 볼밀에 넣은 후 볼 : 분말의 비는 6:1로 하여 300 rpm으로 10시간 동안 분쇄하였다. 볼밀링을 마친 시료는 유발기로 옮겨 담아 에탄올이 증발하여 마를 때까지 유발기를 사용하여 혼합하였다. 그 후에 강제순환식 오븐에서 80 ℃에서 약 24시간 건조하여 에탄올을 증발시켰다. 그 후에 박스형 오븐에서 TGA분석 방법을 통해서 적합하다고 생각되는 850 ℃로 8시간 공기분위기에서 열처리하였다. 열처리 중에 리튬이 휘발되는 것을 막기 위해 리튬을 화학양론비보다 소량 더 첨가하였다. 그 후에 유발기를 통해 분쇄하고 200메쉬 체를 통해 최종 활물질을 얻었다.
TA Instruments SDT-2960으로 공기분위기에서 110 mL/min의 기체흐름 속도와 5 ℃/min의 승온 속도로 TGA 분석을 하였고, 결정성 분석을 위해 X선 회설 분석(X-ray diffraction, D8 Discover with GADDS, Bruker)을 실시하였다. 주사범위는 2θ = 10~80°의 범위에서 CuKα1을 사용하여 분석을 실시하였으며 가속 전압은 40 kV, 전류는 40 mA에서 실시하였다. 입자 크기와 표면 상태를 관찰하기 위하여 주사전자현미경(scanning electron microscopy, LEO 1530FE, Carl Zeiss)분석을 실시하였다.
얻어진 최종 활물질을 전극으로 제조하기 위해서 슬러리로 만들어서 Cu 집전체에 닥터블레이드를 이용하여 일정한 두께로 도포하였다. 슬러리의 비율은 활물질 : 도전제(acetylene black) : 결합제(polyvinylidene fluoride 8%)가 무게비로 87 : 8 : 5의 비율로 맞추었다. 캐스팅 된 전극은 80 ℃의 강제순환식 오븐에서 3시간 동안 건조시킨 후 압연기를 이용해서 전극을 30%의 두께 감소로 압착하였다. 압착된 전극은 100 ℃의 진공오븐에서 24시간 건조하여 수분을 제거한 후 펀칭기를 이용해서 지름 16 mm으로 뚫어서 음극을 제조하였다. 만들어진 음극의 특성을 평가하기 상대극으로 Li 금속을 사용한 반쪽 전지를 제조하였다. 분리막으로는 PP (poly-propylene, Cellguard 2500)을 사용하였으며, 전해질은 1M의 LiPF6가 용해된 EC : EMC : DMC (1:1:1 v/v)을 사용하였다.
제작된 전지의 전기화학적 특성을 평가하기 위해 충·방전 실험은 Maccor사의 Series 4000 (Korea Thermo-tech Co., LTD) 기기를 사용하여 합성된 시료 전극의 사이클 특성과 충·방전 곡선을 보았다.
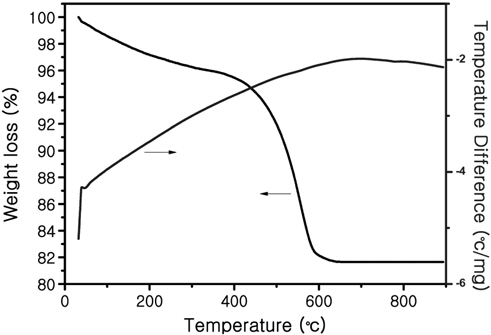
고상법을 이용해 합성된 Li4Ti5O12 전극을 열처리하기 전에 수분, 에탄올등의 불순물이 제거되는 양과 온도를 알고, 어느 온도가 열처리 구간으로 적당한지 판단하기 위해서 TGA-DTA 분석을 실시하였고 그 결과는 Figure 1에 나타내었다. 분석 결과를 보면 처음부터 무게 감소가 발생하는데, Wang et al. [16]에 의하면 낮은 온도에서 발생한 무게감소는 수분과 알콜이 증발하는 것과 관련된 것이다. 그 후 약 650 ℃ 이후부터는 시료들의 무게감소가 거의 나타나지 않아 불순물들이 다 사라졌고 합성이 마쳤을 것임을 예측할 수 있었다.
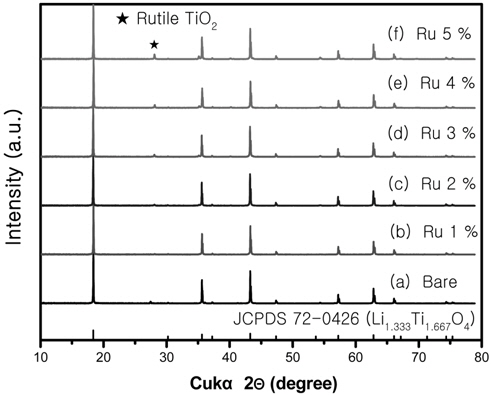
합성에 따른 시료의 구조적인 변화를 관찰하기 위해서 XRD를 실시하였다. Figure 2에는 Ru를 첨가한 Li4Ti5O12의 XRD 결과를 나타내었다. Yuan et al.[1]에 따르면 Li2CO3를 전구체로 사용한 Li4Ti5O12의 제조는 보통 800 ℃ 이상에서 제조하였고 본 실험에서도 850 ℃로 제조하였으며, 850 ℃의 열처리 과정에서 Li의 휘발성으로 인하여 Li+의 결핍이 예상되므로 0.1 mol만큼 더 첨가하였다. 이 시료가 스피넬구조의 Li4Ti5O12를 갖는지 구별하기 위해서 하단에 JCPDS 72-0426을 나타내었고 모든 시료의 주 피크는 JCPDS 72-0426와 거의 일치하였다. 그렇기 때문에 스피넬구조의 Li4Ti5O12를 형성하였다고 볼 수 있다. Ru을 Ti대비 1%~5%까지 첨가하였는데 Ru의 첨가량이 변해도 XRD의 결과로부터 스피넬구조의 Li4Ti5O12이 합성되었다고 생각한다. 하지만 합성과정에서 전구체로 사용된 아나타제 TiO2가 전부 LiOH와 반응하지 않아서 27°에서 아나타제상의 TiO2가 변한 루타일상의 TiO2가 검출되었다. Li4Ti5O12에 금속을 도핑하면 격자상수가 약간 증가하며 이에 따라서 전기적인 특성이 변화한다는 보고가 있다[11].
합성된 시료를 일정한 온도에서 열처리 한 뒤 분쇄와 체거름 과정을 거쳐서 제조된 각 시료의 입자 표면을 관찰하기 위해서 SEM 이미지를 살펴보았다. Ru가 첨가된 Li4Ti5O12의 SEM 이미지를 Figure 3에 나타내었다.
각각의 이미지는 입자들이 고르게 분산이 되었는지, 입자들의 크기는 비슷한지 확인하기 위해서 2만 배율의 이미지를 보았고, 입자의 모양과 크기를 확인하기 위해서 더 확대하여 5만 배율의 이미지를 관찰하였다.
모든 시료는 Li4Ti5O12 특유의 입자 모양인 각진 형태를 갖고 있었으며, 입자의 크기는 대략 0.3 µm~0.5 µm 정도로 관찰되었다. 모든 시료는 비교적 균일한 입자가 고르게 분포되었음을 확인할 수 있었으며 5만 배율의 이미지에서 보듯이 각각의 입자가 약간씩은 응집된 것을 확인할 수 있었다. Jiang et al.[12]에서는 입자가 많이 뭉쳐있으면 높은 C-rate에서는 겉부분의 Li+만 움직이기 때문에 좋지 않은 특성이 있다고 하였다.
Figure 3에서 보는 것과 같이 Ru의 첨가량이 1%~5%까지 증가할수록 1차 입자들이 더욱 응집되는 것으로 볼 때 Ru이 입자들의 응집에 대해서 어느 정도 관여하는 것으로 보이며 입자들의 크기도 Ru의 첨가량에 따라서 커지는 것을 통해 입자의 크기에도 영향을 미친다고 볼 수 있다.
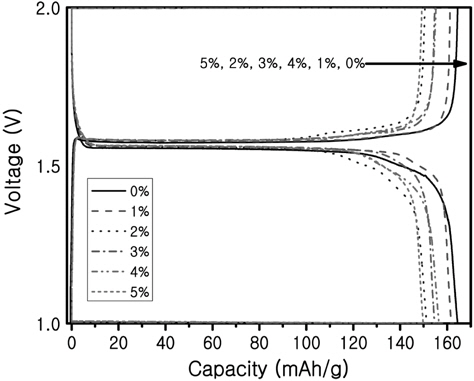
Figure 4에 Ru을 0%에서 5%까지 첨가한 Li4Ti5O12의 첫 번째 충·방전 테스트 결과를 나타내었다. 2.0 V에서 1.0 V 사이에서 충·방전 테스트를 실시하였다. 모든 시료가 약 1.5 V이상에서 평탄전위구간을 형성하였다. 초기 첫 번째 충·방전에서 Ru이 첨가되지 않은 시료가 가장 높은 용량을 보였으며 약 165 mAh/g의 용량을 나타내었고, 5%를 첨가하였을 때 초기 용량이 약 150 mAh/g으로 제일 크게 감소하는 것으로 나타났다. Ru을 첨가하면서 그 화학양론비에 맞추어 Ti의 첨가량을 감소시켰는데 Ru가 Ti의 자리에 정확하게 치환되지 않으면 스피넬 구조의 Li4Ti5O12가 형성되지 않아 용량이 감소할 가능성이 있다.
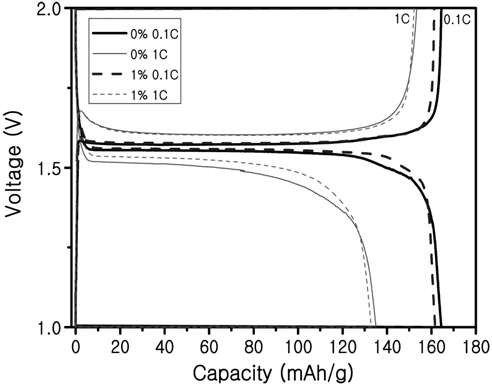
Figure 5는 Ru가 첨가된 시료와 첨가되지 않은 시료의 충·방전 곡선을 비교한 그림이다. 사이클 곡선을 살펴보면 평탄 전위구간에서 Ru이 첨가된 시료가 첨가되지 않은 시료보다 과전압이 적은 것을 볼 수 있는데, 0.1 C에서는 전류밀도가 낮기 때문에 Ru이 첨가된 것과 첨가되지 않은 것과 차이가 거의 없지만 1 C에서는 전류밀도가 높기 때문에 과전압이 더 발생해서 확연하게 차이점을 볼 수 있다.
과전압이란 분극현상 때문에 발생하는 것으로 전극전위 값이 평형상태에서 과하거나 부족하게 되는 현상이다. 전지에서 반응이 진행될 때 전하 이동과정이 모든 곳에서 같은 속도로 일어나지 않으므로 특정 과정에서 전하 이동과정이 늦어지면서 충·방전 시 전압이 상승하거나 하강하게 된다. 그렇기 때문에 전기전도도가 낮은 경우에는 더 많은 과전압이 발생할 수 있다. Ru이 1%첨가된 시료가 첨가되지 않은 시료보다 과전압이 적기 때문에 전도도가 향상되었다고 추측할 수 있다.
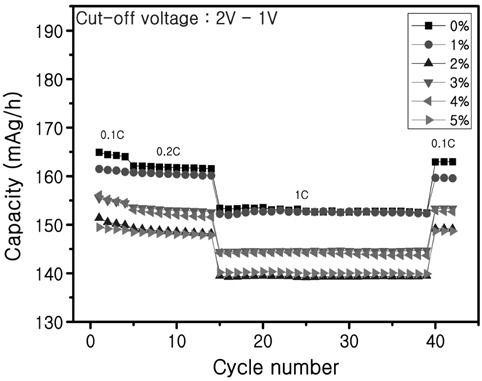
Figure 6은 Ru의 첨가량을 Ti대비 0 mol%, 1 mol%, 2 mol%, 3 mol%, 4 mol%, 5 mol%로 한 후에 사이클 특성을 나타내었다. 4번째 사이클까지 0.1 C로 충·방전한 후에 0.2 C, 1 C 그리고 다시 0.1 C로 C-rate를 변화시켰다. 0.1 C에서 1 C까지 변화시킨 이유는 C-rate가 높아지면서 용량의 감소폭을 확인하여 전기전도도가 증가했는지 확인하기 위해서이다. 그리고 1 C 이후에 다시 0.1 C까지 낮춘 이유는 높은 C-rate에서 전지를 충·방전시킨 후에 다시 낮은 C-rate로 바꾸었을 때 전극이 손상되지 않고 용량이 처음용량과 비슷하게 나오는지를 확인하기 위해서이다. 거의 모든 시료에서 98 이상의 용량이 회복되어서 높은 C-rate에서도 전극이 손상되지 않았다고 생각한다. Figure 6에서 나타난 것처럼 Ru이 첨가되지 않았을 때 용량이 Ru이 첨가된 것보다 높고 Ru이 더 많이 첨가될수록 용량은 감소하고 있다. Li4Ti5O12에서 Ti4+는 16d의 팔면체 자리를 차지하고 있다. Ru를 소량 첨가하면 Ti의 자리에 치환되어 들어간다. Ru가 치환될 경우에 전기전도도가 향상된다는 것이 문헌에 보고되어 있다[14].
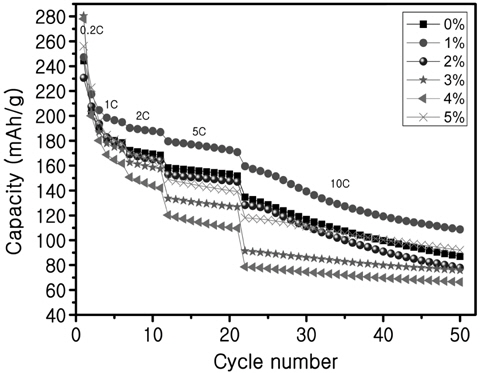
하지만 Ru의 첨가량이 증가하면 일부의 Ru이 Ti의 자리에 치환되지 못하였을 가능성이 있다. 그러나 Figure 5에서처럼 Ru이 첨가되었을 때 과전압이 감소하는 모습은 전도도가 향상된 모습을 보여준다. 그래서 더 높은 C-rate로 충·방전을 실시하면 더 명확하게 향상되었는지 아닌지를 알 수 있을 것이라고 생각하여 0.01 V까지 방전하여 10 C까지 C-rate를 변화시킨 테스트를 실시하였고 그 결과를 Figure 7에 나타내었다.
컷오프 전압을 1.0 V까지 한 경우 용량은 약 160 mAh/g 전후를 나타내었지만, 컷오프전압을 0.01 V까지 한 경우 용량은 이론용량을 뛰어넘는 약 260 mAh/g의 용량을 나타내었다. 0.01 V까지 방전할 때 용량 상승이 나타나는 큰 이유로는 컷오프전압을 0.01 V까지 할 때는 약 1.5 V에서 평탄구간을 제외하고 약 0.6 V에서 또 하나의 평탄구간이 발생하기 때문이다. Lu et al.[17]은 약 1.5 V의 평탄구간은 Ti4+/Ti3+의 산화/환원반응 때문이고, 약 0.6 V 이하에서의 평탄구간은 Ti4+가 갖는 또 다른 산화/환원반응이라고 하였다. 또 다른 산화/환원반응이란 낮은 전압에서 유사 암염구조를 형성하기 때문이라고 하였다.
Yao et al.[18]과 Ge et al.[19]은 도전재로 사용된 AB (acetylene black)가 Li4Ti5O12입자를 둘러쌓고 있으면서 약 0.6 V에서 Li이온을 받아들여서 Li4Ti5O12입자로 Li을 이동해주는 연결통로 역할을 해주기 때문에 Li이온이 더욱 원활하게 삽입되어서 용량이 증가한다고 하였다. 그리고 AB 또한 리튬을 저장할 수 있기 때문에 약 0.5 V 이하에서 방전곡선의 길이가 길어지면서 용량증가를 가져온다고 하였다. 그래서 0.01 V까지 방전한 경우는 Li4Ti5O12 스피넬 구조의 고유의 평탄구간인 1.5 V 구간, 1.5 V-0.6 V 구간 그리고 AB에 의한 0.6 V 구간, 0.6 V-0.01 V의 구간으로 나눠질 수 있다.
초기용량은 Ru이 첨가되지 않거나 약간 첨가된 것이 높았고 10 C 이후에도 여전히 용량은 높았지만 급격하게 사이클 특성이 감소하였다. 반면에 Ru 첨가량이 3%, 4%로 많이 첨가된 시료는 10 C에서도 사이클 특성이 사이클이 지남에 따라서 거의 변하지 않고 일정하게 유지되었다. 높은 C-rate에서 용량이 일정하게 유지된다는 것은 높은 전류밀도에서도 전자나 이온이 빠르게 이동한다고 생각할 수 있기 때문에 전기전도도가 Ru의 첨가로 인해서 향상되었다고 생각한다.
본 연구에서는 Li의 삽입 및 탈리 시에 격자의 부피변화가 매우 적기 때문에 수명 특성과 안정성이 매우 뛰어난 장점을 갖는 Li4Ti5O12의 단점인 낮은 전기전도도를 향상시켜보고자 연구하였다. Ru와 같은 3가의 전이금속을 Ti대신에 소량 첨가하여 합성해서 전기전도성을 향상시키려 하였고 그 결과를 충·방전 테스트를 통해 알아보았다. 여러 분석방법과 전기 화학적 테스트를 통해서 얻어진 결론은 다음과 같다.
XRD를 통하여 스피넬구조의 Li4Ti5O12가 합성되었음을 확인하였고 SEM을 통하여서 입자가 고르게 분산되어있는 것과 약간은 뭉쳐진 부분이 있는 것을 확인하였다. Ru을 첨가하였을 때 그렇지 않은 시료보다 약간씩 용량이 감소하는 모습을 보였지만, Ru을 첨가하였을 때 과전압이 감소하는 것을 확인하였다. 또한 10 C-rate로 전지의 충·방전 테스트를 실시하였을 때 Ru이 3%, 4% 첨가된 시료의 용량감소가 첨가되지 않은 시료보다 더 적었음을 확인하였다