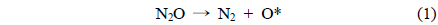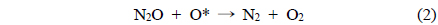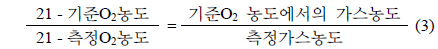This study was performed to investigate the effects of fluidizing media on N2O production in fluidized bed incineration of sewage sludge. The fluidized media were prepared in a form of 2 mm bead by mixing zeolite powders in our lab. Sand having 0.4 mm of the mean size showed 0.44 m/s of minimum fluidization velocity (Umf), while the prepared zeolite media 0.5 m/s. When the ratio of fluidizing media height to the inside diameter of the incinerator (bed aspect ratio) increased from 1.4 to 3.1, it was found that Umf of the zeolite media was varied from 0.5 m/s to 0.7 m/s. Under the operation conditions in 1.79 of excess air ratio, 909 ℃ of bed temperature and ca. 1.65 m/s of superficial velocity, as the weight of fluidizing meadia was increased, O2 concentration in the flue gas was slightly decreased, and CO2 increased. Above 6 kg of fluidizing media weight (1.98 of bed aspect ratio), it was observed that N2O concentration was significantly reduced, which might result from the decomposition of N2O on the zeolite media rather than transformation of N2O to NOx. On the other hand, in a variation of the zeolite media mixing ratio to sand and bed temperature at a constant total bed height, significant difference was exhibited in N2O emission concentration according to the temperature. Considering the operation temperature in the incineration, the effective calcination temperature of the zeolite media was suggested to be around 900 ℃.
하수종말처리장에서 발생하는 슬러지 발생량은 매년 증가하는 추세이다. 이와 같이 발생되는 슬러지는 지금까지 해양투기와 매립에 의존해왔지만, 런던협약으로 인해 2012년부터 해양투기가 금지되어, 매립지 확보문제, 주민의 민원 등이 문제가 되고 있다[1]. 이에 선진국에서는 감량화, 무해화 및 자원화를 동시에 이루고자 소각처리방법을 채택하고 있다[2]. 그러나 하수슬러지는 화석연료에 비해 높은 함량의 질소성분을 함유하고 있어서, 다른 화석연료나 소각 폐기물에 비해 소각 시 상대적으로 높은 농도의 질소산화물이 발생된다. 소각으로 인해 발생하는 배출가스 중 아산화질소(N2O)는 대표적인 온실가스중 하나이다. N2O가 지구 온난화에 미치는 영향은 CO2가 미치는 영향의 약 10% 정도지만 대기 중에서 매우 안정하기 때문에 150년 동안 체류하며, 지구온난화지수(global warming potential, GWP)가 CO2에 비해 310배나 높다[3-5].
유동층 소각과 같이 고정 연소장치에서는 N2O의 발생을 억제하기 위하여 연소온도의 상승, 산소농도의 저하, 접촉입자와의 혼합 촉진 및 고압화(가압유동층 연소) 등이 연구되고 있다[6]. 이러한 방법의 문제로는 유동층연소에서 N2O 생성을 감소시키면 NOx의 생성이 증가하는 경우가 대부분이므로, 확실한 N2O 억제로 보기 어려운 것이 현실이다. 암모니아를 이용하여 NOx를 선택적으로 환원시키는 배연탈질장치에서도 적은 양이지만 N2O가 발생하며, Combined Cycle용의 가스터빈 배가스에 적용하는 경우에는 온도가 높아 N2O의 생성이 많아진다[6]. 따라서 NOx보다 저감이 어려운 N2O를 분해 처리할 수 있는 촉매 개발이 연구되고 있다.
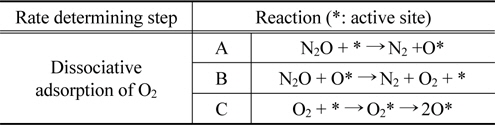
촉매에서 일어나는 N2O 분해반응은 두 단계의 반응을 나눌 수 있다. 첫 번째 반응(1)은 1 mol의 N2O가 1 mol의 질소 분자와 촉매 사이에 흡착된 산소원자로 분해되는 반응이고, 두 번째 반응(2)은 율속단계로써 다른 1 mol의 N2O 분자가 흡착된 산소와 반응하여 각각 1 mol의 질소와 산소로 분해되는 반응이다[7].
여기서, *는 활성점을 나타낸다.
배가스에 존재하는 N2O의 저감을 위해서는 기존 소각장치에 추가적인 저감장치가 장착되어야 하므로, 추가적인 설치비용과 공간의 문제가 발생한다. 따라서, 본 연구에서는 N2O를 분해할 수 있는 촉매 물질을 유동매체로 사용함으로써, 추가적인 저감장치의 설치 없이 하수슬러지 소각로 내부에서 N2O를 저감하고자 하였다. 이때 유동매체의 사용 조건에 따른 N2O의 발생량을 조사하였다. 또한 과잉공기비(실제 공기비/이론 공기량)와 소각온도 등을 변화 시키며 N2O 발생량의 변화를 조사하였다.
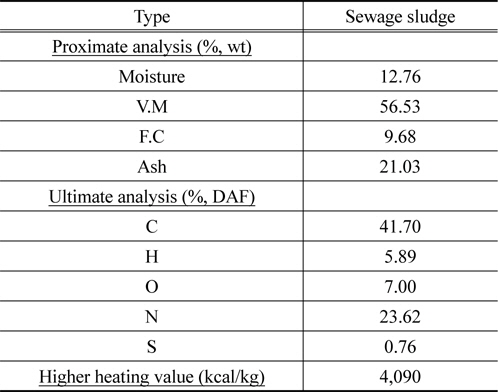
소각에 사용된 건조하수슬러지는 N시의 하수처리장에서 디스크 건조기를 통과한 시료를 공급받았으며, 공업분석, 원소분석 및 고위발열량을 측정을 실시하였다. 결과는 Table 1과 같다. 한편 유동매체로 유동사 및 자체 제조된 구형 zeolite 유동매체는 각각 혹은 혼합하여 사용하였다.
[Table 1.] Proximate and ultimate analysis of sewage sludge
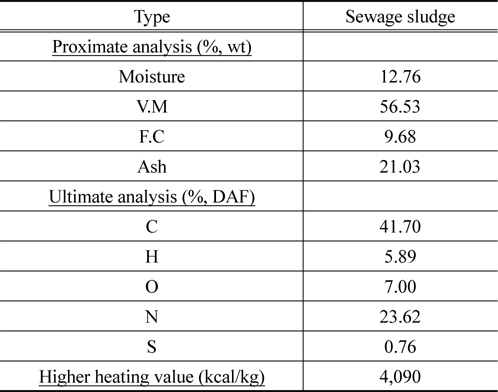
Proximate and ultimate analysis of sewage sludge
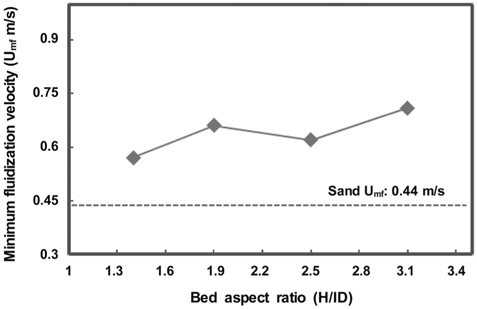
유동사와 제조된 구형 zeolite 유동매체의 유동화 특성을 파악하고자, cold mode test를 수행하였다. Cold mode test용 실험 장치는 실제 10 kg/h 하수슬러지 유동층 소각 실험 장치와 동일한 비율의 아크릴로 제작하였다. 유동화가 일어나는 관의 내경은 200 mm이며, 공탑속도는 0-2.5 m/s로 조절하였다. 이때, 유동화가 일어나면서 변하는 유동층의 높이와 차압을 측정하였다. 또한, 소각로 내경에 대한 유동층 높이의 비(bed aspect ratio)는 1.4, 1.9, 2.5, 3.1로 조절하였다.
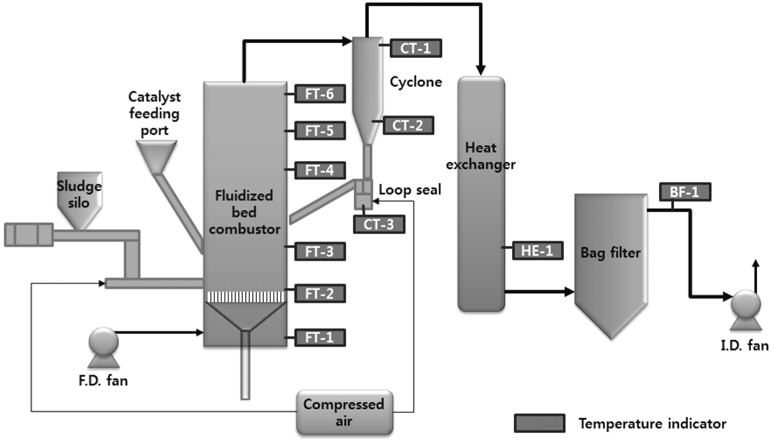
10 kg/h 하수슬러지 유동층 소각 실험 장치를 Figure 1과 같이 제작/설치하였다. 유동층의 내경과 높이는 각각 0.2 m와 6 m이며, 분말 형태의 건조하수슬러지는 소량의 압축공기와 함께 혼합하여 유동층 내로 공급하였다. 유동매체의 유동화를 위해, F.D. fan으로 소각로 내로 대기 공기를 공급하였으며, 소각로 내 압력이 걸리지 않도록 공정 후단에 I.D. fan으로 항상 일정 공기를 배출시켰다. 유동매체는 촉매 투입구를 통하여 소각로 내부로 투입하였다. 소각로 후단에는 싸이클론을 두어 소각로로부터 넘어오는 큰 입자의 분진을 포집하도록 하였다. 또한 싸이클론에 포집된 분진은 다시 루프실을 통하여, 소각로 내로 재투입되었다. 싸이클론을 통과한 가스는 열교환기를 통해 온도를 냉각 시켰으며, 이 후 백필터에서 미세분진을 포집하였다. I.D. fan으로부터 배출된 배기가스는 악취와 같은 문제를 방지하기 위하여, 물이 저장된 흡수 탱크를 통과하도록 하였다. 소각로 내의 온도분포를 측정하기 위해, k-type 열전대를 소각로의 하부로부터 1 m 간격으로 6개를 장착하였으며, 싸이클론과 열교환기, 백필터 후단에도 장착하여 가스의 온도변화를 측정하였다. 또한, 차압계를 장착하여 소각로 내부와 각 단계별 압력변화를 측정하였다.
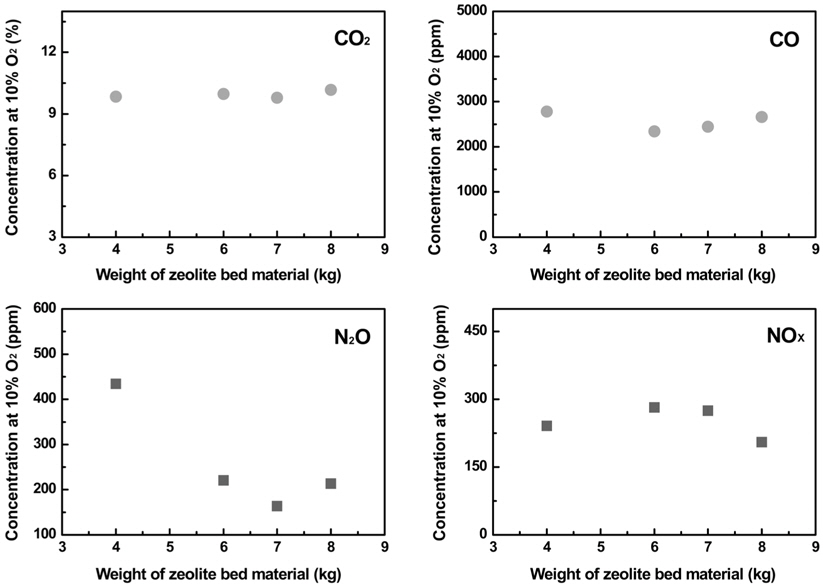
유동매체의 양에 따른 영향을 조사하기 위하여, 유동매체로 유동사 3 kg과 2 mm zeolite 유동매체를 혼합하여 사용하였다. 유동층 높이를 조절하기 위해, 2 mm zeolite 유동매체를 4 kg, 6 kg, 7 kg, 8 kg으로 증가시켰으며, 이때 bed aspect ratio는 각각 1.45, 1.98, 2.25, 2.52이었다. 과잉공기비는 1.79로 맞추었으며, 유동층 온도는 약 909 ℃로 조절하였다. 이때, 공탑속도는 약 1.65 m/s이었다. zeolite 유동매체의 양에 따른 각 가스의 농도 변화를 측정하였다.
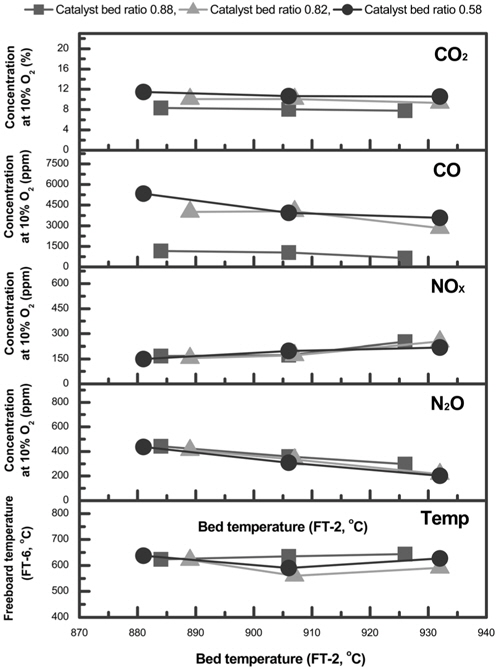
또한, 유동층의 zeolite 유동매체 비율에 따른 영향을 조사하였다. 2 mm zeolite 유동매체를 전체 유동층의 0.88, 0.82, 0.58 비율로 혼합하여, 소각로 내경에 대한 전체 유동층 높이의 aspect ratio를 2.2로 하였다. 공탑속도와 과잉공기비는 각각 약 1.65 m/s와 1.59로 맞추어 운전하였다. 유동층의 촉매 zeolite 비율의 변화에 따른 각 가스의 농도 변화를 측정하였다.
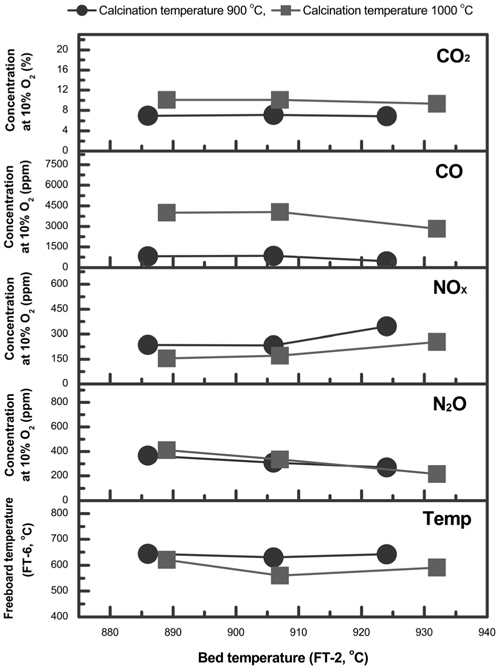
Zeolite 유동매체의 소성온도의 변화에 따른 영향을 보기위해서 온도는 900 ℃와 1,000 ℃에서 소성을 실시하였다. 소성시 승온시간은 분당 10 ℃로 하였으며, 소성온도에서 4시간 유지하였다. 소성한 유동매체는 유동사와 2 mm zeolite 유동매체를 혼합하여 유동층의 높이비(aspect ratio)는 2.25로 하고, 공탑속도와 과잉공기비는 각각 약 1.65 m/s와 1.77로 하여 운전하였다. 가스의 측정은 O2(전기화학식), CO, CO2, NO, NO2, N2O, SO2(비분산적외선식) 센서가 장착된 이동형 분석기(sensonic IR-1 & G-2)로 분석하였다(과잉공기에 의한 가스 희석효과를 배제하기 위하여 10% O2 농도를 기준으로 각 가스의 농도를 보정하였다).
3.1.1. 유동매체의 특성
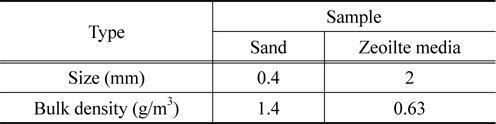
유동층 소각로에서 유동매체로 사용된 매체별 평균크기 및 벌크밀도를 Table 2에 나타내었다. Zeolite 유동매체는 유동사에 비해 평균크기가 큰 반면, 벌크밀도는 유동사에 비해 크게 낮았다. 입자의 무게는 zeolite가 유동사보다 56배 무거웠으나, 접하는 면적도 25배 증가하여 유동화 공기를 두 입자 간의 최소유동화속도는 무게에 비하여 작은 차이를 나타내었다. 따라서 혼합사용이 가능할 것으로 판단하였다. 이러한 유동매체의 최소유동화속도를 알아보기 위해 cold mode test를 수행하여 나타내었다.
[Table 2.] The average size and bulk density of fluidizing media
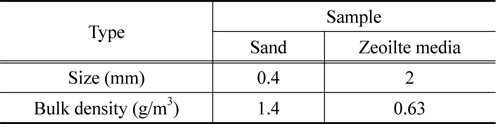
The average size and bulk density of fluidizing media
3.1.2. 유동매체의 최소유동화속도
일반적으로 사용되는 유동사와 2 mm 구형 zeolite 유동매체의 최소유동화속도는 각각 0.44 m/s와 0.5 m/s으로, zeolite 유동매체가 유동사에 비해 다소 높은 최소유동화속도를 나타내었다. 이는 유동사의 평균 입자크기가 약 0.4 mm인 것에 비해, 성형된 zeolite 유동매체의 입자가 2.0 mm로 다소 크기 때문에 무게비를 상쇄하였기 때문인 것으로 사료되었다. 이러한 유동매체 입자크기 증가에 따른 최소유동화속도의 증가는 기존 문헌[12]에서의 결과와 유사하게 관찰되었다. 또한 유동입자의 최소유동화속도는 유동화 입자의 크기가 증가할수록 증가하며, 반응기의 운전 온도가 증가함에 따라 감소하는 것으로 보고되었다[13]. 그러나 유동입자의 벌크 밀도가 zeolite 유동매체가 유동사에 비해 매우 낮아, 입자크기에 대한 최소유동화속도의 증가가 상대적으로 크지 않은 것으로 사료되었다. 또한, 유동사와 zeolite의 균일하게 혼합되는 것은 cold mode test를 통해 확인을 할 수 있었다.
소각로 내경에 대한 유동층높이의 비(bed aspect ratio)를 Figure 2에 나타내었다. Bed aspect ratio을 1.4에서 3.1로 증가시킨 결과, 입자간의 충돌 및 압력강하를 극복하기 위한 에너지의 필요로 인하여 zeolite 유동매체의 최소유동화속도가 다소 증가한 0.7 m/s로 측정되었다. bed aspect ratio가 2.5에서의 유동화 속도의 감소는 유동의 불균형으로 인해 감소하였을 것으로 사료된다. 또한 bed aspect ratio가 2.5 이상인 경우, 최소유동화속도를 초과하는 공탑속도 범위에서 슬러깅 현상이 관찰됨에 따라, 유동층의 높이는 bed aspect ratio가 2.5 미만이 되도록 조절하는 것이 바람직할 것으로 판단되었다. 이러한 슬러깅 현상은 슬러그 위쪽에 존재하는 고체에 미치는 상승력과 하강력이 같아질 때 일어나며, 상승력은 상승하는 기체에 의해 일어나고 하강력은 슬러그 상부에 존재하는 고체의 무게와 고체와 벽사이의 전단력에 의해 일어난다고 알려져 있다[14]. 따라서, 동일한 상승력의 기체 유속에서 층높이가 증가할수록, 고체의 무게 증가뿐만 아니라 고체가 층벽과 접촉하는 면적의 증가로 전단력이 증가하면서 하강력이 증가하여 상승력과 같아지기 때문에 슬러깅 현상이 관찰된 것으로 사료되었다. 한편, 본 연구에서 제작/설치된 소각로의 내경이 200 mm인 것을 고려하면, 900 ℃의 소각온도에서 최소 유량을 18.5 m3/h 이상으로 유지하여야 하는 것으로 나타났다.
3.2.1. 유동매체의 양의 증가에 따른 가스농도의 변화
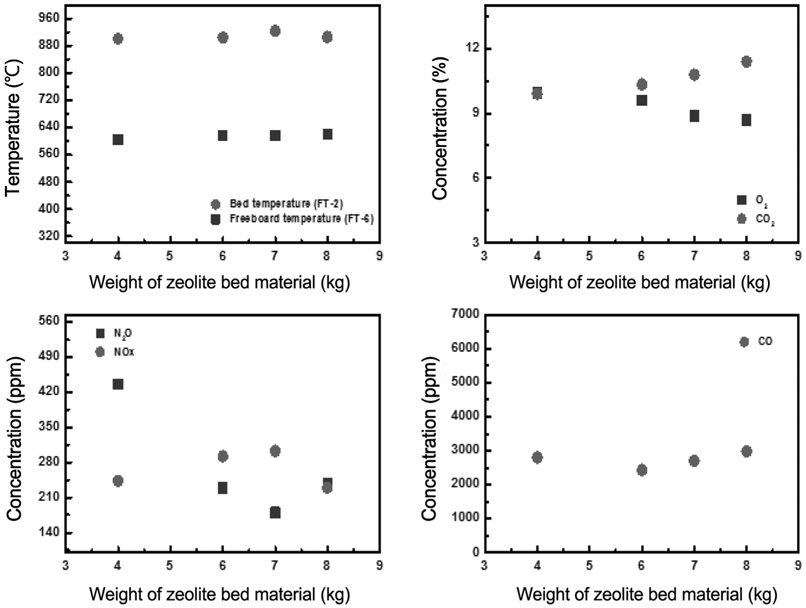
유동매체 양의 증가에 따른 가스의 농도를 비교하여 Figure 3에 나타내었다. O2의 농도는 유동매체 사용량의 증가에 따라 다소 감소하였으며, 반면 CO2의 농도는 다소 증가하는 것으로 나타났다. 이러한 현상은 유동매체의 증가로 유동층 내의 압력강하를 높여, 분말 하수슬러지의 체류시간을 증가시키고, 그 결과 유동층 내에서의 하수슬러지 소각이 보다 잘 일어나기 때문으로 사료되었다. 한편, 유동매체 투입량이 늘어나면 유동매체가 축열재 역할을 하여 유동층 내 온도 편차를 줄이게 되어 슬러지의 고른 연소가 진행될 수 있다는 점도 CO2농도가 늘고 O2농도가 낮아지는 원인으로 사료된다. CO의 농도는 약 2,700 ppm으로 유동매체 사용량에 영향을 받지 않았다. Zeolite 유동매체 사용량이 6 kg (bed aspect ratio 1.98) 이상으로 증가할 경우, N2O의 농도는 크게 감소하였으며, NOx의 농도는 다소 증가하는 것으로 나타났다. 이는 유사한 운전 조건에서 산소농도가 감소함에 따라 NO의 농도는 증가하는 것으로 보고되고 있다[15]. 따라서, 본 연구에서는 NOx 농도의 증가는 위에서 언급한 유동층 내의 하수슬러지 소각율이 증가함에 따라, 유동층 내의 온도가 다소 증가하고 이에 의하여, NOx의 농도가 다소 증가한 것으로 사료되었다. 한편, N2O 농도의 감소는 유동층 온도의 증가에 의한 N2O의 NOx로 전환과 zeolite 유동매체에 의한 N2O의 분해반응에 의해 일어난 것으로 사료되었다. 그러나 N2O 농도의 감소는 200 ppm 이상이고 NOx 농도의 증가는 50 ppm 미만인 것을 고려하였을 때, N2O의 감소는 NOx로의 전환보다는 대부분 zeolite 유동매체에 의한 N2O 분해 반응에 의해 주로 일어난 것으로 판단되었다. 또한, 촉매에 의한 N2O의 분해반응은 Table 3에 나타난 바와 같이, 활성화된 산소와 아산화질소 분자가 반응하여 질소와 산소로 탈착하고 활성점이 재생되며 재생된 활성점에 산소분자가 해리 흡착하는 과정을 거친다[16-21]. 산소 분압이 낮아지면 분해 속도가 빨라지며, 재생한 활성점의 수가 증가하여 전체 분해반응속도가 빨라진다[22]. 따라서 zeolite 유동매체 양의 증가는 N2O 분해를 위한 다량의 활성점을 제공할 뿐만 아니라, 분해 반응속도의 증가를 야기하는 것으로 사료되었다. 그리고, 산소 존재시 NO의 환원이 일어나는 온도범위에서 약 15%의 N2O가 생성되는 반면, 산소가 존재하지 않은 경우에는 10% 이하의 N2O가 생성된다[23]. 그러므로 본 연구에서와 같이 50 ppm의 NOx 농도 변화에 따른 N2O농도의 변화는 상대적으로 매우 적을 것으로 판단되었다. 한편, 산소에 의한 희석 효과를 배제하고자, 10% O2 농도를 기준으로 각 가스의 농도를 (3)에 의해 계산하였다.
[Table 3.] The catalytic decomposition mechanism of nitrous oxide
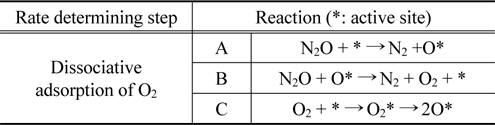
The catalytic decomposition mechanism of nitrous oxide
10% O2를 기준으로 하여 각 가스의 농도를 환산한 결과를 Figure 4에 나타내었다. 그 결과로써 유동매체 사용량의 증가에 의한 CO2, CO, NOx의 가스 농도 변화는 크지 않은 것으로 나타났다. 반면, N2O의 농도는 zeolite 유동매체의 사용량이 4 kg에서 6 kg (bed aspect ratio는 1.45에서 1.98)으로 증가하면서 크게 감소하는 것으로 나타났다. 그러나 사용량이 6 kg (bed aspect ratio 1.98)을 넘는 범위에서는 N2O의 발생 농도가 크게 감소하지 않는 것으로 관찰되었다. 이러한 현상은 zeolite 유동매체의 증가로 N2O 분해를 위한 활성점과 분해 반응속도의 증가가 일어날 수 있지만, 유동매체의 일정양 이상에서는 제공되는 모든 활성점이 N2O 분해 반응에 참여하지 못하는 것으로 사료되었다. 따라서 조사된 운전 조건의 범위에서 는 약 2.0의 bed aspect ratio가 되도록 유동매체의 양을 조절하여, 소각 운전하는 것이 바람직 할 것으로 판단되었다.
3.2.2. 유동매체의 차지하는 비율에 따른 가스농도의 변화
전체 유동층의 높이를 일정하게 유지하고 zeolite 유동매체가 차지하는 비율과 유동층의 온도를 변화 시켰을 때, 10% O2의 농도를 기준으로 각 가스의 농도를 비교하여 Figure 5에 나타내었다. CO2의 농도는 약 8-12%의 범위에서 일정하게 발의 온도가 증가함에 따라 감소하는 것으로 나타났으며, zeolite 유동매체의 비율이 0.9 부근으로 높을 때, CO의 농도가 현저생되는 것으로 나타냈으며, CO의 농도가 일반적으로 유동층히 줄어드는 것으로 나타났다. NOx, N2O의 농도는 zeolite 유동매체의 비율에 따라서는 큰 차이를 나타내지 않았다. 그러나, 유동층 운전온도가 880 ℃에서 930 ℃로 증가에 따라 NOx의 농도는 150-300 ppm 범위에서 증가하였으며, 한편, N2O의 농도는 유동층 온도 증가에 따라 200-400 ppm의 범위에서 감소하였다. 이는 온도 증가에 따라 NOx가 증가하면 N2O는 감소하는 것으로 서로 상대적인 관계에 의한 것으로 사료되었다[24]. 또한 사용된 zeolite 유동매체의 양이 bed aspect ratio 1.9 미만의 범위에서 있어, N2O 분해에 대한 zeolite 유동매체의 영향이 나타나지 않은 것으로 사료되었다. 이는 zeolite 유동매체의 혼합비율에 따른 변화 보다는 bed aspect ratio을 약 2.0 이상으로 조절하며, 일정한 유동사와 zeolite 유동매체의 양의 충족하였을 때 N2O의 영향이 나타나는 것으로 판단된다.
3.2.3. 유동매체의 소성온도에 의한 영향
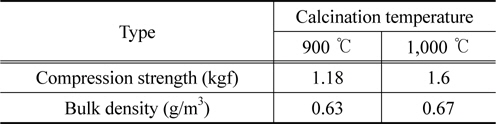
소성온도의 변화에 따른 영향은 10% O2 농도를 기준으로 각 가스의 농도를 비교하여 Figure 6에 나타내었다. 그 결과 zeolite 유동매체의 소성온도에 의한 발생 가스 농도의 차이는 미비한 것으로 나타났다. CO의 농도가 900 ℃에서 소성한 zeolite 유동매체의 경우 1,000 ppm 이하인 반면, 1,000 ℃에서 소성한 zeolite 유동매체는 2,000 ppm 이상인 것으로 나타났다. 한편 N2O와 NOx의 농도는 두 zeolite 유동매체의 종류에 무관하게 유사한 농도 범위에서 나타났다. 여기서 한 가지 주의하여야 할 것은 사용된 zeolite의 특성으로 인하여 소성온도를 1,000 ℃ 이하로 하여야 한다. Zeolite의 소성온도가 1,000 ℃를 초과하는 경우 zeolite의 구조가 파괴되는 것으로 나타났다. Table 4에 나타난 바와 같이, zeolite 유동매체의 소성 온도별 압축강도 및 벌크밀도가 1,000 ℃보다 900 ℃에서 비교적 낮지만, 이것은 하수슬러지의 유동층 소각에서 N2O 발생 농도에 큰 영향을 미치지 않는 것으로 사료되었다. 또한, 소성온도에 따른 zeolite입자 비표면적을 알아보기 위하여 zeolite 유동매체를 소성전, 900 ℃ 소성후, 1,000 ℃ 소성후로 나누어 BET를 측정하였다. 측정한 결과, 소성전 촉매의 비표면적은 각각 385.77 m2/g으로 나타났으며, 반면 900 ℃ 소성후, 1,000 ℃ 소성후에는 218.34 m2/g와 156.27 m2/g로 소성온도의 증가에 따라 비표면적인 줄어드는 것으로 판단된다. 이는 비표면적의 감소로 인한 확산속도의 영향 보다 유동흐름속도가 상대적으로 빠르기 때문에 비표면적의 영향은 미비할 것으로 판단된다.
[Table 4.] Compression strength and bulk density of zeolite fluidizing media
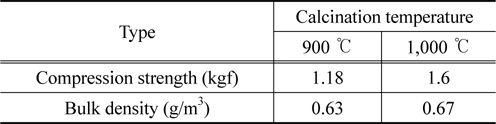
Compression strength and bulk density of zeolite fluidizing media
유동매체를 이용하여 하수슬러지를 소각시 N2O의 발생량에 대한 실험으로 다음과 같은 결론을 얻을 수 있었다.
1) 평균 입자의 크기가 0.4 mm인 유동사의 최소유동화속도는 0.44 m/s인 것에 비해 입자의 크기가 2 mm인 유동매체의 최소유동화속도는 0.5 m/s으로 다소 증가하는 것을 수 있었으며, 이는 유동매체의 평균 입자의 크기로 인한 것으로 사료된다.2) 유동층 소각로에 사용된 유동매체의 양이 4 kg에서 6 kg (bed aspect ratio는 1.45에서 1.98)으로 증가함에 따라 CO2, CO, NOx의 농도는 큰 차이를 나타내지 않는 것을 알 수 있었으나, N2O의 농도는 크게 감소하는 것을 알 수 있었다. 한편, 사용량이 6 kg (bed aspect ratio 1.98)을 넘는 범위에서는 N2O의 농도가 크게 감소하지 않는 것으로 관찰됨에 따라 유동매체의 사용양은 bed aspect ratio 2.0 부근에서 운전하는 것이 적절할 것으로 판단되었다.3) Zeolite 유동매체가 유동층 높이를 차지하는 비율의 변화에 따라 발생하는 가스의 농도는 크게 영향을 받지 않는 것으로 나타났다. 한편, 유동층의 온도가 올라갈수록 NOx의 농도는 150-300 ppm 범위에서 증가하였으며 N2O의 농도는 200-400 ppm의 범위에서 감소하는 것을 알 수 있다.4) 유동매체의 소성 온도의 의한 변화는 온도가 증가함에 따라 다소 압축강도와 벌크밀도가 증가하였으나 유동층 운전에는 큰 영향을 미치지 않는 것으로 보아 900 ℃ 온도에서의 소성이 유리할 것으로 사료되었다.