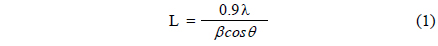In order to investigate the effect of cerium oxide addition, Cu-ZnO-CeO2 catalysts were prepared using co-precipitation method for water gas shift (WGS) reaction. A series of Cu-ZnO-CeO2 catalyst with fixed Cu Content (50 wt%, calculated as CuO) and a given ceria content (e.g., 0, 5, 10, 20, 30, 40 wt%, calculated as CeO2) were tested for catalytic activity at a GHSV of 95,541 h-1, and a temperature range of 200 to 400 ℃. Cu-ZnO-CeO2 catalysts were characterized by using BET, SEM, XRD, H2-TPR, and XPS analysis. Varying composition of Cu-ZnO-CeO2 catlysts led the difference characteristics such as Cu dispersion, and binding energy. The optimum 10 wt% doping of cerium facilitated catalyst reduction at lower temperature and improved the catalyst performance greatly in terms of CO conversion. Cerium oxide added catalyst showed enhanced activities at higher temperature when it compared with the catalyst without cerium oxide. Consequently, ceria addition of optimal composition leads to enhanced catalytic activity which is attributed to enhanced Cu dispersion, lower binding energy, and hindered Cu metal agglomeration.
전력 생산을 위한 화석 연료의 대규모 이용으로 전 세계적인 지구 온난화가 발생하였다. 현재, 많은 국가들은 다양한 법적 수단 및 기술을 도입함으로써 온실 가스의 방출을 감소시키기 위해 노력하고 있다[1,2] 석탄과 석유 같은 기존의 화석연료들의 대체 에너지로서, 수소는 온실가스를 생산하지 않는 청정연료로 간주되어왔다. 수소는 일반적으로 천연가스와 액화석유가스(LPG)와 같은 탄화수소의 수증기 개질 반응을 통해 생산된다[3,4]. 개질 반응된 생성물은 수소뿐만 아니라 일산화탄소, 이산화탄소, 수증기를 포함한다. 수성가스전이반응(WGS: water gas shift, CO + H2O → CO2 + H2, ΔH = -10 kcal/mol)은 개질 반응된 생성물 내의 일산화탄소(CO)를 수증기(H2O)와 반응시켜 수소(H2)와 이산화탄소(CO2)를 생산하며 수소의 수율을 높이는 역할을 한다[5-8]. 고순도의 수소를 생산하기 위하여, 산업 분야의 수성가스전이반응은 고온수성가스전이반응(HT-WGS: high temperature WGS, 350~400 ℃)과 저온수성가스전이반응(LT-WGS: low temperature WGS, 200~230 ℃)을 순차적으로 실시하는 두 단계로 이루어진다[9,10]. 고온수성가스전이반응은 매우 빠른 반응 속도를 제공하지만 낮은 CO 전환율을 가지고 있으며, 상대적으로 저온수성가스전이반응은 높은 CO 전환율을 갖지만 반응속도가 느리다[11]. 그러므로, 현재의 연구 추세는 빠른 반응속도와 낮은 온도 영역에서 높은 활성을 가지는 WGS 촉매 개발에 초점을 두고 있다. 일반적으로, LT-WGS에서는 Cu/ZnO나 Cu-ZnO/Al2O3 같은 Cu를 활성물질로 하는 비 귀금속 촉매를 사용한다[12-15]. 촉매에서의 산화구리(CuO)는 WGS 반응에 사용하기 전에 Cu 금속으로 환원된다. 그러나, 미세하게 분산된 구리 입자는 고온에서 지지체의 표면으로 이동하려는 경향을 가지고 있고 응집이 쉽게 일어나는 것으로 알려져 있다[16,17]. 또한, 수증기 또는 산소 함유 반응물이 존재하는 산화 분위기에 노출되면, Cu계 촉매는 쉽게 산화된다[18]. 이러한 장애를 극복하기 위해서, WGS 촉매의 연구는 낮은 온도에서의 반응속도와 산화 분위기에 대한 내구성의 향상에 집중되고 있다. 여러 지지체 물질 중에서, CeO2는 독특한 산화환원 특성으로 인하여 구리나 귀금속 같은 촉매 물질의 촉매적 활성을 높이는 우수한 물질로 여겨진다[19-22]. CeO2는 기상의 분위기에 따라 산소 함유량이 비 양론적으로 존재할 수 있으므로, Ce의 화학적 상태는 Ce3+와 Ce4+의 화학 형태를 취하며 격자(latteic)의 산소 결핍을 보완한다. 이 특성은 산소 빈자리를 통해 산소의 확산을 빠르게 하며, 산소를 반응물과 효과적으로 주고받으면서 금속의 촉매 표면 반응을 용이하게 할 수 있다[23,24]. Stubenrauch와 vohs는 환원 정도가 다른 CeO2를 지지지체로 사용한 Rh/CeO2 촉매에서 CO의 해리를 조사하였고 CeO2지지체 표면에서 해리 반응에 직접 참여하는 산소빈자리를 조사하였다[25]. Flytzani-Stephanopoulos와 동료들은 다양한 금속과 금속산화물을 CeO2와 조합한 촉매를 이용하여 WGS반응을 조사하였고 CeO2의 첨가는 다른 촉매의 활성을 향상시킨다고 주장했다[26-28]. 주로, CeO2의 독특한 산화환원 메커니즘이 촉매 활성 향상에 기여한다고 알려져 있다. Ce(La)Ox 촉매에 Li과 Cu를 도입하여 CeO2의 첨가가 활성물질과 지지체 사이에 강한 상호작용을 이끌어 내는 것을 확인하였다[26]. Jeong과 그의 동료들은 다양한 비율의 Cu/CeO2 촉매로 WGS 반응을 조사하였고 Cu 80 wt%와 CeO2 20 wt%를 포함한 촉매가 가장 높은 CO전환율을 나타낸다고 하였다. 그들은 또한 Ce의 첨가는 Cu와 지지체의 강한 상호작용으로 장기적인 활성테스트에서 촉매 안전성을 높인다고 주장하였다[29]. Rønning과 그의 동료들은 Cu-ZnO 촉매에 CeO2의 첨가로 Cu와 ZnO의 분리를 유도하여 이러한 현상은 촉매 안정성을 증가시켰다고 주장하였다[30]. 지금까지 촉매활성에 CeO2가 미치는 영향을 밝히기 위하여 다양한 연구들이 진행되어 왔다. 하지만, CeO2 첨가에 의한 촉매 활성 향상 메커니즘은 복잡하고 CeO2 첨가의 효과는 촉매의 조성과 반응조건에 따라 달라지기 때문에 명확한 CeO2의 역할은 밝혀지지 않은 상태이다.
본 연구에서는 WGS반응을 위한 Cu-ZnO-CeO2 촉매들을 Ce 전구체의 양을 조절하여 공침법을 이용하여 제조하였다. 또한, 촉매 활성의 향상을 위한 촉매 최적 조성과 CeO2 첨가의 역할을 다양한 분석 기술을 통하여 조사하였다.
Cu(NO3)2・3H2O(Aldrich, puriss. p. a. grade), Zn(NO3)2・6H2O (Aldrich, 98.0%), Ce(NO3)3・6H2O (Aldrich, 99.0%)를 정한 비율에 맞추어 증류수에 넣어 0.1 M의 수용액을 만들었다. 이 수용액을 교반시키고 있는 Na2CO3 (Aldrich, ACSgrade) - 0.1 M수용액에 분당 5 mL의 속도로 펌프(Eldex, 1 HM, ¼” Head, stainless, Eldex Laboratories, Inc.)를 이용하여 주입하였다. 이 때, 0.1 M의 NaOH(Aldrich, ≥97.0%) 수용액으로 pH를 9.7이 되도록 유지하였다. 그 후에, 60 ℃로 24시간 동안 숙성하였다. 이후 여분의 Na+를 제거하기 위하여 증류수로 세척 후, 회수하여 12시간 동안 105 ℃에서 건조했다. 건조한 시료는 분당 2 ℃씩 온도를 올려 400 ℃에서 공기 조건으로 3시간 소성하였다. 모든 촉매는 CuO의 비율은 50 wt%로 고정을 하였고, 나머지 ZnO와 CeO2의 합이 50 wt%가 되도록 제조하였다. 제조된 촉매들은 CuO, ZnO, CeO2의 순서대로 비율을 나열하여 C5Z5C0, C5Z4.5C0.5, C5Z4C1, C5Z3C2, C5Z2C3, C5Z1C4라고 명명하였다. 예를 들어, C5N4C1은 CuO-50 wt%, ZnO-40 wt%, CeO2-10 wt%를 의미한다.
촉매의 표면형태분석은 주사전자현미경(S-4800, HITACHI)을 이용하여 수행되었으며 BET 표면적 분석은 micrometrics ASAP 2010 system장비를 사용하여 200 ℃에서 4시간 동안 전 처리한 후, 77K에서 질소 흡착 정도를 측정하여 수행되었다. 제조된 촉매의 결정구조 분석은 X-선 회절분석(D8 ADVANCE, 40 kV, 100 mA)을 이용하여 수행되었다. Temperature-programmed reduction (TPR)분석에는 BEL CAT B (BEL Japan, Inc.)장비를 이용하였으며 10 vol% H2/Ar 분위기에서 35 ℃부터 500 ℃까지 5 ℃/min으로 승온 시키면서 촉매의 환원정도를 측정하였다. X-ray photo electron spectrocopy (XPS)에는 A1-Ka선의 단일광이 탑재된 MultiLab 2000 (Thermo)장비를 사용하였다.
WGS 반응 테스트는 고정층 반응기를 이용하여 200~400 ℃의 온도범위에서 수행되었다. 입자크기가 150~300 μm인 촉매를 1/8인치 내경의 석영관에 0.5 cm 높이까지 장입하였으며 촉매반응을 수행하기 전에 장입된 촉매를 20 vol% H2/N2 분위기에서 상온에서 300 ℃까지 2 ℃/min으로 승온시킨 후에 1시간 동안 유지하여 환원시켰다. 환원공정이 끝난 후 반응기의 온도를 200 ℃로 낮추고 혼합가스(9.11 vol% CO, 10.10 vol% CO2, 59.81 vol% H2, 1.06 vol% CH4, balanced N2)를 흘려주는 동시에, 증류수는 micro pump (MINI-CHEM I PUMP NS, TOKYO・JAPAN)를 이용하여 steam/carbon = 2인 비율로 공급하였다. 이때, 증류수는 150 ℃로 예열된 스테인레스관을 통과하여 수증기(H2O)형태로 촉매 반응기에 공급되었다. 가스 유량은 100 sccm으로 고정하였으며 이는 기체공간속도(GHSV=gas hourly space velocity) 95,541 h-1에 해당한다. 반응기 후단의 가스 조성은 기체 크로마토그래피(gas chromatography, Agilent 3000)를 이용하여 분석하였다.
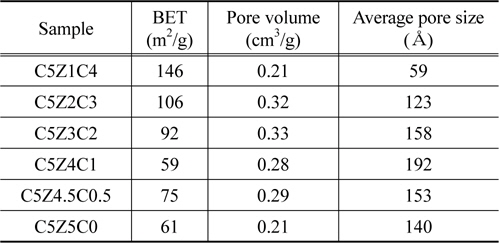
Table 1은 각각 시료들의 BET 분석결과를 보여주고 있다. Cu-ZnO-CeO2 촉매들은 CeO2 함량이 증가되면서 BET 표면적이 증가하였으나 예외적으로 10 wt% 첨가된 C5Z4C1 촉매는 59 m2/g으로 가장 낮은 값을 나타내었다. 촉매들의 세공부피는 0.21 cm3/g에서 0.33 cm3/g으로 나타났으며 CeO2 함량이 증가되면서 증가하다가 C5Z4C1에서 최대값이 되었다가 다시 감소되는 경향을 보였다. C5Z4C1 촉매는 CeO2를 포함하지 않는 C5Z5C0 촉매와 비교하여 비슷한 BET 표면적을 나타내었으나 평균 기공 크기에서 192 Å과 140 Å로 차이를 보였다.
[Table 1.] BET analysis results of prepared catalysts
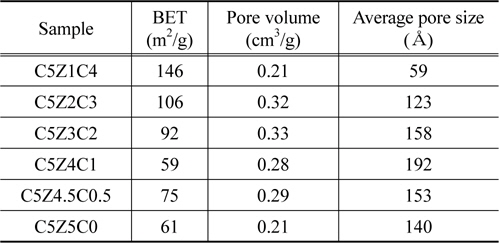
BET analysis results of prepared catalysts
Figure 1은 Cu-ZnO-CeO2 촉매들의 SEM 이미지를 보여주고 있다. 촉매 입자의 모양은 C5Z5C0 촉매에서 넓은 판형의 형태를 나타내었고 CeO2가 첨가되면서 판형 입자가 줄어들었고 구형의 모양의 입자들의 생겼으며 10 wt% 첨가된 C5Z4C1 촉매 입자에서는 더 이상 넓은 판형의 입자는 더 이상 보이지 않고 직경이 18~25 nm 정도의 구형 입자들이 관찰되었다. C5Z3C2 촉매의 입자는 구형과 타원형 형태의 입자가 같이 존재를 하며 입자끼리 응집되었고, CeO2가 30 wt% 이상이 첨가된 C5Z2C3, C5Z1C4 촉매들에서 입자들의 응집 현상은 더 강하게 나타난다. 이 결과를 통해 CeO2의 첨가는 Cu-ZnO 촉매의 결정성을 저하시키면서 입자들을 응집시킨다고 판단된다.
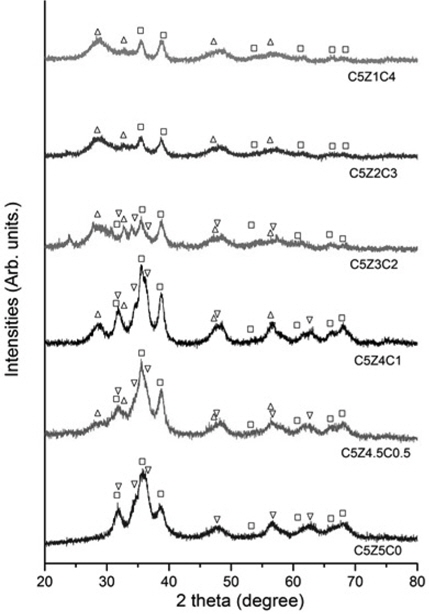
Figure 2는 각 시료들의 XRD 패턴을 보여주고 있다. C5Z5C0 촉매의 XRD 패턴은 CuO (JCPDS #48-1548)와 ZnO (JCPDS #03-0891)의 특성 피크들이 나타났다. CeO2가 첨가된 다른 촉매들의 XRD 패턴은 CeO2 (JCPDS #34-0394)의 특성 피크들이 추가로 생겼다. CeO2가 30 wt% 이상이 첨가된 C5Z2C3, C5Z1C4 촉매들의 XRD 패턴은 ZnO의 특성 피크들이 나타나지 않으며 CuO의 특성 피크의 크기가 감소하였다. C5Z5C0 촉매의 CuO 결정 크기는 Scherrer’s equation을 이용하여 계산하면 10.1nm를 나타냈다. Scherrer’s equation은 하기 식 (1)과 같으면, 식 내의 L은 CuO의 결정 크기, λ는 분석에 적용된 X-선의 파장, β는 특성 피크의 반가폭, 그리고
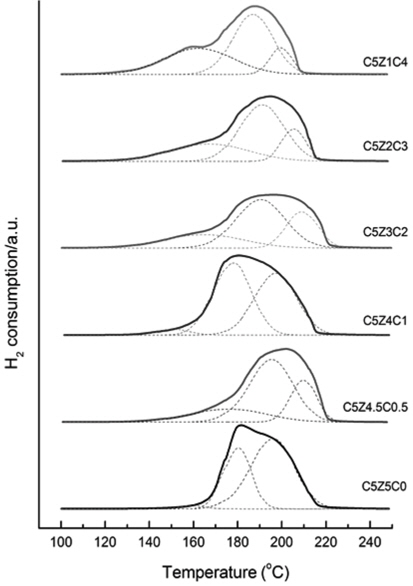
Figure 3은 각 촉매들의 H2-TPR분석 결과를 보여주고 있다. Reitz는 Cu계열 촉매에서 Cu+의 형성을 확인하였고, Cu2+가 Cu+를 거쳐 Cu0로 2단계 환원이 이루어진다는 것을 알아냈다[31]. 그러므로, C5Z5C0 촉매에서 관찰되는 2개의 피크는 낮은 온도영역의 피크는 Cu+의 환원에 따른 것이고 높은 온도영역의 피크는 Cu2+의 환원에 의한 것으로 판단된다. 하지만, CeO2가 첨가된 촉매들은 2개가 아닌 3개의 피크들이 관찰되었다. 문헌에 따르면, 낮은 원자가의 Cu 종들(species)은 Ce 격자의 구조적 결함을 일으키고 CeO2 격자는 산소 격자 결함(Oxygen vacancies)의 형성을 일으킨다고 알려져 있다[32]. 따라서, CeO2이 첨가된 촉매들에서 추가된 하나의 피크는 산소 결함을 포함한 CeO2-x 환원에 의해서 발생되며 가장 낮은 온도 영역의 피크로 판단된다[33]. CeO2이 첨가된 촉매들은 CeO2의 첨가량이 증가할수록 가장 낮은 온도영역의 환원피크의 값이 증가되었다. 그러나 C5Z4C1 촉매는 예외적으로 산소 결함의 환원에 의한 피크의 값이 가장 작으며 모든 피크들이 다른 촉매들에 보다 더 낮은 온도 영역으로 이동하였다. 잘 분산된 CuO는 bulk CuO보다 낮은 온도에서 TPR 피크들이 발견되는 것으로 알려져 있다[34]. 그러므로 C5Z4C1 촉매는 다른 촉매들에 비하여 CuO가 잘 분산되었고 잘 분산된 CuO와 CeO2 사이에서 강한 상호작용이 발생한다고 판단된다. CeO2의 첨가는 CeO2이 첨가된 촉매들을 C5Z5C0 촉매와 비교하였을 경우 Cu2+환원피크보다 Cu+환원피크가 더 큰 값을 보여 CeO2의 첨가가 Cu+를 더 쉽게 환원시키는 것을 확인할 수 있었다. 결과적으로, 적절한 CeO2의 첨가는 CuO의 분산도를 높게 하여 환원이 더 낮은 온도에서 일어나게 하며, CuO와 CeO2사이에 강한 상호작용이 발생하게 하는 것으로 해석된다.
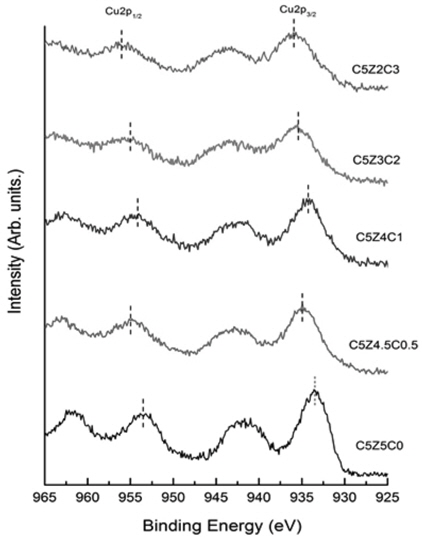
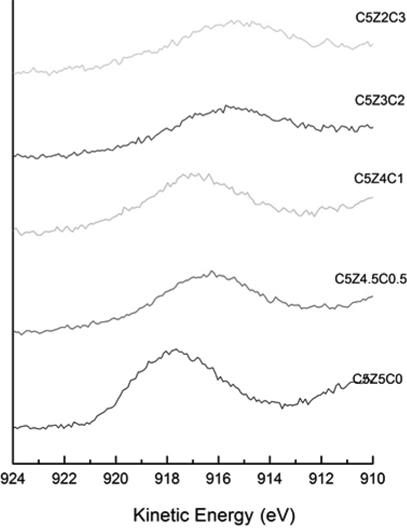
Figure 4는 각 촉매들의 Cu 2p XPS 스펙트럼을 보여주고 있다. C5Z5C0촉매가 가장 Cu 2p3/2와 Cu 2p1/2에서 가장 낮은 결합에너지를 보였다. CeO2이 첨가된 촉매들은 결합에너지가 증가하였다. 결합에너지가 값이 변하였다는 것은 촉매의 조성으로 인하여 CuO의 화학적 상태(chemical state)가 영향을 받았다는 것을 나타낸다. Cu 2p3/2와 Cu 2p1/2의 Binding Energy가 낮다는 것은 구리종들(copper species)이 Cu2+ 보다 Cu+ or Cuo로 존재한다는 뜻이다[35]. 그러나, Cu+ (cuprous oxide)와 Cu0 (metallic copper)가 Cu 2p3/2 피크에서 결합에너지가 같기 때문에 Cu0와 Cu+중에서 어떤 것으로 존재하는 지에 대한 구별하기는 하기는 어렵다. 이러한 문제를 해결하기 위해서 Cu LMM Auger spectra를 이용하였다. Figure 5는 각 촉매들의 Cu LMM Auger spectra를 보여주고 있다. 문헌에 따르면, Cu LMM Auger spectra에서 Cu2+, Cu+, Cu0는 각각 913-914, 916.8-917.3, 918.6 eV의 값을 나타낸다고 한다[36]. 그러므로 제조된 각 촉매의 표면에 Cu2+와 Cu+가 같이 존재한다고 판단된다.
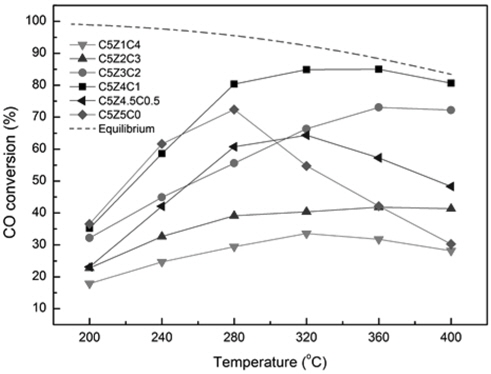
본 연구에서는 상용 WGS 공정의 GHSV보다 약 30배 높은 95,541 h-1에서 반응을 수행하여 가혹한 조건에서 촉매 활성을 분석하였다. Figure 6은 제조된 촉매의 반응 온도에 따른 CO전환율을 보여주고 있다. 촉매 활성도는 200 ℃와 240 ℃에서는 C5Z5C0 > C5Z4C1 > C5Z3C2 > C5Z4.5C0.5 > C5Z2C3 > C5Z1C4의 순으로 280 ℃에서는 C5Z4C1 > C5Z5C0 > C5Z4.5C0.5 > C5Z3C2 > C5Z2C3 > C5Z1C4의 순으로 나타났으며 320 ℃와 360 ℃에서는 C5Z4C1 > C5Z3C2 > C5Z4.5C0.5 > C5Z5C0 > C5Z2C3 > C5Z1C4의 순으로 촉매 활성이 감소하였다. C5Z5C0 촉매는 200~240 ℃까지 가장 높은 CO전환율을 갖지만 280 ℃ 이후부터는 CO전환율이 떨어지는 것을 확인되었다. 반면, CeO2이 첨가된 촉매들의 경우에는 200~240 ℃에서 C5Z5C0 촉매보다 CO전환율이 낮지만 280 ℃ 이후에도 CO전환율이 감소되지 않았다. 예외적으로 C5Z4.5C0.5 촉매만 320 ℃ 이후에 CO전환율이 떨어졌다. 모든 촉매활성도는 저온영역온도에서는 XPS분석 결과에서 결합에너지가 낮은 순서대로 CO전환율이 높았다. CeO2이 첨가된 촉매들의 촉매 활성도는 C5Z4C1 > C5Z3C2 > C5Z4.5C0.5 > C5Z2C3 > C5Z1C4순으로 일정한 경향성을 보이지 않고 일정한 비율의 CeO2 10 wt%가 첨가하였을 때 가장 높은 촉매 활성도를 나타내었다. CeO2가 10 wt%가 첨가된 C5Z4C1가 다른 촉매들에 비해 높은 활성을 보인 이유는 TPR분석에서 확인된 바와 같이 분산도가 높고 CuO와 CeO2 사이의 강한 상호작용으로 인해 촉매의 환원성이 향상되었고 XPS분석에서 확인된 결합에너지가 낮은 것으로 보아 CeO2 첨가에 의한 촉매의 전기적 특성이 향상되었기 때문이라고 판단된다. C5Z5C0 촉매는 280 ℃ 이후의 온도에서 급격한 CO전환율의 감소가 지속적으로 이루어진다. 분산된 구리입자들이 응집되어 구리입자들의 표면적의 감소되었기 때문에 고온영역에서는 촉매활성도가 떨어졌을 것이라 판단된다. CeO2가 10 wt% 이상 첨가 C5Z4.5C0.5 촉매는 320 ℃ 이후에 CO전환율이 감소되고 CeO2가 10 wt% 이상 첨가된 촉매들의 경우에는 고온영역에서의 CO전환율이 감소되지 않는 것으로 보아 CeO2의 첨가는 분산된 구리입자의 응집을 방지하여 고온영역에서 촉매활성도가 감소되는 것으로 판단된다.
결론적으로 C5Z4C1 촉매는 높은 CO전환율을 얻기 위한 낮은 결합에너지와 높은 분산도로 인해 낮은 환원온도와 지지체와의 강한 상호결합을 얻었으며 고온영역에서 분산된 구리입자들의 응집을 방지하기 때문에 가장 높은 촉매활성도를 보여주는 것으로 사료된다.
본 연구에서는 Cu-ZnO촉매에 CeO2를 첨가하여 공침법을 이용해 촉매를 제조하였고 CeO2 전구체의 양을 조절하여 지지체 물질을 조성에 따른 촉매 활성도 차이를 비교하였다. 최적 비율의 CeO2 첨가는 결합에너지가 낮고 높은 분산도로 인한 낮은 환원온도를 가지고 있어 높은 촉매 활성을 나타내었다. 또한, CeO2 첨가는 분산된 구리이온의 응집을 방해하여 고온영역에서도 촉매 활성도가 저하되지 않게 하였다. 반면 CeO2가 첨가되지 않은 C5Z5C0 촉매는 280 ℃ 이상의 온도에서 구리입자의 응집을 방지할 요소가 존재하지 않아 촉매 활성도가 떨어졌다.
즉, Cu-ZnO-CeO2촉매는 최적의 조성을 유지할 경우에 낮은 결합세기와 높은 분산도로 인하여 높은 촉매 활성을 유지하며 분산된 구리입자의 응집현상을 억제한다는 것을 확인하였다.