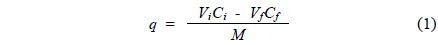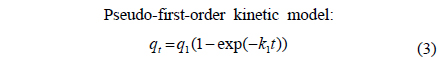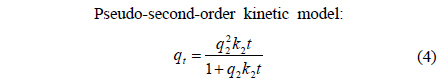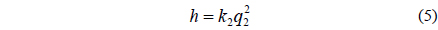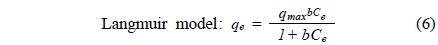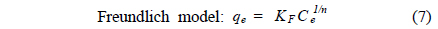In this study, polysulfone-
최근 섬유의 고품질화 및 다양한 수요에 의해 많은 양의 염색폐수가 발생하고 있으며, 특히 소득수준의 향상과 천연섬유의 사용 비중이 급증하여 소비자의 욕구, 유행, 계절의 변화에 따라 염료 사용이 증가하고 있다. 우리나라의 경우 2012년도 폐수배출업소 중 섬유제품 제조업 1,616개소로 일일 폐수 발생량은 404,000 m3/day으로 2010년도 380,179 m3/day 보다 약 6.3% 증가하였다[1]. 염색폐수에 포함된 염료가 소량일지라도 폐수는 짙은 색을 보이므로 방류 시 심미적으로 부정적인 영향과 불쾌감을 유발하여 민원의 대상이 된다[2]. 그리고 수계에서는 햇볕을 차단하는 역할을 함으로 수중식물의 광합성을 방해하여 성장을 저해하는 결과를 초래하는 것으로 알려져 있다[3]. 또한, 대부분의 염료는 무독하지만 일부 염료의 경우 발암성과 돌연변이를 유발하는 것으로 알려져 있다[4]. 따라서 염색폐수의 색도 유발물질인 염료를 방류 전에 적절하게 처리할 필요가 있다.
염료를 제거하는 방법에는 주로 화학적, 물리적, 생물학적 처리방법 등을 들 수 있다. 하지만 화학적 처리방법은 화학적 슬러지를 발생시키고 침전조에서 고액분리가 쉽지 않으며 운전비용 또한 비싸다는 단점이 있다[5]. 생물학적 처리의 경우 가장 많이 이용되는 활성슬러지 공법은 슬러지 발생량이 많고, 염색폐수내의 염료는 생물학적으로 처리하기에 어려운 물질로 구성되어 있어 처리효율이 낮은 단점이 있다[6]. 반면, 물리적 처리방법 중 하나인 흡착법은 원리가 간단하고 오염물질을 효과적으로 제거할 수 있어 여타의 방법에 비해 경제적이고 적용가능성이 높은 방법으로 알려져 있다[7]. 그러나 일반적으로 많이 사용되고 있는 활성탄은 대체로 처리효율은 좋으나 재생이 잘 되지 않는 문제점을 가지고 있다[8,9]. 따라서 재생이 가능한 흡착제의 탐구 또는 개발이 시급하다.
본 연구에서는 재생 가능한 생체흡착제로 발효공정에서 발생되고 있는 발효 폐기물인
본 연구에 사용된 biomass는 발효산업체에서 대량으로 발생하는
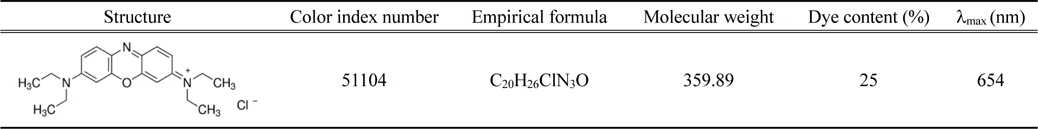
[Table 1.] General characteristics of Basic Blue 3
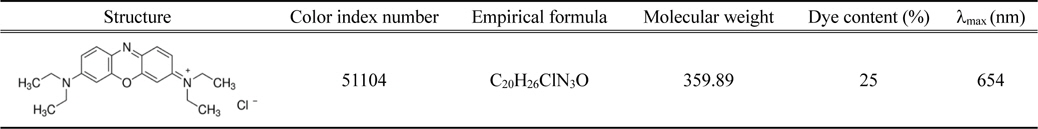
General characteristics of Basic Blue 3
DMF 100 mL에 9 g의 PS를 넣고 40 ℃에서 10시간 동안 용해하여 9% PS 용액을 제조하였다. 10% (w/v)
AM-PSBF를 제조하기 위하여, 400 mL formaldehyde와 800 mL formic acid의 혼합용액에 10 g의 PSBF을 넣고 6시간 동안 Eschweiler-Clarke 반응을 이용하여 다음과 같은 PSBF의 아민기가 메틸화된 AM-PSBF를 제조하였다. 제조된 AM-PSBF는 증류수로 여러 번 세척하였고 24시간 동안 동결건조하였다.
PSBF와 AM-PSBF의 BB3 흡착에 있어 최종 pH와 염료 흡착량 간의 관계를 알아보기 위하여 pH edge 실험을 수행하였다. 실험은 여러 개의 50 mL polypropylene conical tube에 50 mg/L의 염료수용액 30 mL와 흡착소재 0.01 g씩을 각 tube에 넣고 1 M HCl 또는 1 M NaOH을 이용하여 pH를 2에서 8까지 각각 다르게 조정하였다. 그리고 pH가 조정된 tube들은 25 ℃에서 24시간 동안 160 rpm으로 교반하였으며, 흡착실험이 진행되는 동안 각 tube의 pH는 일정하게 조절하였다. 흡착평형에 도달한 후 최종 pH를 측정하였으며, 분석샘플들은 9,000 rpm에서 5분간 원심분리 시킨 후 상등액만을 취하여 준비하였다. 분석샘플은 증류수로 적절히 희석하여 BB3의 최대파장인 654 nm에서 분광광도계(UVmini-1240, Shimadzu, Kyoto, Japan)를 이용하여 염료의 잔류농도를 분석하였다. 흡착소재에 흡착된 염료 흡착량(
여기서,
흡착 평형에 도달하는 시간을 확인하기 위하여 접촉시간에 따른 흡착량 변화를 평가하였다. 실험은 50 mL 비이커에 100 mg/L의 염료수용액 15 mL을 넣고 pH 8로 조정하였고, 다른 비이커에는 흡착제 0.01 g과 증류수 15 mL을 넣고 pH 8로 맞추었다. 이 두 수용액이 50 mL 비이커에 혼합되는 시점을
등온흡착실험은 아민의 메틸화가 최대흡착량에 미치는 효과를 알아보기 위하여 수행하였다. 등온흡착실험은 일정한 온도와 pH 조건에서 BB3의 농도만을 변화시켜 흡착제에 흡착되는 염료의 양을 측정하였다. 실험은 여러 개의 50 mL polypropylene conical tube에 흡착소재 0.01 g과 염료 초기 농도를 10 mg/L에서 200 mg/L으로 달리한 염료수용액 30 mL씩을 넣었다. 그리고 각 tube는 특정한 pH로 일정하게 조절하였고, 25 ℃에서 24시간 동안 160 rpm으로 교반하였다. 흡착 실험이 진행되는 동안 pH는 1 M HCl 또는 1 M NaOH을 이용하여 일정하게 조절하였다. 흡착평형에 도달한 후에 각 분석샘플들은 pH edge 실험과 동일한 방법으로 준비하였고 각 샘플의 염료농도를 분석하였다.
흡착실험은 30 mL의 염료 수용액(50 mg/L)에 흡착소재 0.01 g을 넣고 pH 8에서 24시간 동안 실시하였다. BB3 흡착 후, 흡착소재는 9,000 rpm으로 원심분리하여 상등액을 제거하였다. 상등액은 잔여 염료의 농도를 분석하는데 이용하였다. 탈착실험은 BB3를 흡착한 흡착제를 특정 pH로 맞춘 증류수 30 mL에 넣고 흡착실험과 동일한 조건에서 교반하였다. 탈착된 염료의 농도는 적당히 희석하고, 분광광도계를 이용하여 분석하였다. 탈착효율은 식 (2)를 사용하여 계산하였다. 또한, 흡착소재의 재사용 가능성을 평가하기 위하여 위에서 언급한 흡·탈착 실험을 반복적으로 총 4회 수행하였다.
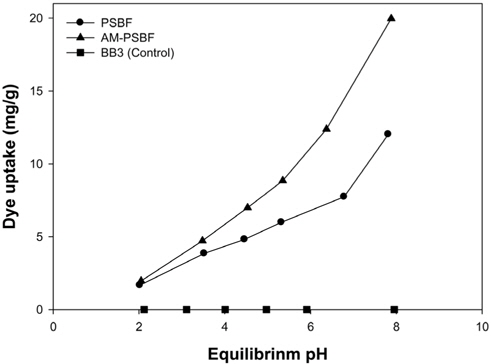
PSBF와 AM-PSBF에 의한 BB3 흡착에 있어 pH의 영향을 알아보기 위하여 pH edge 실험을 실시하였으며, pH edge 실험은 BB3 침전이 발생하지 않는 pH 2-8 영역에서 수행하였다. 그 결과는 Figure 1에 나타내었다. PSBF와 AM-PSBF 모두 pH가 증가할수록 흡착량이 증가하였고 pH 2에서는 두 흡착제간의 흡착량 차이는 미미하였다. 하지만 pH 3 이상에서는 AM-PSBF가 PSBF보다 높은 BB3 흡착량을 보였다. 이 결과는 PSBF에 함유된
PSBF와 AM-PSBF의 흡착량은 pH 7.8에서 12.02 mg/g와 19.97 mg/g으로 가장 높은 흡착량을 보였다. pH 6.3 부근에서 AM-PSBF의 흡착량은 12.38 mg/g으로 pH 7.8에서의 PSBF의 흡착량과 유사함을 알 수 있다. 이 결과는 염기성 염료 제거를 위한 흡착공정에서 AM-PSBF가 PSBF보다 보다 넓은 pH 범위에서 운전될 수 있음을 나타낸다.
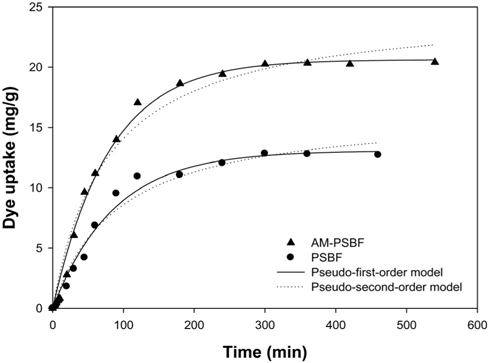
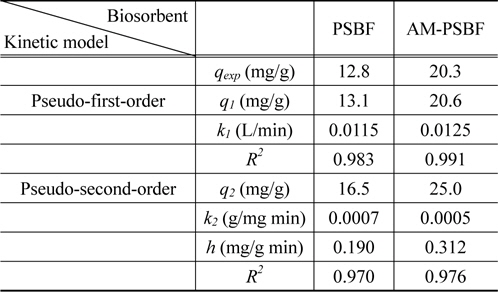
흡착속도는 흡착성능을 평가하는데 있어 중요한 인자 중 하나로 흡착공정을 설계하는데 중요한 정보를 제공한다[16]. 흡착속도론 실험은 PSBF와 AM-PSBF에 대하여 염료 흡착평형에 도달하는 시간을 평가하기 위하여 50 mg/L의 염료농도, pH 8 그리고 상온 조건하에서 실시하였다. 시간에 따른 PSBF와 AM-PSBF에 의한 BB3의 흡착결과는 Figure 2에 나타내었다. Figure 2에서 보는 것처럼, 염료의 흡착량은 초기에 급격하게 증가하다가 서서히 일정해지는 형태를 보였다. 특히, 흡착제에 흡착된 염료의 양 중 50%가 접촉시간 1시간 이내에 흡착되었으며 흡착평형은 5시간 이내에 도달함을 알 수 있었다.
BB3의 흡착속도를 파악하기 위하여 실험 데이터는 유사 1차 속도 모델식(pseudo-first-order kinetic model)과 유사 2차 속도 모델식(pseudo-second-order kinetic model)을 적용하여 묘사하였다. 유사 1차 속도 모델식과 유사 2차 속도 모델식은 다음과 같다.
여기서,
유사 1차와 2차 속도 모델식으로부터 산출된 매개 변수들과 초기 흡착속도(
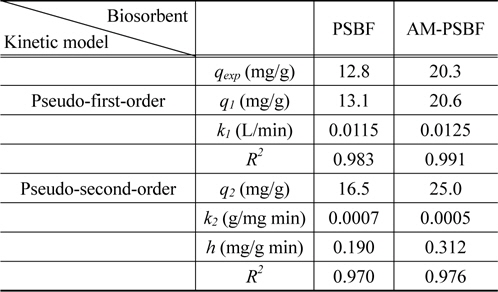
Biosorption kinetic constants obtained from pseudo-first-order and pseudo-second-order models
또한, 유사 1차 속도 모델식으로부터 산출된
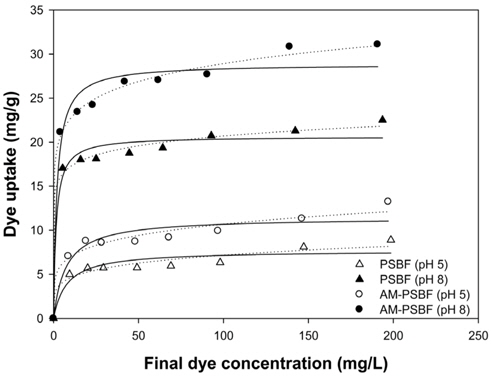
등온흡착(isotherm) 곡선은 흡착공정을 설계하는데 필요한 주요인자로 흡착제와 흡착질간의 흡착평형관계를 알 수 있다. 등온흡착실험은 PSBF와 AM-PSBF의 BB3에 대한 최대흡착량을 평가하기 위하여 pH 5와 8에서 실시하였다. 등온흡착 실험결과는 Figure 3과 같으며, 흡착량은 저농도에서 급격하게 증가하다가 고농도에서 서서히 일정해지는 일반적인 등온흡착곡선의 형태를 보였다. 그리고 PSBF와 AM-PSBF 모두 BB3 흡착은 예상했던 것처럼 더 높은 pH에서 높은 흡착량을 보였다. 또한, pH 5에 비해 pH 8이 등온흡착곡선의 초기 부분이 가파른 형태를 띠고 있으므로 이를 통해 더 높은 pH에서 흡착제에 대한 흡착질의 친화도가 높음을 예상할 수 있다.
등온흡착 실험결과는 2매개 변수 모델인 Langmuir 식과 Freundlich 식을 사용하여 묘사하였다. 이들 모델식은 일정 온도 하에서 흡착제에 흡착된 흡착질의 양과 수용액상에 남아있는 흡착질의 양간의 비선형 평형 관계를 묘사할 수 있다. 그리고 이 모델을 통해 흡착현상에 대한 메커니즘을 확인할 수는 없지만 실험적으로 구하기 어려운 최대흡착량을 예측할 수 있어 다양한 흡착제의 최대흡착량을 평가하는데 많이 사용된다. Langmuir 식과 Freundlich 식은 아래와 같이 나타낼 수 있다.
여기서,
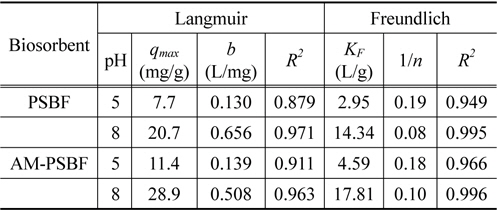
[Table 3.] Langmuir and Freundlich parameters for BB3 adsorption by PSBF and AM-PSBF at pH 5 and 8
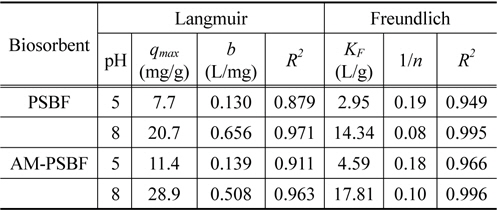
Langmuir and Freundlich parameters for BB3 adsorption by PSBF and AM-PSBF at pH 5 and 8
Freundlich 식에 적용한 결과, 결정계수(
Langmuir 식을 적용한 결과에 따르면, pH 5에서 PSBF와 AM-PSBF의 최대흡착량은 8.9 mg/g과 13.2 mg/g으로 AM-PSBF가 PSBF보다 약 1.5배 높은 최대흡착량을 보였다. pH 8에서도 AM-PSBF의 최대흡착량은 28.9 mg/g으로 PSBF의 최대흡착량 20.7 mg/g보다 증가하였다. 유사한 결과를 Bai et al.[19]은 formaldehyde 처리에 의해 아민기를 메틸화시킨
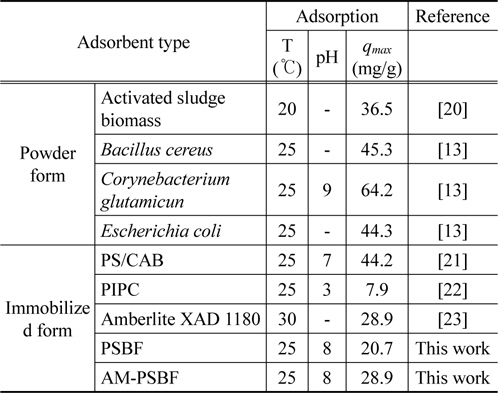
동일한 염료 BB3에 대한 다른 흡착제의 최대흡착량을 Table 4에 정리하였다. Chu and Chen[20]은
[Table 4.] Comparison of Basic Blue 3 uptake by different adsorbents
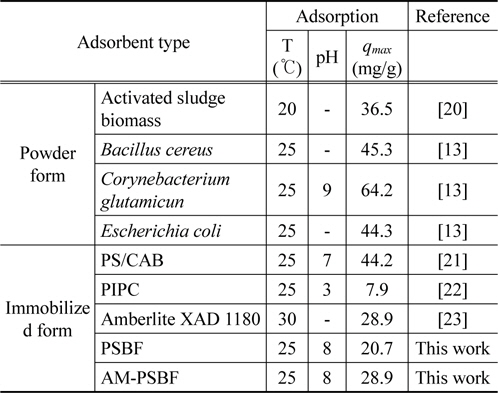
Comparison of Basic Blue 3 uptake by different adsorbents
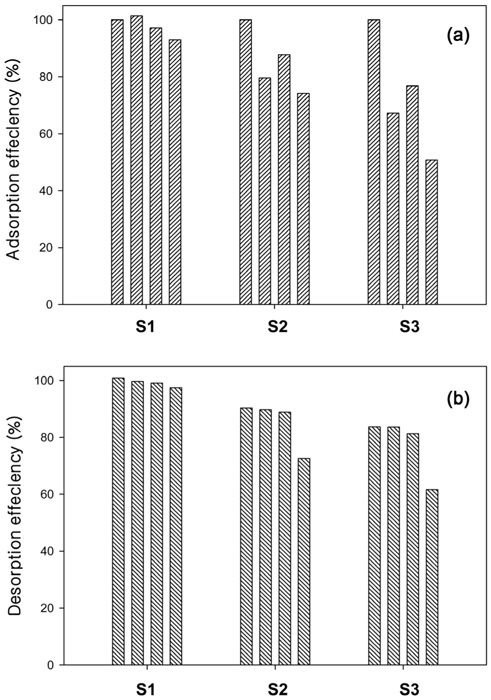
연구를 통해 개발된 흡착제가 실제 흡착공정에 응용되기 위해서는 염료흡착 후에 재생이 가능해야 하며, 재생방법 역시 손쉬워야 한다. 만약 흡착된 염료가 탈착되지 않는다면 흡착제의 일회성 이용에 따른 흡착공정의 운영비가 상승할 수 있고, 흡착공정에 사용된 흡착제는 소각과 같은 방법으로 2차적인 처리가 필요할 것이다[14,24]. 본 연구에서는 PSBF보다 우수한 BB3 흡착성능을 보인 AM-PSBF에 대해서 탈착 및 재사용 실험을 평가하였다. Figure 1에서 보듯이, AM-PSBF는 pH 8에서 가장 높은 BB3 흡착량을 보인 반면에, pH 2에서는 가장 낮은 BB3 흡착량을 보였다. 따라서 흡착실험은 pH 8에서 수행하였고, 탈착실험은 pH 1~3의 영역에서 실시하였으며, 반복적인 흡·탈착 실험은 총 4회 이루어졌다. 그 결과는 Figure 4(a)와 (b)에 나타내었다. 첫 번째 탈착효율을 살펴보면, pH 1에서 100%, pH 2에서 90.3%, pH 3에서 83.7%로 탈착 pH가 증가할수록 탈착효율은 감소하였다. 이는 pH edge 실험결과에서 알 수 있듯이, pH 2와 3에서도 일부의 염기성 염료가 AM-PSBF에 흡착되기 때문인 것으로 사료된다. 탈착 pH 1의 경우, 흡착효율은 4회 연속 90% 이상을 유지하였고, 탈착효율은 100%에서 97.4%로 다소 감소하였다. 이에 반해, 탈착 pH 2와 3은 흡·탈착 실험이 반복될수록 흡착효율과 탈착효율 모두 감소하는 경향을 보였으며, 탈착 pH 3에서 그 감소폭이 더욱더 두드려졌다. 탈착 pH 2와 3에서 4번째 탈착효율은 각각 72.6%와 61.6%이었다. 이 결과는 염료흡착 후에 간단히 pH를 조정함으로써 AM-PSBF를 재생할 수 있음을 나타낸다. 그리고 탈착 pH는 효과적으로는 pH 1이 선호되지만 탈착공정의 경제적인 측면에서는 pH 1~3 영역까지 고려할 수 있을 것이다.
본 연구에서는 염기성 염료 제거를 위한 흡착제로서 발효폐기물인
1) PSBF와 AM-PSBF에 의한 BB3 흡착은 수용액의 pH 변화에 민감하게 반응하였고, pH가 증가할수록 AM-PSBF가 PSBF보다 높은 흡착량을 보였다. 2) Langmuir 식에 따르면, pH 8에서 AM-PSBF의 최대흡착량은 28.9 mg/g으로 PSBF의 최대흡착량(20.7 mg/g)보다 약 1.4배 증가하였다. 3) 흡착속도론 실험을 통해 두 흡착제 모두 5시간 이내에 흡착평형에 도달하였으며, AM-PSBF는 PSBF보다 초기흡착속도가 증가하였다. 4) AM-PSBF는 연속적인 흡·탈착이 가능하였으며 흡·탈착 횟수가 증가할수록 흡·탈착효율이 다소 감소하는 경향을 보였다. 5) 흡착제에 존재하는 아민기를 메틸화시킴으로써 염기성 염료에 대한 흡착제의 흡착성능을 향상시킬 수 있었다.