Odontoclasts and osteoclasts resorb tooth root and alveolar bone, respectively. Many studies have focused on osteoclast formation in periodontitis, but effect of periodontitis on odontoclast formation is not clearly clarified. In this study, we observed formation of odontoclasts as well as osteoclasts in rats with ligature-induced periodontitis. To induce periodontitis, ligatures were placed around the first molars in left mandibles of rats. Rats were sacrificed at days 1, 3, and 10 after ligation. After tartrate resistant acid phosphatase (TRAP) staining in mandible section, the number of TRAP-positive odontoclasts and osteoclasts were histologically counted along the root and the alveolar bone surfaces of tooth, respectively. Odontoclasts increased until day 10 in mesial and furcation root surface, but did not increase in distal root surface. When compared odontoclast formation to osteoclast formation in mesial surface, osteoclasts peaked at day 3, and then decreased gradually, whereas odontoclasts were continuously increased until day 10. The number of odontoclasts was lower than that of osteoclasts before and after periodontitis induction. These indicate that periodontitis increased formation of odontoclasts as well as osteoclasts, but odontoclast formation occurs slower and weaker than that of osteoclasts.
상아질파괴세포(odontoclast)와 뼈파괴세포(osteoclast)는 경조직을 파괴하는 세포로 상아질파괴세포는 치아를, 뼈파괴세포는 골을 흡수한다1). 상아질파괴세포와 뼈파괴세포는 기원과 세포의 특성이 유사한 것으로 알려져 있다2). 조혈모세포에서 형성된 단핵의 뼈파괴세포 전구세포(osteoclast precursor)는 혈관을 통해 골 표면으로 이동하며 뼈모세포(osteoblast), 림프구 등 주변 세포로부터 생성되는 receptor activator of nuclear factor-kappa B ligand (RANKL)에 의하여 tartrate-resistant acid phosphatase (TRAP)를 발현한 후 융합하여 다핵의 뼈파괴세포로 분화한다. 뼈파괴세포는 골 표면에 부착한 후 양성자 펌프를 통하여 수소이온을 분비하여 골 표면의 pH를 낮추어 골 탈회를 일으킨다. 또한 matrix metalloproteinase를 분비하여 골의 유기물질을 분해하여 골을 흡수한다3).
상아질파괴세포는 영구치 맹출에 의한 유치의 치근 흡수와 교정력에 의한 치근 흡수에서 주요한 역할을 한다. 상아질파괴세포도 뼈파괴세포와 유사한 과정을 거쳐 형성되는 것으로 여겨지는데, Sahara 등2)은 상아질파괴세포도 조혈모세포로부터 유래된 상아질파괴세포 전구세포(odontoclast precursor)가 혈관을 통해 치아 표면으로 이동한 후 융합과정을 거쳐 형성될 가능성을 제시하였다. 골 표면의 뼈 모세포 뿐만 아니라 치아 주변의 치주인대세포, 상아질모세포와 시멘트질모세포도 RANKL을 생성한다4,5). 또한 뼈파괴세포 형성 유도인자인 RANKL이 상아질파괴세포의 분화에도 관여하는 것으로 보고되었다2).
치주염은 세균 감염에 의하여 야기되는 감염성 염증 질환으로 치아의 소실을 야기하는 치주분야의 중요한 질병 중 하나이다. 지금까지 치주염에서 치조골 흡수를 유도하는 뼈파괴세포 형성 기전에 대한 연구는 활발히 진행되어 온 것에 비해 상아질파괴세포 형성에 대한 연구는 없다. Crespo Abelleira 등6)과 Rodriguez-Pato7)는 치주염으로 발치한 치아의 치근면을 관찰하여 치주염 시 치근 흡수가 발생할 수 있음을 제시하였으나 치근 흡수에 중요한 역할을 수행하는 상아질파괴세포의 형성 정도는 관찰하지 않았다. 발표된 상아질파괴세포 형성에 대한 연구는 주로 발치한 유치, 교정력과 관련된 동물 모델에서 이루어져 왔으며8,9), 치주염 진행과정에서 일어날 가능성이 있는 상아질파괴세포의 형성변화에 관한 생체 내 연구결과는 아직 없다. 따라서 치주염 유발 쥐를 이용하여 치주염 유발 경과에 따른 상아질파괴세포의 형성을 뼈파괴세포의 형성과 비교하여 관찰하였다.
중앙실험동물(Seoul, Korea)에서 공급받은 6주령된 수컷쥐(Fischer 344)를 이용하였으며, 사육 cage에서 1주일간 적응시키고 물과 음식은 자유롭게 섭취시켰다. 사육장의 환경은 실내온도 23±2℃, 습도 55±5%로 유지하였고, 12시간 씩 명암을 조절하였다. 순화과정이 끝난 쥐에 Zoletin (Virvac S.A, Carros, France)과 Ketamine (Bayer, Seoul, Korea)을 섞어 만든 혼합 마취 액을 복강 내 주사하여 마취하였다. 마취 후 쥐의 하악 왼쪽 제1대구치 치경부에 치실을 묶어 치주염을 유발하였다(치주염군). 치실을 묶지 않은 하악 오른쪽 제1대구치를 대조군으로 설정하였다(대조군). 치주염을 유발시킨 날을 0일로 하였으며, 치주염을 유발한 날부터 1, 3, 그리고 10일 후에 쥐를 희생하였다. 각 군당 날짜 별로 12 마리의 쥐를 사용하였다. 치주염을 유발한 날로부터 쥐를 희생시킨 날까지 치실이 유지되어 있는지 확인하였고, 체중의 증가 정도와 사료 소비율 등을 실험 기간 동안 확인하였다. 본 실험은 연세대학교 의과대학 임상의학연구센터 윤리위원회의 승인(No. 2013-0235)을 받아 진행하였으며, 국제 Institutional Animal Care and Use Committee 규정의 동물실험관련 윤리과정을 준수하였다.
쥐를 희생시킨 후 하악을 적출하였다. 오른쪽과 왼쪽 하악을 분리한 후 10% 중성 포르말린에서 1주일간 고정하고 10% ethylenediaminetetraacetic acid에서 2달간 탈회하였다. 탈회된 하악을 파라핀에 포매 한 후 4 μm 두께로 슬라이드 절편을 제작하였다. 제1대구치의 근심과 원심 치근의 치수가 가장 잘 보이는 절편을 선택하여 TRAP 염색을 시행하였다.
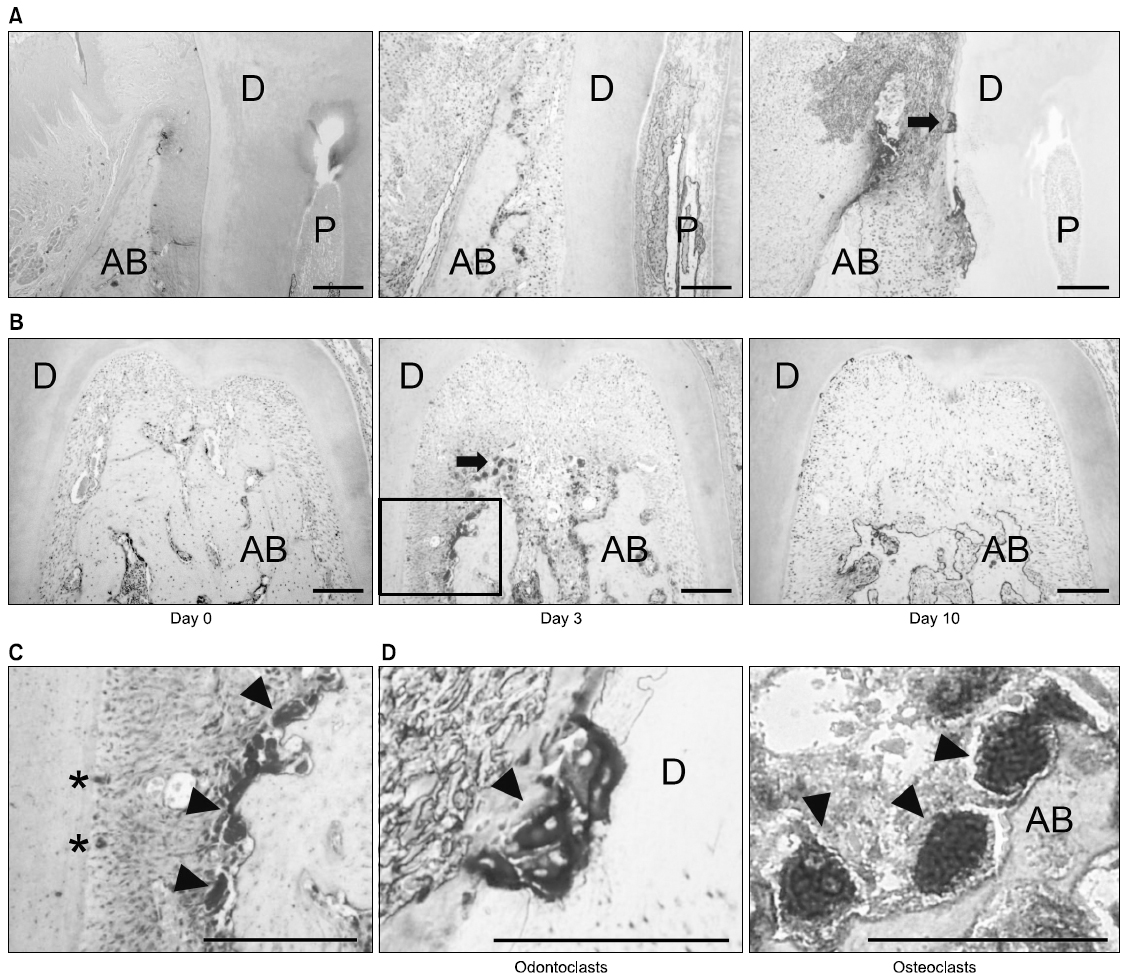
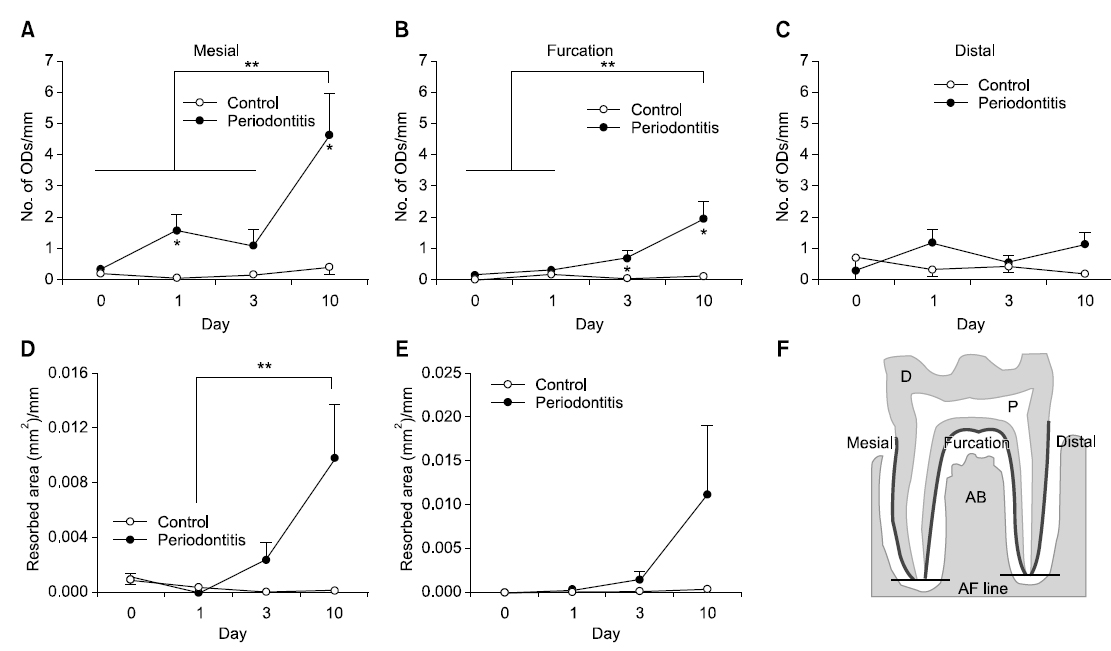
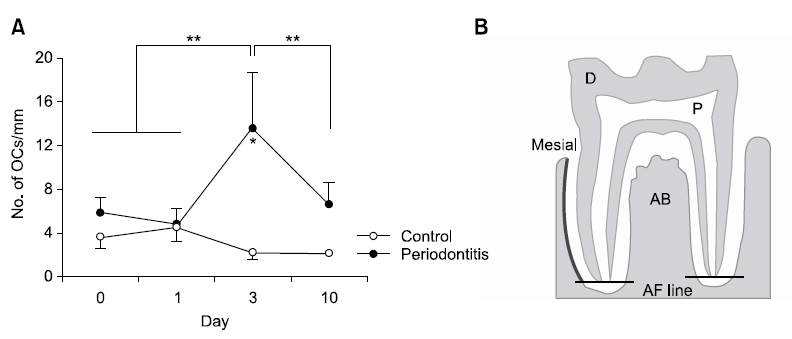
상아질파괴세포와 뼈파괴세포의 형성은 이들 세포의 표식인자인 TRAP에 대한 염색을 실시한 후 TRAP 양성 다핵세포의 수를 세어 평가하였다. TRAP 염색은 TRAP 염색 kit (Sigma-Aldrich, St. Louis, MO, USA)를 이용하여 kit에 기재된 염색과정을 지켜 실시하였다. 탈파라핀과 함수과정을 거친 슬라이드를 고정액(citrate 용액 25 ml, acetone 65 ml, 37% formaldehyde 8 ml)에 30초간 담근 후 흐르는 물에 10분 동안 수세하였다. 37℃ 증류수 45 ml, fast garnet GBC 용액 0.5 ml, sodium nitrite 용액 0.5 ml, naphthol AS-BI 0.5 ml, acetate 용액 2 ml, tartrate 용액 1 ml를 혼합한 용액을 슬라이드 글라스에 떨어뜨린 후 평균 16시간 정도 37℃ humid chamber에서 반응시켰다. 그 후 100% 알코올에 수세하고 대조염색을 위해 1시간 동안 methyl green으로 염색하고 봉입하였다. 광학현미경을 이용하여 제1대구치의 치근을 따라 형성된 TRAP 양성 다핵의 상아질파괴세포(핵 3개 이상)와 치조골 표면을 따라 형성된 TRAP 양성다핵의 뼈파괴세포(핵 3개 이상)의 수를 세었다. 상아질파괴세포는 근심 치근면(mesial root surface), 이개 치근면(furcation root surface), 원심 치근면(distal root surface)으로 각각 나누어 세었으며, 뼈파괴세포는 근심 치조골면(mesial alveolar bone surface)에서 수를 세었다. 세포의 수는 측정한 치근면의 길이 또는 치조골 표면의 길이로 나누어 나타냈다(세포 수/mm).
TRAP 염색을 시행한 슬라이드에서 치근의 흡수가 일어난 부위의 사진(400배율)을 광학 현미경으로 촬영한 후 ImagePro software (Media Cybernetics, Silver Spring, MD, USA)를 사용하여 흡수된 치근 표면의 면적을 측정하였다. 흡수면적은 측정한 치근면의 길이로 나누어 나타내었다(흡수면적/mm).
본 연구에서는 통계분석을 위해 SPSS ver. 12.0 (SPSS Inc., Chicago, IL, USA)을 이용하였다. 치주염에 의한 상아질파괴세포와 뼈파괴세포의 수, 치근의 흡수 정도를 알아보기 위하여 one-way ANOVA 및 Tukey’s test를 실시하였다. 통계적 유의성 평가를 위한 유의 수준은 0.05를 기준으로 하였다(p < 0.05).
TRAP 염색 후 광학 현미경으로 치주염 유발 전(0일), 치주염 유발 후 3일과 10일에 제1대구치 근심면과 치근 이개부위의 치근 흡수와 치조골 흡수를 관찰하였다. 치조골 면적은 치주염 유발 전과 비교하여 치주염 유발 후 3일과 10일에 감소하는 양상을 보였다(Fig. 1A, B). 치근면 면적의 변화는 치주염 유발 10일 후에 관찰되었으나 치조골 면적의 변화만큼 뚜렷하지 않았다. 치근면과 치조골 표면에서 붉은 색으로 염색된 TRAP 양성 다핵의 상아질파괴세포와 뼈파괴세포가 각각 관찰되었으며, 뼈파괴세포가 상아질파괴세포보다 많이 관찰되었다(Fig. 1C, D).
2. 치주염 유발에 따른 상아질파괴세포 형성과 치근 흡수
제1대구치의 근심 치근면에서 상아질파괴세포의 수는 치주염 유발 전(0일)과 비교하여 치주염 유발 후 1일과 3일에 증가하는 경향을 나타내었으며 10일에는 유의적으로 증가하였다(Fig. 2A). 이개 치근면에서도 상아질파괴세포의 수는 치주염 유발 후 10일에 유의적으로 증가하였다(Fig. 2B). 그러나 원심 치근면에서는 상아질파괴세포 수는 치주염 유발 전과 후에 차이를 나타내지 않았다(Fig. 2C). 근심 치근면의 치근면 흡수 면적(resorbed area)은 치주염 유발 후 10일에 유의적으로 증가하였으며 이개 치근면에서도 증가하는 경향이 관찰되었다(Fig. 2D, E).
상아질파괴세포의 수와 치근면 흡수의 증가가 제1대구치의 근심 치근면에서 가장 뚜렷하게 나타났으므로 근심 치조골의 뼈파괴세포의 수를 세었다. 뼈파괴세포의 수는 치주염 유발 전과 비교하여 치주염 유발 후 3일에 유의적으로 증가하였으며 10일에는 감소하였다. 치주염 유발 후 3일의 뼈파괴세포의 수는 1일과 비교하였을 때 유의적으로 증가하였고, 10일에는 3일의 뼈파괴세포 수보다 뚜렷하게 감소하였다(Fig. 3A). 대조군에서는 날짜 별 뼈파괴세포의 수는 비슷하였으며, 변화를 보이지 않았다.
본 연구팀은 치주염 동물 모델을 이용하여 치주염 시 뼈파괴세포 형성뿐만 아니라 상아질파괴세포의 형성도 증가하며 상아질파괴세포가 증가하는 양상이 뼈파괴세포와 차이가 있음을 관찰하였다.
뼈파괴세포의 형성은 근심 치조골에서 치주염 유발 3일까지 증가한 후 감소하였다. 본 연구팀10,11)은 이전 연구에서 치근 이개와 원심에서 근심과 동일한 양상의 뼈파괴세포 증가 양상을 보고하였다. 상아질파괴세포 형성은 뼈파괴세포 형성과 다르게 근심과 이개 부위의 치근면에서 증가하였으며 치주염 유발 후 10일이 되어야 유의적으로 증가하였다. 또한 근심면에서 상아질파괴세포의 수는 치주염 유발 전(1개 미만/mm)과 후(5개 미만/mm) 모두 뼈파괴세포(4개 미만/mm, 12개/mm)와 비교하여 적었다. 이들 결과는 치주염 유발 시 상아질파괴세포 형성이 뼈파괴세포와 동일하게 증가하지만 뼈파괴세포보다는 서서히 약하게 진행된다는 것을 시사한다.
Crespo Abelleira 등6)은 치주염 외의 이유로 발치한 치아(7개)와 치주염으로 발치한 치아(67개)에서 치근 흡수를 관찰하였다. 치근 흡수는 2개의 건강한 치아와 66개의 치주염이 있는 치아에서 관찰되었으며 치근 흡수 위치는 건강한 치아에서는 치근 단 쪽에서만, 그리고 심한 치주염을 보이는 치아에서는 치근단 뿐만 아니라 치은 쪽에서도 관찰되었으며, 이러한 결과를 통해 치주염이 있는 경우 치근 흡수가 일어나며 치근 흡수 정도는 염증과 관련이 있음을 제시하였다. 본 연구에서도 근심에서 치조골 흡수가 증가할수록 치근 흡수가 증가함을 관찰할 수 있었으며 이는 치주염이 심한 경우 치조골 흡수뿐만 아니라 치근 흡수도 함께 유발될 수 있음을 시사한다.
상아질파괴세포와 뼈파괴세포의 형성은 크게 두 과정으로 나뉜다. 혈액 내 상아질파괴세포 전구세포와 뼈파괴세포 전구세포의 치근 또는 치조골 표면 이동 과정과 이동한 전구세포의 융합과 활성화 과정이다2). 상아질파괴세포의 형성이 뼈파괴세포보다 서서히 증가하며, 적은 세포 수를 나타나는 것은 위의 세포 과정 중 어느 과정의 차이에 의한 것인지는 명확히 밝혀져 있지 않다. Oka 등12)은 세포배양법을 이용하여 치근의 시멘트질모세포가 발현하는 F-spondin이라는 물질이 상아질파괴세포 전구세포의 이동을 억제하며 뼈파괴세포 분화 유도인자인 RANKL에 의한 뼈파괴세포 형성을 억제하는 것을 관찰하여 백악질에 존재하는 F-spondin이 치근 흡수가 일어나지 않도록 치근을 보호할 가능성을 제시하였다. 그러나 이 결과는 상아질파괴세포 전구세포가 아닌 뼈파괴세포 전구세포를 배양하는 방법을 통해 얻은 결과이므로 앞으로 이를 확인할 수 있는 생체 내 연구가 필요하다고 판단된다.
치주연구 분야에서 사용되어 온 동물 모델 중 치주염 유발 동물 모델은 치주염에 의해 나타나는 뼈파괴세포 형성기전을 밝히는 데 유용하게 사용되어 왔다10,11,13). 본 연구는 치주염 동물 모델에서 뼈파괴세포 형성뿐만 아니라 상아질파괴세포 형성도 일어나며 이들 세포 형성에 차이가 있음을 확인하여 치주염 동물 모델이 이들 세포의 형성 기전의 차이점 연구에 유용하게 사용될 수 있음을 제시하였다. 본 연구에서 사용한 치주염 동물 모델은 사람에서의 치주염 상황과 직접적으로 연관시켜 결론 내리기에는 한계가 있으나 치주염 동물 모델을 통하여 축적된 본 연구와 같은 기초 연구결과들은 치주염에 의한 골 흡수와 그에 관여하는 세포들에 대한 전반적인 지식에 활용될 수 있을 것이다. 뿐만 아니라 상아질파괴세포 혹은 뼈파괴세포에 의해 동반되는 치근 또는 치조골 흡수를 억제할 수 있는 약물의 개발 등에도 유용하게 사용될 수 있을 것으로 기대한다.