Although tobacco use has been known as one of the biggest risk factors on periodontal health, little is known about the effect of smoking cessation on it. The aim of this study was to investigate the change of concentration of matrix metalloproteinase (MMP)-8, MMP-9 and interleukin (IL)-1β in gingival crevicular fluid (GCF) of 11 quit-smokers for 1 year after smoking cessation. Eleven male subjects to maintain quit-smoking for 1 year participated the oral examination, GCF and saliva collection without periodontal treatments at baseline, after 2 weeks, 2 months, 4 months, 6 months and 1 year. To confirm quit-smoking, nicotine and cotinine concentrations in saliva were measured by high performance liquid chromatography. MMP-8, MMP-9 and IL-1β concentrations in GCF of upper anterior teeth area were measured by enzyme-linked immunosorbent assay. Change of MMP-8 in GCF during smoking cessation showed fluctuation with decrease (5 subjects) or increase (2 subjects) or maintenance tendency (4 subjects). Changes of MMP-9 were decrease (6 subjects), or increase (2 subjects), or maintenance (3 subjects). Change of IL-1β also showed fluctuation with decrease (5 subjects) or increase (3 subjects) or maintenance tendency (3 subjects). The subjects with increase tendency had the relatively smaller amount concentration of MMP-8 and MMP-9 at the baseline. It was unclear smoking cessation without periodontal treatment could affect MMP-8, MMP-9, and IL-1β in GCF. Fluctuation of periodontal biomarkers during smoking cessation might result from feedback interaction between environmental factors and periodontal cells.
치주질환은 박테리아에 의해 시작되지만 여러 원인에 기인한 만성 염증성 질환이며, 저작기능 상실, 심미기능 상실, 치아발거, 삶의 질 저하, 사회불평등 심화, 공중보건비용 상승 등을 일으키는 흔한 질환이다1). 흡연과 치주염과의 관계는 수백 편의 연구를 통해 입증되었으나 비흡연자들에 비해 흡연자들의 불결한 구강위생상태, 낮은 사회경제적 지위, 스트레스 등은 혼란요인으로 작용해서 흡연이 치주건강에 미치는 효과는 정확하게 판단하기 어렵다2).
그럼에도 불구하고 흡연에 의한 조직의 변화 기전은 세포 실험과 동물 실험을 통해 분자 단계에서 밝혀지고 있다3). 흡연에 의한 활성산소는 상피세포의 세포내 signaling을 활성화하여 염증관련 유전자를 활성화한다4). 흡연은 보조 T세포 1형 반응을 억제하고 보조 T세포 2형 반응을 촉진함으로써 치주조직의 안정성을 저해해서 치주질환이 진행되도록 한다5,6). 또한 흡연은 직접적으로 상피세포를 자극해서 chemokine과 염증인자를 분비하게 유도하기도 하고7), 호흡기 계통에서는 기관지에서 점막 섬모의 유동성을 감소시키고 점액 분비를 촉진하여 지속적인 점막상피의 활성화를 가져와 항균작용을 저해한다4). 흡연은 NF-ᴋB를 활성화시켜 염증성 chemokine, 스테로이드에 대한 내성, 병원성 세균에 대한 반응, 세포사 조절 등의 변화가 일어나게 된다는 연구도 있다8). 흡연이 유도한 만성염증은 감염 조건에 대한 감소된 급성반응을 나타나게 하는 것 같다고 하며3), 치주질환에서도 니코틴이 혈관수축작용을 하여 치주염증의 징후를 감추고9) 흡연자는 치면세균막지수와 치은출혈지수가 비흡연자에 비해 더 약한 관계를 나타낸다10). 실험치은염 모형에서도 흡연자의 경우 치은지수가 1주차를 기점으로 감소되어 시진상 치은염이 억제되어 보였다11).
Matrix metalloproteinase (MMP)는 조직발생, 성장, 정상적인 조직의 교체 등에서 세포외 기질과 기저막을 분해하는 효소이며 정상적인 조건에서는 농도가 매우 낮지만 염증, 암발생, 전이 등에서는 농도가 유의하게 높아지고 구강조직파괴에 있어서도 MMP는 중요한 역할을 한다12). 이 중 콜라겐분해효소인 MMP-8은 치주염, 임플란트주위염의 대표적 바이오마커13)로 중성구, 치은열구상피세포, 섬유모세포, 대식세포 등에서 유도될 수 있다13). MMP-8의 경우 단일항체기법을 활용한 진료실 dip-stick test로 치주염 진단키트도 개발되어 있다14). MMP-9는 MMP-8과 동반하는 효소로 치주염의 대표적인 콜라겐 분해효소이다12). Interleukin(IL)-1β는 염증전 cytokine 중 현재까지 가장 연구가 많이 이루어져있으며 MMP를 통하여 연조직을 파괴하고 골흡수를 유도한다15).
본 연구는 흡연이 치주조직에 미치는 영향을 파악하기 위해서 흡연자 11명이 금연 시작 후 1년간의 치은열구액 내 MMP-8, MMP-9, IL-1β의 농도변화를 관찰하여 사례 보고하고자 한다.
본 연구는 건양대학교 임상시험윤리시험위원회(KYUH 9-25)에서 연구승인을 받았다. 2009년 9월부터 2010년 2월까지 대전 서구보건소, 서구 관저보건지소, 건양대학교 금연클리닉에 자발적으로 참여한 대상자들에게 연구동의를 얻고 연구를 시작하였다. 금연만을 변화요인으로 개입하기 위해서, 1년간 치과방문을 금하였고 연구대상자의 구강환경관리 교육을 하지 않고 이전의 상태대로 유지하도록 하였기 때문에 연구대상자의 선정기준은 다음과 같았다. 1) 진행 중인 치아우식증이 없을 것, 2) 실험 시작 시점 시 치주낭이 5.5 mm 이상 되지 않을 것, 3) 전체 치아수가 20개 이상일 것, 4) 조절되지 않는 전신질환이 없을 것, 5) 실험 시작 3개월 이내에 지속적인 항생제, 소염제 복용이 없을 것.
실험 도중 중도 탈락 기준은 다음과 같았다. 1) 실험 도중 의과적 또는 치과적 치료가 필요한 경우, 2) 실험 도중 항생제나 소염제 복용이나 항생 작용이 있는 양치액 사용이 발생한 경우, 3) 자의적으로 실험중단 의사를 밝힌 경우.
최초 금연대상 연구참여자는 총 122명이었으나, 연구과정 중 중도탈락한 대상자가 70명이며 1년간 추구조사된 52명 중 내소 시점 6회(기초 시점, 2주, 2개월, 4개월, 6개월, 12개월 시점)에 모두 방문한 금연대상자는 26명이었다. 그러나 금연대상자가 연구과정에 지속적으로 참여하였다고 하더라도 1년간 지속적으로 금연이 유지된 대상자는 11명에 지나지 않았고, 15명은 금연과 흡연이 중도에 반복이 되었다. 따라서 본 연구에서는 금연을 유지한 11명의 자료만을 분석하여 사례 보고한다.
1) 구강검사
구강검사는 치면세균막지수 검사, 치은지수 검사, 탐침시 출혈, 치주낭 측정을 실시하였다. 지속적인 구강검사는 치면세균막관리에 영향을 끼칠 것으로 생각되어 현존 치아의 협설면을 Turesky modification of the Quingley-Hein index를 이용하여 치면세균막지수 변화 검사를 하였으며, 치면세균막검사시점을 일정하게 하고자 비슷한 시간대에 내원하게 하였다. 치은지수 Silness-Loe index를 사용하였고 탐침은 WHO probe를 사용하였다. 치은지수, 치주낭, 탐침시 출혈은 근심협면, 중앙협면, 원심협면, 근심설면, 중앙설면, 원심설면 6부위를 검사하였다.
2) 타액 및 치은열구액 채취
타액은 금연여부를 구두보고하기는 하나 객관적으로 검증하고자 내소시점마다 비자극성 타액으로 2∼4 ml 정도 수집하여 −70℃에서 보관하다가 2011년 1월에 인제대학교 의과대학 약리학교실에 의뢰하여 니코틴, 코티닌, OH-코티닌 농도를 분석하였다16). 타액 내 니코틴 농도분석은 high performance liquid chromatography법을 이용하였다. 시료는 Phenomenex Synergy MAX RP 80 (150×4.6 mm; Phenomenex Inc., Torrance, CA, USA)이 장착된 Applied Biosystems API-4000 LC MS/MS (Applied Biosystems, Foster, CA, USA)를 사용하여 분석하였고 이동상은 20% ammoniumacetate buffer (pH 6.8)와 80% methanol을 사용하였다. 니코틴 분석은 nicotine-methyl-D3 (Sigma Aldrich, St. Louis, MO, USA)를 사용하였다.
흡연이 악궁 중 상악에 더 영향을 미친다는 선행된 연구결과17,18)에 따라 치면세균막을 제거하고 방습한 후 상악전치부 치간 사이 다섯 부위에서 치은열구액을 각각 paper point #25번으로 1분간 흡습시켰다. 치은열구액은 −70℃에서 보관하다가 2012년 Human IL-1β enzyme-linked immunosorbent assay (ELISA) Kit (Promokine, Heidelberg, Germany), Quantikine human MMP-8 (R&D Systems, Minneapolis, MN, USA), Quantikine human MMP-9 (R&D Systems)를 이용하여 ELISA로 치은열구액의 IL-1β, MMP-8, MMP-9의 농도를 측정하였다. 각 표본은 두 번 반복 실험한 후 각 표본의 대표값으로는 반복실험의 평균값을 사용하였다.
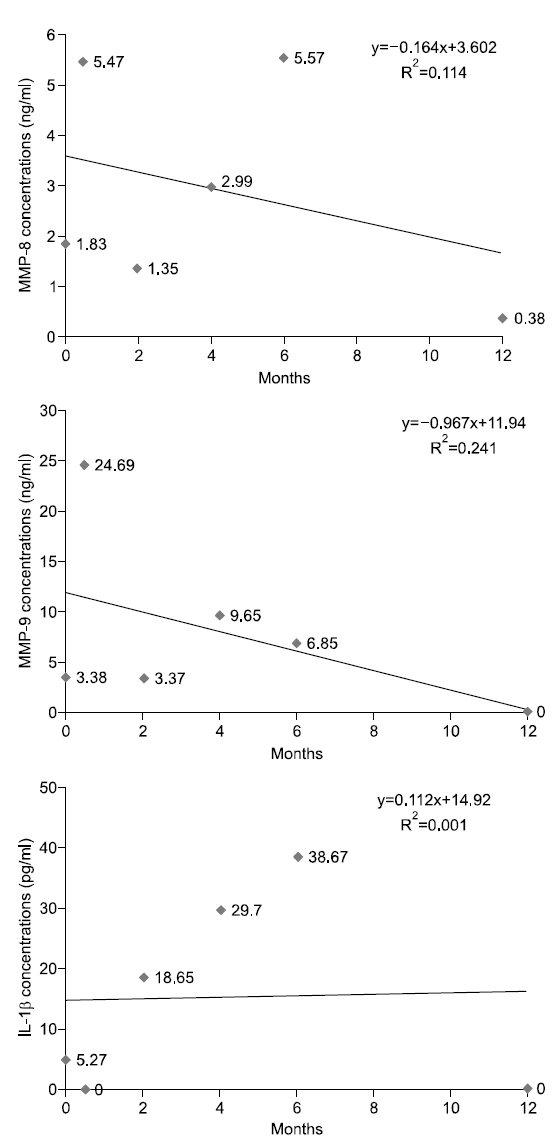
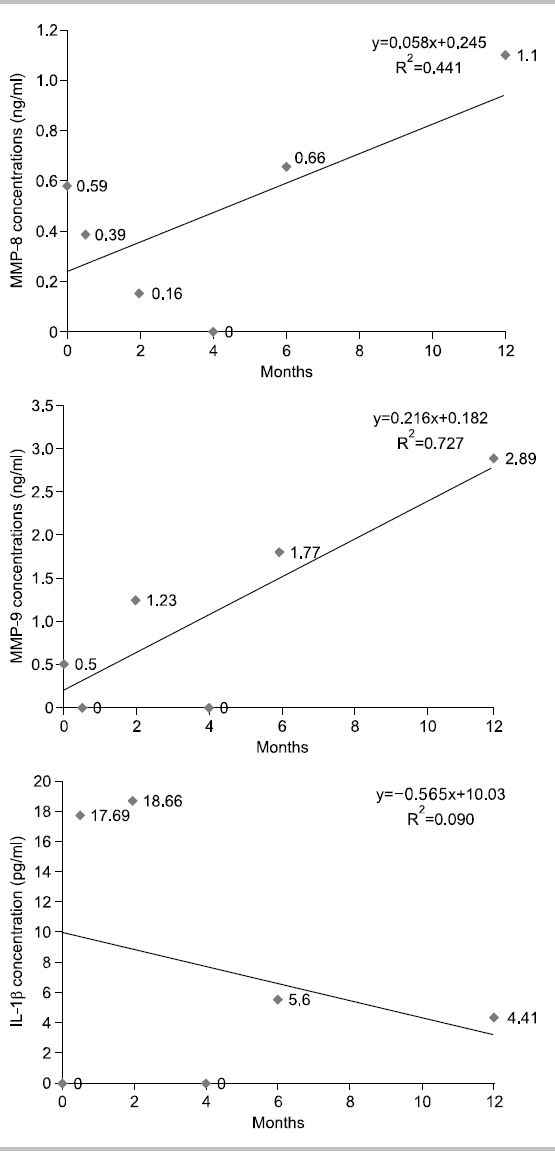
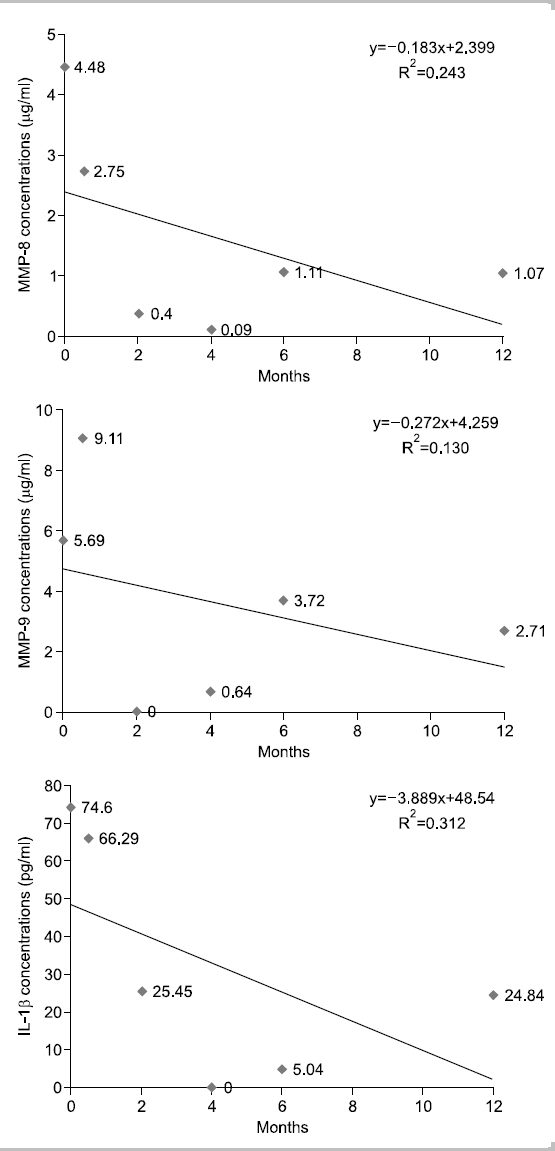
대상자 A는 1955년생으로 35년간, 1일 평균 30개비 흡연을 하였고 이전 금연시도 경험은 있다. 음주는 주 5회, 1일 평균 소주 4잔 정도이며, 구강상태는 진행되는 우식은 없고 총 치아수는 30개이며, 기초 시점에 상악전치부에서 천치주낭이 3부위 탐지되었으나 2주 후 시점부터는 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 7.45 ng/ml로 내소 1주일 전부터 금연을 시도하였으며, 2주 후 시점부터는 지속적으로 니코틴 농도가 0 ng/ml으로 나타났다. 상악전치부의 평균 치면세균막지수는 시기별로 0.5, 0.75, 1.17, 1.17, 1, 0점으로 구강환경관리가 양호하였다. 치은지수의 경우에는 0∼0.14점으로 거의 변화가 없었다. Fig. 1에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9의 농도는 시점에 따라 오르내림 현상이 보였으나 전체적인 추세는 감소하였고, IL-1β의 농도는 6개월 시점까지는 증가하는 추세였으나 1년 시점에서는 검출되지 않았다.
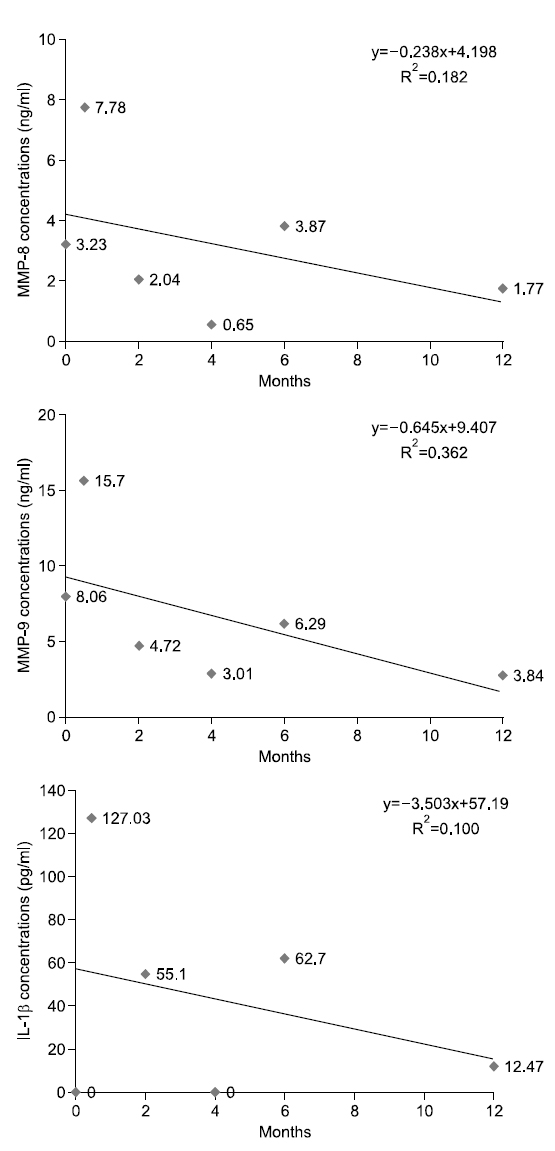
대상자 B는 1973년생으로 14년간, 1일 평균 10개비 흡연을 하였고 이전 금연시도 경험은 없다. 음주는 주 1회, 1일 평균 소주 7잔 정도이며, 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점부터 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 1.73 ng/ml로 내소 3일 전부터 금연을 시도하였으며, 1개월 후 시점부터는 니코틴 농도가 0 ng/ml으로 나타났다. 상악전치부의 평균 치면세균막지수는 시기별로 0.33, 0.83, 0.67, 0.67, 0.92, 0.42로 구강환경관리가 양호하였다. 치은지수의 경우에는 기초 시점은 1.03으로 경미치은염으로 관찰되다가 4개월 시점부터 정상치은으로 판정되었다. Fig. 2에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9, IL-1β의 농도는 시점에 따라 오르내림 현상이 보였으나 전체적인 추세는 감소하였다.
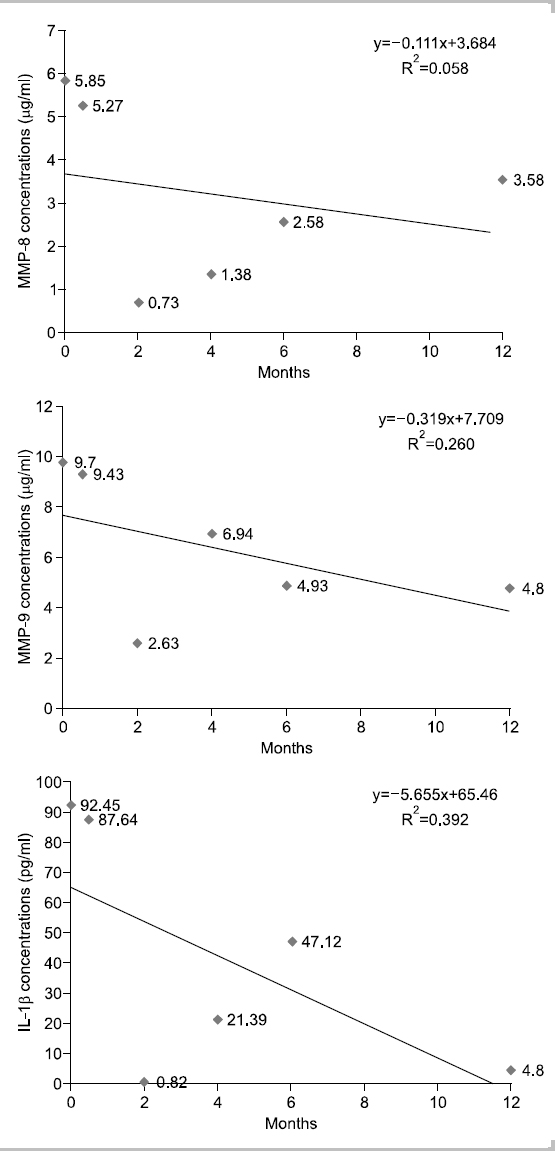
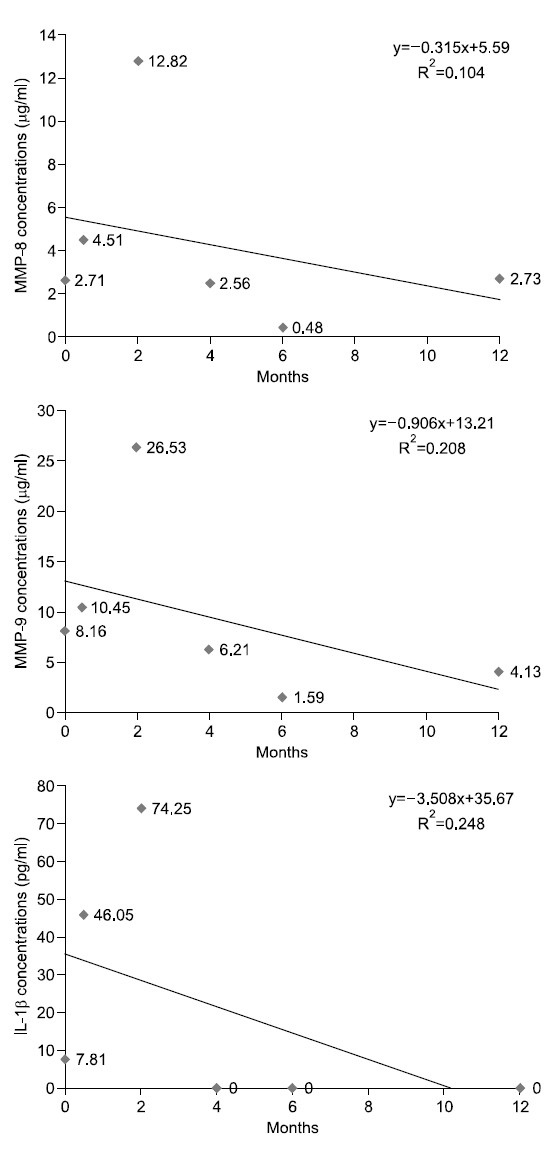
대상자 C는 1953년생으로 30년간, 1일 평균 20개비 흡연을 하였고 이전 금연시도 경험은 있다. 음주는 주 2∼3회, 1일 평균 소주 3잔 정도이며, 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초시점 47 ng/ml였고 2주 후 2.18 ng/ml, 2개월 후 1.41 ng/ml, 4개월 후부터는 0 ng/ml를 나타내었다. 금단증상을 막기 위해 필요시 니코틴 패치를 1개월간 사용하였다. 상악전치부의 평균 치면세균막지수는 1.08, 1, 1.08, 1.33, 0.67. 0.5점으로 구강환경관리가 양호하였다. 치은지수는 기초시점부터 6개월 시점까지는 정상치은이었으나 12개월 시점에 0.36으로 관찰되었다. Fig. 3에서 보는 바와 같이, 치은열구액 내 MMP-9의 농도만이 시점에 따라 오르내림 현상이 보이면서 전체적인 추세는 감소하였다.
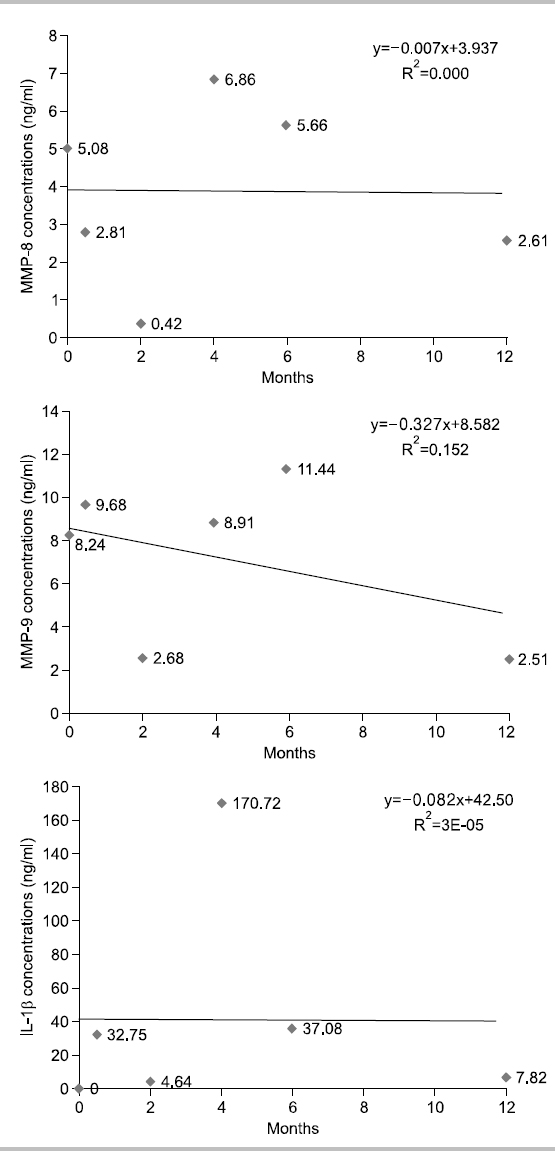
대상자 D는 1960년생으로 30년간, 1일 평균 1∼2개비 흡연을 하였고 이전 금연시도 경험은 있다. 음주는 거의 안하고, 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초시점 5.24 ng/ml였고 2주 후부터는 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 1.33, 1.42, 2.33, 1.58, 1.67, 1.33점으로 치은연 상에 점상 또는 선상의 치면세균막이 관찰되었다. 치은지수는 기초시점에 정상치은이었다가 2개월 시점에 경미 치은염 증상이 나타났다가 다시 회복되었다. Fig. 4에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9, IL-1β의 농도가 시점에 따라 오르내림 현상이 보이면서 전체적인 추세는 감소하였다.
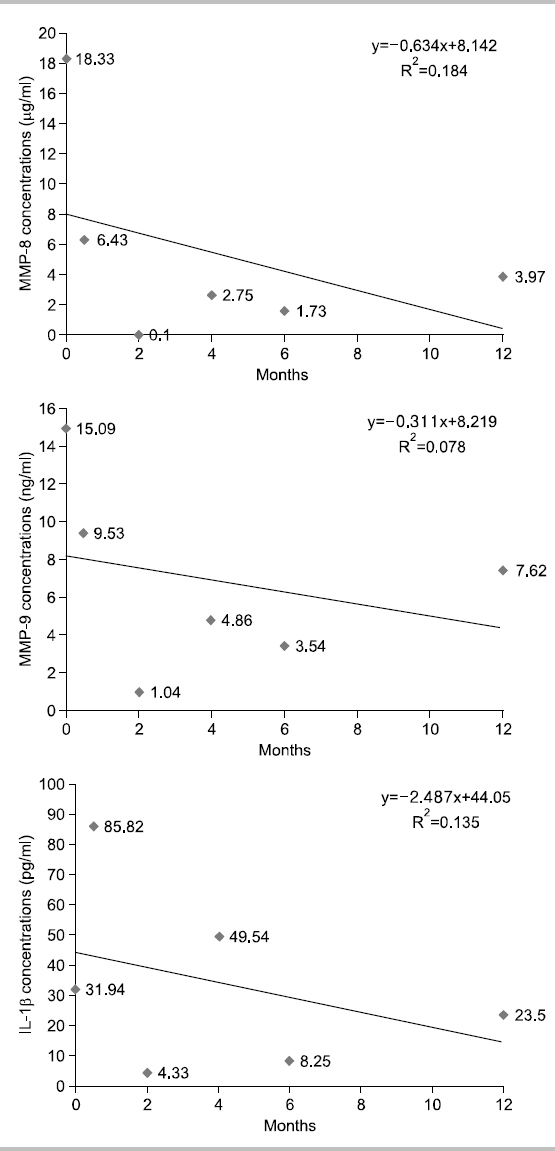
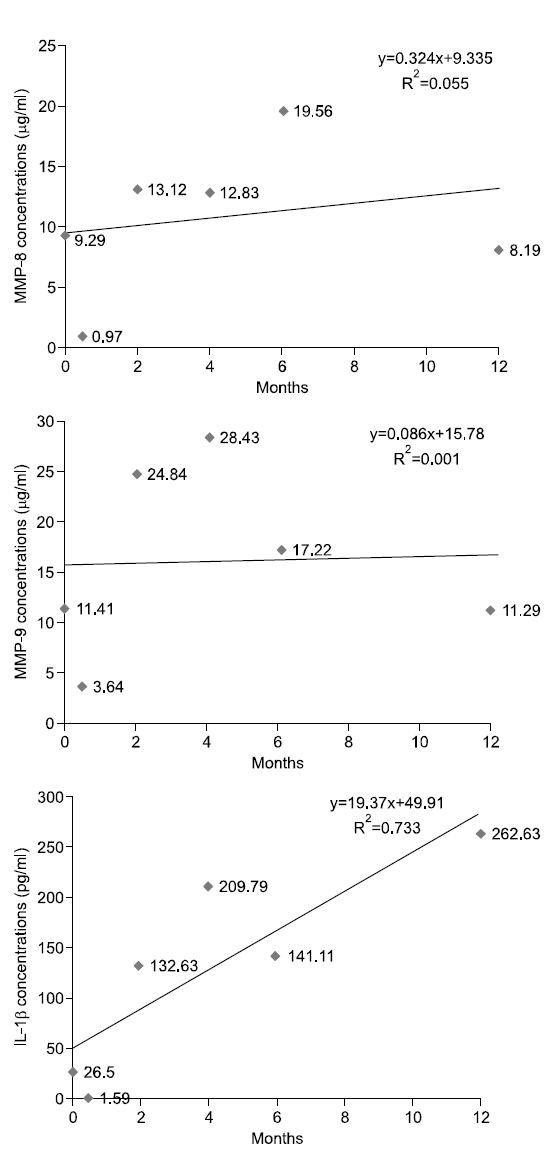
대상자 E는 1956년생으로 35년간, 1일 평균 20개비 흡연을 하였고 이전 5.3년간 금연한 경험이 있다. 음주는 주 1회, 1일 평균 소주 14잔 정도이며, 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 49.6 ng/ml였고 2주 후 37.7 ng/ml, 2개월 후 60.2 ng/ml, 4개월 후 0 ng/ml, 6개월 후 0 ng/ml, 12개월 후 0 ng/ml였고 금연 6주차까지 니코틴 패치를 장착하고 있었다. 따라서 니코틴 패치로 인한 니코틴 흡수에 의해 타액내 니코틴 농도가 2개월 차까지 유지된 것으로 보고 본인 보고와 동일하게 금연을 유지하는 것으로 판단하였다. 상악전치부의 평균 치면세균막지수는 시기별로 0.75, 0.33, 0.83, 0.83, 0.67, 0.08이었으며 치면세균막관리는 양호하다고 판단되었다. 치은지수는 0, 0, 0, 0, 0.22, 0.22로 관찰되었다. Fig. 5에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9의 농도가 시점에 따라 확실한 증가추세를 보였고, IL-1β는 감소되는 추세이나 설명력이 낮았다.
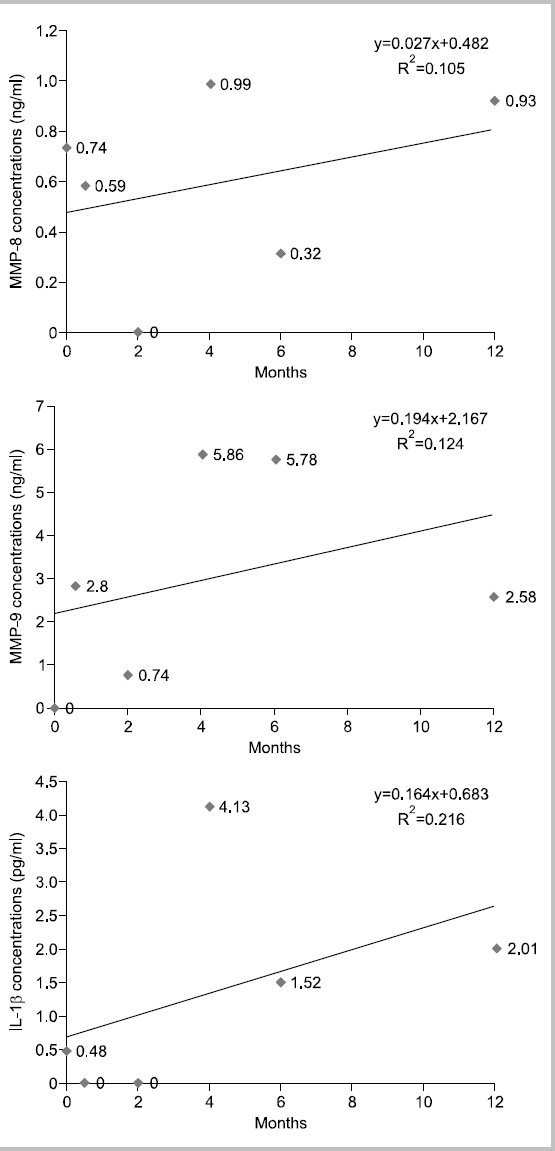
대상자 F는 1962년생으로 30년간, 1일 평균 10개비 흡연을 하였고 이전 금연시도 경험은 없다. 음주는 거의 하지 않으며, 구강상태는 진행되는 우식은 없고 총 치아수는 27개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 4.66 ng/ml였고 2주 후부터는 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 1.33, 0.67, 0.83, 0.83, 0.83, 0.83점이었다. 치은지수는 지속적으로 정상치은으로 관찰되었다. Fig. 6에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9, IL-1β의 농도가 시점에 따라 오르내림 현상이 보이면서 전체적인 추세는 증가하였고, MMP-8의 최대 차이는 0.99 ng/ml, MMP-9는 5.86 ng/ml, IL-1β는 4.13 pg/ml였다.
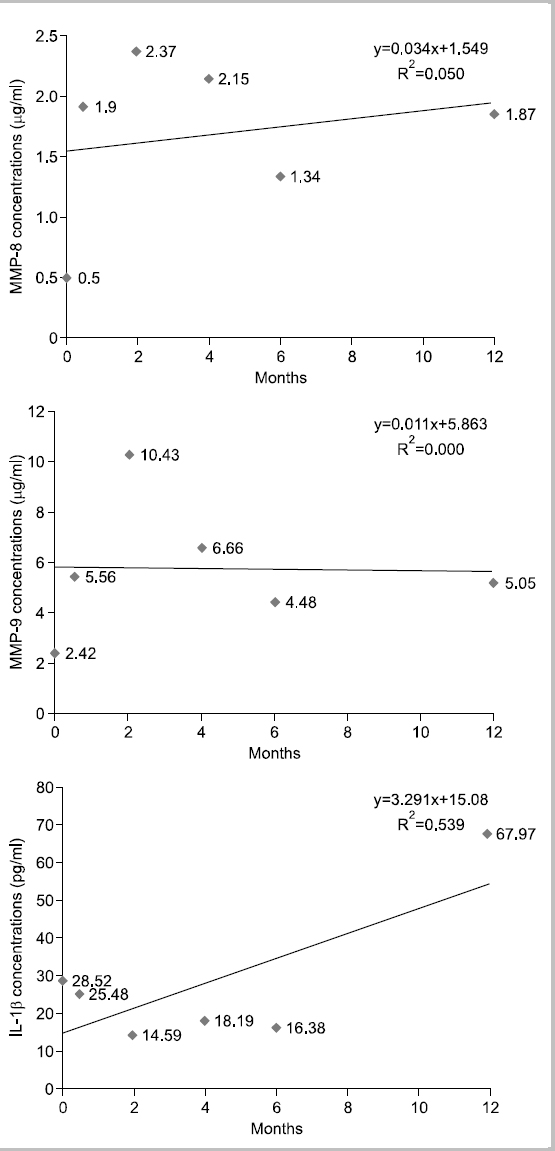
대상자 G는 1972년생으로 20년간, 1일 평균 30개비 흡연을 하였고 이전 금연시도 경험은 있고 3년간 성공하였다가 다시 흡연하고 있다가 내소 1개월 전부터 금연을 시작하였고 흡연 욕구가 다시 생겨서 금연클리닉에 내소하였다. 음주는 거의 하지 않으며, 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초시점 0 ng/ml였고 지속적으로 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 2.08, 1.25, 0.92, 0.92, 1.17, 0.42점이었고 초기시점에 비해서 치면세균막관리는 양호하게 변했다. 치은지수는 지속적으로 정상치은으로 관찰되었다. Fig. 7에서 보는 바와 같이, 치은열구액 내 MMP-8, MMP-9의 농도가 시점에 따라 오르내림 현상이 보이면서 전체적인 추세는 증가하거나 유지되었다. MMP-8의 최대 차이는 1.87 ng/ml, MMP-9은 8.01 ng/ml, IL-1β는 53.38 pg/ml였다.
대상자 H는 1980년생으로 17년간, 1일 평균 25개비 흡연을 하였고 이전 금연시도 경험은 있고 1.06년간 성공하였다가 다시 흡연하고 있다가 2주전부터 금연을 시작하였고 금연클리닉에 내소하였다. 음주는 주 2∼3회 정도였으며 1일 음주량은 소주 8잔이다. 구강상태는 진행되는 우식은 없고 총 치아수는 27개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초시점 0 ng/ml였고 지속적으로 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 1.25, 1.41, 1.33, 1.58, 1.33, 1.33점이었고, 치은지수는 0, 0, 0, 0, 0.17, 0.06이었다. Fig. 8에서 보는 바와 같이, 치은열구액 내 바이오마커의 전체적인 추세는 MMP-8는 유지, MMP-9, IL-1β의 농도는 감소를 나타내었다.
대상자 I는 1964년생으로 1년간, 1일 평균 20개비 흡연을 하였고 이전 금연시도 경험은 있고 20년간 성공하였다가 최근 1년 전부터 다시 흡연하고 있다가 금연클리닉에 내소하였다. 음주는 주 2회 정도하며 1일 음주량은 소주 10잔이다. 구강상태는 진행되는 우식은 없고 총 치아수는 27개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 1.24 ng/ml였고 이후 지속적으로 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 1.08, 0.83, 2.08, 1.91, 1.41, 1.58점이었고, 치은지수는 지속적으로 0이었다. Fig. 9에서 보는 바와 같이, 치은열구액 내 바이오마커의 전체적인 추세는 MMP-8, MMP-9, IL-1β의 농도는 모두 감소를 나타내었다.
대상자 J는 1970년생으로 23.5년간, 1일 평균 35개비 흡연을 하였고 이전 금연시도 경험은 있고 4개월간 성공한 적이 있다. 음주는 주 3회 정도하며 1일 음주량은 소주 17.5잔이다. 구강상태는 진행되는 우식은 없고 총 치아수는 28개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초 시점 34.5 ng/ml였고 이후 지속적으로 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 1.75, 1.75, 1.17, 1.17, 1.17, 0.83점이었고, 치은지수는 0, 0, 1.5, 0.33, 0.69, 1.14였다. Fig. 10에서 보는 바와 같이, 치은열구액 내 바이오마커의 전체적인 추세는 MMP-8, MMP-9의 농도는 유지였으나, IL-1β의 농도는 상당한 증가를 나타내었다.
대상자 K는 1988년생으로 1년간, 1일 평균 5개비 흡연을 하였고 이전 금연시도 경험은 없다. 음주는 주 0.5회 정도하며 1일 음주량은 소주 3.5잔이다. 구강상태는 진행되는 우식은 없고 총 치아수는 27개이며, 기초시점에 상악전치부에서 천치주낭은 탐지되지 않았다. 타액 내 니코틴 농도는 기초시점 7.45 ng/ml였고 이후 지속적으로 0 ng/ml를 나타내었다. 상악전치부의 평균 치면세균막지수는 시기별로 1.08, 0.75, 0, 0.75, 1, 0.41점이었고, 치은지수는 지속적으로 0이었다. Fig. 11에서 보는 바와 같이, 치은열구액 내 바이오마커의 전체적인 추세는 MMP-8, MMP-9, IL-1β의 농도는 모두 감소를 나타내었다.
금연과 구강건강과의 연관성을 탐구하고자 하는 사람대상 추적연구는 그리 많지 않다. Fiorini 등19)은 금연과 치주건강에 대한 메타분석을 위해 가능성 있는 331개의 논문을 검토하였으나 적어도 1년 이상의 추적이 된 연구는 단지 5개만 존재하였다고 하였다. Chambrone 등20)은 비외과적 치주처치에 미치는 금연의 효과를 메타분석하기 위해서 2,455개의 논문을 검토하였으나 금연이 6개월 이상 추적된 연구는 2개만이 존재하였다고 하였다. 그러나 Fiorini 등19)과 Chambrone 등20)은 메타분석이 불가함에도 불구하고, 금연자는 치주처치 후 치주낭 감소가 흡연자에 비해 유의하여 금연은 치주건강에 긍정적인 영향을 끼친다고 하였다.
보건소 금연클리닉의 6개월 성공률은 2006년 42.0%, 2007년 46.5%, 2008년 48.1%로 상당히 높은 성공률을 나타내고 있지만21), 실제 금연과 치주건강에 관한 연구대상자의 중도탈락률은 상당히 높다. 12개월간 금연의 치주 임상 지표에 대한 Rosa 등22)의 연구에서 201명의 대상자 중 연구 조건에 맞는 대상자가 93명이었으며 1년 후 52명만 남았고 그 중 17명만이 금연에 성공하였다고 하였다. 본 연구에서도 연구조건에 맞는 122명의 흡연자가 금연을 시도하였으나 1년 후 단지 11명만이 지속적으로 금연을 유지하였다. 이는 금연클리닉에 방문한 흡연자들이 금연시도 의사결정을 하였다 하더라도 흡연 자체의 중독성과 흡연자의 건강행위에 대한 동기가 비흡연자에 비해 낮은 편이다23). 금연클리닉의 금연성공률은 인터넷이나 전화로도 상담이 가능하고 성공여부 판별도 가능하나, 연구에 진입하였을 때는 방문을 통한 검사가 필수적인데 반해 흡연자의 방문 순응도는 비흡연자에 비해 낮은 측면도 있다24).
금연성공군 11명의 1년간 치은열구액내 MMP-8, MMP-9의 변화를 살펴보면 9명의 대상자는 파동을 보이면서 감소하는 경향을 나타내거나 동일한 수준을 유지하였다. 2명의 대상자는 파동을 보이면서 증가하는 경향성을 보이고 있지만 다른 대상자에 비해 바이오마커들의 농도가 적었고 증가폭 또한 미량이었다(Fig. 5, 6). 치면세균막의 양에 따라 염증 지표의 수치도 영향을 받을 것으로 예측하여 조사하였으나, 치은열구액내 MMP-8, MMP-9, IL-1β의 농도와 상관관계의 유의성이 없으며 그 변화량이 미미하여 결과에 제시하지 않았다. 11명의 사례연구의 한계점과 잦은 방문시점에 의한 구강관리에 관한 관심 향상 등 혼란변수가 미친 영향의 가능성도 있지만, 금연은 치주처치의 개입 없이도 치은열구액 내 바이오마커의 감소를 가져올 가능성도 있다고 판단하였다. 그러나 파동성 증가감소 시점의 유사성에 있어서는 대상자별로 각기 다른 시점에 증가하고 감소하였기 때문에 유사성을 관측하기는 어려웠다. 본 연구자의 이전 3주간의 실험치은염 모형 연구11)에서도 치은열구액 내 MMP-9, IL-1β의 농도가 실험기간 동안 지속적인 증가추세를 보이는 것이 아니라 파동을 보여주었는데, 환경요인에 따른 염증의 증가나 감소에 따라 치주조직내 세포들이 염증에 대한 피드백 작용을 하면서 염증 바이오마커들이 파동을 보여주는 것이 아닐까 예측하고 있으며, 환경요인과 세포간의 피드백 작용에 관한 연구가 필요할 것으로 생각된다.
본 연구에서는 각 대상자의 추이를 1차 함수에 의해 증가와 감소를 판별하였으나 그 설명력이 대부분 0∼40% 사이로 상당히 낮은 편이다. 10% 이하의 설명력을 가지는 1차 함수는 증가 감소 추이가 없는 것으로 판단한다 가정하면, 치은열구액 내 MMP-8 농도는 대상자 11명 중 2명 증가, 5명 감소, 4명이 유지를 나타내고, MMP-9의 농도는 2명 증가, 6명 감소, 3명 유지를 나타낸다. IL-1β의 경우 5명은 감소, 3명은 증가, 3명은 변화가 없다고 판단할 수 있다. 그러나, 앞서 언급한 바와 같이 각 바이오마커가 파동성을 보이며 변화하고 있으므로 설명력을 높이기 위해서는 고차함수적 접근이 필요할 것으로 생각된다. 또한 금연과 치주건강에 관한 추구조사 연구시 연구중도탈락률과 혼란요인에 관한 통제를 고려해서 연구 초기 시점의 연구대상자 확보가 200명 이상 되어야 통계분석이 가능할 것으로 보이며 연구실행시 금연자가 탈락하지 않도록 지속적인 금연동기유발교육과 추구조사 내원시점에 대한 보완이 필요할 것으로 보인다. 또한 치주조직의 임상적 변화를 보기 위해서는 추구조사 기간을 더 확보하여 치주조직의 임상적 지표의 변화 양상과 치은열구액 내 바이오마커를 관찰하는 것이 필요할 것으로 생각된다.