인구증가와 생활수준의 향상 등으로 인하여 물의 사용량은 갈수록 증가하고 있으며, 크고 작은 하수처리장 건설 및 하수도 보급률 또한 증가하였다. 결과적으로 질소와 인을 다량 함유하고 있는 슬러지도 증가하여 처리 방법에 대한 부분이 사회문제를 일으킨다. 질소 및 인과 같은 영양염류 물질은 하천이나 호소로 유입 시 부영양화를 일으키는 주원인이 되는 물질이며(Lee and Yun, 2013; Yim, 2010), 악취유발, 병원성 세균의 번식 및 사후 저질토에서의 생분해 시 용존 산소를 고갈시켜 어류와 같은 수생생물에 악영향을 줄 수 있다. 특히, 암모니아 질소의 경우는 수계에서 고농도로 존재 시 생물체 독성을 야기하는 대표적인 오염물질이다. 오늘날 질소와 인에 대한 처리기준은 점차 강화되고 있고 질소와 인의 제거를 위해 많은 공학적 노력이 이루어지고 있다.
하수 슬러지에서 질소와 인을 처리하는 방법으로는 인산 칼슘, 지르코늄 흡착법, struvite (magnesium ammonium phosphate, MAP, MgNH4PO4・6H2O)을 형성하는 방법 등이 있다(Jaffer et al., 2002). 그 중에서도 struvite 형성하는 방법은 농축하수슬러지, 축산폐수, 혐기성발효액, 침출수 등에서의 암모니아성 질소 및 인을 처리 및 회수하기 위한 방법으로써 연구가 활발히 이루어지고 있다(Choi et al., 2009). Struvite 침전법은 폐수 중의 질소와 인에 대한 처리 및 회수방법으로 그 효율성이 매우 높은 것으로 알려져 있다. 특히 생성된 struvite는 식물성장에 필요한 질소, 인, 마그네슘 등을 포함하고 있을 뿐만 아니라 물에 대한 용해도가 낮아 친환경적 완효성 비료로서 직접 활용이 가능하다는 장점을 가지고 있다(Luz and Yoav, 2004; Muryanto and Bayuseno, 2012).
하수슬러지는 질소와 인이 과량 존재하며, struvite 형성에서 필요한 영양염류는 마그네슘(Mg2+) 공급원을 필요로 한다. Mg2+의 공급원으로 염화마그네슘(MgCl2), 황산마그네슘(MgSO4), 수산화마그네슘(Mg(OH)2) 등이 사용되고 이는 전체 공정비에 상당한 비율을 차지한다(Lahav et al., 2013). 비용적 측면을 보완하기 위해 간수, 바닷물 등을 활용하는 연구가 진행되어 오고 있다(Liu et al., 2013; Ryu et al., 2007). 그 중 바닷물은 지구상 물의 97.2%를 차지하고 있는 풍부한 자원으로 손쉽게 이용가능하다. 또한 바닷물 내에 Mg2+ 농도는 하수슬러지 내 인을 처리하기에 충분하다(Liu et al., 2013).
지금까지 발표된 논문 중 바닷물을 Mg2+의 공급원으로 사용하고 대상폐수를 축산폐수(Ryu et al., 2007), 하수슬러지 탈수 상등액(Lahav et al., 2013), 사람 소변(Liu et al., 2013) 등을 사용한 논문은 있지만, 바닷물을 Mg2+의 공급원으로 하면서 혐기소화액을 대상 폐수로 사용한 논문은 찾아 볼 수 없었다. 따라서 본 연구에서는 암모니아성 질소(NH4+-N)와 인산염 인(PO43--P)을 회수하기 위한 struvite 결정화 반응에서 바닷물을 혐기성소화액에 적용하였을 때 최적의 pH와 마그네슘과 인의 몰비를 도출하고자 하였다.
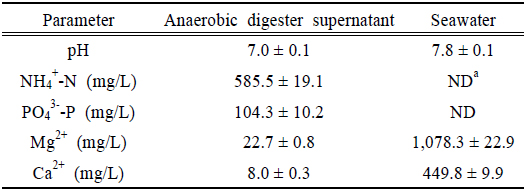
본 연구에 사용된 시료는 춘천 하수처리장에서 발생하는 농축 2차 슬러지를 이용하여 본 실험실에서 운전하고 있는 혐기소화조에서 발생하는 소화액을 사용하였다. 실험에 사용한 바닷물은 충남 서천군 비인면에서 채취하였다. 본 연구에서 사용된 바닷물의 Mg2+ 농도는 1,078 mg/L이다. 실험에 사용된 소화액 내 NH4+-N의 농도는 585.5 mg/L, PO43--P의 농도는 104.3 mg/L였다(Table 1). 바닷물과 소화액에 포함되어 있는 Mg2+, NH4+-N, PO43--P의 농도를 몰비로 환산하였을 때 40:31:1이다. Struvite 생성에서 요구되는 이론적인 몰비는 1:1:1이므로 NH4+-N와 PO43--P를 회수하는데 있어서 바닷물은 충분한 Mg2+을 포함하고 있음을 확인할 수 있다.
[Table 1.] Characteristics of anaerobic digester supernatant and seawater
Characteristics of anaerobic digester supernatant and seawater
본 실험은 struvite 결정화에 있어 바닷물을 주입하였을때의 최적 pH와 Mg2+와 PO43--P의 최적 몰비([Mg2+]/[PO43-])를 결정하기 위하여 진행하였다. Struvite 결정화를 위한 Mg2+ 공급원으로써 MgCl2과 바닷물을 사용하여 비교실험을 진행하였다. 최적의 pH를 도출하기 위한 pH의 범위는 8, 9, 10, 11, 12 등으로 조절하여 NH4+-N와 PO43--P의 회수율을 측정하였다(Kim et al., 2006; Kim et al., 2007; Liu et al., 2013). 이를 위해 [Mg2+]/[PO43-]는 1로 하여 실험을 진행하였으며, 1 N NaOH를 사용하여 시료의 pH를 조절하였다.
몰비에 따른 NH4+-N와 PO43--P 회수율을 알아보기 위하여 Mg2+ 농도를 달리하여 [Mg2+]/[PO43-] (0.6, 0.8, 1, 1.2, 1.4)를 조절하였다(Ryu et al., 2007). 이 때 pH는 10으로 고정하고 실험방법은 최적 pH를 도출하는 실험과 동일하게 진행하였다. Struvite 결정화하기 위한 모든 실험은 6개의 패들을 가진 자-테스트장치(jar-test)를 이용하여 실험을 진행하였다. 시료의 용량은 500 mL로 하였고 패들의 회전속도를 200 rpm으로 조정하여 3분 동안 반응시키고 패들을 멈추고 30분 동안 침전시켰다(Ryu et al., 2007). 침전후 50 mL 주사기를 이용하여 상등액을 채취하여 1.2 μm 공극의 유리섬유여과지(Glass microfiber filter, GF/C)로 여과한 후 PO43--P, NH4+-N, Mg2+, Ca2+ 등을 측정하였다.
시료 및 struvite 처리 후 상등수의 성분 분석 시 Mg2+, Ca2+은 원자흡광광도계(Atomic Absorption Spectroscopy, Analytik Jena, novAA®300, Germany)로 분석하였다. PO43--P은 수질공정시험방법에 준하여 전처리한 후 자외선분광광도계(UV-Vis spectrophotometer, PG Instruments Ltd., T-60, UK)를 사용하여 분석하였고(Choi, 2003), NH4+-N은 킬달법으로 분석하였다(APHA, 2012).
3.1. pH에 따른 NH4+-N와 PO43--P 회수율
[Mg2+]/[PO43-] = 1일 때, MgCl2의 경우 pH를 8-12로 변화를 주어 NH4+-N와 PO43--P의 회수율을 도출하였다(Fig. 1). NH4+-N의 회수율은 pH 8-10 구간에서는 증가하였고 pH 10에서 59.2%로 가장 높게 나타났다. pH 10 이후 구간에서는 회수율이 점차 감소하여 pH 12에서 13.7%로 가장 낮게 나타났다. PO43--P의 회수율도 pH 8-10에서 증가하고 그 이후에는 감소하였다. NH4+-N와 마찬가지로 PO43--P의 회수율은 pH 10의 조건에서 96.1%로 가장 높게 나타났고 pH 12에서 61.1%로 회수율이 가장 낮게 나타났다.
바닷물의 경우에도 NH4+-N, PO43--P 모두 pH 10에서 최고 회수율을 보였으며, pH 11 이상에서는 모두 회수율이 감소하였다. NH4+-N의 회수율은 pH 10에서 최대 61.8%까지 회수되었고 가장 적게 회수된 지점은 pH 8에서 34.1%의 회수율을 보였다. PO43--P의 회수율은 pH 10에서 최대96.5%까지 회수되었고 회수율이 가장 낮은 지점은 pH 8에서 75.3%의 회수율을 보였다.
바닷물은 MgCl2에 비해 거의 모든 구간에서 NH4+-N와 PO43--P의 회수율이 높게 나타났다. PO43--P의 회수율의 차이는 pH 12를 제외하고 5% 내외의 적은 차이를 보였다. NH4+-N의 회수율 차이는 pH 8-10에서는 10% 이내로 적은 차이를 보였으나 pH 11, 12에서는 약 20% 차이로 pH 8-10보다 더 큰 차이를 보였다. 따라서 MgCl2와 바닷물 모두 pH 8-10의 구간에서는 NH4+-N, PO43--P의 회수율이 증가하는 경향을 보였지만 pH 11 이상에서 NH4+-N, PO43--P의 회수율이 감소하였다.
3.2. pH에 따른 바닷물 내 Mg2+과 Ca2+의 영향
[Mg2+]/[PO43-] = 1일 때, struvite을 생성하는 동안 바닷물에 존재하는 Mg2+과 Ca2+이 pH에 따라 NH4+-N와 PO43--P의 회수율에 끼치는 영향을 알아보았다(Fig 2). Mg2+은 struvite 생성에 사용되는 공급원으로 pH 8에서 10까지 증가할 때 Mg2+의 농도가 96.2 mg/L에서 26.5 mg/L로 감소함과 동시에 NH4+-N, PO43--P의 회수율은 증가하는 경향을 보이는데, 이는 Mg2+, PO43--P, NH4+-N가 struvite를 형성하고 있기 때문으로 판단된다. 일반적으로 pH 11 이상에서는 Mg(OH)2 생성반응이 우선하였기 때문에 struvite 생성반응에 참여하지 못한 NH4+가 많아 회수율이 떨어진다(Kim et al., 2006). 본 연구에서도 pH 11 이상에서는 PO43--P, NH4+의 회수율이 떨어지는 반면 Mg2+의 농도가 감소하는 것으로 보아 pH 11 이상에서는 Mg(OH)2의 반응이 우선 시 될 것이라 추정된다.
Ca2+은 struvite 생성에 있어서 hydroxylapatite(Ca10(PO4)6 (OH)2)를 형성시켜 NH4+-N가 struvite 형태로 결정화될 기회를 줄인다(Ichihashi and Hirooka, 2012). Ryu et al. (2007)의 연구에서 Mg2+의 공급원으로 간수와 MgCl2・6H2O의 영향을 비교한 결과 간수를 사용할 때 NH4+-N의 회수율이 더 낮게 나타났다. 이는 간수에 포함된 Ca2+의 농도가 매우 높기 때문에 NH4+-N와 반응해야 할 PO43--P가 Ca2+과 반응하여 hydroxylapatite를 형성시키기 때문이다. 따라서 본 연구에서도 바닷물을 공급할 때 pH 10 이상에서 hydroxylapatite의 생성으로 인해 NH4+-N의 회수율에 영향을 끼쳤을 것이라 판단된다. pH 조건별로 Ca2+를 측정한 결과, pH 10부터 Ca2+의 농도가 측정되지 않았다. 바닷물에 포함되어 있는 Ca2+이 Ca(OH)2 생성 및 hydroxylapatite 등의 반응에 참여한 것이라 판단된다. pH 8에서 Ca2+의 농도가 73.8% 감소한 것으로 보아 Ca2+이 hydroxylapatite 반응에 pH 8 이하에서도 참여하는 것으로 판단된다.
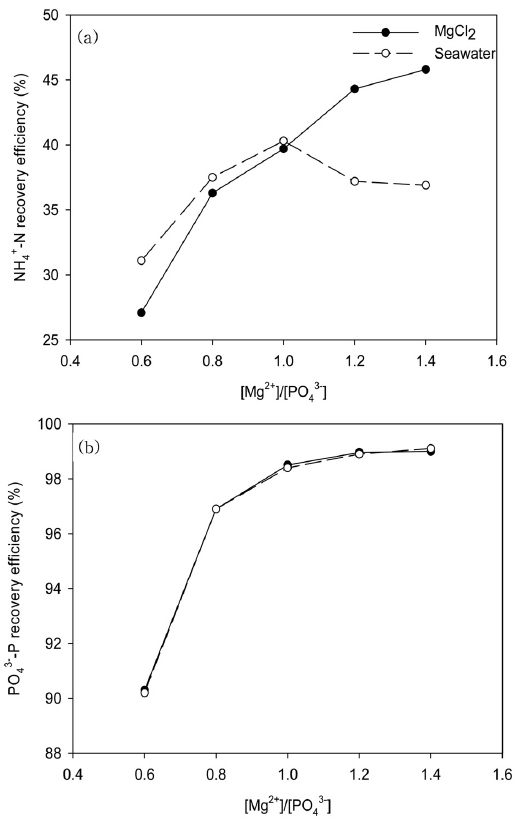
3.3. 몰비에 따른 NH4+-N와 PO43--P 회수율
Struvite 형성에 있어서 이론적으로 적절한 Mg2+:NH4+-N:PO43--P의 몰비는 1:1:1이다. 소화액에 존재하는 NH4+-N와 PO43--P는 회수해야하는 대상이고 Mg2+은 공급이 필요한 물질이다. 일반적으로 하수나 하수슬러지의 구성은 PO43--P가 제한인자로써 작용하며, 본 연구에서도 PO43--P가 제한인자로 작용하여 Mg2+ 공급을 조절하여 몰비를 조절하였다(Fig. 3).
MgCl2을 주입하였을 경우에 [Mg2+]/[PO43-]가 증가함에 따라 NH4+-N의 회수율이 증가하였다. 가장 크게 회수율의 차이를 보인 지점은 몰비 0.6에서 0.8로 증가될 때 9.2%만큼 회수율이 증가하였고 몰비 1.4에서 최대 45.8%까지 회수되었다. PO43--P의 회수율은 몰비가 증가함에 따라 회수율이 점차 증가하였고 최대 99.0%까지 증가하였다.
바닷물을 주입하였을 경우 NH4+-N의 회수율은 몰비 1.0에서 40.3%로 최고 회수율을 보였다. 이 때 회수율은 몰비1.0에서의 MgCl2을 주입했을 때보다 0.6% 높은 회수율을 보였다. 그러나 MgCl2을 사용했을 때와 다르게 몰비 1.2와 1.4는 1.0에 비해 NH4+-N의 회수율이 낮아지는 결과를 얻었다. 다른 문헌(Liu et al., 2013; Ryu et al., 2007)에서도 바닷물을 이용하여 struvite 회수하는 실험에서 몰비가 1.0 이상에서 NH4+-N의 회수율이 낮아진다고 보고하였다. 이는 바닷물의 경우에는 Ca2+이 다량 포함되어 있고 pH 10에서 실험으로 진행하였기 때문에 hydroxylapatite 생성으로 인한 PO43--P의 감소가 NH4+-N 회수율에 영향을 끼쳤을 것으로 추정된다(Tchobanoglous and Burton, 1991). PO43--P의 회수율은 MgCl2를 사용했을 때와 비슷한 경향과 수준으로 최대 99.1%로 나타났다. MgCl2을 공급원으로 사용할 때에 비해 PO43--P의 최대 회수율은 큰 차이를 보이지는 않았다. 최근 다른 연구자(Lahav et al., 2013)에 따르면 하수처리장이 바다 근처에 있을 경우, struvite 생성을 위해 바닷물에서 얻는 마그네슘 생산비용은 화학약품을 사용하는 경우보다 약 50% 이하의 비용만 소요될 것으로 추정한 바 있다.
바닷물을 이용하여 혐기성 소화액에 함유된 NH4+-N와 PO43--P의 struvite 형성에 대하여 살펴본 결과 본 연구는 다음과 같은 결론을 얻었다.
1) 바닷물을 Mg2+ 공급원으로 이용할 때 NH4+-N와 PO43--P 회수율이 가장 높은 pH는 10이었으며, pH가 10보다 높아질 경우 NH4+-N와 PO43--P의 회수율 모두 감소하는 경향을 보였다. 2) 바닷물을 첨가하였을 때 MgCl2 주입했을 때보다 pH 9를 제외한 모든 pH 구간에서 NH4+-N와 PO43--P의 회수율이 높게 나타났다. 3) 바닷물을 첨가하였을 때 NH4+-N 회수율에 가장 적절한 몰비는 1.0이며, PO43--P 회수율은 몰비가 높아짐에 따라 증가하였다. 바닷물의 NH4+-N 회수율의 경우 몰비1.0 이후 회수율이 감소하는 경향을 보였다. 4) Struvite 생성 시 마그네슘원으로 MgCl2와 바닷물의 NH4+-N와 PO43--P 회수율은 큰 차이가 없으므로 바닷물의 이용이 운전비용면에서 경제적일 것으로 판단된다.
![Recovery efficiencies of (a) NH4+-N and (b) PO43--P from anaerobic digester supernatant using MgCl2 and seawater with pH at [Mg2+]/[PO43-] = 1.](http://oak.go.kr/repository/journal/16504/SJBJB8_2015_v31n4_387_f001.jpg)
![Concentration of Mg2+ and Ca2+ in anaerobic digester supernatant after struvite crystallization using seawater with pH at [Mg2+]/[PO43-] = 1.](http://oak.go.kr/repository/journal/16504/SJBJB8_2015_v31n4_387_f002.jpg)