최근 수중 유기물질의 거동과 특성은 주된 환경적인 관심사가 되어왔는데 이는 이러한 물질은 심미적인 영향을 주며, 미량 유해 오염물질의 전달에 기여하며, 정수공정에 의한 소독부산물질을 생성하고, 표류수에서 광학학적인 과정에 영향을 미치기 때문이다(NIER, 2010). 용존유기물질(Dissolved Organic Matter, DOM)의 특성은 수계 내에서 발생하는 모든 생지화학적(biogeochemical) 과정의 결과이다. 예로서 수계 내 수문현상의 변화는 하천 내부의 유기물질의 양 뿐만 아니라 그 특성에도 영향을 줄 수 있다. 따라서 수계내에서의 DOM과 관련된 다양한 기원과 변화과정을 이해한다는 것은 매우 복잡한 과정이지만 향후의 체계적인 수질관리에 중요하다.
대개 DOM의 농도는 분자내의 탄소의 양으로 정량화 한다. 전형적으로 DOM 농도는 시료내의 용존유기탄소(DOC)로 나타낸다(Croue et al., 2000). DOM의 가장 큰 특징은 단일물질로 구성되어 있지 않고 다양한 물질로 이루어진 비균질성 물질로 여기에는 탄수화물, 단백질, 아미노산, 유기산, 리그닌(lignin) 및 각종 생고분자물질이 포함되어 다양한 생성 기원이나 생성 경로에서 짐작할 수 있다(Hur et al., 2006). 표류수와 지하수에 공통적으로 함유되어 있는 유기물질은 내부생성(autochthonous) 물질과 외부생성(allochthonous) 물질로 구분된다. 내부생성 물질은 미생물에 의한 동물과 식물의 분해와, 미생물의 생체와 대사물질의 분해 및 분비에 의하여 수계에 존재한다. 외부생성 물질은 수계의 토양, 산업과 농업활동, 그리고 하・폐수 처리장의 방류수에 의하여 수계내로 유입된다(Malcolm, 1985; Steinberg and Muenster, 1985). 외부 점오염원이 적은 수계에서의 대부분의 DOM는 수계 내 에서의 유기성 부식물질의 분해와 용출에서 기원하여 호소와 지하수로 이동한다. 이러한 외부생성 물질은 지하수와 담수의 상호교환이나 유출수에 의해 대상지역 내부로 이송되며 그 생성기원의 특징으로 인해 대부분 난분해성 자연유기물질의 주요 성분을 구성한다(Wetzel, 2001; Hur et al., 2006).
낙동강은 중·하류수역에서 과다한 영양염의 유입과, 느린 유속으로 인한 체류시간의 증가와 수계의 정온성 등의 환경적 특성이 식물플랑크톤의 성장조건에 적합하여 식물플랑크톤의 과다성장을 유발하고 이러한 결과로 낙동강 중·하류 지역에서는 자생유기물량의 증가, 자생 BOD, 자생 COD 농도의 증가로 이어지고 있다(BDI, 2009). 하천수와 유기물 기원 DOM의 대부분은 난분해성 유기물로 고려되고 있으나 유기물의 성상에 따라서 생분해 정도는 다르다. 또한, DOM의 성분 중 생분해도가 높은 성분과 낮은 성분이 있어 DOM의 종류에 따른 생분해도의 차이와 생분해에 따른 유기물의 성상 변화는 지표수에서의 DOM 성상과 거동을 이해하는데 기초적인 자료로 활용될 수 있다. 이에 본 연구에서는 낙동강 수계의 유기물 기원 시료에 따른 장기 생분해 실험을 수행하여 생분해 과정동안 DOM의 성상 변화를 비교하고자 하였다. 장기적인 체류시간에 따른 낙동강 수계 내 다양한 유기물의 생분해도와 생분해로 인한 유기물의 특성변화를 살펴보기 위하여 하천수, 환경기초시설 방류수, 습지, 하천퇴적토와 같이 유기물의 기원에 따른 시료를 준비하여 기원별 DOM의 성상변화 특성을 비교·조사하였다.
지표수에 함유되어 있는 DOM은 외부유입의 경우 주로 유역내의 토양 유출 또는 동·식물의 부식과 하수처리장 등의 점오염원으로 인하여 수계에 유입된다. 이러한 유기물의 유입에 기여하는 낙동강 수계의 유기물 기원을 파악하기 위해 난분해성 유기물의 주된 내·외부 발생원인 하천수, 습지, 농경지, 낙엽, 환경기초시설(공공하수처리시설 방류수) 등의 시료를 선정·채취하여 유기물의 성상을 비교 분석하였다. 각 기원별 유기물 시료는 낙동강으로 유입되는 지역의 하천수, 방류수를 채취하여 연구를 진행하였다. 발생원별 시료 중 하천수(낙동강)와 습지는 원수를 이용하였으며, 하천퇴적토와 낙엽 등은 국제휴믹물질학회(International Humic Substances Society, IHSS)의 표준절차를 따라 유기물을 추출하여 이용하였다. 하천 퇴적토는 0.1 N NaOH와 순수를 1:10의 비율로 하여 130 rpm에서 24시간 교반시킨 후, 상징액을 3000 rpm으로 15분간 원심분리를 실시한 후 초순수로 희석하였고, 낙엽 시료는 표토층과 그 위층에 쌓인 낙엽을 충분히 섞어 채취하여 통풍이 잘 되는 곳에서 건조시킨 후 크고 굵은 나뭇가지는 제거하고 유기물 추출이 잘 되도록 잘게 분쇄하여 낙엽과 순수의 비를 1:20으로 하여 130 rpm에서 24시간 교반시킨 후, 상징액을 3000 rpm으로 15분간 원심분리를 실시한 후 초순수로 희석한 후 시료로 사용하였다.
COD 측정방법으로 과망간산칼륨(KMnO4)을 사용해서 산성에서 100℃로 30분간 처리하는 CODMn (산성 과망간산칼륨법)법을 이용하여 측정하였으며, UV254는 시료를 GF/C 필터로 여과한 후 그 여액을 UV spectrophotometer (UV-1650PC, Shimadzu, Japan)을 사용하여 측정하였다. UV 흡광도비(SUVA, Specific UV Absorbance)는 UV/DOC를 나타내는 값으로 유기물의 특성변화에 유용한 지표로 사용되고 있다.
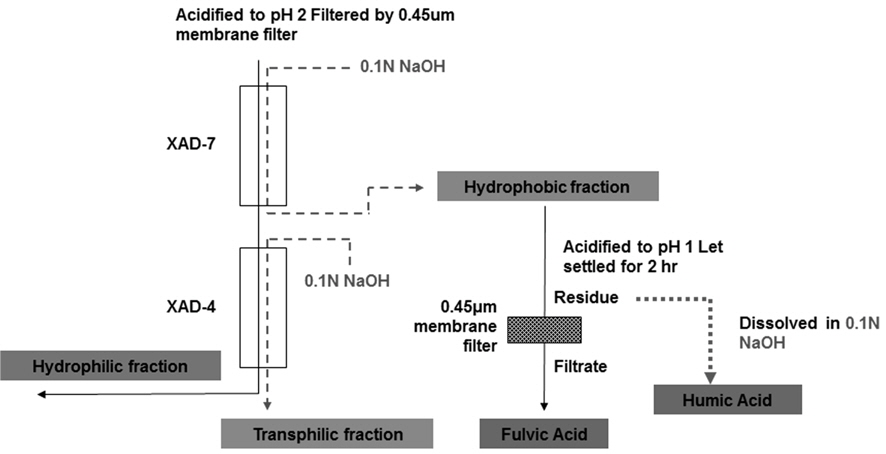
이온교환수지에 의한 DOM의 성상분류를 Amberlite 계열(Aldrich, CO.)의 XAD 이온교환수지를 사용하였으며 XAD 수지는 humic substance의 분류를 위하여 Standard Methods로서 제안되었다(Eugene et. al, 2005). DOM은 유기물의 극성과 산과 염기의 용해도에 따라 분류할 수 있는데, humic acid 와 fulvic acid, hydrophilic acid는 XAD-7수지와 XAD-4수지에 의해 분리된다. pH 2의 조건에서 hydrophobic acid는 XAD-7수지에 흡착이 일어나며 hydrophilic acid 는 XAD-4 수지에 흡착이 일어나는 성질을 이용하여 분리할 수가 있다(Malcom, 1985). 수지에 흡착된 유기물질은 NaOH를 이용하여 탈착시키며 75~100%의 회복율을 얻을 수 있다(Collins et al., 1986). 탈착된 소수성 유기물 중에서 humic acid와 fulvic acid의 분류는 다시 pH 2 이하로 산성화시켜 humic acid는 침전물로 형성되게 하여 분류하며, fulvic acid는 용존성으로 존재하게 하여 분류한다(Leenheer, 1996). Fulvic acid는 하천수 DOC의 46% 정도 차지하는 주요 구성 성분이며, hydrophilic acid와 humic acid에 비해 sugar와 amino sugar가 차지하는 비중이 높으며 DOC의 25% 정도 차치한다.
시료는 0.45 μm membrane filter로 여과시킨 후 시수를 pH 2로 산성화시킨 다음 Amberlite XAD-7부터 통과시킨 후, XAD-7 수지에 흡착된 물질은 0.1 N NaOH 250 mL로 탈착시켜 0.45 μm membrane filter로 여과하여 그 여액을 fulvic acids로 분류하였고, 여과지 위에 남은 잔류물은 0.1 N NaOH 250 mL로 용해시켜서 그 용액을 humic acids로 분류하였다. Fig. 1은 이온교환수지를 이용한 분석방법을 도식화하여 나타낸 것이다.
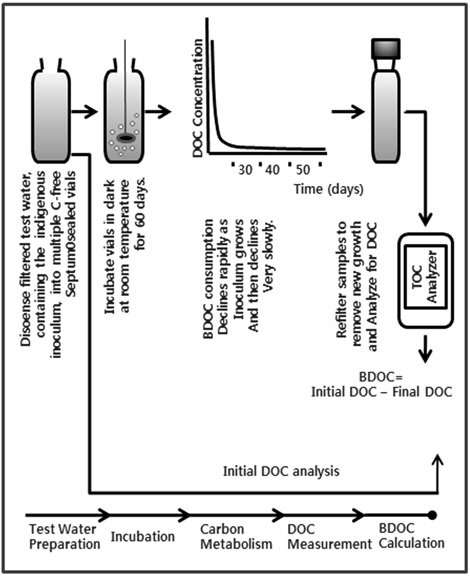
DOM 중 생분해 성분(biodegradable DOC, BDOC)은 종속영양 박테리아에 의해 무기화(mineralization)되는 DOC의 한 부분을 나타내는 것으로 생물학적으로 산화되어질 수 있는 유기탄소를 측정하는 것이다(Huck, 1990). BDOC는 초기 DOC 농도와 박테리아 식종 후 일정기간 배양하여 DOC가 최소농도에 도달하였을 때와의 차이를 측정하는 원리이며(Frias et al., 1992), 실험 전에 vial을 세제로 여러 번 세척한 후, 질산으로 세정하여 3차 증류수로 3번 이상 헹군 다음, 멸균기에서 121℃로 15 min 동안 고온 고압에서 멸균하여 잔존하는 박테리아와 미생물을 멸균 한 뒤 실험에 사용하였다.
0.2μm membrane filter로 여과한 시료(초기 DOC) 500 mL에 시료 중에 존재하는 유기탄소가 미생물의 대사에 제한 인자로 작용되도록 하기 위하여 시료에 농축된 무기 영양염 용액을 주입 하였다. 폭기에 의해 시료수중의 용존산소 농도를 포화상태로 만든 후 미생물을 식종하였다. 각 시료의 식종액은 하천수를 이용하여 20℃의 배양기에서 배양하였다. 원수 중에 존재하는 큰 유·무기물 입자 및 원생동물(protozoa)을 제거하기 위해 식종액을 2 μm polycarbonate filter (millipore, USA)로 여과하여 시료 100 mL 당 식종액 1 mL를 식종하였다. 식종 후 incubator 내에서 20℃의 조건에서 배양하였으며, BDOC농도 산정은 미생물을 접종한 후 배양기간 동안 배양 후의 잔존하는 DOC 농도를 초기 DOC 농도에서 뺀 값으로 하였다. Fig. 2는 생분해 실험방법을 도식화 하여 나타낸 것이다. 또한 체류시간에 따른 유기물의 생분해성을 파악하기 위한 일부 시료는 60일 동안 20℃의 배양기에서 장기 배양하였으며, 유기탄소가 미생물의 대사에 제한 인자로 작용되도록 하기 위하여 시료에 농축된 무기 영양염 용액을 주입 하였고 배양기간 동안 폭기시켰다.
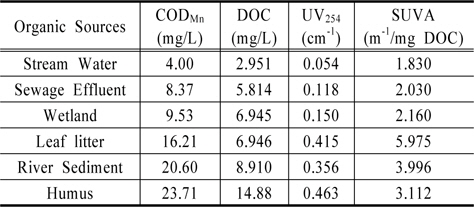
유기물 발생원 시료에 대한 생분해 특성을 파악하기 위해서, 각 발생원별 유기물의 지표를 Table 1에 나타내었다. 유기물 발생원별 시료 중 하천퇴적토와 낙엽이 각각 3.996 m−1/mg DOC, 5.975 m−1/mg DOC로 높은 SUVA 값으로 나타났으며, COD 역시 하천퇴적토와 낙엽이 높은 농도를 보였다. 대체적으로 COD와 DOC의 농도가 증가하면서 UV254의 값도 증가하였으며 SUVA 값을 통하여 하천수(Stream water), 환경기초시설 방류수(Sewage effluent), 습지(Wetlands)는 hydrophilic이 많이 함유하고 있으며 비방향족 물질과 저분자량 성분을 많이 함유하고 있으며, 낙엽(Leaf litter)과 하천퇴적토(River sediment), 부식질(Humus)은 hydrophobic이 많이 함유되어 있고 상대적으로 소수성 방향족 물질과 고분자 물질을 많이 함유하고 있음을 알 수 있었다(Edwald and Van Benschoten, 1990). 일반적으로 SUVA 은 유기물의 성상을 나타내는 지표로 SUVA 값이 3 m−1/mg DOC 보다 작을 때는 상대적으로 친수성, 비 방향족 물질과 저분자량 성분을 많이 함유하고 있으며, SUVA 값이 4~5 m−1/mg DOC 일 때는 소수성 방향족 물질과 고분자 물질을 많이 함유하고 있다고 하였다(Edwald and Van Benschoten, 1990).
[Table 1.] Analytical values for DOM extracted from various organic sources
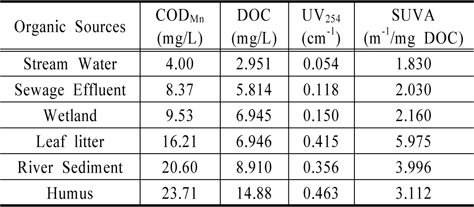
Analytical values for DOM extracted from various organic sources
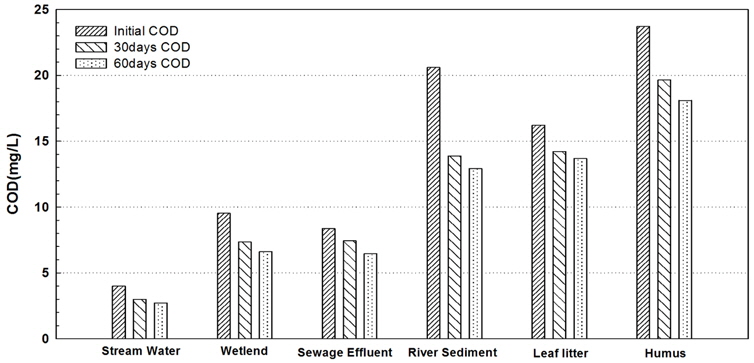
Fig. 3은 유기물 시료 특성에 따라 60 일간의 장기 생분해 실험을 실시한 후 유기물 농도의 변화를 나타낸 것이다. Fig. 3에 나타난 DOC 농도 변화에서 나타나듯이, 생분해 30일 경과 후 DOC 농도는 최소 27% (부식질)에서 최대 52% (하천수)까지 감소하였으며, 생분해 60일 경과 후에는 최소 3% (부식질)에서 최대 16% (하천수)까지 생분해가 추가적으로 일어났다. 이는 생분해 기간 중 산소의 주입을 위하여 폭기를 하였는데, 산소가 일정하게 유지됨으로 인해 수 중 미생물과 박테리아의 활동이 활발해짐에 의해 생분해가 활발히 이루어 졌을 것이라 예상되어진다. 또한, 토양기원의 용존 유기물에서는 10~50%의 낮은 생분해율을 보이는 반면, 휴믹화가 덜 진행된 산림기원(낙엽, 갈대 등)에서는 60~90%의 높은 생분해율을 보이는 것으로 보고하였다(Aiken, 1985). Fig. 4는 장기 생분해 실험을 실시한 후 COD를 분석하여 나타낸 것으로 생분해가 진행되면서 COD 역시 감소함을 알 수 있었다. 각 유기물 기원 시료의 생분해 전 COD 농도는 생분해 후 하천수의 경우 초기 COD 보다 32% 감소하였으며, 습지는 30%, 환경기초시설 방류수는 23%, 퇴적토 37%, 낙엽 15%, 부식질이 23% 비율로 감소하였다. 그에 비해 DOC는 하천수는 69%, 습지는 52%, 환경기초시설 방류수는 60%, 퇴적토는 67%, 낙엽은 34%, 부식질은 30%의 감소율을 보였다.
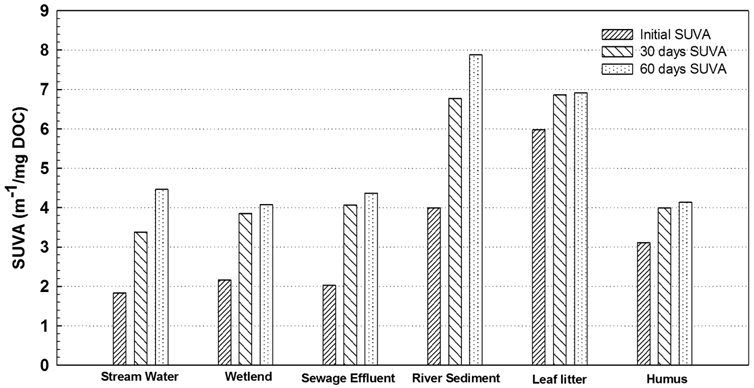
Fig. 5는 유기물 시료의 장기 생분해를 실시 한 후 생분해 전·후의 SUVA 값을 비교한 결과 생분해 후가 생분해 전 원수의 SUVA 값보다 2배 정도 증가하였다. 생분해 30일과 60일 후 유기물 시료에 대한 SUVA 값을 비교한 결과 유기물 초기의 SUVA 값은 방류수 2.030 m−1/mg DOC, 퇴적토 3.996 m−1/mg DOC, 낙엽 5.957 m−1/mg DOC, 부식질 3.112 m−1/mg DOC 이었으나 생분해 30일 후에는 방류수 4.064 m−1/mg DOC, 퇴적토 6.772 m−1/mg DOC, 낙엽 6.864 m−1/mg DOC, 부식질 3.998 m−1/mg DOC 으로 증가하였으며, 60일 후에는 방류수 4.367 m−1/mg DOC, 퇴적토 7.867 m−1/mg DOC, 낙엽 6.912 m−1/mg DOC, 부식질 4.137 m−1/mg DOC로 나타났다. 이는 생분해 기간 동안 유기물의 친수성 성분이 선택적으로 분해되면서 친수성 성분이 감소하고 소수성 성분이 상대적으로 증가하였음을 알 수 있었다. SUVA는 방향족 탄소함량과 정량적인 상관성이 높아 유기물의 방향족 탄소함량의 지표로 흔히 사용 된다(Kalbitz et al., 2003). SUVA는 유기물 중 방향족 화합물의 양과 밀접한 관계를 가지며, 상대적으로 분자량이 큰 소수성 성분에서 높은 값을 나타내는 것으로 알려졌다(Chin et al., 1994). SUVA의 크기는 humic acid > fulvic acid > transphilic > hydrophilic 순으로 알려져 있다. Reckhow et al. (1992)에 따르면 응집공정에 의하여 높은 SUVA값을 갖는 humic 성분은 70~80%의 DOC가 제거된 반면 hydrophilic neutral의 경우 단지 10%의 DOC가 제거되었다. Edwald and Van Benschoten (1990)은 다양한 수원에 대하여 SUVA의 측정을 통해 SUVA의 값에 따른 유기물질의 제반 특성을 분류할 수 있다고 하였으며, SUVA 4~5 m−1/mg DOC는 수중 DOC 성분이 주로 humic 물질로 이루어져 있고, 상대적으로 소수성 방향족 물질과 고분자 물질을 많이 함유하고 있으며, SUVA 3 m−1/mg DOC는 주로 nonhumic 물질로 이루어져 있고, 상대적으로 친수성, 비 방향족 물질과 저분자량 성분을 많이 함유하고 있다고 하였다. Yanagi et al. (2002)과 Almendros and Dorado (1999)은 난분해성으로 분류되는 휴믹물질도 생분해에 기인한 “휴믹화 과정(humification)”을 통해 지속적인 물질 변환이 일어나며, 변환의 정도는 휴믹물질의 기원 및 물질특성(탄수화물과 방향족 탄소 함량비, 탄소구조 특성 등)에 따라서 변화된다고 하였다.
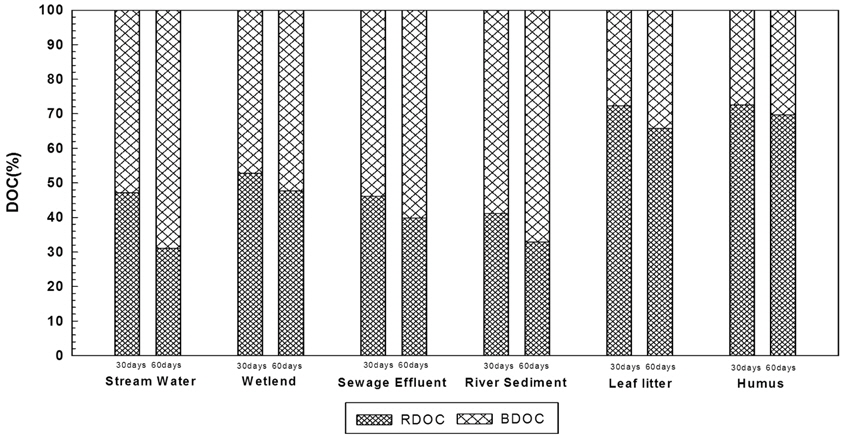
Fig. 6은 유기물 시료 특성에 따라 장기 생분해 실험을 실시한 후 RDOC (Refractory Dissolved Organic Cabon)와 BDOC (Biodegradable Dissolved Organic Cabon)의 비교를 나타낸 것이다. 생분해 후 시료의 생분해 정도를 분석한 결과 유기물 시료별에 따른 차이는 있었으나 대부분의 시료들이 약 50%의 생분해를 보였으나, 부식질의 경우 60일 경과 후에도 30%의 밖에 되지 않는 생분해를 보였는데, 이는 다른 유기물 시료에 비해 현저히 낮은 분해율을 보인 것이다. 배양 30일 후 시료의 생분해율을 비교한 결과 하천수와 습지는 각각 53%, 47%의 생분해율을 보였으며, 60일 경과 후에는 각각 16%와 5% (총 생분해율 : 하천수 68%, 습지 52%)의 추가 생분해가 진행되긴 하였으나 30일 후 생분해에 비하여 생분해율은 낮았다. 환경기초시설 방류수와 하천퇴적토의 경우 30일 경과 후 약 50%의 생분해율을 보였으며, 60일 후에도 생분해는 지속되었으나 분해율은 미세하였다. 낙엽과 부식질의 경우 30일 경과 후 생분해율은 20% 정도였으며, 60일 경과 후에도 생분해가 30%로 그다지 높은 분해율을 보이지 않았다. Namour and Mouller (1998)은 하수처리장 방류수를 대상으로 배양실험을 통해 휴믹물질과 같은 난분해성 물질이 10~40% 이상 증가하는데 이는 방류수에서 생물학적 처리공정과정에서 생분해가 용이한 유기물이 우선 제거되면서 상대적으로 분해가 어려운 난분해성 물질이 잔류 또는 생성되었기 때문에 높은 난분해성 물질을 보였다고 보고한 바 있다. 장기생분해 실험을 통하여 모든 유기물 시료는 최초 30일간 생분해가 활발하게 일어나며, 30일 후에 생분해가 일어난다 하여도 그 생분해 율은 매우 낮다는 결과를 알 수 있었다.
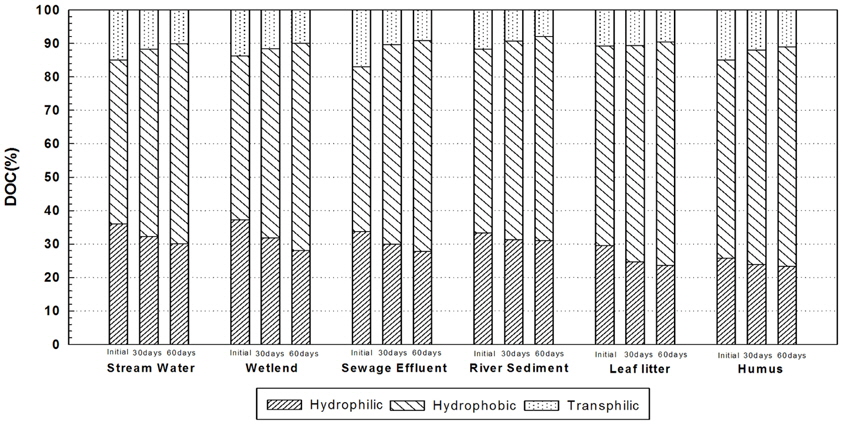
Fig. 7은 유기물 장기 생분해 전·후의 유기물 성상을 분류하여 나타 낸 것이다. 실험에 사용된 각 시료 모두 유기물 생분해 후 유기물의 hydrophilic 성분이 감소하고 hydrophobic 성분이 증가하였는데, 이는 생분해가 쉬운 hydrophilic 성분이 쉽게 분해되어 감소하여 상대적으로 hydrophobic 성분이 증가하였다고 판단된다. 각 유기물 시료 별로 살펴보면 하천수는 hydrophilic 성분이 초기 36%였으나, 자기 생분해 후 30%로 감소하였으며 transphilic 는 15%에서 10%로 감소하였다. 반면 hydrophobic 은 49%에서 60%까지 증가하였다. 습지의 경우 hydrophilic 성분이 37%에서 28%로 transphilic 성분이 14%에서 10%로 감소하였으며, hydrophobic 성분이 49%에서 62%로 증가하였다. 하수방류수 역시 hydrophilic 성분이 34%에서 28%, transphilic 성분이 17%에서 12%로 감소하였고, hydrophobic 성분은 49%에서 63%로 증가하였다. 하천퇴적토는 hydrophilic 성분이 33%에서 31%, transphilic 성분은 12%에서 8%, hydrophobic 성분이 55%에서 61%로 증감이 있었으며, 낙엽은 hydrophilic 성분이 29%에서 24%, transphilic 성분이 12%에서 9%, hydrophobic 성분이 59%에서 67%로, 부식질은 hydrophilic 성분이 26%에서 23%, transphilic 성분이 15%에서 11%, hydrophobic 성분이 59%에서 65%로 성상의 변화가 있었다. 따라서 미생물에 의한 유기물질의 분해시 생분해의 용이성은 hydrophilic > transphilic > hydrophobic의 순으로 나타난다는 것을 알 수 있다. Ogawa et al. (2001)은 glucose와 glutamate 등 생물학적 분해가 용이한 유기물도 생분해과정에서 난분해성의 유기물을 생성한다고 하였다. 수계에 유입된 유기물은 생분해를 통해 이산화탄소로의 무기질화 또는 생물학적 변환 과정을 거친다. 기존 연구에 따르면 일반적으로 DOM은 생분해과정을 거치면서 탄수화물, 단백질 계 등의 친수성 유기물이 미생물의 먹이로 우선적으로 사용되고 방향족계의 난분해성 유기물이 잔류하거나 생성되는 것으로 보고한바 있다(Kalbitz et al., 2003).
기원별 유기물 시료에 따른 생분해 특성을 파악하기 위하여 유기물 시료에 따른 유기물 성상과 생분해 후 유기물 성상을 검토한 결과, 다음과 같은 몇 가지 결론을 도출할 수 있었다.
1) 기원별 유기물 시료에 따른 특성을 살펴 본 결과, 물기원(하천수, 환경기초시설 방류수, 습지)는 hydrophilic 성상이 많이 함유되어 있으며, 토양기원(하천퇴적토, 부식질)과 산림기원(낙엽)은 hydrophobic 성상이 많이 함유되어 있음을 알 수 있었다.
2) 기원별 유기물 시료를 이용하여 생분해 전·후 DOC, COD 농도로 살펴본 결과, 모든 유기물 기원 시료에서 최초 30일간의 생분해율이 가장 높게 나타났으며, 물 기원 시료인 하천수의 생분해율은 52%로 가장 높았으며, 토양기원시료인 부식질은 27%로 가장 낮은 분해율을 보였다.
3) 기원별 유기물 시료의 생분해 전·후 SUVA (DOC/UV254) 값의 변화를 살펴본 결과, 생분해가 진행될수록 SUVA 값은 증가하였으며, 초기 SUVA 값에 비하여 생분해 후 SUVA 값이 약 2배 정도 증가함을 보였으며, 이는 생분해 과정 중 친수성 성분이 선택적으로 우선 분해되면서 친수성 성분이 감소하고 소수성 성분이 상대적으로 증가함을 알 수 있었다.
4) 기원별 유기물 시료의 RDOC (난분해성 유기물)와 BDOC (생분해성 유기물)의 변화에 따르면, 물 기원 시료의 경우 50% 생분해율을 보였으나, 토양기원 시료인 부식질의 경우 장기생분해 후에도 30%로 물 기원시료와 다른 토양기원시료에 비해 낮은 생분해율을 보임을 알 수 있었다.
5) 기원별 유기물 시료의 생분해 전・후에 따른 유기물 성상 변화에 대하여 살펴본 결과, 생분해 전보다 생분해 후에 친수성인 hydrophilic과 transphilic 성분이 감소하였고, hydrophobic 성분이 증가함을 보였다. 따라서 미생물에 의한 유기물질의 분해시 생분해는 hydrophilic>transphilic>hydrophobic의 순으로 나타난다는 것을 확인할 수 있었다.
유역 내 점오염원과 산림, 논, 밭, 조류, 지하수 등의 외부생성물질과 낙동강과 호소 내 내부생성 유기물의 TOC 농도 및 화학적 성상에 대한 연구결과는 낙동강 유역의 난분해성 유기물의 근원과 거동 및 이동경로를 파악하고 유기물의 성상 변화를 파악하는데 기초자료로 활용 되리라 생각되어지며, 특히 본 연구에서 확보된 다양한 기원별 DOM의 성상자료는 향후 낙동강 유기물의 유입원 판단과 변화 및 거동에 효과적인 수질관리는 물론 유역관리에 다양한 측면에서 유익할 것으로 생각된다.