For commercial production of greenhouse crops under shorter day length condition, supplementary radiation has been usually achieved by the artificial light source with higher electric consumption such as high-pressure sodium, metal halide, or incandescent lamps. Light-Emitting Diodes (LEDs) with several characteristics, however, have been considered as a novel light source for plant production. Effects of supplementary lighting provided by the artificial light sources on growth of Kale seedlings during shorter day length were discussed in this experiment.
Kale seedlings were grown under greenhouse under the three wave lamps (3 W), sodium lamps (Na), and red LEDs (peak at 630 nm) during six months, and leaf growth was observed at intervals of about 30 days after light exposure for 6 hours per day at sunrise and sunset. Photosynthetic photon flux (PPF) of supplementary red LEDs on the plant canopy was maintained at 0.1 (RL), 0.6 (RM), and 1.2(RH)μmol/m2/s PPF. PPF in 3 W and Na treatments was measured at 12μmol/m2/s. Natural light (NL) was considered as a control. Leaf fresh weight of the seedlings was more than 100% increased under the 3 W, Na and RH treatment compared to natural light considering as a conventional condition. Sugar synthesis in Kale leaves was significantly promoted by the RM or RH treatment. Leaf yield per 3.3m2 exposed by red LEDs of 1.2μmol/m2/s PPF was 9% and 16% greater than in 3W or Na with a higher PPF, respectively.
Growth of the leafy Kale seedlings were significantly affected by the supplementary radiation provided by three wave lamp, sodium lamp, and red LEDs with different light intensities during the shorter day length under greenhouse conditions. From this study, it was suggested that the leaf growth and secondary metabolism of Kale seedlings can be controlled by supplementary radiation using red LEDs of 1.2μmol/m2/s PPF as well as three wave or sodium lamps in the experiment.
온실과 같은 재배 시설내 구름, 강우 등의 기후변화에 의해 태양광 입사량이 부족해지거나 계절적으로 일장이 짧아지는 시기에는 작물의 광합성과 생장을 촉진시키기 위해서는 인공광을 이용하여 온실내 부족한 광을 인위적으로 보충해주는 보광기술이 필요하다(Albright, 1997; Dorais, 2003; Heo
상기 인공광원을 보광광원으로 사용할 경우 램프 자체로부터의 발열로 인해 동절기 이외에는 시설내 공조비가 증가하고 보광에 필요한 전력소모량이 높기 때문에, 발열량과 전력소모량을 절감시킬 수 있는 발광다이오드(Light-Emitting Diodes, LEDs)와 같은 대체광원에 대한 연구가 진행되고 있다(Bula
십자화과에 속하는 케일(
일반적으로 온실과 같은 시설내에서 녹즙용 케일 잎을 재배할 경우에는 화학물질을 사용하지 않고 미생물 제제를 사용하여 병충해를 방제하면서 친환경적으로 연중 재배한다. 하절기와 같이 자연일장이 비교적 긴 계절에는 문제가 되지 않지만, 가을부터 이듬해 봄까지 케일을 재배하는 경우에는 자연일장이 짧아지거나 구름, 강우 등에 의해 온실 내부로 입사되는 태양광의 양이 감소하여 케일 잎의 생체중이나 수량이 감소하게 된다. 따라서, 본 연구에서는 자연일장이 감소하는 시기에 시설내에서 케일을 재배하는 경우, 삼파장등, 나트륨 등 및 적색 LEDs를 인공광원으로 이용하는 보광재배가 케일신선엽의 생장 및 수량에 미치는 영향을 검토하였다.
식물재료는 파종후 3주간 육묘하여 본엽이 2~3매 전개한 케일(
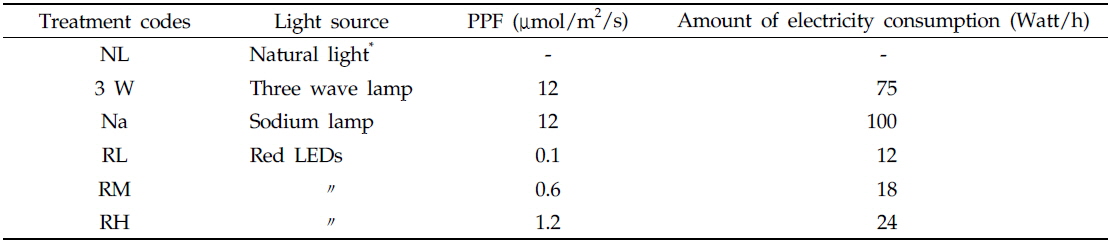
보광기간은 정식기인 9월부터 이듬해 3월까지 6개월로 하였으며 1일 평균 보광시간은 해질녘과 해뜰무렵 각각 3시간씩 총 6시간으로 설정하였다. 각 보광광원은 온실 지면에서 2 m 높이에 1 m 20 cm 간격으로 설치하였다. 보광을 위해 사용한 인공광원은 삼파장등, 나트륨등 및 630 nm 적색 LEDs 3종이였으며, 대조구는 보광을 하지 않은 자연광구(NL구)로 하였다(Table 1). 보광처리구 중에서 적색 LEDs 처리구의 보광강도는 각각 0.1 (10 Lux, RL구), 0.6 (50 Lux, RM구) 및 1.2 (100 Lux, RH구)μmol/m2/s의 세 수준으로 설정하였다. 또한 삼파장등(75 W, 3 W구) 및 나트륨등(100 W, Na구) 보광구의 보광강도는 12 (1,000 Lux) μmol/m2/s였다.
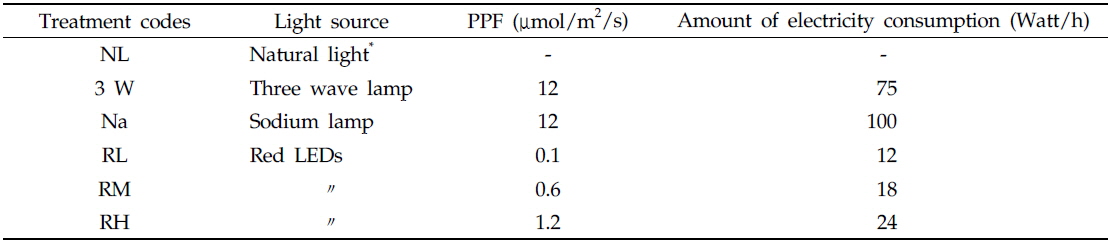
Experimental design and amount of electricity consumption in each treatments of the experiment
보광기간 동안 30일 간격으로 케일 실생묘 전개엽을 수확하여 총 6회 생육조사를 실시하였다. 임의로 선발한 20개체의 실생묘를 대상으로, 30일 간격으로 농가 출하시기에 맞추어 각 개체 하부의 전개엽을 차례로 수확한 후 생체중, 건물중, 엽장 및 엽폭 등을 측정하였다. 또한 1, 3 및 5회차 수확시에는 케일 잎을 수확하여 잎에서 합성된 당함량을 측정하여 평균값을 산출하였다(Rufty and Huber, 1983). 3.3 m2에 정식한 케일 개체수는 총 42개체로, 1개체에서 수확한 엽수를 수확량으로 하여, 보광개시 180일째 42개체 케일 잎의 평당 수확량을 조사하였다. 케일 잎의 건물중은 생체중을 측정한 후에 70° ℃로 설정된 드라이오븐(VS-1202D4, VISION Co., LTD, Korea)에서 4일간 건조시킨 후 측정하였다. 통계분석은 SAS 프로그램(Version 6.21; SAS Institute Inc., Cary, NC, USA)을 이용하여 수행하였으며, ANOVA 분석 후 6회 평균 생육 결과에 대하여 Duncan의 다중검정(
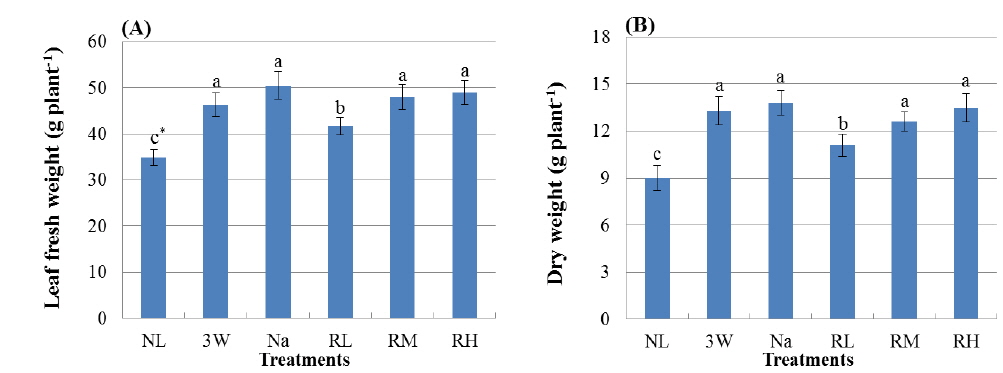
실험기간 동안 인공광원에 의한 보광강도 및 광질 제어는 케일 실생묘의 잎생장에 유의한 영향을 미치는 것으로 나타났다(Fig. 2). 삼파장등(3 W구), 나트륨등(Na구) 및 적색 LEDs (RL구, RM구 및 RH구)를 이용하여 보광 재배한 케일 잎의 생체중(엽병포함)은 보광하지 않은 자연광구인 NL구에 비해 증가하였다(Fig. 3A). 생체중은 NL구에서 최소값을 나타내었으며 보광강도 12 μmol/m2/s의 3 W구, Na구 및 1.2 μmol/m2/s의 RH구에서 증가하였고, 이들 세 처리구의 생체중 간에는 통계적인 유의성이 없는 것으로 나타났다. NL구의 생체중은 보광강도 0.1 μmol/m2/s의 적색 LEDs 보광구인 RL구에서 약 20%, RH구에서 40% 이상 증가하였으며, RM구와 RH구 간에는 보광강도 차이에 의한 유의성이 인정되지 않았다. RH구는 3 W구 및 Na구에 비해 보광강도가 1/10로 낮았음에도 불구하고 3 W 및 Na구에 비해 생체중이 감소하지 않았으며 세 처리구 간에 통계적인 유의차가 없는 것으로 나타났다. 건물중은 생체중 증가와 유사한 경향을 나타내었는데, 보광하지 않은 NL구에서 현저히 감소하였으며 3 W구, Na구 및 RH구에서 증가하는 것으로 보아 온실조건에서 보광재배한 케일 잎의 건물중 증가 역시 보광광도 보다 보광광질의 영향이 큰 것을 알 수 있었다(Fig. 3B). Na구에서 건물중이 증가하는 경향을, 3 W구에 비해 감소하는 경향을 보였으나 두 처리구간에는 통계적인 유의성은 없었으며, 3 W구, Na구와 RH구의 건물중은 NL구에 비해 47% 이상 증가하였다. 온실조건에서 적색광을 이용하여 보광하는 경우, 0.6 μmol/m2/s 이상의 보광강도에서는 건물중 증가에 유의한 차이를 나타내지 않았으며 0.1 μmol/m2/s의 낮은 보광강도 조건에서도 보광하지 않은 경우에 비해 건물중이 20% 이상 증가하였다.
일반적으로 단일의 적색광질은 엽채류를 비롯한 다양한 작물의 생체중, 건물중 및 광합성에 영향을 미치는 것으로 보고되고 있다(Yanagi
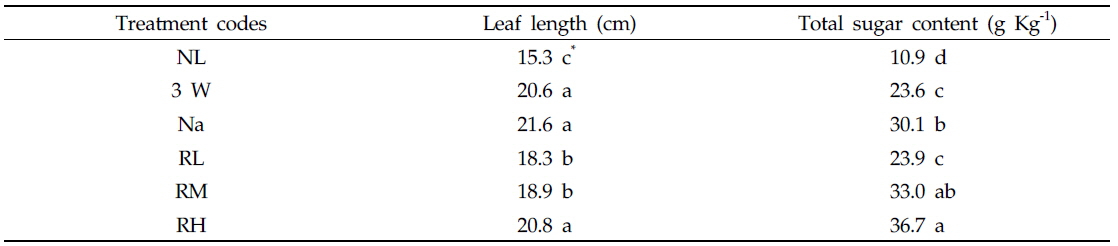
본 실험조건에서는 다른 보광처리구에 비해 비교적 보광강도가 높았던 3 W구, Na구와 RH구의 경우, 엽병을 제외한 엽장 신장은 보광광질이나 보광강도의 차이에 의한 영향이 그다지 크지 않은 것으로 나타났다(Table 2). 그러나, 적색 LEDs 보광구의 경우 보광광도가 0.1 μmol/m2/s인 RL구에서는 Na구에 비해 엽장신장이 억제되었다. 보광강도가 0.6, 1.2 또는 12 μmol/m2/s 였던 RM구, RH구, 3 W구 및 Na구의 엽장은 RL구에 비해 약 6%, NL구에 비해 17% 증가하였으며 NL구에서는 엽장신장이 억제되었다. 한편 결과에는 나타내지 않았으나 보광하지 않은 NL구에서는 보광강도 및 보광광질의 차이와 상관없이 케일 잎의 엽장 및 엽폭이 감소하는 것으로 보아, 보광에 의한 엽생장 촉진효과를 확인할 수 있었다. 본 실험조건에서 엽장/엽폭 비율 변화에는 통계적인 유의성이 인정되지 않았는데, 이는 실험기간 동안 보광강도 및 보광광질의 차이가 케일 잎의 형태적인 변화에는 영향을 미치지 않았다는 것을 의미한다.
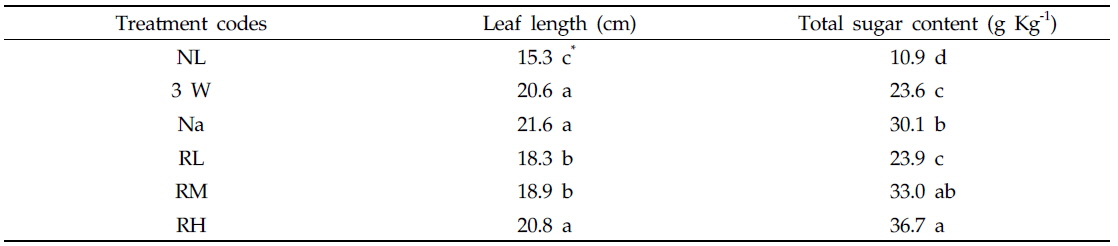
Leaf length and total sugar content in the leaves of kale seedlings grown under supplementary lighting conditions with different light sources or intensities for 30 days
보광기간 동안 케일 잎에서 합성된 당의 함량을 측정한 결과, 적색 LEDs 보광구의 경우 NL구에 비해 보광강도가 증가할수록 엽내 당합성이 촉진되어 보광강도 1.2 μmol/m2/s인 RH구에서 유의하게 증가하였다(Table 2). 그러나 RM구와 RH구에 있어서 보광강도의 차이에 의한 유의성은 인정되지 않았다. 엽내 당함량은 NL구에 비해 RH구에서 약 3.5배, RM구에서 약 3배 증가하였다. 12 μmol/m2/s로 보광강도가 높았던 3 W구와 Na구의 경우, Na구에서 3 W구에 비해 합성량이 27% 이상 증가하는 것으로 나타났다. 보광강도가 가장 낮았던 RL구에서는 보광강도가 120배 높았던 3 W구와 비교하여 당합성량에 유의한 차이가 인정되지 않았으나 NL구에 비해 2배 이상 증가하였다.
광합성 부산물의 하나인 당은 다양한 환경요인의 영향에 의해 합성되는데, 그중에서도 엽내에서 합성되는 당함량 증가에 영향을 미치는 광환경에 관한 연구결과들이 보고되고 있는데(Boo,
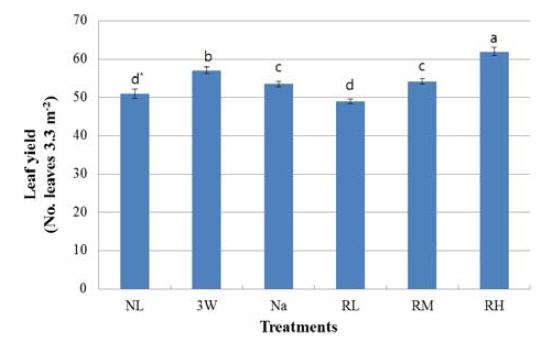
보광기간 중 3.3 m2 내 1개체당 30일 간격으로 수확된 총 케일 잎의 평균 수확량은 Fig. 4와 같다. 보광기간 동안 RH구의 수확량은 최대였으며, 보광강도가 높은 3 W구나 Na구에 비해 RH구에의 잎수확량은 각각 9% 및 16% 증가하였다. RL구와 NL구의 수확량은 다른 보광처리구에 비해 현저히 감소하였다. 본 실험에서 설정된 광강도 범위내에서 적색 LEDs는 삼파장등이나 나트륨등에 비해 보광강도는 현저히 낮은 조건이지만 보광강도가 증가할수록 수확량이 증가하는 경향을 나타내었다.
Gomez 등(2013)의 연구결과에 의하면 과채류인 토마토의 경우 고압나트륨등이나 LEDs를 보광광원으로 이용할 경우 보광하지 않는 것보다 토마토의 수량이 증가하지만 케일과 달리 보광광원의 차이에 따른 수량 차이는 없었다. 그러나 보광광원으로 이용한 고압나트륨등과 LEDs의 전력소모량에는 현저한 차이가 있을 것으로 판단된다. 본 실험조건에는 적색 LEDs 보광구 중에서 보광강도가 비교적 높았던 1.2 μmol/m2/s RH구 및 12 μmol/m2/s Na구의 경우, 두 처리구간의 보광강도 및 광질은 상이하였다. 그러나 보광시간이나 보광기간이 동일한 조건에서는 생체중이나 건물중 증가에 있어서 두 처리구간에 유의한 차이가 없었다. 또한 나트륨등의 시간당 전력소모량이 RH구에 비해 4배 이상 높은 것으로 보아, 경제적 측면에서도 적색 LEDs를 이용한 보광이 전기에너지 절감면에서도 유용하다는 것을 알 수 있었다. 밀의 경우에는 적색의 단일의 적색 LEDs 광질 이외에 청색이나 백색 LEDs를 적색 LEDs와 혼합하여 조사하는 것이 수량 증가에 유의하다고 보고되었다(Dong
한편, 모든 처리구 중에서 보광강도가 비교적 높았던 3 W구나 Na구에서는 RH구에 비해 생장량이나 수확량이 동등한 수준이거나 감소하는 경향을 보였는데, 온실조건에서 보광하여 케일을 재배할 경우에는 보광강도나 광질의 차이뿐만 아니라 보광광원으로부터의 발열도 잎 생장에 영향을 미친 것으로 판단된다. 실제로 적색 LEDs 보광구에 비해 3 W구나 Na구에서는 잎 끝이 마르거나 황화하는 현상이 관찰되기도 하였는데, 삼파장이나 나트륨 광원 하부에서 지표면 1 m 높이에서의 온도를 측정한 결과, 적색 LED 광원에 비해 3 W구나 Na구에서 평균 1.5~2℃ 높은 것으로 확인되었다.
결과에 나타내지는 않았으나 삼파장등, 나트륨등 및 적색 LEDs와 같은 인공광을 이용한 보광은, 보광하지 않은 NL구에서와 마찬가지로 실험기간 동안 케일 실생묘에서 개화 및 추대 현상은 관찰되지 않았다. 이로써 본 실험에서 설정된 0.1~12 μmol/m2/s 수준에서의 보광강도는 실험기간 9월에서 이듬해 3월까지 케일의 추대 및 개화에 영향을 미치지 않는 광강도 범위임을 알 수 있었다. 특히, 1.2 μmol/m2/s 적색 LEDs 보광구에서 케일 잎의 수확량이 유의하게 증가한 것은 적색광질이 엽채류 개화 및 추대지연에도 영향을 미쳤다는 것을 시사한다. 개화와 관련된 광질 특성 연구는 주로 화훼류를 중심으로 연구되고 있는데, Arabidopsis에서도 적색광질 조건에서 개화가 지연되었으며(Kenneth, 2006), 케일에서도 마찬가지로 적색광 하에서 개화가 지연되는 것으로 보아, 잎을 수확하는 엽채류의 경우에 개화 및 추대 특성이 수확량과 연결되기 때문에 특정 파장역을 갖는 LEDs를 보광광원으로 이용할 경우에는 보광광질의 특성을 파악하여 보광광원을 결정해야 할 것으로 생각된다.
일반적으로 녹즙용 케일은 2월과 9월 년 2회 파종하여 신선엽을 지속적으로 수확하는데, 2월 파종 실생묘의 경우 일반적으로 6월 이후부터 8월 수확기까지 고온장일 의 보광하지 않은 자연광 조건에서는 개화 및 추대가 관찰된다. 한편 9월 파종 실생묘의 경우, 춘 하절기에 비해 추 동절기에는 자연일장이 짧아지고 외부 기온이 낮아지기 때문에 의해 인공광원을 이용한 적정 광강도 수준에서의 보광에 의한 일장 연장이 케일 실생묘의 개화 및 추대에는 영향을 미치지 않은 것으로 생각된다. 온실내에서 나트륨이나 메탈할라이드 등과 같은 인공광을 이용한 보광은 온실작물의 주년생산을 위해 필요한 재배기술의 하나이다(Dorais, 2003; Moe