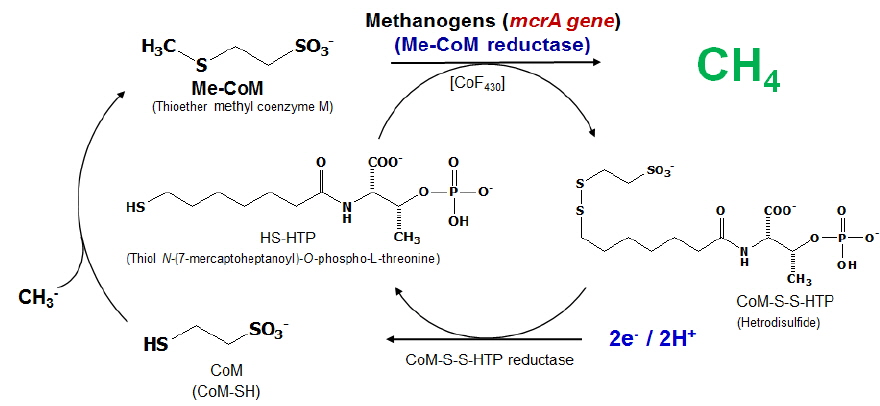
Methane(CH4) is considered as the secondmost potent greenhouse gas after carbon dioxide (CO2). Methanogenesis is an enzyme-mediated multi-step process by methanogens. In the penultimate step, methylated Co-M is reduced by methyl Co-M reductase (MCR) to CH4 involving a nickel-containing cofactor F430. The activity of MCR enzyme is dependent on the F430 and therefore, the bioavailability of Ni to methanogens is expected to influence MCR activity and CH4 production in soil. In this study, different doses of EDTA(Ethylene Diamine Tetraacetic Acid) were applied in flooded soils to evaluate their suppression effect on methane production by chelating Ni of methanogenesis cofactor.
EDTA was selected as chelating agents and added into wetland and rice paddy soil at the rates of 0, 25, 50, 75, and 100 mmol kg-1 before 4-weeks incubation test. During the incubation, cumulative CH4 production patterns were characterized. At the end of the experiment, soil samples were removed from their jars to analyze total soil Ni and water-soluble Ni content and methanogen abundance. Methane production from 100 mmol application decreased by 55 and 78% in both soils compared to that from 0 mmol. With increasing application rate of EDTA in both soils, water-soluble Ni concentration significantly increased, but total soil Ni and methanogen activities showed negative relationship during incubation test.
The decrease in methane production with EDTA application was caused by chelating Ni of coenzyme F430 and inhibiting methanogenesis by methyl coenzyme M reductase. Consequently, EDTA application decreased uptake of Ni into methanogen, subsequently inhibited methanogen activities and reduced methane production in flooded soils.
메탄은 이산화탄소에 이어 두 번째로 발생량이 많은 온실가스로 높은 적외선 흡수능과 대기 중에서의 반응 때문에 이산화탄소의 약 25 배에 달하는 지구온난화지수(Global warming potential, GWP)를 지니고 있다. IPCC (Intergovernmental Panel on Climate Change, 2007)에 의하면 논이나 습지토 양과 같은 담수 토양에서 방출되는 메탄의 비율은 전체 발생량의 약 30%를 차지한다고 한다.
메탄생성반응은 메탄생성균에 의해 다단계의 효소 반응을 거쳐 일어난다. 이러한 메탄 생성균은 공통적으로
지금까지 coenzyme F430은 methanogenic archaea에서 오직 발견되어지고 있다. 니켈 원자 배위의 존재와 피롤 고리 체계에서의 환원 위치는 oenzyme F430의 두드러지는 특징을 가지며(Friedmann
메탄생성균에 의한 메탄생성 반응으로부터 메탄 생성균 체내에 기질 유입량을 조절하여 전구체 Methyl Coenzyme M (CH3-S-CoM) 양을 저감시키거나, 메탄 생성효소인 MCR의 활성을 조절하여 메탄 발생량을 저감시키는 것이 가능할 것으로 판단되어 진다. 메탄 생성균의 니켈 흡수를 방해하여 MCR의 활성을 억제하고 메탄 생성량을 효과적으로 저감시키는 방안으로서 상대 음이온과의 침전, 석회처리를 통한 pH 상승에 따른 니켈 용해도를 감소시키는 방법이 있으며, 킬레이팅 에이전트를 이용한 킬레이팅 결합을 통한 cofactor F430과의 결합을 저해시키는 방안을 고려해 볼 수 있다. 특 히 킬레이팅 에이전트는 중금속을 가진 복합체로서 물에 쉽게 용해 가능한 형태로 변형된다고 한다(Chen and Cutright, 2001).
따라서 메탄 생성균의 Intracellular bochemical reaction에 의해 메탄이 생성되기 때문에 EDTA와 같은 유기성 킬레이팅 에이전트로 자유 니켈 (Free Ni2+)을 킬레이트화 시키면 Cofactor인 Ni의 미생물체내 흡수를 억제할 수 있어 메탄 생성량을 효과적으로 저감 시킬수 있을 것으로 판단되어진다. 본 연구에서는 담수토양 중 논토양과 습지토양에서 EDTA가 enzyme M reductase의 보효소 coenzyme F430 내의 니켈을 킬레이팅하여 효과적인 메탄 저감이 가능한지 평가하고자 하였다.
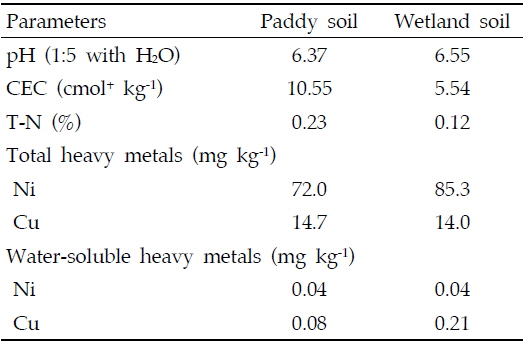
킬레이팅 에이전트 처리에 따른 메탄 생산량 저감의 효과를 조사하기 위한 시험을 외부의 간접요인을 차단하기 위해 실내에서 정밀하게 실시하였다. 실험 대상 토양인 벼 재배 논토양과 습지토양을 채취하여 자연건조 후 사분(<2mm)하여실내 실험에 이용하였다. 실험에 사용한 논토양은 pH가 6.37로서 국내 논토양 평균 5.5-5.9보다 다소 높았으며(농촌진흥청, 1985), 공시 토양의 이화학적 특성은 Table 1과 같다.
[Table 1.] Soil properties before the test
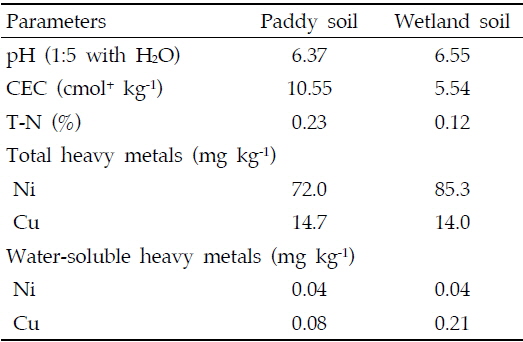
Soil properties before the test
사분된 토양 25g을 125ml vial병에 넣고, 처리 제재인 킬레이팅 에이전트로서는 Ethylene Diaminetetraacetic acid (EDTA)를 선정하여 이용하였다. 처리량은 토양 무게의 0, 25, 50, 75, 100 mmol의 비율로 0, 0.183, 0.365, 0.548, 0.731 g을 토양 전체와 완전 혼합 후 증류수 50 mL를 넣어 수위를 토양으로부터 3 cm 높이로서 담수상태화 시켰다. vial병 headspace는 폐쇄시킨 뒤 30-35℃의 암 조건에서 인큐베이터를 이용하여 4주간 이루어졌다(Yang and Chang, 1998). 시험 기간 동안 담수상태는 상시 3 cm 높이로 유지하였다.
가스 채취는 실내 시험 실시 1일 후부터 나흘간격으로 한번씩 이루어 졌다. Headspace에서 채취된 가스 시료는 Gas Chromatography(packed with Porapak NQ column(Q80-100mesh) and a flame ionization detector(FID),Shimadzu, GC-2010, Tokyo) 로 분석하였으며, 이때 column 100 ℃, injector 200 ℃, detector 200 ℃로 온도 설정 하였으며 운반 기체로는 헬륨을, 연소기체로는 수소를 이용하였다. 메탄 생산량은 다음 식에 따라서 계산하였다.
CH4 Production(mg kg-1) = CH4 Flux(㎕ L-1)⋅d⋅h / Soil Weight(g) [d= Methane density (0.714 kg m-3), h= Headspace volume(mL)]
시험 후 자연 건조시킨 토양을 이용하여 총 니켈 함량을 분석하기 위해 1 g의 토양을 20 ml의 왕수(Aqua regia, HCl:HNO3, 3:1 v v-1)에 강열 분해시켰으며, 수용성 니켈 함량을 측정하기 위해 토양 2 g에 10 mL의 증류수를 가해 1시간동안 침출하고 여과한 후 ICP-OES(Inductively coulpled plasma-optical emission spectrophotometer, Shelton Connecticut USA)를 이용하여 니켈의 함량을 측정하였다. 토양수는 0.45 ㎛ membrane Filter로서 여과시켜 Ni 함량을 조사 하였다.
일반적으로 메탄생성균의 정량 분석은 대부분의 메탄생성균에 존재하는
통계 분석은 SAS package version 9.2 을 이용하여 실시하였으며 최소유의차 (LSD, Least significant difference)를 이용한 분산분석 (ANOVA, analysis of variance) 방식으로 각 처리구간의 평균값 간의 차이를 비교하였다. 또한 상관관계 분석은 PASW statistics 18.0 을 이용하여 실시하였으며 단순 상관분석(Simple correlation analysis)으로서 Pearson 상관계수 (Pearson correlation coefficient)을 이용하여 각 변수간의 상관관계를 비교하였다.
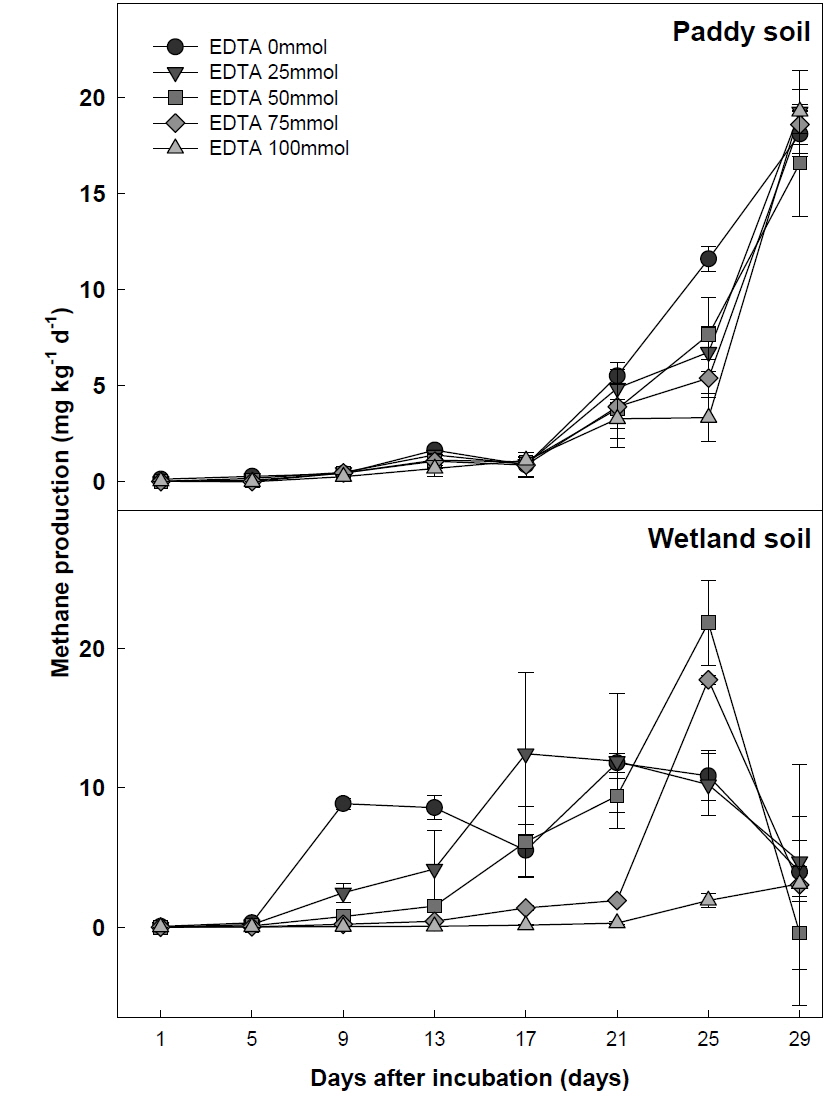
논토양에서는 실내 시험 시작 후 17일 경과까지 메탄 생산량이 증가하지 않았으나, 이후부터 메탄 생산량이 크게 증가함을 관찰할 수 있었다(Fig. 1). 이는 벼 재배를 위해 시용 되었던 질소 비료에 의해 증가한 질산태 질소가 전자수용체로서 작용하여 일시적으로 메탄 생성균의 활성을 저해시켜 메탄이 17일 경과 후에 증가한 것으로 판단된다(Wang
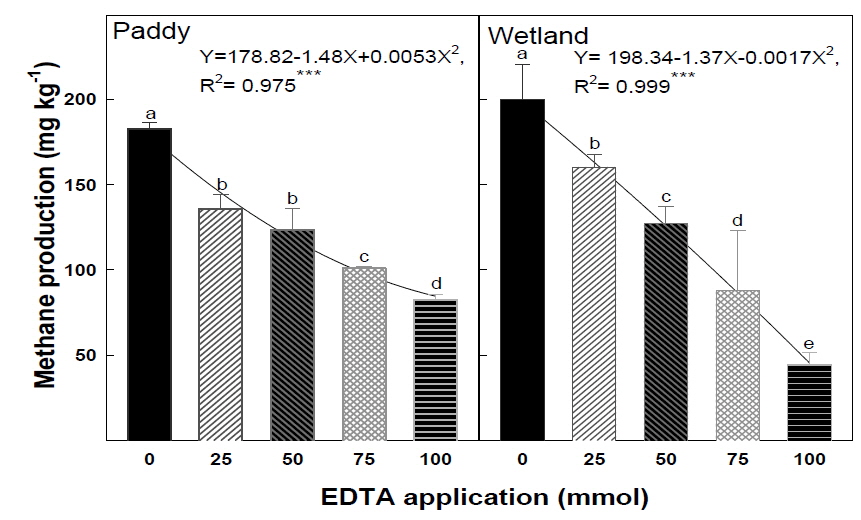
EDTA 처리량에 따른 4주간의 총 메탄 생산량은 논토양의 EDTA 0 mmol 처리구에서 182.8 CH4 mg kg-1, 100 mmol 처리구에서 82.4 CH4 mg kg-1 으로 EDTA 100 mmol 처리구에서는 0 mmol 대비 약 55 %의 메탄 생산량이 감소하였다. 습지토양의 총 메탄 생산량은 EDTA 0 mmol 처리구에서 199.7 CH4 mg kg-1, 100 mmol 처리구에서 44.7 CH4 mg kg-1로서 약 78 %의 메탄 생산량 이 저감되었다(Fig. 2). 이상의 결과를 통해 EDTA 처리량이 증가함에 따라 메탄 생산량 저감효과가 증대됨을 확인하였다.
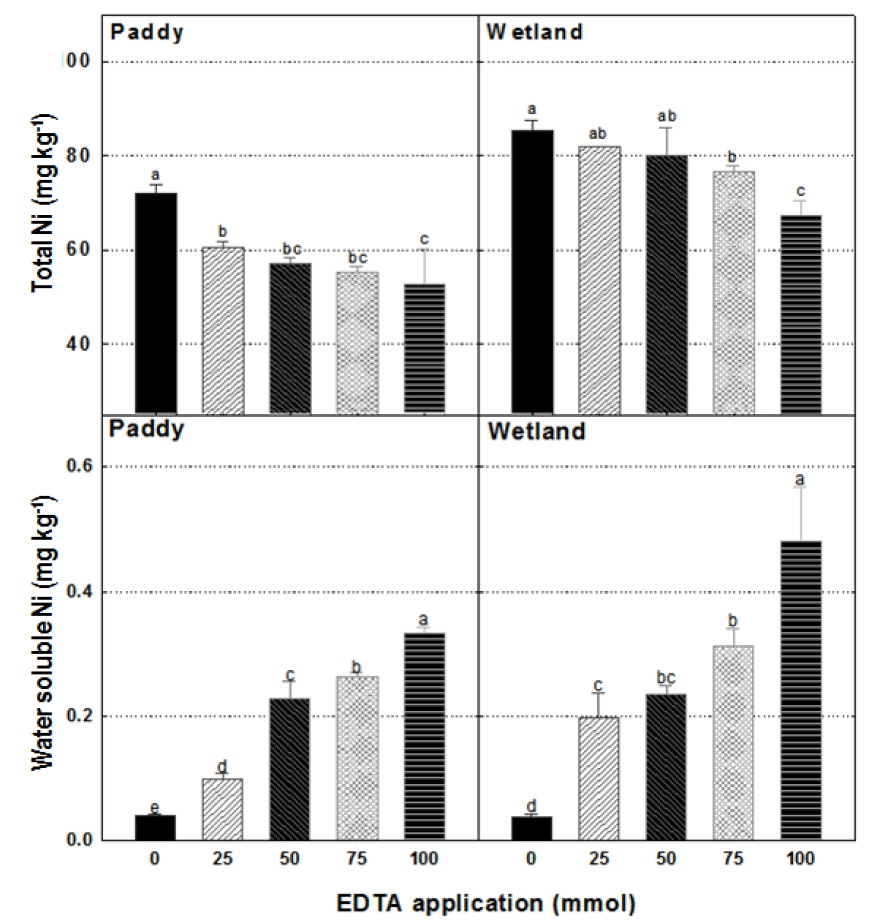
EDTA 처리에 따른 메탄 저감효과에 대한 영향인자를 확인하기 위해 시험 후 토양의 총 니켈 및 수용성 니켈을 측정하였다. 논토양과 습지토양 모두에서 EDTA의 처리량을 증가시킴에 따라 총 니켈 함량이 감소하는 경향을 보였다(Fig. 3). 이는 킬레이팅 에이전트가 니켈 이온과 결합함에 따라 토양 내 존재하는 MCR의 활성이 감소함으로서 토양수로 니켈이온이 용해된 것으로 고려되어진다. 토양의 총 Ni 함량과는 달리, EDTA 처리량 증가는 토양 내 수용성 니켈 함량을 증대시켰다. 논토양에서 EDTA 0 mmol 처리구 0.04 mg kg-1, EDTA 100 mmol 처리구 0.33 mg kg-1이며 습지토양에서 EDTA 0 mmol 처리구 0.04 mg kg-1, EDTA 100 mmol 처리구 0.48 mg kg-1 으로 나타났다 (Fig. 3). 이는 니켈이온이 EDTA에 의해 킬레이팅 됨에 따라 MCR이 이용하지 못하여 상대적으로 물 속에서 용해 가능한 니켈이 높아졌기 때문이라고 판단되어 진다(Kosson and Garrabrants, 2000; Chen and Cutright, 2001).
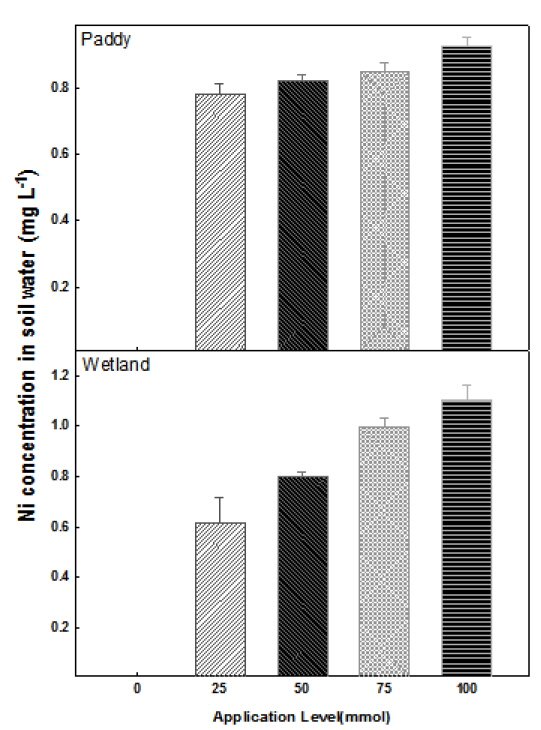
다른 형태의 토양 내 Ni 함량 조사와 함께 토양수 내 용해된 수용성 니켈 함량을 알아본 결과, EDTA 처리량의 증가에 따라 토양수 내 니켈 함량이 증가하는 경향을 보였다(Fig. 4). EDTA 0 mmol 처리구에서는 논토양과 습지토양에서 니켈 함량이 측정되지 않았다. 그러나 토양수 내 니켈함량은 EDTA 처리를 함에 따라 나타났으며, 논토양은 EDTA 25 mmol 처리구와 100 mmol 처리구 간에 각각 0.78, 0.93 mg L-1로서 0.15 mg L-1의 차이를 보였고 습지토양은 각각 0.61, 1.10 mg L-1로서 0.5 mg L-1의 차이를 보였다 (Fig. 4). 실제 토양수내 용해된 수용성 니켈의 함량은 EDTA 100 mmol 처리구에서 전체 토양수 50 mL에 대하여 습지토양의 경우 0.06 mg이었고 논토양의 경우 0.05 mg이었다. 하지만 총 니켈 함량의 감소량에 비해 토양수 내 용해되어 나온 수용성 니켈 함량 간의 차이는 크게 없었다. 이는 니켈이 수용성 니켈이 아닌 다른 형태로 전환 되었거나 토양 내 EDTA 처리량에 따른 토양부피 증가에 따른 니켈 농도의 희석효과라고 판단되어 진다.
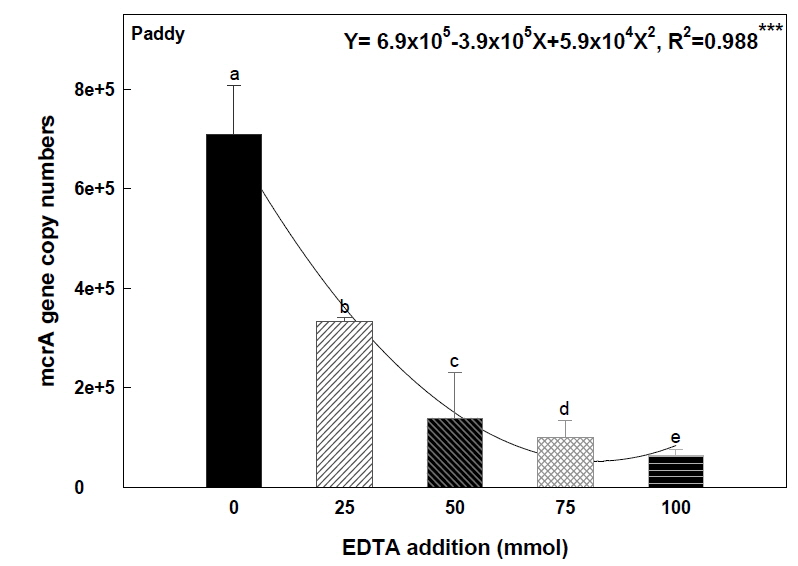
논토양에서 메탄 생성균의 활성, 즉 mcrA 유전자의 개체수를 Quantitative PCR을 통해 알아본 결과, EDTA 처리량의 증가에 따라 유의적으로 메탄 생성균의 활성이 감소함을 보였다. EDTA 0 mmol 처리구에서 mcrA 유전자의 개체수가 7.08×105 이며 그에 반해 100 mmol 처리구에서는 6.46×104 으로 상당히 감소함을 확인할 수 있었다(Fig. 5). 이는 토양 내 메탄 생성균이 흡수 할 수 있는 토양 내 수용성 니켈 함량과 토양수 내 니켈함량이 증가함에 따라 보효소 coenzyme F430 내의 니켈의 미생물 체내 흡수가 억제되게 되고 그에 따라 메탄 생성균의 활성(
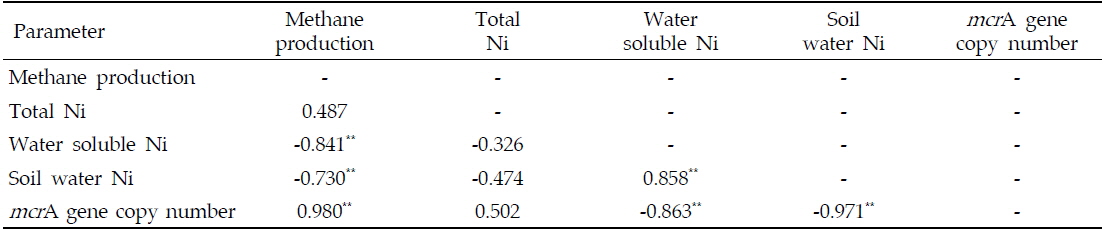
EDTA 처리에 따른 메탄 생산량 감소에 영향을 미친 결정적인 요인을 분석하기 위해 각 변수간의 상관관계를 알아 보았다. 메탄 생산량과 토양 내 니켈 함량 간에는 총 니켈 함량의 경우 0.487로서 유의한 상관관계를 보이진 않았으나, 토양 내 수용성 니켈 함량과는 상관계수가 -0.841**로서 상당히 유의한 부의 상관관계를 가지고 있는 것으로 나타났으며 토양수 내 니켈 함량과는 상관계수가 -0.730**로서 높은 부의 상관관계를 보였다. 따라서 EDTA 처리에 따라 수용성 니켈이 증가하는 것은 메탄 생산성에 크게 영향을 주었을 것으로 고려되어 진다(Table 2). 또한 토양 내 메탄 생산균의 활성과 인큐베이션 실험 후 메탄 총 생산량은 변수 중에 가장 높은 상관계수인 0.980**로 나타났으며 상당히 유의한 정의 상관관계를 가지고 있는 것으로 보아 메탄생성균의 활성이 메탄 생산량에 가장 큰 영향을 미쳤을 것이라 판단된다.
[Table 2.] Correlation among parameters after incubation test
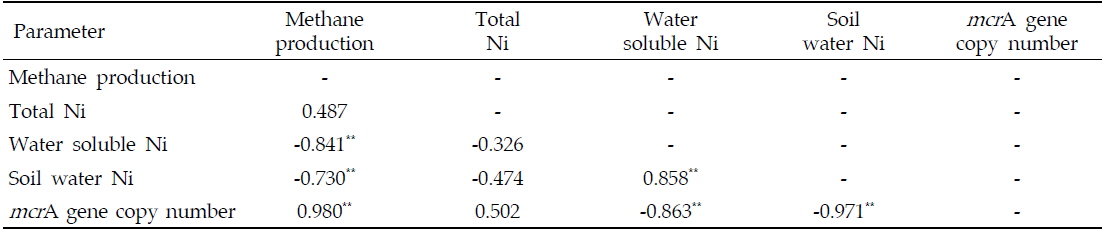
Correlation among parameters after incubation test