뇌졸중은 사망률이 높을 뿐 아니라 심각한 후유증을 동반하는 가장 흔한 질환중 하나로1,2), 뇌졸중 후 동반되는 뇌손상과 인지 및 각종 기능장애를 극복하기 위한 치료제 개발에 집중해 왔다. 하지만 여러 위험요소와 부작용을 내포하고 있어 아직까지 신경세포를 보호할 수 있는 획기적인 치료법은 없는 실정이다3).
뇌허혈(腦虛血)에 의한 신경세포 손상은 초기와 후기로 나누어지는데 초기에는 대부분 뇌졸중으로 유발된 허혈로 인해 일시적 혈관폐쇄가 일어나 산소부족으로 신경세포가 괴사하게 되고, 후기에는 재관류 후 활성산소(ROS)에 의해 지연성 세포사(delayed neuronal death)가 일어나게 된다4,5). 생체 내에서는 활성산소에 대한 방어기구로 다양한 항산화 효소 및 비타민(vitamin) 같은 항산화 물질이 존재하여 스스로를 보호하고 있는데, 과도한 활성산소의 발생은 산화적 스트레스(oxidative stress)를 야기하여 세포자연사(apoptosis)를 일으킨다6). 따라서 산화적 스트레스가 후기 허혈성 뇌손상의 주요 원인으로 주목 받고 있으며7,8), 산화적 스트레스는 지연성 세포사에 관여하는 것으로 알려진 각종 염증의 중개물질로도 작용하는 것으로 알려져 있다9).
Donepezil (AriceptTM)은 비교적 경미한 Alzheimer형 치매의 신경증상 완화를 위해 개발된 중추성 acetylcholinesterase(ACE) 억제제로서10), 현재 다양한 정도의 알츠하이머 치매뿐만 아니라11,12) 혈관성 치매치료에도 사용되고 있으나13), 임상에서 의도하지 않은 여러 부작용이 유발되는것으로 알려져 있어 그 사용이 제한되고 있는 실정이다14). 하지만 donepezil은 설치류, 특히 rat의 경우 10 mg/kg 전후의 용량에서 뇌 조직에 대한 강력한 항산화 효과를 통한 신경보호 효과를 나타내는 것으로 알려져 있어, 신경보호 약물 개발에 대표적인 대조 약물(reference drug)로 사용되고 있다15,16).
허혈성 신경세포 손상은 혈관성 치매의 주요 원인으로17) 최근 진단기준의 확립, 예방과 치료의 높은 가능성, 알츠하이머 치매와의 유관성이 밝혀지면서 점점 연구가 활발해지고 있다18). 뇌손상 관련 질환은 한의학에서 중풍(中風)의 범주에 해당되며 원인으로는 내풍선동(內風旋動), 기혈역란(氣血逆亂), 협담협화(挾痰挾火), 졸연혼도(卒然昏倒), 반신불수(半身不隨), 수족탄탄(手足癱瘓) 등이 있다고 알려져 있다19).
성심산(醒心散, Sungshim-san; SSS)은 심(沈)의 ≪심씨존생서(沈氏尊生書)≫에 처음으로 수록되었으며20) 이후 조선시대 의가인 허준(許浚)의 ≪동의보감(東醫寶鑑)≫에 소개된 처방으로 인삼, 맥문동, 오미자, 원지, 백복신, 생지황, 석창포 등 7종의 약재로 구성되며 “치심허열(治心虛熱)”이라 하여 심(心)의 허열을 다스린다고 기록되어 있다21). 현재까지 성심산(醒心散)의 노화 억제와 관련한 연구에서 심장 내 과산화지질 및 유리기의 생성에 유의하게 작용하는 항노화 효과가 관찰된 바 있고22), 각 구성 약물의 신경보호 효과가 이미 잘 알려져 있다. 한편 심허열(心虛熱)은 주로 심혈허(心血虛) 및 심음허(心陰虛)와 관련되어 건망 등의 뇌졸중 유사 증상을 동반하나23,24), 현재까지 뇌와 직접적으로 연관된 신경보호 및 항산화와 관련한 성심산(醒心散)의 연구결과는 거의 없었다.
이에 저자는 현재 한의학에서 심장보호 작용으로 알려져 있는 성심산(醒心散)의 허혈성 뇌손상에서 인지 및 운동기능 회복효과를, 심한 뇌졸중 동물모델인 pMCAO rat를 이용하여 평가해 유의성 있는 결과를 얻었기에 이에 보고하는 바이다. 본 실험에서는 성심산(醒心散)을 경구투여하고, 체중, infarct volume, 신경학적 운동행동 및 인지적 운동행동 검사의 변화를 관찰하였으며, 실험결과는 donepezil 10 mg/kg 투여군15,16)과 각각 비교하였다. 신경학적 운동행동 검사로 limb placing test25) 및 body swing test26)를, 인지적 운동행동 검사로 water maze test를 이전의 방법27)에 따라 측정하였다.
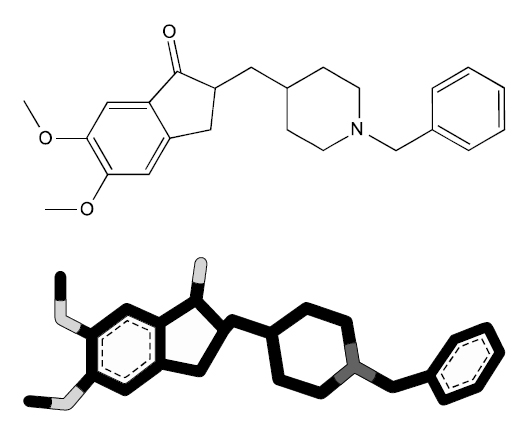
본 실험의 약재는 대구한의대학교 방제과학글로벌 연구센터에서 매입한 것을 관능검사를 통하여 선정된 것을 사용하였으며, 본 실험에 사용된 성심산(醒心散,Sungshim-san;SSS)의 조성은 Table 1과 같다. 선정된 약제 30첩 분량(787.5 g)을 전기 미세분쇄기(Sungchang Machine Co., Sungnam, Korea)로 세말하여, 정제수 10 L로 80℃에서 3시간 동안 3번 가열 추출한 후, 흡인 여과한 여과액을 rotary vacuum evaporator (Eyela N-1110, Tokyo, Japan) 로 감압·농축하여 점조성의 추출물을 얻은 다음 programmable freeze dryer (Operon FDB-5503, Kimpo, Korea)를 사용하여 동결 건조시켜, 총 132.45 g (수율 약 16.82%)의 연갈색 물 추출물을 얻어 실험에 사용하였다. 물 추출한 성심산(醒心散) 동결 건조물은 −20℃의 냉장고에 보관 후 실험에 사용하였으며, 용매인 증류수에 100 mg/ml의 농도까지 갈색으로 비교적 잘 용해되었다. 일부 성심산(醒心散) 물 추출 동결건조물은 방제과학글로벌 연구센터의 시료보관 냉장고에 −20℃ 조건하에 보관하였다(Lot No: SSSKu 2013-01). 또한 백색분말의 donepezil HCl H2O (Fig. 1)은 Jeil Pharm., Co., Ltd (Youngin, Korea)에서 제공받아 대조 약물로 사용하였다.
[Table 1.] Composition of Sungshim-san Used in This Study

Composition of Sungshim-san Used in This Study
120마리의 수컷 Sprague-Dawely Rat (6-wk old upon receipt, SLC, Japan)를 10일의 순화과정을 거쳐 실험에 사용하였으며, 순화과정 및 실험 전 기간 동안 온도(20~25℃), 습도(50~55%) 및 명암주기(12시간 주기)가 일정하게 유지된 사육실에서 rat용 polycarbonate 사육상자에 5마리씩 수용하여 사육하였고, 사료(Samyang, Korea)와 음수는 자유롭게 공급하였다. pMCAO 수술 24시간 후 생존한 실험동물 중 신경운동학적 및 인지행동 검사를 통하여, 유사한 이상 소견을 보이는 대략 반수 정도의 실험동물만 선정하여, 실험 군당 8마리씩 무작위 배치시켜 실험에 사용하였다. 또한 8마리의 위수술 동물을 선정하여 위수술 대조군으로 사용하였다. 모든 실험동물은 수술일 및 최종 부검일에 각각 18시간 정도 절식을 실시하였으며(음수는 자유롭게 공급함), picric acid로 개체를 식별하였다. 본 실험에 사용된 모든 실험동물은 국제 기준에 부합되는 “대구한의대학교 동물실험 윤리 위원회”의 규정을 준수하여 취급하였으며, 사전 승인 하에 실험을 실시하였다[승인번호: DHU2013-024].
실험동물은 군당 8마리씩 Table 2에 기록한 6그룹으로 구분하였다. 즉, 위수술을 실시한 후 멸균 증류수를 투여한 위수술 대조군(sham control), pMCAO 수술 후 멸균 증류수를 투여한 pMCAO 대조군(pMCAO control), pMCAO 수술 후 donepezil 10 mg/kg 투여군(대조약물군; reference), pMCAO 수술 후 성심산(Sungshim-san; SSS) 400 mg/kg(SSS 400), 200 mg/kg (SSS 200) 및 100 mg/kg (SSS 100) 투여군의 6군으로 구분하여 실험하였다(Table 2). 성심산(醒心散) 400 mg/kg, 200 mg/kg 및 100 mg/kg은 각각 80, 40, 20 mg/ml의 농도로, donepezil은 2 mg/ml의 농도로 멸균 증류수에 용해시켜 동물 체중 kg당 5 ml의 용량으로 매일 1회씩 28일간 금속제 Sonde (Jeongdo Industry Co., Seoul, Korea)가 부착된 5 ml 주사기(syringe)를 이용하여, pMCAO 수술 24시간 후부터 강제 경구 투여하였다. 본 실험의 사용한 성심산(醒心散) 400, 200 및 100 mg/kg은 rat에서 250 mg/kg 투여군에서 명확한 항노화, 항산화 효과를 나타낸 이전의 보고22)를 기준으로 선정하였으며, donepezil 역시 이전의 실험들15,16)의 결과를 바탕으로 rat에서 확실한 항산화 효과를 통한 신경보호 효과를 나타내는 것으로 알려져 있는 10 mg/kg을 투여용량으로 선정하였다.
[Table 2.] Experimental Design Used in This Study
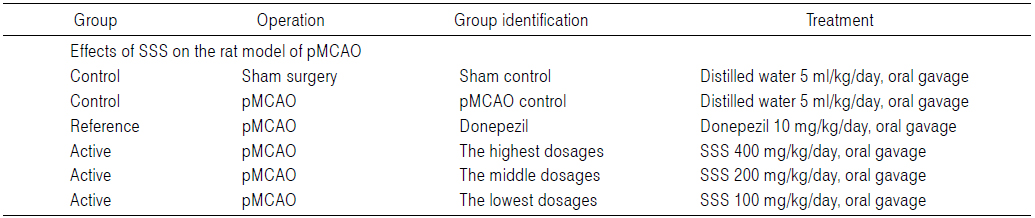
Experimental Design Used in This Study
Severe stroke을 유발하기 위해 이전의 방법28)에 따라 우측 proximal MCA를 영구적으로 폐쇄하였다. 즉, 70% N2O와 28.5% O2가스에 1.5% isoflurane (Hana Pharm. Co., Hwasung, Korea)을 혼합한 마취가스로 전신마취를 시킨 후 수술대에 고정하고, 안와와 외이도 사이에 가로로 우측 두부 피부를 절개하여 측두근(temporalis muscle)을 노출시킨 후, 안면신경(facial nerve)과 안와골(zygomatic arch)에 손상 없이 절제하여 측두골의 일부를 노출시켰다. 이후 dental drill (Saeshin, Daegu, Korea)을 이용한 subtemporal craniectomy를 통하여, proximal MCA를 노출시켰다. 다음으로 olfactory tract 근처의 cerebral vein 직하에서 micro-bipolar coagulator (Harvard Apparatus, Holliston MA, USA)를 이용하여 혈관부위를 압박하여 열을 가해 응고를 유발시켜 proximal MCA를 영구적으로 폐쇄하였다. 흡입전신마취 후 직장온도계와 열 패드를 이용하여 체온을 일정하게 유지시켰으며, 그 결과 rat의 전체적인 사망률은 10% 이하로 관찰되었다. Sham MCAO는 pMCAO에서와 동일한 방법으로 proximal MCA를 노출시킨 다음 microbipolar coagulation을 실시하지 않고, 창강을 폐쇄하였다.
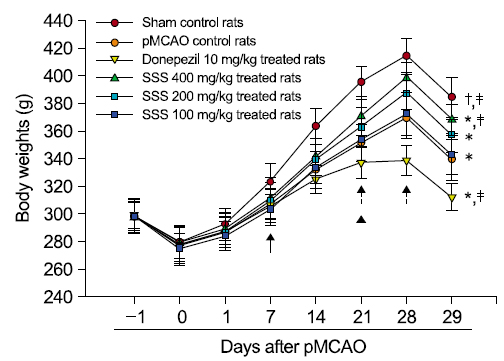
모든 실험동물의 체중을 pMCAO 수술 1일전, pMCAO 수술일(투여 시작일), pMCAO 수술 1, 7, 14, 21, 28 및 최종 희생일(pMCAO 수술 29일 후)에 각각 측정하였으며, 사료섭취에 따른 체중 변화를 최소화하기 위해 pMCAO 수술일 및 최종 희생일에 모든 실험동물을 18시간 정도 절식시켰으며, 실험 시작시의 개체 차이에 의한 체중 변화를 최소화하기 위해 하기의 공식 [1]을 이용하여 투여 시작일에서 투여 29일 후까지의 체중 변화량인 증체량(body weight gains)을 산출하였다.
EQUATION [1]. Body Weight Gains(g) during 29 Days after pMCAO
= (Body weight at the 29 days after pMCAO − body weight at the day of pMCAO)
pMCAO에 의한 신경학적 운동행동 검사는 체지 배치 검사(limb placing test)25) 및 body swing 검사26)를 이용하여 평가하였다. 신경학적 운동행동 검사는 pMCAO 수술 1일전 base line을 설정하기 위해 실시하였으며, pMCAO 수술 24시간 후 일정한 점수를 나타내는 동물만 선정하여 실험에 사용하였고, 이후 pMCAO 1, 3, 7, 14, 21 및 28일 후에 각각 약물 투여 전 실시하였다.
1) Limb placing test
평가 시 관찰자가 실험군 및 실험동물의 개체 번호를 알지 못하도록 하여, 전지(forelimb) 및 후지(hindlimb)에 대한 위치 이상 여부를 각각 독립적으로 실시하였다. Forelimb placing 검사를 위해 전지가 자유롭도록 실험동물의 몸통을 잡아 실험대의 모서리 부분으로 천천히 움직이면서, 시각, 코털(vibrissae) 감각, 촉각 및 고유감각 등 4가지 감각에 대한 배치이상 유무 검사를 실시하였다. Hindlimb placing 검사에서는 동일한 방법으로 촉각 및 고유감각에 의한 배치 이상 유무를 검사하였다. 각각의 감각에 대한 척도는 즉각적으로 정확하게 배치시키면 0점, 한쪽 발만 배치시키면 1점, 불완전하지만 2초 이상 지연된 이후 배치시키면 2점, 반응이 없으면 3점을 주어, Forelimb placing 검사는 총점 0점을 정상으로, 12점을 최대 신경 장애 점수로 하였으며, Hindlimb placing 검사는 총점 6점으로 검사를 수행하였다.
2) Body swing test
실험동물의 꼬리 시작점에서 2 cm정도 떨어진 부분을 잡고 실험대에서부터 대략 2 cm정도 떨어지게 들어 올렸을 때 수직선상에서 머리를 좌측 또는 우측으로 10° 이상 움직인 경우를 body swing으로 간주하였다. 정상 동물에서 좌우 body swing의 비율이 대략 1:1인 반면에, 오른쪽 pMCAO를 실시한 경우, 실험동물은 수술한 반대편인 좌측으로만 body swing을 하려는 경향을 나타내므로, 실험동물 당 총 30번의 body swing동안 수술부위 반대쪽인 왼쪽으로의 body swing 횟수에 대한 수술부위인 오른쪽으로 body swing의 비율을 각각 산출하였다.
실험동물의 인지행동 이상 유무를 검사하기 위해, water maze test를 이전의 방법27)에 따라 pMCAO 14 및 28일후 각각 측정하였다. 모든 실험동물은 3회의 시도를 통해 water maze tank (150×50 cm)내 escape platform (15×30 cm)에 도달하기까지의 거리 및 시간을 측정하여, 인지 및 학습 능력의 변화를 관찰하였다. 즉, 검사장비는 직경 150 cm, 높이 50 cm인 원통형의 검은색 수조가 사용되었고, 직경 15 cm, 높이 30 cm인 원형 탈출대(escape platform)를 원통형 수조의 한 사분면의 중앙에 위치시켰으며, rat의 출발은 원형 탈출대가 위치한 사분면의 대각선 끝에서 실시하였다. 물은 탈출대가 수면으로부터 2 cm 아래에 잠길 정도로 채우고 물의 온도는 22.0±1.0℃를 유지하였으며, 원형 탈출대는 수중에서 물과 구분되지 않도록 투명 아크릴을 사용하였다. 수조 안에서 움직이는 rat의 움직임을 a computer interfaced camera tracking system (Smart junior, PanLab, Barcelona, Spain)을 이용하여 기록하였으며, 10분 간격으로 각 3회 동안 연속적으로 실시하여 rat가 원형 탈출대 위로 도피하기까지 걸리는 시간(second)과 거리(m)를 각각 측정하였다.
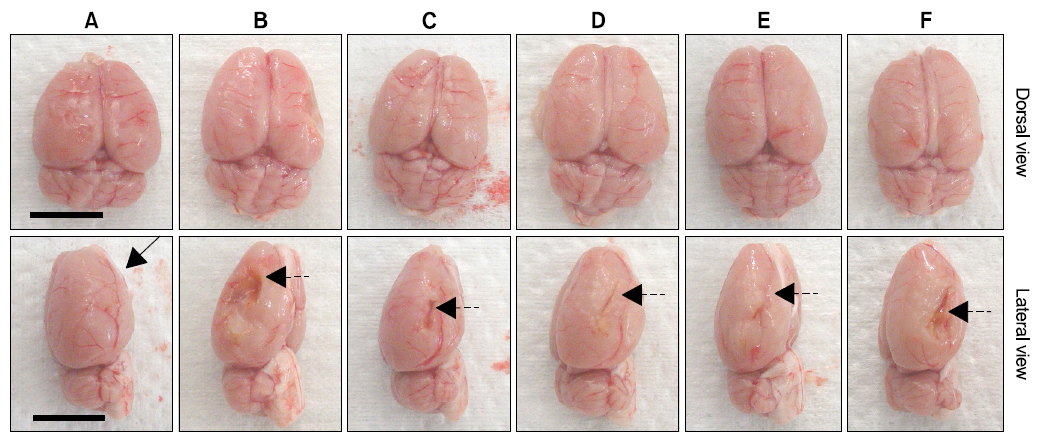
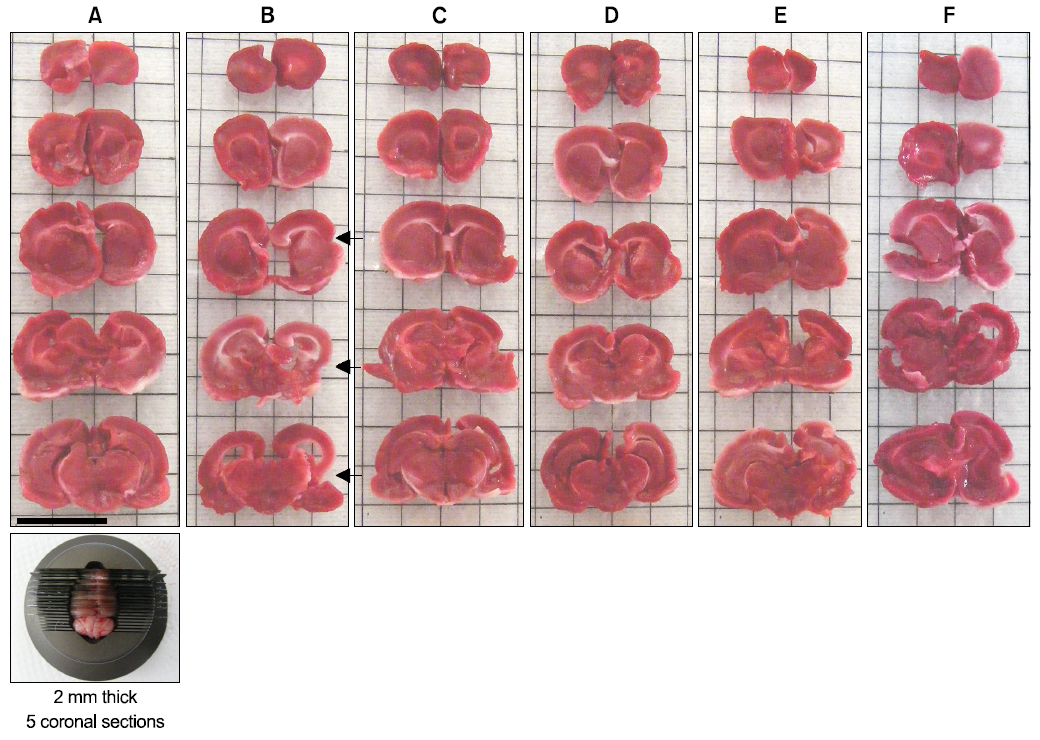
Lee 등29)의 방법에 따라, 최종 희생일에 70% N2O와 28.5% O2가스에 3% isoflurane을 혼합한 마취가스로 전신 심마취를 시킨 후, 뇌조직을 적출한 다음 4℃ 정도의 phosphate buffered saline (PBS, pH 7.4)로 냉각시키고, brain stainless steel coronal matrix (Harvard, MA, USA)를 이용하여 후뇌에서 2~14 mm 부분의 대뇌를 2 mm 두께로 연속 절편 6개를 준비하고(Fig. 2 and 3), 2% TTC (2, 3, 5-triphenyl tetrazolium chloride (Sigma, MO, USA)) 용액으로 37℃에서 30분간 5개의 뇌조직 절편을 염색한 다음, 10% neutral buffered formalin (NBF)에 overnight 고정시켰다. 이후 0.5 mm 간격의 grid 위에 놓은 다음 digital camera (Fujifilm, Tokyo, Japan)로 영상을 촬영하여, 대뇌에서 관찰되는 infarct 부위의 면적을 하기의 공식 [2]에 의해 자동영상분석장치(iSolution FL ver 9.1, IMT i-solution Inc., Canada)를 이용하여 산출하였다.
EQUATION [2]. Infarct volumes
= ∑infarct region area of five cerebral slices×2 mm (thicknesses)
모든 수치는 평균±표준편차로 표시하였고, 다중비교검증을 이용하여 통계처리를 실시하였으며, 분산 동질성은 Levene test를 실시하여 검증 하였다30). 등분산일 경우에는 one way ANOVA test를 실시한 다음 least-significant differences (LSD) test로 사후 검증을 실시하여 군 간의 유의성을 측정하였으며, 비등분산일 경우에는 비모수 검증인 Kruskal-Wallis H test를 실시하여 유의성이 인정된 경우, Mann-Whitney U (MW) test를 실시하여 군간의 유의성을 검증하였다. 모든 통계처리는 SPSS for Windows (Release 14.0K, IBM SPSS Inc., Armonk, NY, USA)31)를 이용하여 평가하였으며, p-value가 0.05 이하인 경우 통계적 유의성을 인정하였다. pMCAO에 대한 성심산(醒心散)의 뇌보호 효과, 신경운동학적 및 인지행동 장애 회복 효과를 좀 더 명확히 하기 위하여, 성심산(醒心散) 투여군과 pMCAO 대조군과의 percent change를 하기의 공식 [3]을 이용하여 측정하였으며, pMCAO 수술에 의한 신경운동학적 및 인지 행동 장애의 유발 정도를 보다 명확히 하기 위해 sham 대조군과 pMCAO 대조군과의 percent change를 하기의 공식[4]를 이용하여 측정하였다.
QUATION [3]. Percentage Changes as Compared pMCAO Control (%)
=((Data of SSS administered groups−Data of pMCAO control)/Data of pMCAO control)×100
EQUATION [4]. Percentage Changes as Compared with Sham Control (%)
=((Data of pMCAO control−Data of sham control)/Data of sham control)×100
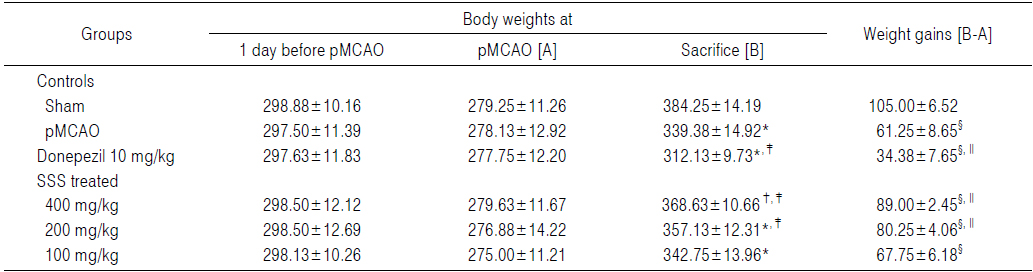
pMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) 체중의 감소가 pMCAO 7일 후부터 인정되기 시작하여, 실험기간 동안 증체량의 유의성 있는(p<0.01 또는 p<0.05) 감소를 나타내었다. 한편 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 증가가 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 21 및 28일 후부터 인정되기 시작하여, pMCAO 대조군에 비해 유의성 있는(p<0.01) 증체량의 증가를 각각 나타내었다. 반면 donepezil 투여군에서는 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 감소가 pMCAO 21일 후부터 인정되기 시작하여, 실험기간 동안 증체량의 유의성 있는(p<0.01) 감소를 나타내었고, 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 의미 있는 체중 및 증체량의 변화는 실험 전 기간 동안 인정되지 않았다(Table 3, Fig. 4).
[Table 3.] Changes on the Body Weight Gains during 29 Days of pMCAO in Rats
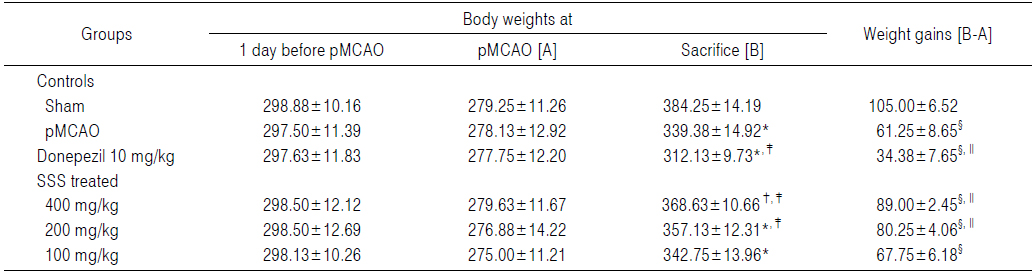
Changes on the Body Weight Gains during 29 Days of pMCAO in Rats
pMCAO 후 29일 동안의 증체량은 pMCAO 대조군에서 sham 대조군에 비해 −41.67%의 변화를 나타내었으며, donepezil, 성심산(醒心散) 400, 200 및 100 mg/kg 투여군에서 pMCAO 대조군에 비해 각각 −43.88, 45.31, 31.02 및 10.61%의 변화를 나타내었다.
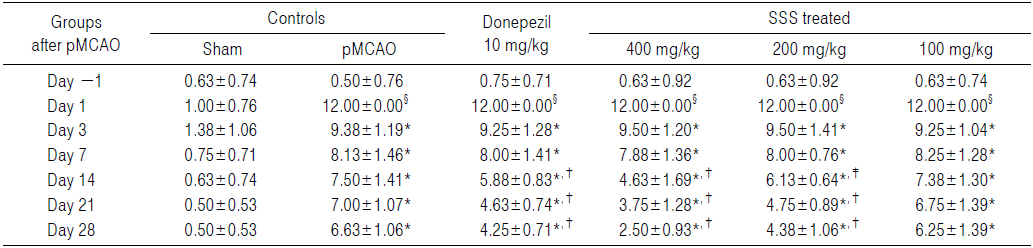
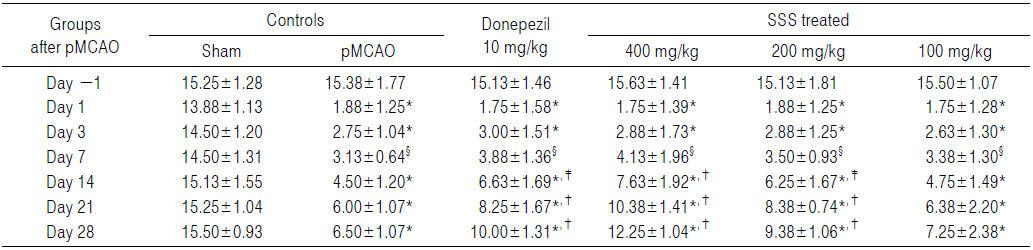
pMCAO수술 24시간 후 신경학적 운동행동 검사 점수가 동일한 실험동물을 선정하여 사용하였으므로, pMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) forelimb placing test 점수의 증가가 pMCAO 24시간 후부터 실험 전 기간에 걸쳐 인정되었다. 한편 donepezil 10 mg/kg, 성심산(醒心散) 200 및 400 mg/kg 투여군에서는 각각 pMCAO 14일 후부터 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) forelimb placing test 점수의 감소가 인정되었으나, 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군과 비교하여 의미 있는 forelimb placing test 점수의 변화는 인정되지 않았다(Table 4).
[Table 4.] Forelimb Placing Scores Detected in pMCAO Rats
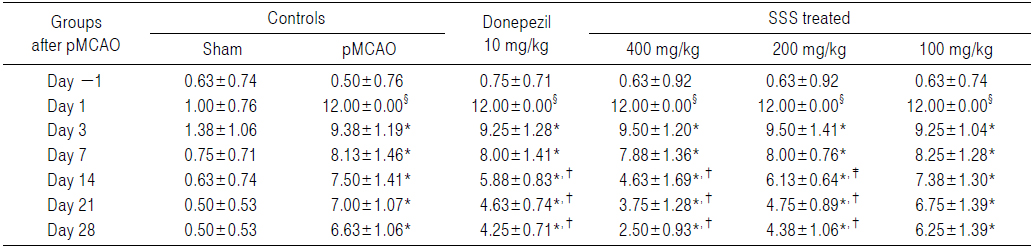
Forelimb Placing Scores Detected in pMCAO Rats
pMCAO 대조군에서는 sham 대조군에 비해 forelimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 1,100.00, 581.82, 983.33, 1,100.00, 1,300.00 및 1,225.00%의 변화를 나타내었다.
Donepezil 투여군에서는 pMCAO 대조군에 비해 forelimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −1.33, −1.54, −21.67, −33.93 및 −35.85%의 변화를 나타내었다.
성심산(醒心散) 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 forelimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, 1.33, −3.08, −38.33, −46.43 및 −62.26%의 변화를 나타내었다.
성심산(醒心散) 200 mg/kg 투여군에서는 pMCAO 대조군에 비해 forelimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, 1.33, −1.54, −18.33, −32.14 및 −33.96%의 변화를 나타내었다.
성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 forelimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −1.33, 1.54, −1.67, −3.57 및 −5.66%의 변화를 나타내었다.
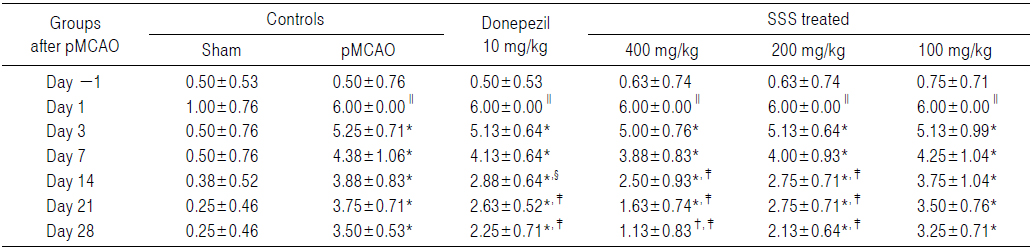
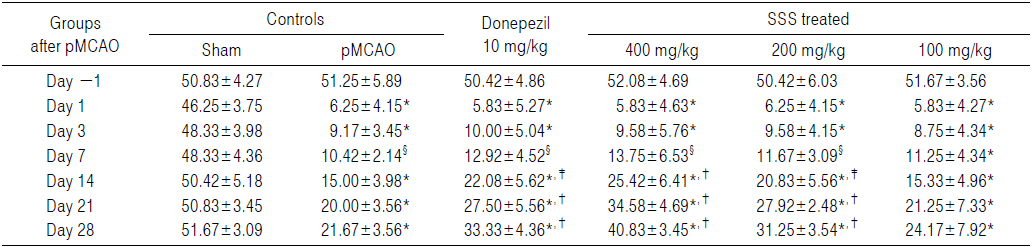
pMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) hindlimb placing test 점수의 증가가 pMCAO 24시간 후부터 실험 전 기간에 걸쳐 인정되었다. 한편 donepezil 10 mg/kg, 성심산(醒心散) 200 및 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 각각 유의성 있는(p<0.01) hindlimb placing test 점수의 감소가 pMCAO 14일 후부터 인정되었으나, forelimb placing test 에서와 동일하게, 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군과 비교하여 의미 있는 hindlimb placing test 점수의 변화는 인정되지 않았다(Table 5).
[Table 5.] Hindlimb Placing Scores Detected in pMCAO Rats
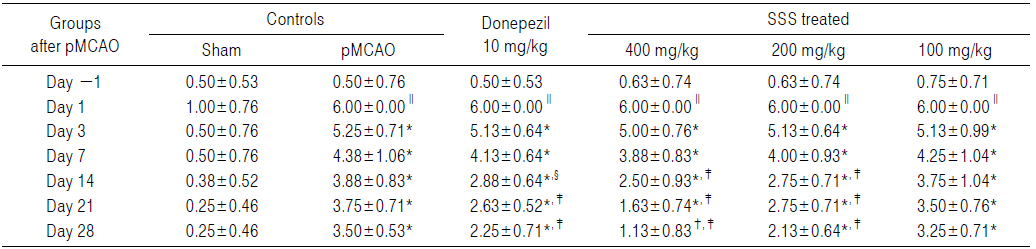
Hindlimb Placing Scores Detected in pMCAO Rats
pMCAO 대조군에서는 sham 대조군에 비해 hindlimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 500.00, 950.00, 775.00, 933.33, 1,400.00 및 1,300.00%의 변화를 나타내었다.
Donepezil 투여군에서는 pMCAO 대조군에 비해 hindlimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −2.38, −5.71, −25.81, −30.00 및 −35.71%의 변화를 나타내었다.
성심산(醒心散) 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 hindlimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −4.76, −11.33, −35.48, −56.67 및 −67.86%의 변화를 나타내었다.
성심산(醒心散) 200 mg/kg 투여군에서는 pMCAO 대조군에 비해 hindlimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −2.38, −8.57, −29.03, −26.67 및 −39.29%의 변화를 나타내었다.
성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 hindlimb placing test 점수가 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, −2.38, −2.86, −3.23, −6.67 및 −7.14%의 변화를 나타내었다.
pMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) 우측으로의 body swing 횟수 및 비율의 감소가 pMCAO 24시간 후부터 실험 전 기간에 걸쳐 인정되었나, donepezil 10 mg/kg, 성심산(醒心散) 200 및 400 mg/kg 투여군에서는 각각 pMCAO 대조군에 비해 유의성 있는(p<0.01 or p<0.05) 우측으로의 body swing 횟수 및 비율의 증가가 pMCAO 14일 후부터 실험 전 기간에 걸쳐 각각 인정되었다. 한편 성심산(醒心散) 100 mg/kg 투여군에서는 limb placing test에서의 결과와 유사하게, pMCAO 대조군과 비교하여 의미 있는 우측으로의 body swing 횟수 및 비율의 변화는 인정되지 않았다(Table 6 and 7).
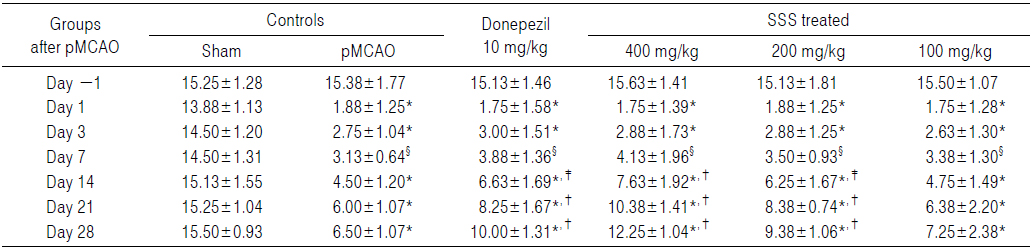
Body Swing Scores Detected in pMCAO Rats, the Numbers of Body Swings to the Ipsilateral Right Sides
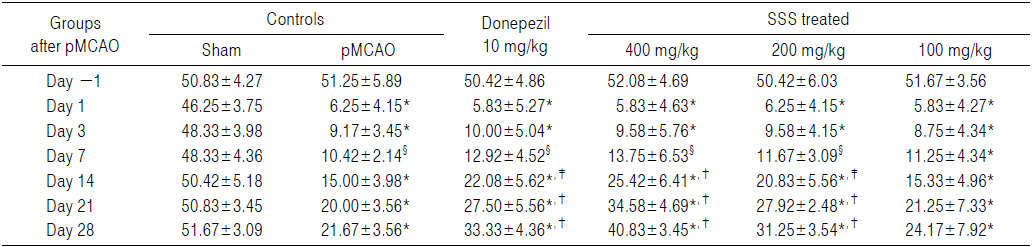
Body Swing Scores Detected in pMCAO Rats, the Numbers of Body Swings to the Ipsilateral Right Sides
pMCAO 대조군에서는 sham 대조군에 비해 body swing 횟수 및 비율이 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 −86.49, −81.03, −78.45, −70.25, −60.66 및 −58.06%의 변화를 나타내었다.
Donepezil 투여군에서는 pMCAO 대조군에 비해 body swing 횟수 및 비율이 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 −6.67, 9.09, 24.00, 47.22, 37.50 및 53.85%의 변화를 나타내었다
성심산(醒心散) 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 body swing 횟수 및 비율이 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 −6.67, 4.55, 32.00, 69.44, 72.92 및 88.46%의 변화를 나타내었다.
성심산(醒心散) 200 mg/kg 투여군에서는 pMCAO 대조군에 비해 body swing 횟수 및 비율이 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 0.00, 4.55, 12.00, 38.89, 39.58 및 44.23%의 변화를 나타내었다.
성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 body swing 횟수 및 비율이 pMCAO 1, 3, 7, 14, 21 및 28일 후 각각 −6.67, −4.55, 8.00, 5.56, 6.25 및 11.54%의 변화를 나타내었다.
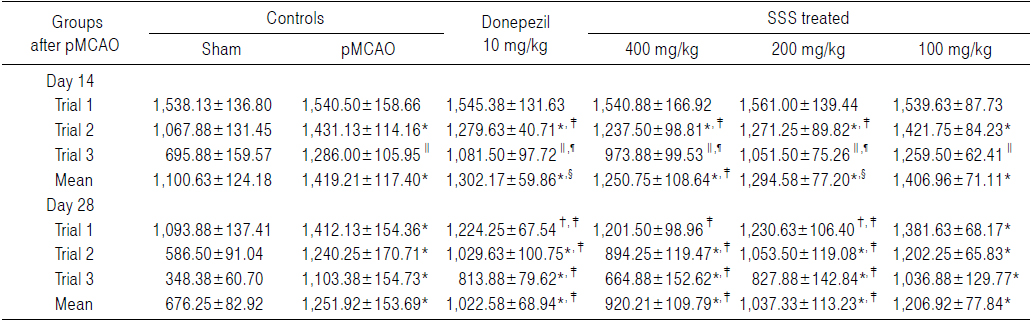
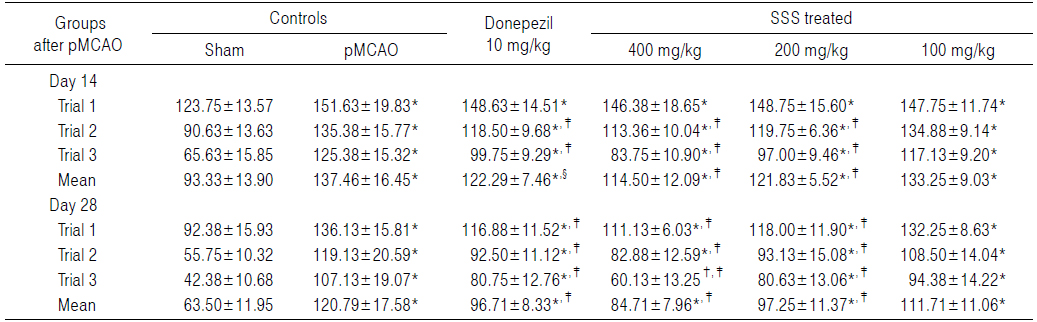
Sham 대조군에서는 water maze tank내에서 escape platform까지 이동거리 및 시간이 trial을 반복할 때 마다 현저히 감소되었으나, pMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) escape platform까지 움직인 거리 및 시간의 증가가 pMCAO 14 및 28일 후 각각 인정되었으며, trial횟수에 따른 이동거리 및 시간의 단축 역시 현저히 억제되었다. 한편 donepezil 10 mg/kg, 성심산(醒心散) 200 및 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) escape platform까지의 이동거리 감소가 pMCAO 14일 후 trial 2 및 trial 3, pMCAO 28일 후 trial 1, 2 및 3에서 각각 인정되었으며, escape platform까지의 이동시간의 유의성 있는(p<0.01) 감소 역시 pMCAO 14 및 28일 후의 모든 trials에서 각각 인정되었으나, 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 의미 있는 escape platform까지의 이동거리 및 시간의 변화는 인정되지 않았다(Table 8 and 9).
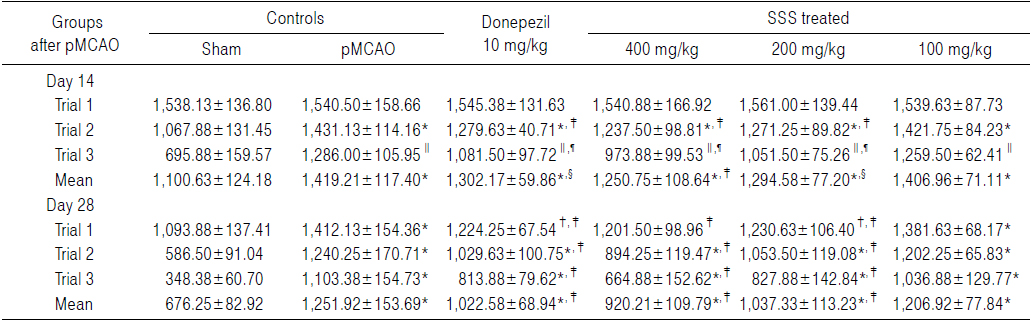
Cognitive Behavioral Scores Detected in Water Maze Test of pMCAO Rats, the Distance to Reach the Escape Platform
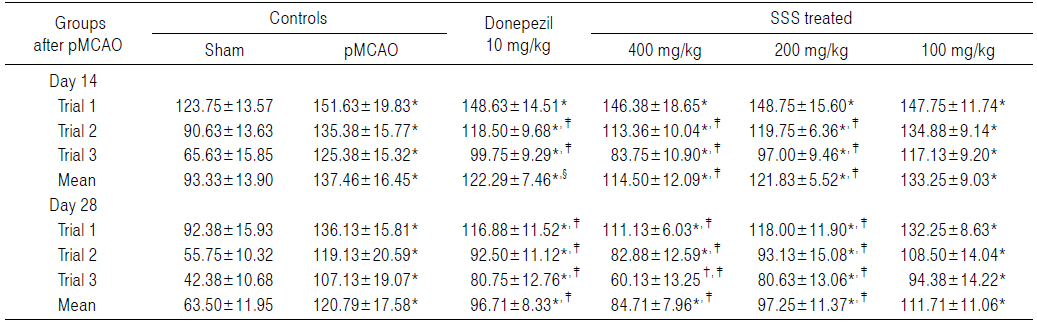
Cognitive Behavioral Scores Detected in Water Maze Test of pMCAO Rats, the Time to Reach the Escape Platform
pMCAO 대조군에서는 sham 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 pMCAO 14일 후 trial 1, 2 및 3에 각각 0.15, 34.02 및 84.80%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 29.09, 111.47 및 216.72%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 거리는 각각 28.95 및 85.13%의 변화를 나타내었다.
Donepezil 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 pMCAO 14일 후 trial 1, 2 및 3에 각각 0.32, −10.09 및 −15.90%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −13.30, −16.98 및 −26.24%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 거리는 각각 −8.25 및 −18.32%의 변화를 나타내었다.
성심산(醒心散) 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 pMCAO 14일 후 trial 1, 2 및 3에 각각 0.02, −13.53 및 −24.27%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −14.92, −27.90 및 −39.74%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 거리는 각각 −11.87 및 −26.50%의 변화를 나타내었다.
성심산(醒心散) 200 mg/kg 투여군에서는 pMCAO 대조군에 water maze tank내에서 escape platform까지의 이동거리가 pMCAO 14일 후 trial 1, 2 및 3에 각각 1.33, −11.17 및 −18.23%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −12.85, −15.06 및 −24.97%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 거리는 각각 −8.78 및 −17.14%의 변화를 나타내었다.
성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 pMCAO 14일 후 trial 1, 2 및 3에 각각 −0.06, −0.66 및 −2.06%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −2.16, −3.06 및 −6.03%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 거리는 각각 −0.86 및 −3.59%의 변화를 나타내었다.
pMCAO 대조군에서는 sham 대조군에 비해 water maze tank내에서 escape platform까지의 이동시간이 pMCAO 14일 후 trial 1, 2 및 3에 각각 22.53, 49.38 및 91.05%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 47.36, 113.68 및 152.80%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동시간은 각각 47.28 및 90.22%의 변화를 나타내었다.
Donepezil 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동시간이 pMCAO 14일 후 trial 1, 2 및 3에 각각 −1.98, −12.47 및 −20.44%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −14.14, −22.35 및 −24.62%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 시간은 각각 −11.03 및 −19.94%의 변화를 나타내었다.
성심산(醒心散) 400 mg/kg 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동시간이 pMCAO 14일 후 trial 1, 2 및 3에 각각 −3.46, −16.25 및 −33.20%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −18.37, −30.43 및 −43.87%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 시간은 각각 −16.70 및 −29.87%의 변화를 나타내었다.
성심산(醒心散) 200 mg/kg 투여군에서는 pMCAO 대조군에 water maze tank내에서 escape platform까지의 이동시간이 pMCAO 14일 후 trial 1, 2 및 3에 각각 −1.90, −11.54 및 −22.63%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −13.31, −21.83 및 −24.74%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 시간은 각각 −11.37 및 −19.49%의 변화를 나타내었다.
성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동시간이 pMCAO 14일 후 trial 1, 2 및 3에 각각 −2.56, −0.37 및 −6.58%의 변화를 나타내었고, pMCAO 28일 후 trial 1, 2 및 3에 각각 −2.85, −8.92 및 −11.90%의 변화를 나타내어, pMCAO 14 및 28일의 평균 이동 시간은 각각 −3.06 및 −7.52%의 변화를 나타내었다.
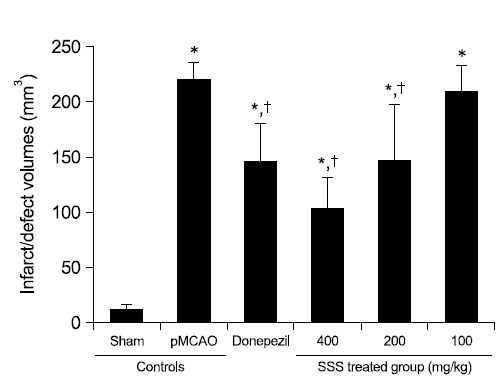
pMCAO 29일 후 최종 부검시, pMCAO 대조군에서는 대뇌 피질의 국소 탈락(defect)을 특징으로 하는 infarct/defect 소견이 인정되었으며, sham 대조군에 비해 유의성 있는(p<0.01) infarct/defect volume의 증가가 TTC 염색에서 인정되었다. 한편 donepezil 10 mg/kg, 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 대조군에 비해 유의성 있는(p<0.01) infarct volume의 감소가 각각 인정되었으나, 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군과 유사한 infarct/defect volume의 변화를 나타내었다(Fig. 2, 3, 5).
pMCAO 29일 후 최종 부검시, infarct/defect volume은 pMCAO 대조군에서 sham 대조군에 비해 1,851.18%의 변화를 나타내었으며, donepezil, 성심산(醒心散) 400, 200 및 100 mg/kg 투여군에서 pMCAO 대조군에 비해 각각 −34.11, −53.21, −33.04 및 −4.79%의 변화를 나타내었다.
뇌졸중(stroke)은 뇌에 혈액의 공급이 차단되거나 뇌동맥이 파열되어 부분적인 뇌손상으로 인한 신경학적 증상이 나타나는 뇌혈관 질환으로서, 사망률이 높을 뿐 아니라 심각한 후유증을 동반하는 가장 흔한 질환중 하나이다1,2,32). 이 중에서 혈관성 치매는 고혈압, 당뇨 등 혈관성 위험인자의 조절을 통해 질병을 예방하고 진행을 막을 수 있다는 점과 알츠하이머병에도 혈관성 위험인자가 관련된 것으로 밝혀지면서 최근 혈관성 치매에 대한 연구가 더욱 활발해 지고 있다13).
허혈성 손상부위에 존재하는 대부분의 신경원은 에너지 장애에 의해 변성이 유발되며, 경색 초기에 뇌 혈류를 개선하거나 세포에 대한 항산화 작용 등 적절한 조치가 취해지지 않으면 회복이 불가능하다33). 현재 antiapoptotic 약물, 국소 영양 인자, glutamate 차단약, sodium-channel 차단약 및 다양한 항산화제(free radical scavengers)들이 사용되고 있고34), 특히 항산화제들은 뇌경색 부위에서 신경원 보호 효과35-37)를 통해 정상인뿐만 아니라, 뇌졸중 후 초래되는 신경증상의 개선에도 매우 효과적인 것으로 알려져 있다37-40).
한의학에서 치매는 장경악(張景岳)이 ≪경악전서·잡증모≫에서 치애증(痴獃證)이라 하여 치매와 유사한 증상을 처음 언급하였으며41), 현재는 매병(呆病)과 건망에 근거하여 치매를 치료하며, 혈관성 치매의 주요 원인으로 담음과 어혈을 들고 있다18).
성심산(醒心散)은 심(沈)의 ≪심씨존생서≫에 처음으로 수록되었으며20) 이후 조선시대 의가인 허준의 ≪동의보감≫에 소개된 처방으로21), 구성약물 중 인삼은 대보원기(大補元氣), 고탈생진(固脫生津), 안신(安神), 맥문동은 자음윤조(滋陰潤燥), 청폐강화(淸肺降火), 오미자는 렴폐(斂肺), 자신(滋腎), 생진(生津), 렴한(收汗), 삽정(澁精), 원지는 영심안신(寧心安神), 거담이규(祛痰利竅), 소산옹종(消散癰腫), 백복신은 영심안신(寧心安神), 이수(利水), 생지황은 청열양혈(淸熱凉血), 양음생진(養陰生津), 석창포는 화습개위(化濕開胃), 개규활담(開竅豁痰), 성신익지(醒神益智)의 효능이 있다42). 현재까지 성심산(醒心散)의 노화 억제와 관련한 연구에서 심장내 과산화지질 및 유리기의 생성에 유의하게 작용하는 항노화 효과가 관찰된 바 있고22), 각 구성 약물의 신경보호 효과가 이미 잘 알려져 있다. 각 구성약물 중 인삼의 신경보호효과는 잘 알려져 있는데 뇌내출혈 유발 쥐에서 출혈부피 억제 및 신경세포 보호효과가 관찰되었고43), 인삼 및 주요성분인 진세노사이드를 매개로 하는 신경세포보호는 주로 항상성의 유지, 항염증, 항산화, 항세포 사멸 및 면역자극 활성을 수반하는 것으로 알려져 있다44). 맥문동은 구속 스트레스로 유발된 기억손상 백서 모델에서 공간기억 능력 저하를 향상 및 신경보호효능을 나타내었고45), 오미자는 schizandrin을 많이 포함한 클로로포름 분획의 항암효과46), 과산화수소로 유발된 세포사에 대한 신경세포의 보호효과47)가 관찰되었다. 원지는 Kainic acid에 의한 신경세포손상 억제효과48) 및 산화질소에 의한 신경세포 사멸 억제효과49)를 나타내었고, 석창포는 저산소증 백서 모델에서 대뇌피질 세포의 세포자멸 및 ROS 억제와 신경친화성 효과50)를 보인바 있다. 또한 성심산(醒心散)의 구성약물의 일부를 포함하는 연구에서 원지, 석창포가 신경아세포암 세포사를 억제하고 신경세포를 보호하는 효과가 관찰되었으며51), 인삼, 복신, 생지황, 맥문동, 원지를 포함하고 있는 익기안신탕(益氣安神湯)은 신경세포의 세포사에 대한 뚜렷한 억제효과를 보이기도 하였다52).
본 실험에서는 한의학에서 심장보호 작용으로 알려져 있는 성심산(醒心散)21)의 허혈성 뇌손상에서 인지 및 운동기능 회복효과를 확인하기 위하여 severe stroke 동물 모델인 pMCAO rat28,53-56)를 이용하여 평가하였다. 즉 성심산(醒心散) 물 추출물(수율: 16.82%) 400, 200 및 100 mg/kg을 pMCAO 유발 1일 후부터 매일 28일간 경구투여하고, 체중, infarct volume, 신경학적 운동행동 및 인지적 운동행동 검사의 변화를 관찰하였으며, 실험결과는 다양한 치매의 증상완화 및 치료제로 흔히 사용되는 donepezil 10 mg/kg 투여군15,16)과 각각 비교하였다. 신경학적 운동행동 검사로 limb placing test25) 및 body swing test26)를 pMCAO 1일전, pMCAO 1, 3, 7, 14, 21 및 28 일 후에 각각 측정하였으며, 인지적 운동행동 검사로 water maze test를 이전의 방법27)에 따라 pMCAO 14 및 28일 후 각각 측정하였다.
실험에 사용된 성심산(醒心散) 400, 200 및 100 mg/kg은 rat에서 250 mg/kg 투여군에서 명확한 항노화, 항산화 효과를 나타낸 이전의 보고22)를 기준으로 선정하였으며, donepezil 역시 이전의 실험들15,16)의 결과를 바탕으로 rat에서 확실한 항산화 효과를 통한 신경보호 효과를 나타내는 것으로 알려져 있는 10 mg/kg을 투여용량으로 선정하였다.
사람에게 있어 중대뇌동맥(MCA)은 뇌졸중이 가장 호발하는 부위로, Tamura 등28)에 의해 처음 개발된 rat MCA 폐쇄술(MCAO)은 사람의 뇌졸중과 유사한 병리 및 증상을 나타내어 이를 연구하는 대표적인 동물 모델로57), 뇌졸중 치료제 개발에서 일반적으로 이용되고 있으며55), rat에서 MCAO에 대한 기본적인 병리생리학적 연구 역시 많이 수행되어 결과 판단에 매우 용이하다58,59). 이중 영구적 MCA 폐쇄술(permanent MCAO, pMCAO)은 뇌수술을 통해 두개강 내 MCA를 노출 후 이를 영구적으로 폐쇄시킴으로써, 비교적 넓은 부위에 뇌경색을 유발시키는 심한 뇌졸중 동물 모델로, 현재 Tamura 등28)의 방법 또는 이를 변형시킨 방법이 가장 흔히 이용되고 있다53,54).
Donepezil (AriceptTM)은 경증의 Alzheimer형 치매의 신경증상 완화를 위해 개발된 중추성 acetylcholinesterase(ACE) 억제제로서10), 현재는 다양한 종류의 치매의 증상완화 및 치료에 적용되고 있다. 그러나 임상에서 소화불량을 비롯하여 서맥, 오심(nausea), 설사, 식욕부진, 악몽 및 정신착란 등 여러 부작용이 유발되는 것으로 알려져 있어 그 사용이 제한되고 있다14,60).
본 실험의 결과, 이전의 연구들과 유사하게55,56) pMCAO에 의해 현저한 체중 감소, 신경학적 및 인지적 운동행동 장애가 infarct/defect volume의 증가와 함께 인정되었다. 한편 이러한 결과가 성심산(醒心散) 400 및 200 mg/kg 투여에 의해 용량 의존적으로 현저히 억제되었다. 따라서 200 mg/kg 이상의 성심산(醒心散)은 뇌경색에 의한 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 매우 유효한 효과를 나타내는 것으로 판단된다. 또한 성심산(醒心散) 200 mg/kg은 donepezil 10 mg/kg 투여군과 유사한 pMCAO에 의해 초래되는 대뇌 손상, 인지 및 운동기능 장애에 대한 개선 촉진 효과를 나타내는 것으로 관찰되었으나, donepezil 투여군에서는 자체의 독성으로 판단되는 현저한 체중 감소 역시 관찰되었다. 한편 성심산(醒心散) 100 mg/kg 투여군에서는 pMCAO 대조군에 비해 의미 있는 대뇌 손상, 인지 및 운동기능 장애에 대한 개선 촉진 효과가 인정되지 않았다.
pMCAO에 의한 허혈성 뇌손상이 진행됨에 따라, 인지 및 운동장애가 초래되고, 결과적으로 현저한 체중 저하가 나타난다61,62). 본 실험의 결과에서도 pMCAO 14일 후부터 sham 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 감소가 모든 pMCAO 수술군에서 인정되었으며, 실험기간 동안 증체량 역시 sham 대조군에 비해 유의성 있는(p<0.01) 감소를 나타내었다. 한편 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 증가가 성심산(醒心散) 400 및 200 mg/kg 투여군에서 pMCAO 21 및 28일 후부터 인정되기 시작하여, pMCAO 대조군에 비해 유의성 있는(p<0.01) 증체량의 증가를 각각 나타내었다. 이러한 결과는 성심산(醒心散) 400 및 200 mg/kg이 pMCAO로 유발된 인지 및 행동장애에 의한 체중 감소를 억제하는 직접적인 증거로 판단된다. 또한 donepezil 투여군에서는 donepezil 자체의 독성에서 기인된 것으로 판단되는 pMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 감소가 pMCAO 21일 후부터 인정되기 시작하여, 실험기간 동안의 증체량의 유의성 있는(p<0.01) 감소를 나타내었다.
TTC는 무색의 용액으로 조직내 탈수소효소(dehydrogenase)와 반응하여 정상조직은 붉은 색으로 관찰되나, 아직까지 완전히 뇌경색이 초래되지 않은 조직에서는 연분홍색으로, 완전한 허혈성 손상 조직에서는 흰색으로 나타나므로, 비가역적 허혈성 뇌손상의 유무를 관찰하는데 흔히 이용된다63,64). pMCAO시 비가역성의 심한 허혈성 뇌손상이 초래되고, 시간이 지남에 따라 대뇌피질의 신경원세포들의 국소 괴사에 의한 cyst 형성이 초래되어, 결국 대뇌피질 및 피질하 조직의 국소 탈락(defect) 소견이 관찰된다55). 본 실험에서도 pMCAO 29일 후 최종부검시 pMCAO 대조군에서는 대뇌 피질의 국소 탈락(defect)을 특징으로 하는 infarct/defect 소견이 인정되었으며, TTC 염색 하에서 sham 대조군에 비해 유의성 있는(p<0.01) infarct/defect volume의 증가가 인정되었다. 한편 본 실험에 사용한 성심산(醒心散) 400 및 200 mg/kg 투여군에서는 pMCAO 대조군에 비해 유의성 있는(p<0.01) infarct volume의 감소가 각각 인정되었으며, 성심산(醒心散) 200 mg/kg은 donepezil 10 mg/kg 투여군과 유사한 정도의 infarct/defect volume 감소 효과가 인정되었다. 이러한 결과는 성심산(醒心散)의 유효한 신경보호 효과를 나타내 주는 직접적인 증거로 판단된다.
뇌졸중 실험모델에서의 대부분 연구는 infarct size의 변화에만 중점을 두고 후보물질의 약효를 평가해왔으나, 최근들어 MCAO 모델에서 infarct size의 현저한 감소를 동반한 경우에도, 인지 및 행동장애에서는 별다른 변화가 관찰되지 않는 경우가 빈번히 보고되고 있다65,66). 반대로 infarct volume에 영향을 미치지 않는 것으로 알려진 일부 약물들이 오히려, 인지 및 행동장애는 현저히 감소시킨다고 보고되고 있는 등66-68), 이들 상관관계를 보정하기 위해 적절한 신경학적 및 인지적 운동행동 검사가 필요하다. 이중 limb placing test는 대표적인 신경학적 운동행동 검사로 전지 및 후지의 배치 이상을 등급화 하여, 등급이 높을수록 심한 신경학적 운동행동 이상을 나타낸다25). 또한 body swing test 역시 흔히 사용되는데26), 정상동물에서는 좌우측으로의 body swing 비율이 유사한 반면, 허혈성 뇌손상이 있는 동물에서는 손상 부위로의 body swing이 현저히 감소된다55,56). 그리고 water maze test는 일반적으로 사용되는 인지적 운동행동 검사로26), 인지행동 장애가 있는 경우 escape platform으로의 이동거리 및 시간이 현저히 증가되고, trial을 반복할 경우에도 거리 및 시간의 감소가 현저히 억제된다55). 본 실험의 결과, 성심산(醒心散) 400 및 200 mg/kg은 limb placing, body swing 및 water maze test에서 pMCAO에 의해 초래되는 신경학적 및 인지적 운동행동 이상 소견을 현저히 억제하였으며, 특히 성심산(醒心散) 200 mg/kg은 donepezil 10 mg/kg 투여군과 유사한 정도의 신경학적 및 인지적 운동행동 이상 개선 촉진 효과가 인정되었다. 이러한 결과는 200 mg/kg 이상의 성심산(醒心散)이 허혈성 뇌손상 rat에서 인지 및 운동기능을 회복시키는 직접적인 증거로 판단된다.
본 실험에서 인정된 성심산(醒心散)의 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애 개선 효과는 현재 항산화 물질들의 허혈성 뇌손상에 대한 신경 보호 효과가 이미 알려져 있고35-37,69), 성심산(醒心散) 자체의 항산화 효과22)와 함께 개별 구성 약제 역시 신경 보호 또는 항산화 효과가 잘 알려져 있어43-50), 항산화를 통한 신경 보호 효과에 의한 것으로 판단되나, 뇌 혈류 증가에 의해서도 허혈성 뇌손상에 유효한 효과가 관찰된다는 보고들56,70)로 미루어보아 다른 작용 기전의 존재 가능성 역시 배제 할 수 없어, 금후 다양한 방면으로 기전적인 연구를 수행해야 할 것으로 판단된다. 또한 성심산(醒心散)은 인삼, 맥문동, 오미자, 원지, 백복신, 생지황 및 석창포 등 7종의 약재로 구성되어 있으며, 각각 수많은 생리활성 물질을 함유하고 있어21), 금후 개별 구성 약재에 대한 효능 및 생리활성을 나타내는 화 학성분의 검색을 수행해야 할 것으로 판단된다.
이상의 결과에서 200 mg/kg 이상의 성심산(醒心散)은 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 유효한 효과를 나타내는 것으로 판단되며, 특히 성심산(醒心散) 200 mg/kg은 donepezil 10 mg/kg 투여군과 유사한 pMCAO에 의해 초래되는 대뇌 손상, 인지 및 운동기능 장애에 대한 개선 촉진 효과를 나타내는 것으로 관찰되었다.
pMCAO로 유발된 허혈성 뇌손상 백서에 성심산(醒心散)을 투여한 후 그 효과를 관찰하여, 다음과 같은 결과를 얻었다.
1. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 21일 및 28일 후에 pMCAO 대조군에 비해 유의성 있는 체중의 증가가 인정되기 시작하여, pMCAO 대조군에 비해 유의성 있는 증체량의 증가를 나타내었다.
2. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 14일 후에 pMCAO 대조군에 비해 유의성 있는 Forelimb placing test 점수의 감소를 나타내었다.
3. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 14일 후에 pMCAO 대조군에 비해 유의성 있는 Hindlimb placing test 점수의 감소를 나타내었다.
4. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 14일 후에 pMCAO 대조군에 비해 유의성 있는 우측으로의 Body swing 횟수 및 비율의 증가를 나타내었다.
5. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 대조군에 비해 유의성 있는 escape platform까지의 이동거리 감소가 pMCAO 14일 후 trial 2 및 trial 3, pMCAO 28일 후 모든 trial에서 각각 인정되었으며, 이동시간의 유의성있는 감소 역시 pMCAO 14 및 28일 후의 모든 trials에서 각각 인정되었다.
6. 성심산(醒心散) 200 및 400 mg/kg 투여군에서 pMCAO 대조군에 비해 유의성 있는 Infarct volume의 감소를 나타내었다.
이상으로부터, 200 mg/kg 이상의 성심산(醒心散)은 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 매우 유효한 효과를 나타내는 것으로 판단된다. 특히 성심산(醒心散) 200 mg/kg은 pMCAO에 의해 초래되는 대뇌 손상, 인지 및 운동기능 장애에 대해 donepezil 10 mg/kg 투여군과 유사한 개선 촉진 효과를 나타내었으며, pMCAO 대조군에 비해 증체량의 증가 또한 인정되었다.