우리나라의 1인당 사용가능한 수자원량은 1,447 m3/년으로 미국 국제경제 행동연구소의 발표자료에 따르면 물 스트레스를 받는 국가에 속한다(PAI, 2012). 일반적으로 물을 많이 사용하는 용수 다소비 업종은 전자산업, 제지산업, 섬유산업 등이 해당되며 각 업종별로 용수사용량은 꾸준히 증가하는 추세이다(MOE, 2010).
산업들이 고도화 되어감에 따라 생산공정에서 오염물질들이 다량 생성되어 폐수 속에 유입되고 있으며, 이러한 폐수 중에는 저농도 유기화합물질들이 포함되어 있을 뿐만 아니라 완전히 처리되지 못하고 배출되어 문제를 일으키고 있다(Parekh et al., 2007). 이러한 유기화합물질들은 현재 사용되고 있는 일반적인 생물학적 처리를 통해서는 효과적으로 처리되지 않기 때문에 물리· 화학적인 처리가 연구되고 있으나, 일반적인 처리의 경우 화학약품 사용으로 인하여 2차 오염이 발생하는 등의 어려움이 있다(Dorn et al., 1987; Spivack et al., 1994).
이러한 문제들을 해결하기 위하여 산화력이 큰 OH 라디칼을 발생시켜 유기물을 처리하는 방법인 고도산화처리공정(Advanced Oxidation Process, AOPs)에 대한 연구가 활발히 진행되었다(Andreozzi et al., 1999). 추가처리 공정 중에 한가지인 AOPs는 OH 라디칼을 이용하여 오염물질을 산화시키는 원리로서, OH 라디칼을 형성하는 방법에는 UV, O3, H2O2를 이용하는 방법이 대표적이나 이들의 경우에도 추가 약품이 필요하다는 단점이 존재한다.
광촉매는 광에너지를 받았을 때 광(光)에 의해 화학반응을 촉진할 수 있거나 촉매작용을 하게 되는 Al2O3, WO3, TiO2, ZnO 등의 물질을 말하며, 대표적인 촉매반응으로는 물분자분해, 유기물질 분해, 표면개질 반응 등이 있다(Osterloh, 2008).
광촉매를 이용한 고도산화처리기술은 추가적인 약품 투입이 없이 반영구적으로 사용이 가능하다는 장점이 있어 오염된 물의 처리를 위한 대체방법으로 연구되어 왔다. 그러나 오염물질이 제거된 이후의 분산된 광촉매를 제거 또는 회수하기가 용이하지 않다는 단점이 존재하여 이를 보완하고자 광촉매를 고정화하는 연구가 진행되고 있다(Agustina et al., 2005).
광촉매를 고정화하는 방법에는 지지체를 매개체로 하여 고정화시키는 방법이 많이 연구되어 왔으며, 사용되는 지지체로는 유리, 모래, 테프론, 활성탄, 세라믹 등의 재료가 사용되었다. 고정화 방법에는 Sol-Gel법에 의한 방법, 박막코팅 제조법, Bead 코팅법, Al2SO4 등과 혼합고정법, 접착제를 이용한 고정방법 등이 연구되었다(Bideau et al., 1995). 최근 연구결과에 따르면 코일 튜브 내부에 TiO2가 코팅되어 자외선 조사하에 유기물을 분해시키는 연구와 PVA 재질의 다공성 담체위에 nano-TiO2 입자가 코팅된 다공성 광촉매 담체를 이용하여 난분해성 유기오염 물질을 제거하는 연구 등이 보고되었다(Jung et al., 2010, Park et al., 2009). 이와 같이 유기계 접착제를 이용한 많은 연구가 보고되고 있으나, 유기계 접착제 및 지지체에 대한 안정성에 대한 검증이 충분하다고는 볼 수 없는 상황이다(Kim et al., 2013).
휘발성 유기화합물은 상온에서 높은 증기압으로 인하여 수중에서 휘발되어 각종 악취의 원인이 될 뿐만 아니라, 장기간 접촉하게 될 경우에는 독성이 발생하여 각종 장애를 유발할 수 있는 물질이다(Heinrich-Ramm et al., 2000). 그럼에도 이들 물질들은 필요성에 의하여 섬유, 제지 및 전자산업 전반에 걸쳐 많이 사용되고 있을 뿐만 아니라 완전 분해되지 않고 산업용수의 사용에도 영향을 미치고 있다(Ahn et al., 2012). 선행연구를 통하여 휘발성 유기화합물중 분자량이 작은 저분자 휘발성 유기화합물들이 저농도 (ppb 단위)로 잔존하여 발생하는 문제로 밝혀졌다.
이에 본 연구에서는 산업에서 배출되는 저농도 유기화합물질을 포함한 폐수의 효율적인 처리 및 재이용을 위한 기반기술을 개발하고자 무기계 접착제를 이용한 광촉매 고정화를 이용한 적용 가능성을 살펴보고자 하였다.
본 연구에서 사용된 물질은 폐수조건을 모사하기 위하여 휘발성 유기화합물(Volatile organic compounds : VOCs)중에 분자량이 65 미만인 6종의 화합물(acetone, acetonitrile, acetaldehyde, IPA (Isopropyl alcohol), ethanol, methanol)과 VOCs 계열 화합물과 유사한 분자량의 유기질소 화합물인 urea를 선정하여 실험을 진행하였다.
저농도 유기물질 제거율의 분석은 TOC (Sievers, 5310C, USA), GC/MS (Agilent, 7920A/5975, USA) 및 LC/MS (Waters, Quattro Premier XE, USA)를 사용하여 실시하였다. TOC 분석의 경우 저농도 영역(0.4 mg/L)의 분석이므로 전처리시에 발생할 수 있는 미량의 유기물질 유입을 방지하기 위해 별도의 전처리를 거치지 않고 측정하였으며, GC/MS 및 LC/MS 분석을 위한 시료의 경우 시린지필터를 이용한 전처리를 실시하였다. GC/MS 분석의 경우 Purge & Trap (Teledyne Tekmar, USA)을 이용하여 추가 전처리를 실시하였다. GC/MS의 정량범위는 10~100 mg/L이고 검출한계는 10 mg/L 였으며, LC/MS의 정량범위는 10~100 mg/L이고 검출한계는 10 mg/L 였다. 고정화된 광촉매 담체의 표면 및 수지접착제를 사용하여 광촉매가 고정된 glass fiber mesh와 glass fiber sheet의 표면 변화는 SEM (Hitachi, S-4800, Japan)으로 관찰하였다. 완성된 고정화 광촉매 담체의 비표면적은 BET (BEL, BELSORP-mini II, Japan)로 확인하였다.
본 연구에서는 다양한 고정화 방법중 접착제를 이용한 방법의 사용이 가능한지를 검토하기 위하여, 기존의 접착제를 사용한 광촉매 고정화 제품의 안정성 검토를 진행하였다. 연구에서 사용된 제품은 유리섬유 위에 불소계수지접착제와 광촉매(산화티타늄)를 혼합한 후에 코팅한 glass fiber mesh와 glass fiber sheet (Nihon Polymer, Japan)로, 근거리(0 cm) 및 원거리(40, 70 cm)에 UV 램프를 설치하여 수지접착제 사용 광촉매의 고정화 안정성을 확인하였다.
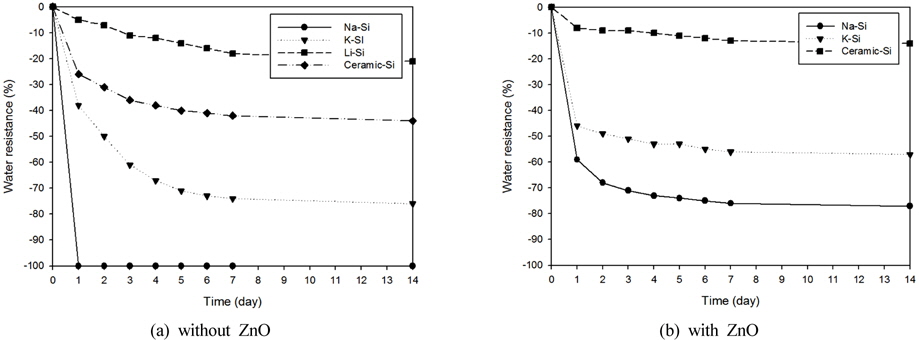
앞서 진행된 수지접착제의 광촉매 안정성 문제로 인하여, 본 연구에서는 무기지지체를 이용한 광촉매 고정화를 연구하였다. 지지체로는 제조 및 제작이 용이하기 위하여 무기 접착제로 알려진 물유리를 선정하였다. 물유리는 일반적인 물유리(S-chemtech, KSM 1종/POSIL 15/Lithium silicate-H, Korea)와 세라믹물유리(Glass Eco, SL-600, Japan)에 대한 실험을 실시하였다. 경화된 물유리를 증류수상에 혼합하여 무게변화를 관찰한 결과, Fig. 1(a)에서 보이는 바와 같이 물유리를 단독으로 사용할 경우 지지체의 불안정성으로 실험을 진행하기 어렵기 때문에 첨가제를 혼합하여 지지체의 안정성 향상을 기대하였다. 첨가제로는 물유리와 결합하여 내열 및 내수성이 향상하는 것으로 알려진 산화아연을 선택하여 진행하였다(Weldes and Lange, 1969).
안정성 평가 실험은 동일한 질량의 물유리별로 일정비율 (물유리 : 산화아연 = 10 : 1)의 산화아연(ACS grade, Sigma-aldrich)을 첨가하여 80℃에서 12시간 이상 건조시킨 후에, 3차 증류수에 침지시켜 상온(25℃)에서 150 rpm으로 교반시키며 24시간 단위로 무게변화 관찰을 통하여 확인하였다. 물유리 중에서 무게변화가 약 20%로 가장 안정적인 것으로 나타난 Li-Si는 실험과정 중 응집력이 없이 분산되는 것으로 확인되어 이를 제외한 나머지 물유리에 대해서 산화아연의 첨가량을 변화시키면서 무게변화를 관찰하였다.
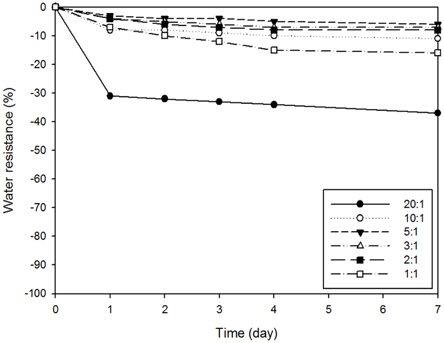
Fig. 1(b)의 실험결과를 보았을 때, 물유리별로 차이가 있었으나 Na-Si 계열과 K-Si 계열의 물유리의 경우에 약 20% 정도의 안정성이 증대된 것을 확인하였다. ceramic-Si 계열의 물유리의 경우는 산화아연의 첨가가 없이도 안정성이 우수하였으며, 첨가시에 약 10% 정도의 무게변화만이 관찰되어 이를 최적화하기 위하여 산화아연 함량변화에 따른 안정성 테스트를 실시하였다. 실험결과 Fig. 2에서 보이는 바와 같이 산화아연의 함량이 증가함에 따라 10 : 1 이상의 비율에서 10% 내외의 무게 감소율을 보였다. 실험결과를 토대로 물유리들 중 가장 큰 안정성을 보인 ceramic-Si 계열의 물유리를 지지체로 최종 선정하여 고정화 광촉매 담체 제조를 실시하였다.
물유리와 산화아연을 혼합한 지지체를 사용하여 광촉매를 고정화 하였을 경우, 높은 비중으로 인해 반응기 내부에서 유동이 원활하지 못함을 확인하였고, 광촉매의 유기물질 제거효율에 부정적인 영향을 미치게 됨을 확인하였다. 일반적인 비중 조절의 방법에는 지지체를 발포하거나 지지체의 중앙을 비우는 중공형태가 보편적으로 사용되나, 무기 지지체의 특성상 지지체를 발포하는 방법은 부적합하기 때문에 중공형태 비드를 추가하여 비중을 조절하는 방법을 선택하였다.
담체는 마이크로중공비드(Potters, Q-Cel, Japan)와 물유리를 지지체로 하여 일정비율로 혼합한 후에 비중 조절을 실시하였고, TiO2(Daegussa, P-25)를 첨가하여 광촉매 효과가 발현될 수 있도록 있도록 하였다. 규격화된 크기를 얻기 위하여 30 mL 실린지로 사출하였으며, 완성된 담체는 Fig. 3에 나타난 바와 같이 5 mm 내외의 원통형 모양으로 비중은 2.19 이였다. Fig. 3과 같이 SEM 관찰을 통하여 담체 내부에 마이크로 중공비드가 분포된 것을 확인하였다.
2.5. 합성폐수를 이용한 광촉매 담체 유기물 분해실험
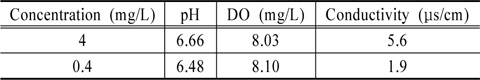
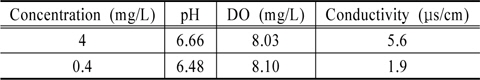
고정화 광촉매 담체의 평가에 앞서서, 대조군으로 활용 및 광촉매의 합성폐수 제거 가능성을 확인하기 위하여 광촉매 분말을 이용한 분해실험을 실시하였다. 바탕실험을 통해 최적실험조건을 확인한 후에, TiO2 (Daegussa, P-25)와 합성폐수 조건을 모사하기 위하여 각 물질들(acetone, acetonitrile, acetaldehyde, IPA, ethanol, methanol, urea)을 고농도(4 mg/L)와 저농도(0.4 mg/L)로 제조하여 가능성을 확인하였다. 이 때의 원수성상은 Table 1과 같았다. 최종적으로 저농도(0.4 mg/L)의 합성폐수 조건에서 고정화 광촉매 담체의 분해실험을 실시하여 고정화 광촉매 담체의 폐수 재이용 적용이 가능한지를 검토하였다.
[Table 1.] Test conditions of the photocatalytic system
Test conditions of the photocatalytic system
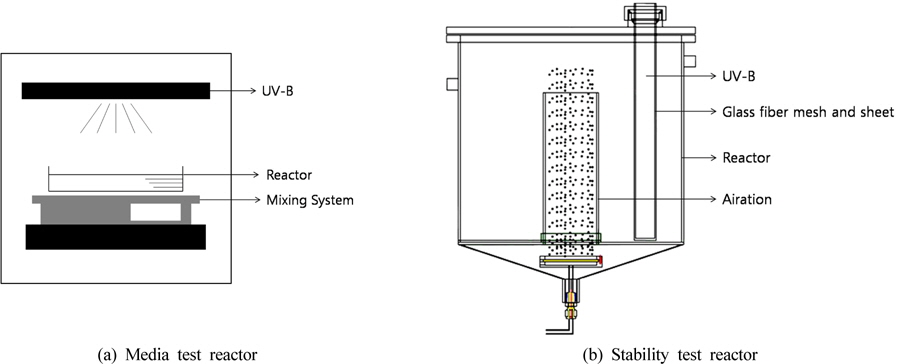
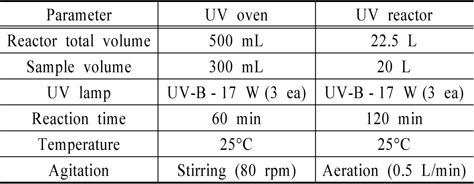
본 연구에서 사용된 회분식반응기는 Fig. 4(a)와 같이 drying oven을 개조하여 장치의 상부에 일자형 UV-Lamp(Ster-L-Ray, 254 nm, 17 w) 3개를 각각 5 cm의 간격으로 병렬 설치하였다. 실험에 사용한 반응기는 유효부피 500 mL의 석영 재질의 디쉬(Φ160 × 50 mm)로 반응수면과의 간격은 5 cm로 고정하였으며, 원활한 유동을 위해 반응기 하부에 magnetic stirrer를 위치하여 100 rpm으로 교반하며 실험을 진행하였다.
또한 수지접착제의 광촉매 안정성 검토를 위한 회분식반응기는 Fig. 4(b)와 같이 Stainless steel 재질의 반응기(Φ320 × 300 mm)로 유효부피는 22.5 L로 제작하였으며, UV-Lamp(Ster-L-Ray, 254 nm, 17 w) 3개를 일정간격으로 배치하였다. 각 반응장치를 이용한 운전 조건은 Table 2와 같다.
[Table 2.] Test conditions of the photocatalytic system
Test conditions of the photocatalytic system
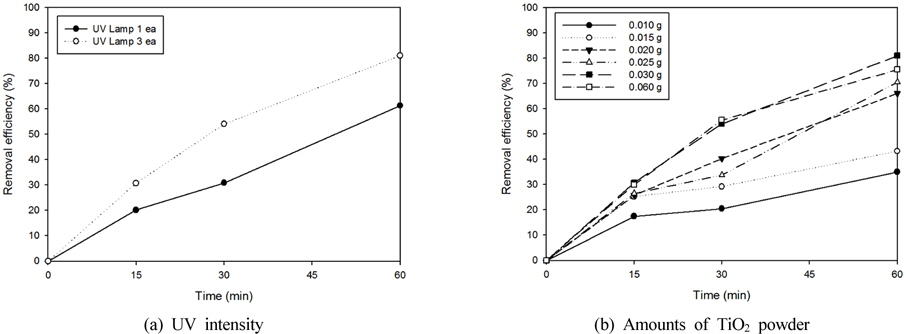
고정화 광촉매 담체 제작을 수행하기 전에 광촉매의 목표물질별 분해가능성 확인 및 추후의 고정화 광촉매의 분해효율 비교를 위하여 Fig. 4(a)의 회분식반응기에서 TiO2 광촉매 분말을 이용하여 유기화합물별 분해성을 검토하였다. 분해성 검토는 UV의 세기 및 광촉매 투입량에 따른 분해효율 차이를 확인한 후에 실시하였다(Ha and Cho, 2003). 실험은 20~40 nm의 입도를 가지는 TiO2 (Daegussa, P-25)를 사용하였으며, urea를 고농도(4 mg/L)로 제조하여 UV 램프의 개수와 광촉매의 투입량을 증가시키는 실험을 진행하였다.
실험결과는 Fig. 5(a)에 나타난 바와 같이 UV 세기가 강해질수록 분해효율이 증가하는 것을 확인하였으며, 광촉매 투입량의 경우는 Fig. 5(b)와 같이 0.03 g(0.01 wt%)까지 분해효율이 증가하였으나 그 이상의 과량을 투입하였을 때는 분해효율에 영향을 미치지 않는 것으로 나타났다.
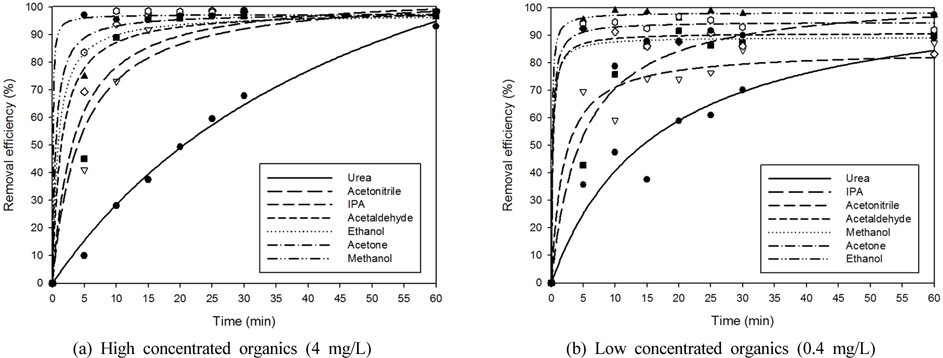
앞선 실험에서의 결정된 실험조건하에서 합성폐수는 각 단일물질별로 고농도(4 mg/L)에서의 실험을 통하여 제거 가능성을 확인한 후에 본 연구에서 목표로 하는 저농도(0.4 mg/L)에서의 실험 순으로 진행하였다.
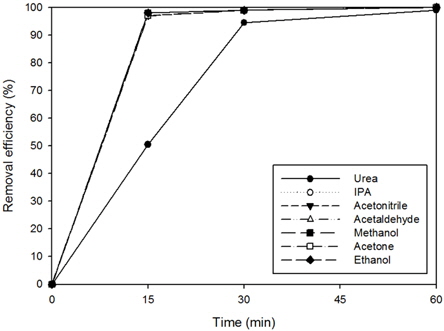
실험결과는 Fig. 6(a)와 같이 고농도에서 acetone, acetonitrile, acetaldehyde, ethanol, IPA, methanol의 경우 15분 반응시 95% 이상 분해되었으며, urea의 경우는 60분 반응시 90% 이상 분해되는 것으로 나타났다. Fig. 6(b)와 같이 저농도에서의 실험결과에서는 acetone, acetonitrile, acetaldehyde, ethanol, IPA, methanol의 경우 15분 반응 시 75% 이상 분해되는 것에 비하여, urea는 60분 반응 시 80% 이상 분해되는 경향성을 나타내었다.
이를 통하여 광촉매를 이용한 저농도 유기물질들의 분해 가능성을 확인하였으며, VOCs 계열의 유기화합물과 urea의 제거정도를 비교하여 보았을 때, VOCs 계열의 유기화합물보다 유기질소화합물이 광촉매를 이용한 제거에서 난분해성인 것으로 판단되었다.
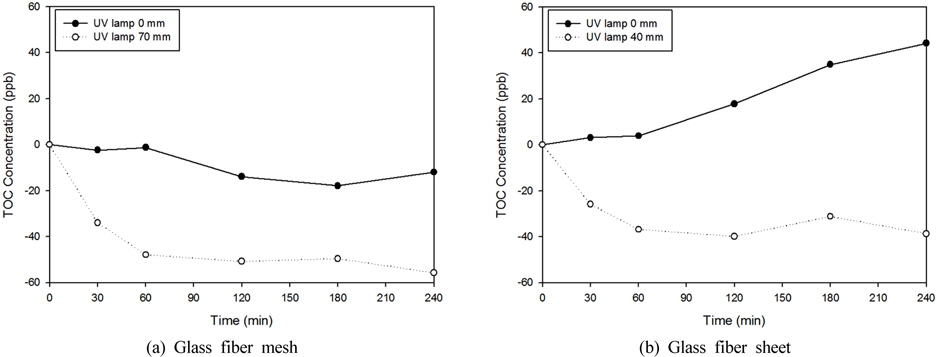
본 실험에서 사용된 제품은 광촉매가 고정된 glass fiber mesh와 glass fiber sheet 제품으로 수중에서 UV를 조사한 이후의 표면을 관찰하였다. 실험결과 Fig. 7에 나타난 바와 같이 수지접착제를 사용한 광촉매의 표면에 갈라짐과 손상이 관찰 되었다. 이는 UV와 부착되어 있는 광촉매간의 산화 작용으로 인하여 불소계 수지접착제가 점차적으로 분해되는 것으로 판단되었다.
배치 위치에 따른 유기물 용출 실험 결과에서는 Fig. 8과 같이 UV lamp와의 거리를 근접하게 배치한 것보다 일정거리를 두어 배치한 경우에서 TOC 농도의 감소량이 높은 것으로 나타났다. 이와 같은 결과는 광촉매와 UV lamp의 거리가 가까울수록 유기물의 분해효율보다 수지접착제의 분해량이 커지며, 멀어질수록 유기물의 분해량보다 수지접착제의 분해량이 작아지면서 나타나는 현상이라고 판단되었다.
앞선 실험을 통하여 mesh와 sheet 형태의 광촉매의 경우, UV lamp와의 근접하게 배치되면 광촉매의 유기물 분해효율보다 UV에 의해서 불소계수지 접착제가 분해되어 배출되는 용출량이 증가하는 것으로 판단되었다.
수지접착제 중에서도 상대적으로 내화학성이 뛰어나다고 알려진 불소계수지 접착제의 용출정도를 보았을 때, 본 연구에서 목표로 하고 있는 저농도(0.4 mg/L) 분해 실험의 경우에는 미량의 용출가능성이 있는 유기접착제 사용은 적합하지 않다고 판단하였다. 이에 무기계 접착제를 이용한 광촉매 고정화 방법을 연구하였다.
완성된 고정화 광촉매 담체를 각 물질별 농도가 0.4 mg/L로 제조된 300 mL의 합성폐수 내에 충진율을 20%로 설정하고 분해 효율실험을 실시하였다. 실험은 Fig. 4(a)의 회분식반응기내에서 Table 1의 실험조건으로 실시하였다.
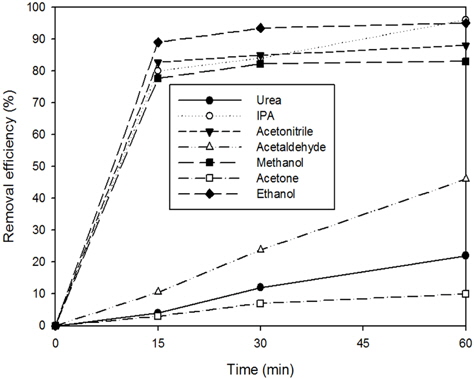
실험결과는 Fig. 9와 같이 광촉매 분말의 경우는 30분 반응시 모든 물질들이 95%이상 분해되는 것을 확인하였으나, 고정화 광촉매 담체의 경우는 Fig. 10에 나타난 바와 같이 acetonitrile, ethanol, IPA 및 methanol의 경우는 15분 반응시 75% 이상 분해되었고, acetone, acetaldehyde, urea의 경우는 60분 반응시 10%, 45%, 20% 만이 분해되는 것으로 나타났다. 이는 광촉매 분말보다 감소된 분해 효율로서 BET를 이용한 비표면적 분석결과를 참고하였을 때, 광촉매 분말의 경우는 50 m2/g, 고정화 광촉매 담체의 경우 2 m2/g으로서 광촉매의 비표면적 감소로 인한 분해효율 저하로 판단되었다. 대상물질들별 분해정도를 비교해 보았을 때, acetone의 급격한 분해효율 감소는 IPA가 산화되면서 발생되는 acetone으로 인하여 분해효율에 영향을 미치는 것으로 판단하였다(Arsac et al., 2006; El-Morsi et al., 2004). 앞선 광촉매 분말을 이용한 실험결과를 종합하여 VOCs 계열의 유기화합물과 urea의 제거정도를 비교하여 보았을 때, VOCs 계열의 유기화합물보다 유기질소화합물이 광촉매를 이용한 제거에서 상대적으로 난분해성인 것으로 판단되었다(Parekh et al., 2007).
본 연구에서는 광촉매 고정화를 통하여 폐수 재이용의 적용가능성을 살펴보고자 하였으며, 다음과 같은 결론을 얻었다.
1) 폐수의 재이용을 위한 저농도 저분자 유기물질 분해의 경우에는 지지체의 불안정성으로 인한 미량의 유기물질 용출이 예상됨으로, 유기계 지지체 및 접착제를 이용한 광촉매 고정화 방법보다는 무기계 물질을 사용하는 것이 적합할 것으로 판단되었다. 2) 세라믹 물유리를 이용한 무기계 고정화 광촉매 담체의 합성폐수 조건에서 유기화합물질들의 분해정도를 비교하였을 때, 초기농도 0.4 mg/L를 기준으로 acetonitrile, ethanol, IPA, methanol의 경우 15분 반응시 75% 이상 분해되었으며, acetone, acetaldehyde, urea의 경우는 60분 반응시 10%, 45%, 20% 가 분해되는 것으로 나타났다.