현재까지
본 연구에서는 두부에 형성되는 궤양 때문에 어민들 간에는 “총 맞은 병(bullet-shot disease)”으로 불리고 있는 질병 원인균의 특성과 인위감염의 결과를 보고한다.
2013년 8월 전북 정읍의 노지양식장에서 발병한 동자개,
병어의 간, 비장 및 신장의 조직 일부분을 슬라이드글라스에 도말하여 Gram염색 또는 May-Grűnwald Giemsa염색하는 동시에 tryptic soy agar (TSA, BD)에 접종하여 25℃에서 48시간 배양하였다. 발육한 균은 순수 분리한 다음 API 20E 및 API 50CH kit (Biomerieux, USA)을 이용하여 사용설명서에 따라 생화학적 검사를 실시하였다. 부가적으로 oxidase, catalase, Oxidation-Fermetation시험, Sulfide, Indole, Motility medium 및 식염첨가에 따른 발육을 상법에 따라 조사하였다. 식염에 따른 발육은 보통한천배지(nutrient agar, NA)에 접종하여 25℃에 48시간 배양한 다음 NaCl을 0, 1.5, 2, 3 및 4%가 되게끔 첨가한 NA와 nutrient broth에 접종하여 48시간 배양한 다음 발육의 유무를 판정하였다.
대조균주로는 표준 균주인 Edwardsiella ictaluri (ATCC 33202), 국산메기 뇌 유래의 B-4 (Park and Kim, 1994) 및 국산 메기에서 분리한
Intervening spacer와 Inter-ribosomal sequence사이의 부분을 증폭시키기 위한 Williams and Lawrence (2010)의
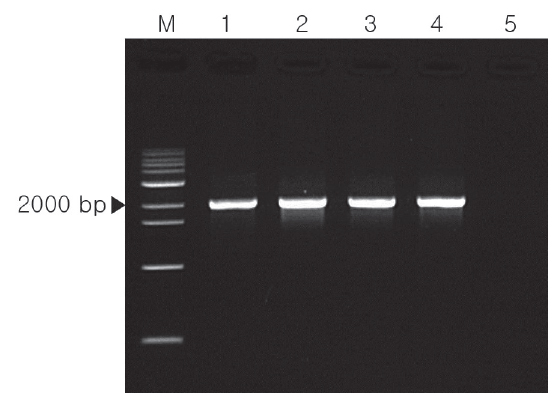
반응조건은 95℃ 4분간 initial denaturation시킨 다음 30 cycles (95℃ 30 s; 60℃ 30 s; 72℃ 2 min)로 증폭시킨 다음 72℃, 10 분간 final extension시켰다. PCR반응물은 전기영동하여 2,000 bp의 특이 밴드를 확인하였다.
복강 주사와 침지 감염에 사용한 어류는 동일 증상의 질병이 발생한 적이 없는 민간의 양식장에서 입수한 체장 6.8-12.5 cm의 개체를 각 농도별로 20미씩 사용하였다.
BHIA에 25℃에 48시간 배양균을 멸균생리식염수로 현탁시켜 104-107 CFU/mL의 균액을 만들어 복강주사의 경우는 항문 앞쪽의 복강에 각각의 희석균액 0.1 mL씩 접종하였다. 침지 감염을 위해서는 수조에 최종 농도가 104 -107 CFU/mL되도록 균액을 첨가한 다음 통기시키면서 1시간 침지시켰다. 인위 감염시킨 후 56 cm×36 cm×30 cm 의 사각수조에 수용하여 수온을 25℃로 통기 사육하면서 매일 1/2씩 환수시켰다. 사육기간 동안 먹이는 투여하지 않았으며, 대조군은 생리식염수를 세균액 대신으로 사용하였다.
복강 접종 또는 침지 감염시킨 어류는 10일간 사육하면서 매일 폐사를 관찰하였으며, 누적 폐사율은 Reed-Muench법 (1938)으로 구하였다. 또 폐사어 및 생잔어의 간장과 신장의 도말표본을 May-Grűnwald Giemsa염색하거나 SS agar에 접종하여 접종균을 재분리를 시도하였다. 또한 침지감염 후 생잔한 개체는 동일 크기의 다른 수조에 옮겨 같은 조건으로 계속 사육하면서 증상의 재현 유무를 관찰하였다.
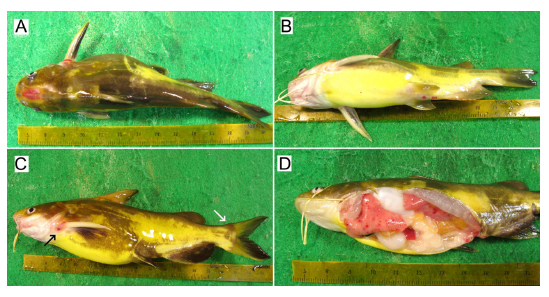
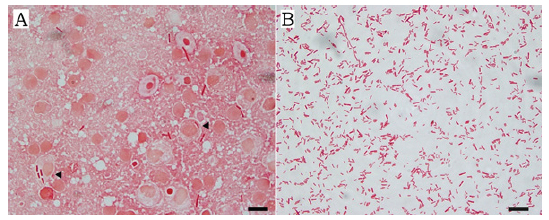
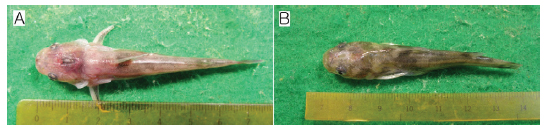
발병시의 수온은 27℃ 였으며, 감염어는 두개골의 궤양 형성, 가슴지느러미와 꼬리지느러미의 발적, 항문과 비뇨생식공 주변의 발적 등의 증상을 나타내며(Fig. 1A-1C), 때로는 물표면에서 발광 유영하면서 폐사하였다. 내부적으로는 간장과 신장의 퇴색 및 발적이 뚜렷하였다(Fig. 1D). 그러나 외관상 복부팽만처럼 보이는 것은 복부 지방의 축적에 의한 것으로 지방과 생식소를 제거하면 신장과 간장이외에는 이상은 발견할 수 없었다. 또한 소화관은 장염이 없이 고유의 색조와 탄력성을 유지하고 있었지만, 항문과의 연결 부위에 발적이 발견되는 정도였다. 병어의 신장과 비장을 도말하여 Gram염색 또는 May-Grűnwald Giemsa염색하면 수많은 장간균이 주로 관찰되었다. 개체에 따라서는 장간균과 단간균이 혼재되고 있는 경우도 있으며, 일부의 마크로파아지는 원인균을 탐식하고 있었다. 신장의 stamp표본을 Gram하여 측정한 장간균의 크기는 0.41∼0.48×2.18∼5.57 μm (n=20)였다(Fig. 2).
병어의 증상은 Yi et al. (2010)이 보고한 동자개의 증상과는 거의 대부분이 일치하였다. 그러나 Ye et al. (2009)의 결과와는 피부의 발적, 두부의 궤양, 이상 유영, 간장의 발적 및 아래 턱과 복부의 점상 출혈 등에서는 거의 일치하지만, 안구돌출 및 복수의 축적과 장염이 없는 점에서는 차이가 있었다. 또한 차넬메기(Hawke, 1978; Hawke et al., 1981; Jarboe et al., 1984; Shotts et al., 1986), 한국산 메기(Park and Kim, 1994), brown bullhead (Iwanowicz et al., 2006)의 증상과 유사하였지만, 안구돌출, 복수의 축적, 피부의 발적과 궤양의 형성 등의 증상이 나타나지 않는 것이 차이가 났다. 또한 두부에 궤양이 형성되지 않는 반면 복수의 축적과 복부의 출혈반점, 신장, 비장 및 간장에 백색 반점이 형성되는 동남아산 메기(Crumlish et al., 2002;Yasuda et al., 2003)와는 현저한 차이를 나타내었다.
Stamp표본에서의 균의 크기는 Yususa et al. (2003)의 동남아산 메기(
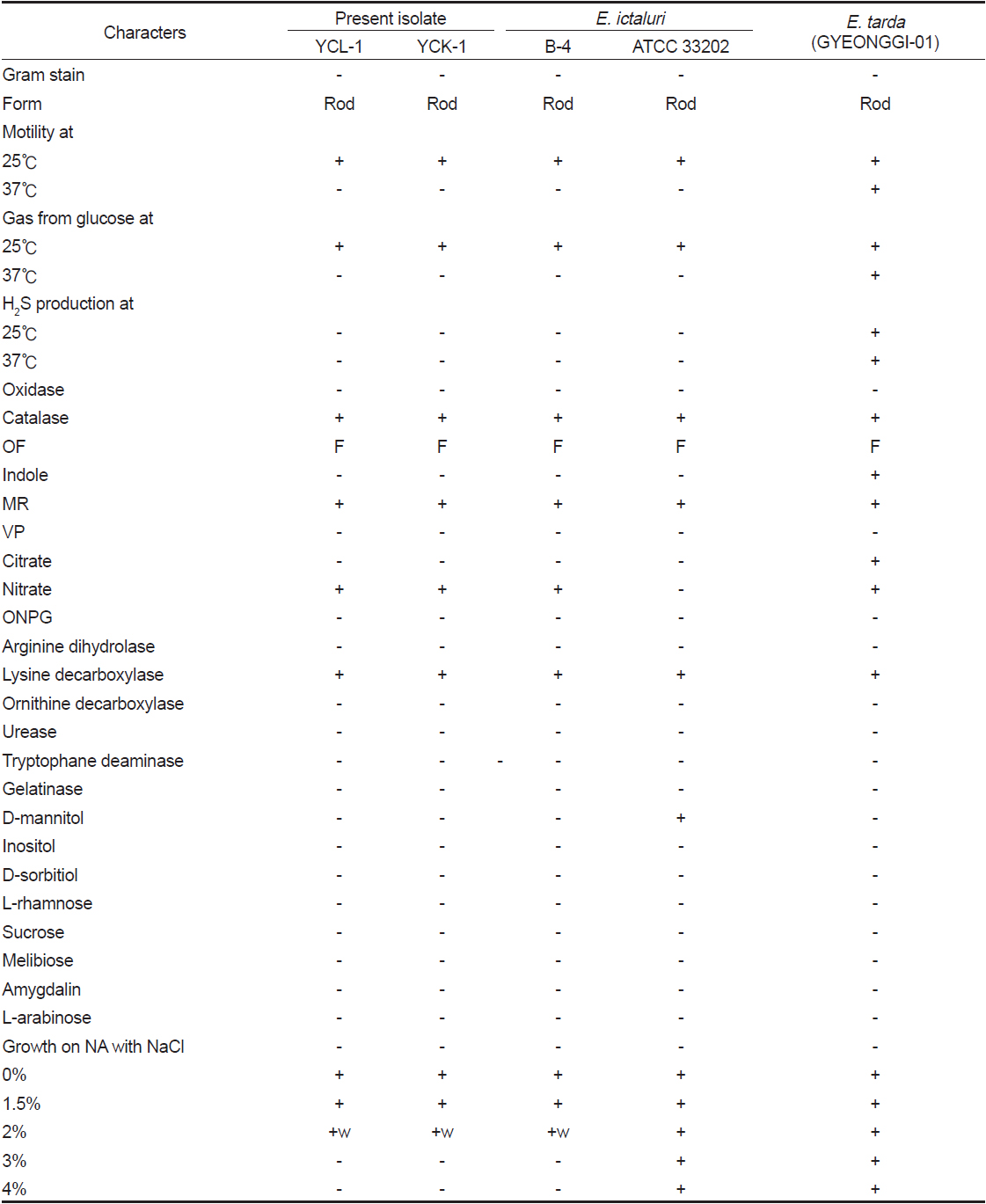
병어의 신장과 비장을 TSA 및 SS에 접종하여 25℃에서 48시간 배양한 결과 원인균으로 추정되는 세균이 순수상태로 분리되어졌다. SS agar에서는 중앙부가 엷은 황색을 띄는 투명한 집락이 형성되었다. 신장과 간장 유래의 균주(YCK-1 및 YCL-1)를 TSA에 순수 분리하여 API 20E에 접종 배양한 결과의 profile은 분리균과 B-4는 400400057, ATCC 33202는 400410067,
분리균의 성상은 대조균으로 사용한 메기 유래의
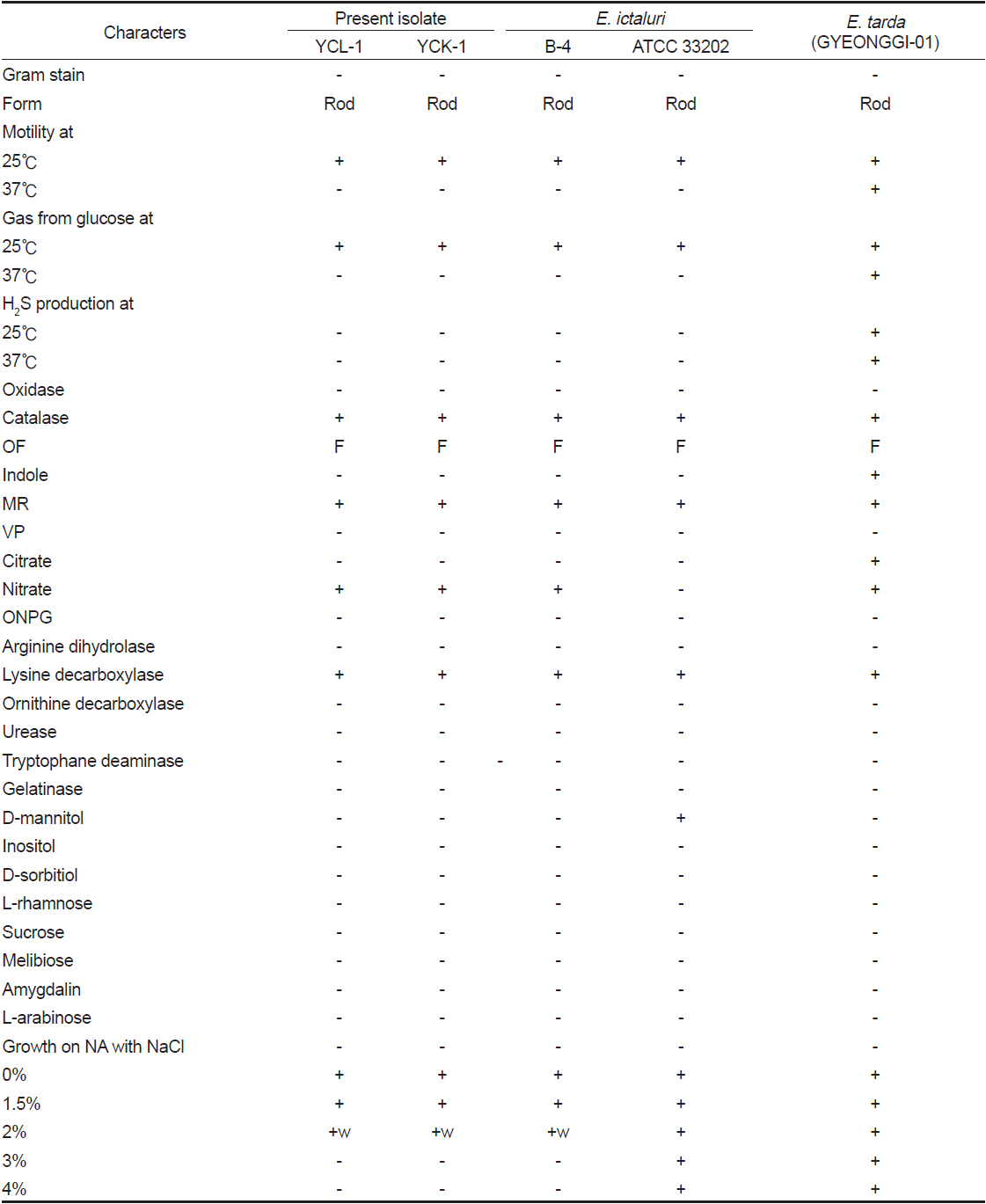
Comparison of biochemical characteristics among the present iolate (YCL-1 & YCK-1), the reference strains, Edwasiella ictaluri (B-4, ATCC 33202) and E tarda (GYEONGGI-01)
분리균과 대조균을
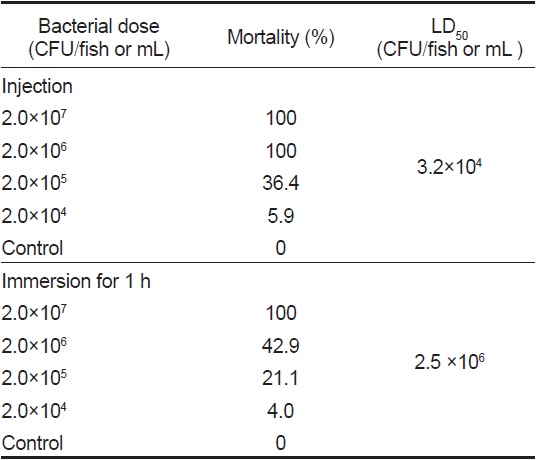
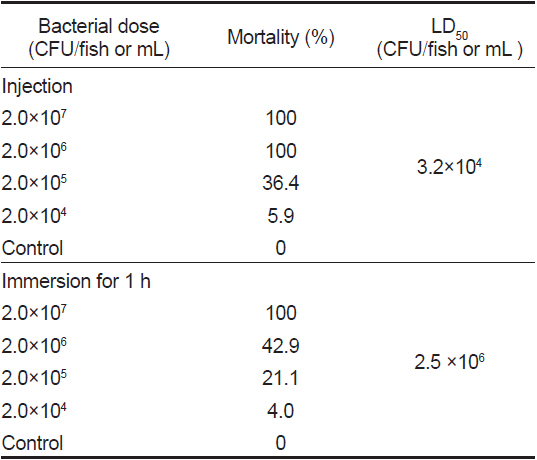
Mortality of yellow catfish challenged with the present isolate (YCK-1) by intraperitoneal or immersion routes at 25℃ for 7 days
그러므로 분리균의 생화학적 성상과 분자생물학적 동정 및 병원성 시험의 결과를 바탕으로 동자개의 두부에 특징적인 궤양 환부를 형성하는 질병의 원인균은