반수체(haploid)는 세포당 하나의 유전체 또는 염색체조가 존재하는 것으로, 자성발생성이배체(gynogenesis diploid) 또는 웅성발생성이배체(androgenesis diploid) 유도 기술에 의해서 생산되어 왔다. 이들은 자외선에 의해서 유전물질이 불활성화된 정자 또는 난자를 이용하여 유도됨으로써, 오로지 난자 또는 정자의 유전물질만으로 발생하게 된다(Tanaka et al., 2004; Yi et al., 2009).
경골어류의 반수체에 대한 연구는 금붕어(goldfish,
넙치(olive flounder,
본 연구에 사용된 넙치는 국립수산과학원 육종연구센터에서 선발육종기법을 통하여 생산된 킹넙치(KingNupchi)가 사용되었으며, 복부 압박법으로 암컷 7미와 수컷 3미로부터 확보된 난과 정자를 실험에 사용하였다.
반수체(haploid)는 자외선 조사에 의해 유전적으로 불활성화된 정자와 정상 난자를 수정함으로써 유도되었다. Kim et al. (1993)과 Yamamoto (1999)에서 보고된 자외선 조사량을 바탕으로, 넙치 정자의 완벽한 유전적 불활성화를 위해 5,400 ergs/mm2의 자외선을 조사한 후 습식법으로 인공 수정시킨 뒤, 수정란은 18±1℃의 부화수조에서 발생을 유도하였다.
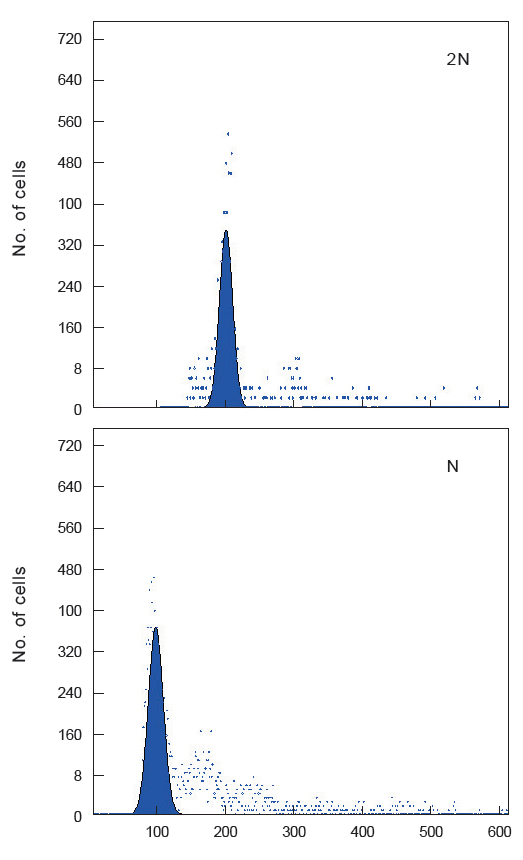
유도된 반수체의 DNA 함량 분석을 위하여 flow cytometry를 수행하였다. 반수체 증후군(haploid syndrome)의 형태를 가지고 있는 자어 10미를 모아 균질기로 세포를 파쇄한 후, Jung et al. (2014)의 방법론에 따라 핵막 제거 및 염색 과정을 수행하였다. 염색된 시료들은 PA II flow cytometry (Partec Co., Münster, Germany)를 이용 분석하였으며, 성체 넙치 꼬리지느러미 및 이배체 자어를 대조군으로 사용하였다.
넙치 반수체 및 이배체 배아는 18±1℃의 수온에서 부화시키며, 해부현미경(AZ100; Nikon Co., Japan)과 이에 부착된 디지털 카메라(DS-Ril; Nikon Co., Tokyo, Japan)를 이용하여 관찰과 촬영을 하였다. 각 발생 단계는 Kimmel et al. (1995)의 배발생 단계를 기준으로 정하였고, 수정된 개체의 90% 이상이 동일한 단계에 도달하였을 시기를 기준으로 각 발생단계별 소요 시간과 특징을 기록하였다. 또한 발생단계별 정확한 시간을 측정하기 위해 16±1℃와 20±1℃의 온도조건에서 발생시간을 비교하여 분석하였다.
반수체의 특이적인 기관 발생을 관찰하기 위해 부화 자어의 조직을 분석하였다. 형태학적으로 반수체 증후군의 형태를 가지고 있는 자어를 4% formaldehyde에 고정한 뒤, 통상의 조직학적 분석방법에 따라 탈수 및 파라핀을 이용한 포매 과정을 수행하였다. 준비된 표본는 6 μm 두께로 연속 절편하여 hematoxylin과 eosin으로 염색을 한 후, 광학현미경 (Eclipse E400; Nikon Co., Japan) 하에서 검경하였고, 이배체와 비교하여 특이적인 조직상은 광학현미경에 부착된 디지털 카메라(MoticampPro 205A; Motic Co., China)로 촬영하였다.
하나의 염색체조만을 가지는 반수체는 효율적인 유전자 분석 및 검색의 방법론으로 이용되고 있다. 그러나 이들 분석방법에 반수체를 이용하기 위해서는 먼저 유도된 반수체의 발생학적 특징에 대한 연구가 선행되어야 한다. 이에 본 연구는 넙치 반수체를 유도하였고, 생물의 고유한 DNA 함량으로 배수성을 판단할 수 있는 flow cytometry 분석법을 이용하여 유도된 반수체 넙치의 DNA 햠량을 측정하였다. 이에 이미 보고되어 있는 넙치의 DNA 함량(0.71 pg/cell; Animal genome size database, 2014)을 대조군으로 하여 측정한 결과, 이배체 부화자어의 DNA 함량은 0.71±0.02 pg/cell으로 확인되었고, 반수체는 0.34±0.01 pg/cell으로 확인되었다(Fig. 1). 이는 이배체 넙치의 DNA 함량의 50%에 해당하는 것으로써 성공적으로 반수체가 유도된 것으로 확인할 수 있었다.
유도된 반수체 넙치의 배발생 시기 및 특징을 관찰한 결과, 2 세포기에서 128 세포기에 해당하는 난할 및 초기 포배기 동안은 반수체와 이배체의 발생 시기 및 형태가 동일한 것으로 관찰되었다(Table 1). Walker (1999)는 제브라피쉬 반수체 배아에서도 초기 포배기까지 이배체와 발생시간이 동일함을 보고한 바 있다.
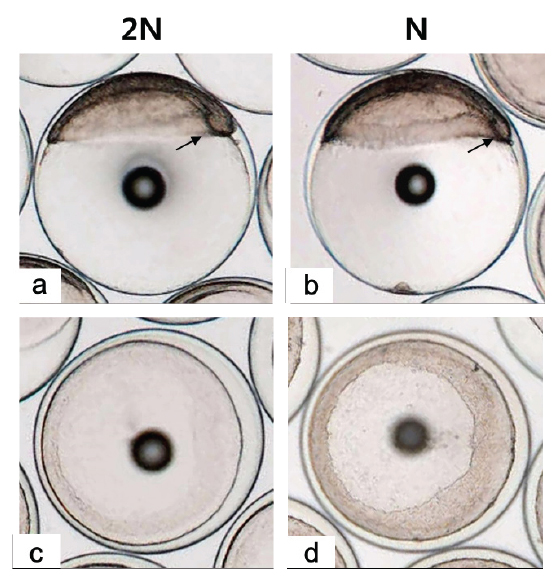
[Table 1.] Stage of embryonic development in diploid and haploid Paralichthys olivaceus
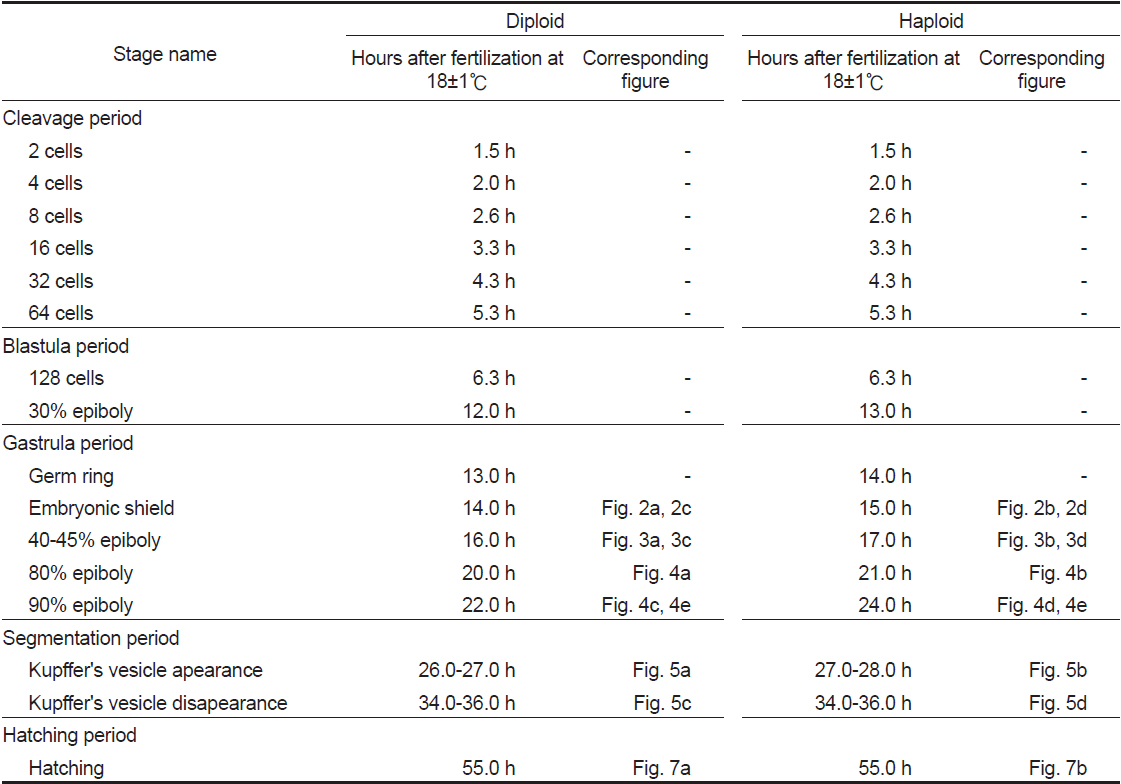
Stage of embryonic development in diploid and haploid Paralichthys olivaceus
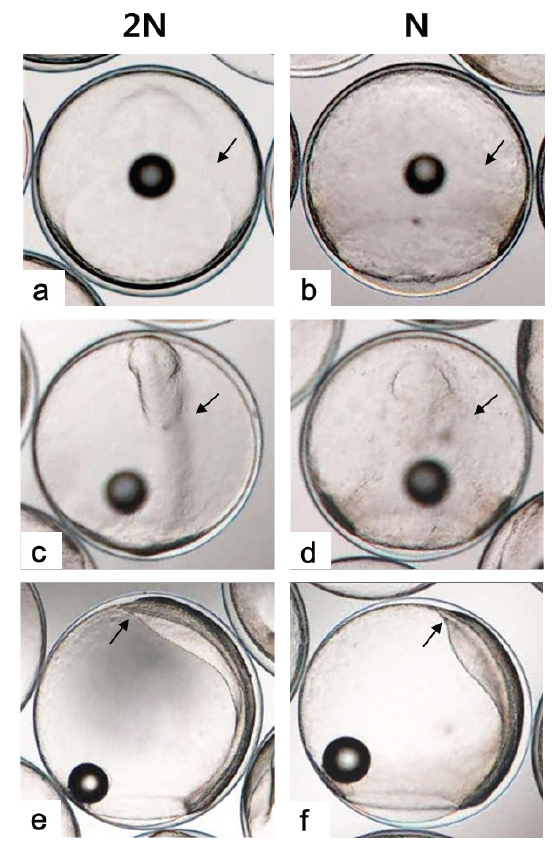
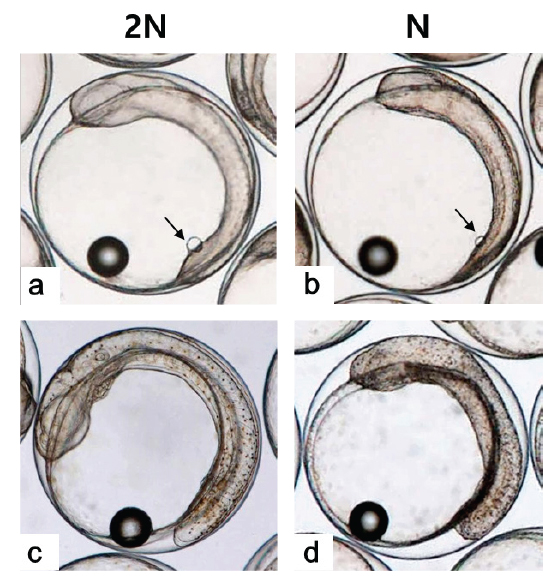
128 세포기 이후부터 반수체의 발생시간이 대조군에 비해 점차 느려져 30% 피포 형성이 이배체는 수정 후 12시간이 소요됨에 비하여 반수체의 경우 13시간이 소요되었다(Table 1). 이후 이배체에서는 수정 13시간 후 최초로 배환(germ ring)이 관찰되었고, 반수체 배아에서는 수정 14시간 후에 관찰되었다. 이때 반수체 배환은 이배체에 비하여 진하고 두껍게 형성되는 것으로 확인되었다(Figs. 2-4). 더욱이 피포 형성 비율이 높아질수록 이배체의 배환은 옅어지는 반면 반수체는 배환이 점차 진하고 두껍게 형성되는 것이 관찰되었으며 피포 형성 속도 또한 대조군에 비하여 점차 더 지연되어 90% 피포 형성은 반수체가 2시간 정도 늦게 관찰되었다(Table 1, Figs. 2-4). 배체(embryonic body)의 형성은 이배체 배아의 경우 80% 피포 형성 단계에서 형태가 나타나기 시작하여 90% 피포 형성단계에서 뚜렷한 배체가 형성되었으나, 반수체 배아는 이들보다 늦어져 90% 피포형성 단계에 도달해야 비로소 불명확한 형태의 짧은 배체가 넓게 형성됨이 관찰되었다(Fig. 4).
낭배기에 배환은 배반엽(blastoderm)이 난황을 감싸면서 일어나는 회절(involution), 수렴(convergence) 및 확장(extension) 의 형태발생 세포 운동(morphogenetic cell movements) 중 가장 먼저 관찰되는 회절(involution)이 일어남으로써 형성된다(Kimmel et al., 1995). 본 연구 결과 반수체 배아의 배환이 대조군에 비하여 매우 진하고 두껍게 형성되며 피포 형성 시간 또한 늦어지는 것이 관찰되었다. Araki et al. (2001)는 송사리 반수체 배아가 이배체 배아보다 피포와 회절이 늦게 관찰되는 것은 반수체가 한쌍의 염색체조만을 가짐으로써 비특이적인 세포사멸이 일어나고, 정상적인 피포와 회절 발생에 영향을 주게 됨으로써 이배체에 비해 늦은 속도로 발생한다고 보고한 바있다. 이에 넙치 반수체 배아도 비특이적으로 사멸된 세포들이 존재하게 되면서 이배체에 비해 두껍고 진한 배환이 형성됨으로 피포 및 회절 발생이 지연되는 것으로 판단된다. 또한 배체의 발생은 배반엽 세포의 수렴과 확장 과정에 의해 형성되고 이과정들이 진행될수록 배체는 점차 좁아지고 신장되면서 더 명확해지게 된다(Kimmel et al., 1995). 그러나 본 연구의 반수체배아는 대조군에 비하여 배체의 형태가 넓고, 짧으며, 분명하지않은 상태로 발생하는 것으로 관찰되었다. 송사리 반수체 배아에서도 초기 배체 형태가 짧고, 넓게 형성되었고 이것의 원인을 회절 지연현상으로 보고한 바 있어(Araki et al., 2001), 넙치 반수체 배아에서 이형적인 초기 배체 형태는 비정상적인 형태발생 세포 운동(회절, 수렴 및 신장) 과정에 의한 것으로 판단된다.
Kupffer’s vesicle은 반수체 배아에서 이배체 보다 한시간 늦은 수정 후 27-28시간에 관찰되었고, 사라지는 시기는 거의 동일하여 이배체 배아에 비해 적은 시간 동안 존재하는 것으로 확인되었다(Table 1). 반수체 배아에서 Kupffer's vesicles은 이배체 배아와 동일한 위치인 꼬리싹(tail bud)에서 형성이 되지만, 그 형태와 크기가 개체에 따라 불규칙적으로 발달하는 것으로 관찰되었다(Fig. 5). 이에 꼬리 중배엽을 형성하는데 영향을 주는 Kupffer's vesicles이 이형적으로 형성됨으로써 배체의 꼬리는 대조군과 비교하여 이형적으로 발생하는 것으로 관찰되었다(Fig. 7). Kupffer’s vesicle은 경골어류의 배아에서만 일시적으로 관찰되는 구체 기관으로, 섬모세포를 이용하여 좌우비대칭을 조정하는 역할을 한다(Essner et al., 2005). 이에 Okabe et al. (2008)은 제브라피쉬 발생과정 중 Kupffer’s vesicle 내에서 일어나는 유체역학적인 현상을 주사전자현미경, video microscopy 및 조직학적으로 밝혀 경골어류의 발생과정 중 그의 중요성을 입증한 바 있다. 본 연구에서 넙치의 반수체 배아의 Kupffer’s vesicle은 모양과 크기가 다양하였으며, 배체의 형태도 대조군과 뚜렷하게 구별되었다. 이는 좌-우 축형성에 영향을 미치는 Kupffer’s vesicle이 반수체 배아에서 이형적으로 발생함으로써, 이들의 후기 배발생 과정에서 다양한 기관들의 정상적인 발달에 부정적인 영향을 준 것으로 판단된다.
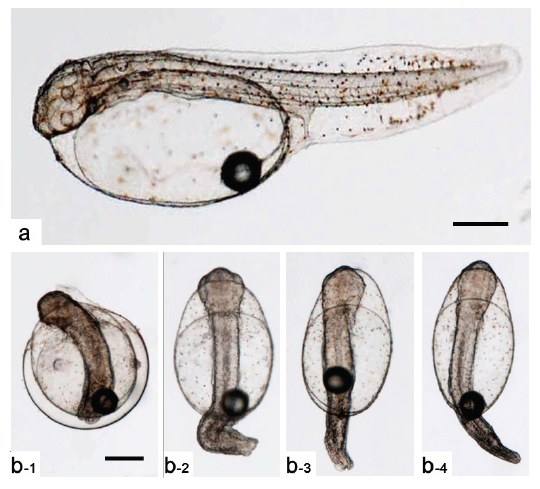
Kupffer’s vesicle이 소실된 후 배체가 부화하기까지 두 실험군간 발생 시간의 차이가 관찰되지 않아 최초의 부화는 반수체와 이배체 모두 수정 후 55시간으로 동일하였으나, 이배체 및 반수체 부화율이 각각 80.0±9.4 % 및 6.9±3.0%로 반수체는 일부 개체만이 부화하는 것으로 관찰되었다. 반수체 부화 자어의 형태는 개체에 따른 차이가 존재하나 대부분 꼬리가 제대로 발달하지 못하였고, 몸체의 길이와 넓이가 이배체에 비하여 짧고, 넓은 것으로 관찰되었다(Figs. 6, 7). 반수체 처리군 1,000알 중 꼬리 및 몸체가 기형적으로 발생한 개체는 962개로 그중 꼬리가 발달되지 못한 형태를 띠는 개체(Fig. 7b)는 903개, 꼬리가 생성은 되었으나 제대로 발달되지 못한 개체(Fig. 7c)는 59개로 확인되었다. 이들 중 꼬리가 전혀 발달되지 않은 개체들은 부화를 하지 못하고 죽는 것으로 관찰되었으며, 꼬리가 이형적으로 발생된 개체는 부화하였을지라도 6시간 이내에 모두 죽는 것으로 관찰되었다. 금붕어, 송사리, 제브라피쉬, 터봇(turbot,
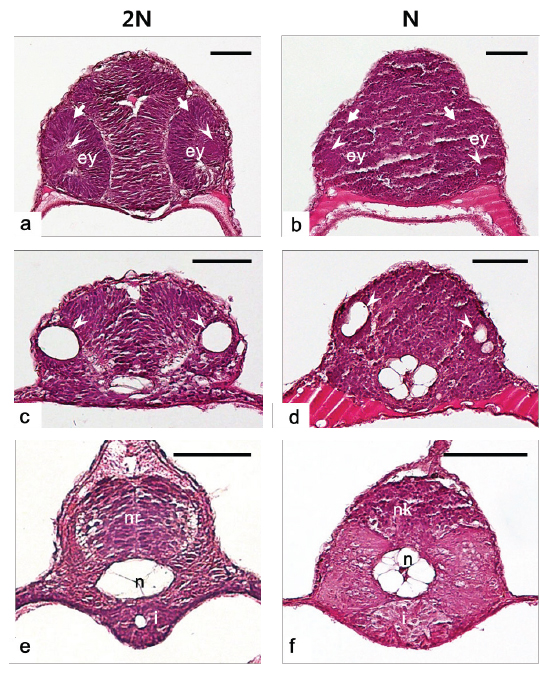
반수체의 다양한 배발생 단계에서 이상발생 및 발생의 지연현상이 관찰됨으로써 반수체에서 각 기관들이 발달되는 형태적 특징을 확인하고자 부화 자어의 횡당면 및 종단면에 대한 조직분석을 수행하였고 그 결과는 Fig. 8 및 Fig. 9와 같다. 수정체(lens)와 신경 망막(neural retina)이 정상적으로 발달된 눈이 분명하게 형성되어 있는 이배체 자어와는 달리, 반수체 자어는 수정체와 신경 망막이 불분명하고, 양쪽 눈이 비대칭적인 위치에서 형성되는 것으로 확인되었다(Fig. 8a, 8b). 또한 귀소포(otic vesicles)의 경우, 이배체에서는 양쪽에 각각 한 개씩 위치 하지만(Fig. 8c), 반수체에서는 이형적인 형태와 개수로 비대칭 적으로 형성되는 것이 관찰되었다(Fig. 8d). 금붕어 반수체 자어의 눈에서도 색소 망막(pigmented retina), 신경 망막, 수정체, 각막(cornea)과 같은 눈을 구성하는 세포들이 모두 형성은 되지만, 각 세포들이 비정상적인 위치에서 형성됨으로써 이형적인 눈의 형태로 발달된다고 보고된 바 있다(Luo and Li, 2003; Tanaka et al., 2004). 본 연구의 결과 역시 기존의 보고에서 기술된 결과들과 유사한 양상을 나타내었다. 이에 반수체에서도 각 기관을 구성하는 세포들이 형성은 되지만, 그 위치 및 형태가 비정상적으로 발달하는 것이 반수체 기관 발달의 특징인 것으로 판단된다.
신경관(neural tube)은 일반적으로 배발생과정에서 신경판 (eural plate)이 neural keel, neural rod 그리고 신경관의 순서대로 발달하지만(Clarke, 2009), 본 종의 이배체 부화자어는 신경관의 내부공간이 생성되지 않은 형태인 neural rod까지 발달하는 것으로 확인되었다(Fig. 8e). 이는 넙치가 짧은 배발생 기간을 가지기 때문에 신경관까지 발달하지 못하고 부화하는 것으로 보인다. 그러나 반수체에서는 구형의 형태조차 띄지 않는 neural keel의 형태로 관찰되어 신경 기관의 발생 지연현상이 관찰되었다(Fig. 8f). 또한 반수체에서 장(intestine)은 형태, 크기 및 내강(lumen)의 유무가 각 개체 별로 불규칙적으로 발달되는 것으로 관찰되었다(Fig. 8f).
중요한 뼈대 역할을 하는 척색(notochord)은 배발생 과정에서 중심세포가 부풀게 되면서 액포가 있는 상태로 발달한 뒤, 길게 늘어진 형태가 되는 과정을 거치게 된다(Stemple et al., 1996; Anderson et al., 2007). 그러나 반수체에서 척색은 액포 세포가 길게 늘어지지 않고 동그란 형태를 유지하고, 그 형태 및 크기가 균일하지 않게 발달하는 것으로 관찰되었다(Fig. 8f). 송사리반수체에서도 본 종의 관찰결과와 동일하게 척색의 중심에 존재하는 액포 세포들이 길게 늘어나는 과정 없이 불규칙하게 둥근 형태를 유지하는 것이 확인된 바 있다(Araki et al., 2001).
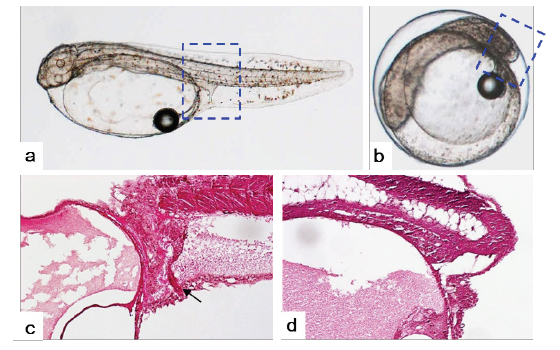
부화 자어의 종단면 조직분석 결과, 반수체에서도 체절(somite)이 발달은 되지만, 그 형태가 불규칙하고 각 체절간의 구분이 불분명한 것으로 관찰되었다(Fig. 9). 또한 장이 몸통부(trunk)까지 발달되어 항문을 형성하는 이배체와는 달리, 반수체는 꼬리가 거의 형성되지 못함으로써 장이 몸통부까지 형성되지 못하고 항문 또한 형성되지 못하는 것으로 관찰되었다(Fig. 9).
이상의 연구 결과, 넙치 반수체 배아는 피포가 시작되는 후기포배기부터 발생 지연 및 이상발생 현상 나타나기 시작하여 짧은 꼬리 및 넓은 몸통을 가진 배체로 발생하였다. 또한 부화단계에서 일부 개체만이 부화하였으며 부화한 개체도 모두 치사함으로써, 넙치 반수체의 이상발생 현상은 다양한 경골어류에서 보고된 반수체 증후군(haploid syndrome)의 특징들과 유사한 것으로 확인되었다. 이러한 넙치 반수체 이상발생 및 치사 현상은 기존의 연구에서 보고된 바와 같이 한 개의 유전체 만을 가지는 반수체 특성에 의한 열성 치사 유전자의 발현 또는 유전자산물의 부족으로 인한 것으로 판단된다. 또한 반수체에서 이형적으로 발달된 기관들은 대부분 축 시스템(axial system)과 연관된 것들로 눈 및 귀소포와 같은 기관은 좌-우 비대칭적으로 발생하였고 신경관, 척색, 장 및 체절과 같이 몸체에서 중심을 이루는 기관들은 대부분 불완전하게 발생하거나 발생하지 않는 것으로 관찰되었다. 이는 반수체 배발생 과정에서 Kupffer’s vesicle이 이형적으로 발생함으로써 정상적인 좌-우 축이 형성되지 못하여 눈 및 귀소포의 이상발생이 나타난 것으로 판단되고, 앞-뒤 축이 형성되는 낭배기 시기의 이상발생으로 신경관, 척색 및 장과 같은 기관들에서 이상발생이 관찰되는 것으로 보여진다.
앞으로 반수체 자어의 부화 전후 나타나는 조기 치사 현상으로 인하여 그 연구에 한계가 있는 넙치의 우성 및 열성 유전자검색 연구를 위해 반수체-이배체 키메라(haploid-diploid chimera)의 유도 연구가 뒤따라야 할 것이다.