우리나라 새우양식은 축제식 양식장에서 반집약적인 방법으로 이루어지고 있으며, 지난 20년간 서해안을 중심으로 빠르게 증가하였으나, 2002년 이후부터는 생산량이 해마다 크게 감소하였다(Jang et al., 2007; Kim, 2010). 그 이유는 여러 요인이 있지만 바이러스성 질병, 특히 흰반점바이러스(white spot syndrome virus)에 의한 대량폐사로 때문인 것으로 알려져 있다(Chou et al., 1995; Jang, 2009). 또한, 새우 양식장에서 배출되는 사료 찌꺼기, 대사산물 및 배설물 등에서 유래된 많은 양의 질산, 아질산 및 암모니아와 같은 질소성분은 사육수의 부영양화와 이에 따른 수질악화를 초래하기 때문에 질병과 함께 가장 문제시되고 있는 점이다(Liu et al., 2004). 이러한 문제에 대한 대안으로 최근에는 물리 또는 화학적 방법보다는 친환경적이며 안정성이 확보된 Bio-floc technology (BFT) 또는 바이오플락 시스템(bio-floc system) 양식이 주목을 받고 있다(Bashan and Bashan, 2010).
바이오플락 시스템(bio-floc system)은 생산성 향상을 위하여 물을 순환시키지 않기 때문에 바이러스 및 세균이 침입하지 못하며, 다른 한편으론 양식 생물에 해롭지 않은 유용 미생물 또는 타가 영양 미생물을 이용하기 때문에 수중의 유기질소와 암모니아 등이 효과적으로 제거되어 사육수의 교환 없이도 수질을 정화할 수 있는 장점이 있다(Emerenciano et al., 2013). 또한 사육수 내 질소 성분에서 전환된 미생물이 양식 생물의 추가 단백질원 즉 양식 생물의 먹이가 되기 때문에 전체 양식 비용의 50% 이상을 차지하는 사료 비용의 절감을 가져오는 장점도 있다(Peterson et al., 2012). Bio-floc 기술의 원리는 간단하지만, 이 기술의 일반적인 기준이 모호하고, 양식기술과 그 시스템에 대한 이해가 부족하기 때문에 실제 양식에 적용하는 것은 쉬운일은 아니다(Hargreves, 2013). Cho et al. (2010)는 새우 양식에 이용되는 bio-floc에 있어 타가영양세균의 종조성과 기능에 관한 연구는 전무하다고 하였으며, 이는 타가영양세균의 대부분은 배양이 불가능한 세균으로 접근방법이 매우 어렵기 때문이라고 하였다. 특히 특정 미생물이 플락(floc) 내에서 유용 미생물로서의 효과가 있음을 입증하기 위해서는 많은 선행 연구가 수행되어야 하며(Fuller, 1992; Crab et al., 2012), 양식 호지 또는 사육수조 내에 자연적인 bio-floc을 형성하기 위해서는 미생물뿐만 아니라 균류, 원생동물, 조류 및 선형동물 등의 대량발생도 유도해야 한다. 이와 같이 bio-floc을 형성시키는 일은 쉬운 일이 아니며, 이미 형성된 bio-floc을 관리함에 있어서도 상당한 주의가 요구된다(Pérez-Rostro et al., 2014). 따라서, 본 연구에서는 이미 그 효과가 알려진 유용 미생물들을 재 조합하여 bio-floc을 인위적으로 형성시킴으로써 새우 양식에 최적화된 bio-floc 시스템을 만들기 위하여 실험을 실시하였다.
유용 미생물은 동물 사육에서 사료에 혼합하여 투여하였을 경우, 동물의 성장을 증가시키고 면역 시스템을 자극하여 질병에 대한 저항성을 높이는 장점 때문에 여러 동물 사육에 사용되어 왔고, 최근에는 어류 및 갑각류에 대해서도 연구가 진행되고 있다(Ali, 2000). 수산 양식에서 주로 사용되는 유용 미생물에는 유산균 박테리아(Lactobacillus, Carnobacterim sp. 등), Bacillus sp., Vibrio sp. 및 Pseudomonas sp. 등이 있다(Verschuere et al., 2000). Lactobacillus는 젖산균 중의 하나로 발효식품에서 오랫동안 사용되었으며, Black tiger shrimp, Penaeus monodon에 Lactobacillus를 첨가한 사료 투여 시, 새우의 성장률과 생존율이 크게 향상되었으며, Vibrio harveryi에 대한 저항성도 상당히 증가되었다고 한다(Gilliland et al., 1980; Uddin et al., 2013). Bacillus는 소화관에서 다양한 세포외효소(exoenzyme)를 분비하여 유해균을 차단하므로 새우의 생존율을 높였다는 보고가 있으며, Black tiger shrimp, P. monodon과 Indian white shrimp, P. indicus에서 성장률과 생존율의 향상을 보였다는 보고가 있다(Rengpipat et al., 2000; 2003; Saeed et al., 2005). Rhodobactor는 광합성 균으로 혐기성 환경에서 광합성을 하며, 산소와 질산염 등을 이용하여 성장하고, 수산양식에서 질소 고정과 유기물 분해에 중요한 역할을 한다(Ryan et al., 2004). 새우 양식에서 광합성 균에 대한 연구는 Rhodopseudomonas palustris를 흰다리 새우 양식에 접목시켰을 때, 균의 농도가 증가함에서 P, N 및 COD (Chemical Oxygen Demand) 제거 비율이 증가하였다는 보고가 있다(Luo et al., 2012).
본 연구에서는 대하, Fenneropenaeus chinensis를 대상으로 이미 알려진 유용 미생물들 즉, Latobacillus, Bacillus와 광합성 박테리아인 Rhodobactor 미생물을 재 조합하여 bio-floc 양식 시스템에 접목하기 위하여, 이들 미생물의 활성과 수질변화를 조사하였고, 새우의 성장률을 조사하여 유용 미생물을 이용한 bio-floc 양식 시스템의 적용 가능성을 제시하고자 하였다.
대하(F. chinensis)는 인천수산자원연구소에서 분양 받아 실험실 조건에서 2주 이상 순치 시킨 후, 외관상 질병증세가 없는 건강한 치하(전장, 1.5±0.3 cm; 체중, 137±12.5 mg)를 선별하여 실험구별 10마리씩 수용하였다. 실험기간 동안 퓨리나사료(Cargill Agri Purina, Inc. Korea)를 매일 2회(오전 9시, 오후 6시), 체중의 3%를 공급하였고, 공식현상을 피하기 위하여 PET병을 이용하여 개별 수용하였으며, 실험은 3반복으로 실시하였다.
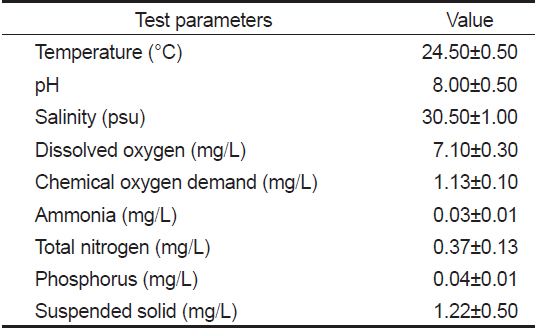
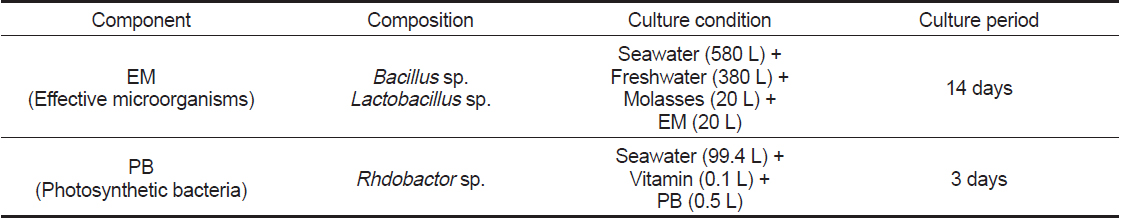
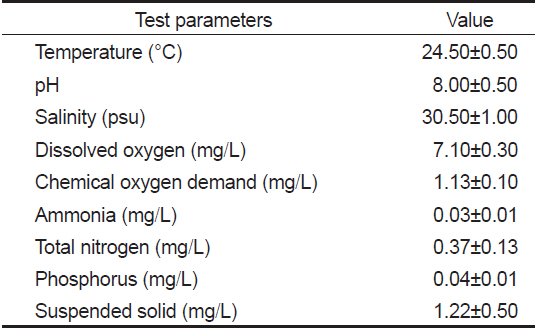
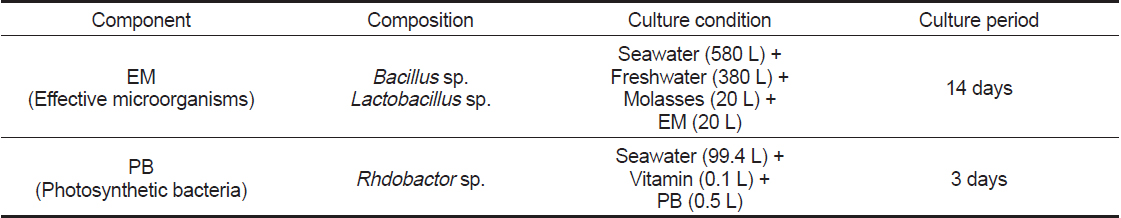
모든 실험은 항온실(20±1℃)에서 실시하였고, 3 cm 가량의 모래가 바닥에 깔린 원형수조(40×40×60 cm)에 해수 180 L를 채워 치하를 입식 하였고, 실험에 사용된 수질조건은 Table 1과 같다. 실험에 사용된 bio-floc은 유용미생물인 Bacillus sp., Lactobacillus sp. (EM, Korea)와 Rhodobactor sp. [(주) 두산 에코비즈넷, Korea] 및 당밀, 비타민 등을 혼합하여 Table 2와 같이 bio-floc 활성액을 제조하였다. 이와 같이 제조된 bio-floc 활성액 1 L를 50 ton 해수에 희석시킨 농도를 100%로 정하고, 이를 다시 해수로 희석 또는 조제하여 0, 60, 80, 100, 120 및 140% 농도로 만들어 대하 사육실험 농도로 사용하였다. 또한, Bacillus sp., Lactobacillus sp. 및 Rhodobactor sp. 균들의 농도를 1×106 CFU/mL 이상으로 유지할 수 있도록 5일을 주기로 bio-floc 활성액을 제조하여 90일 동안 사육실험을 실시하였다.
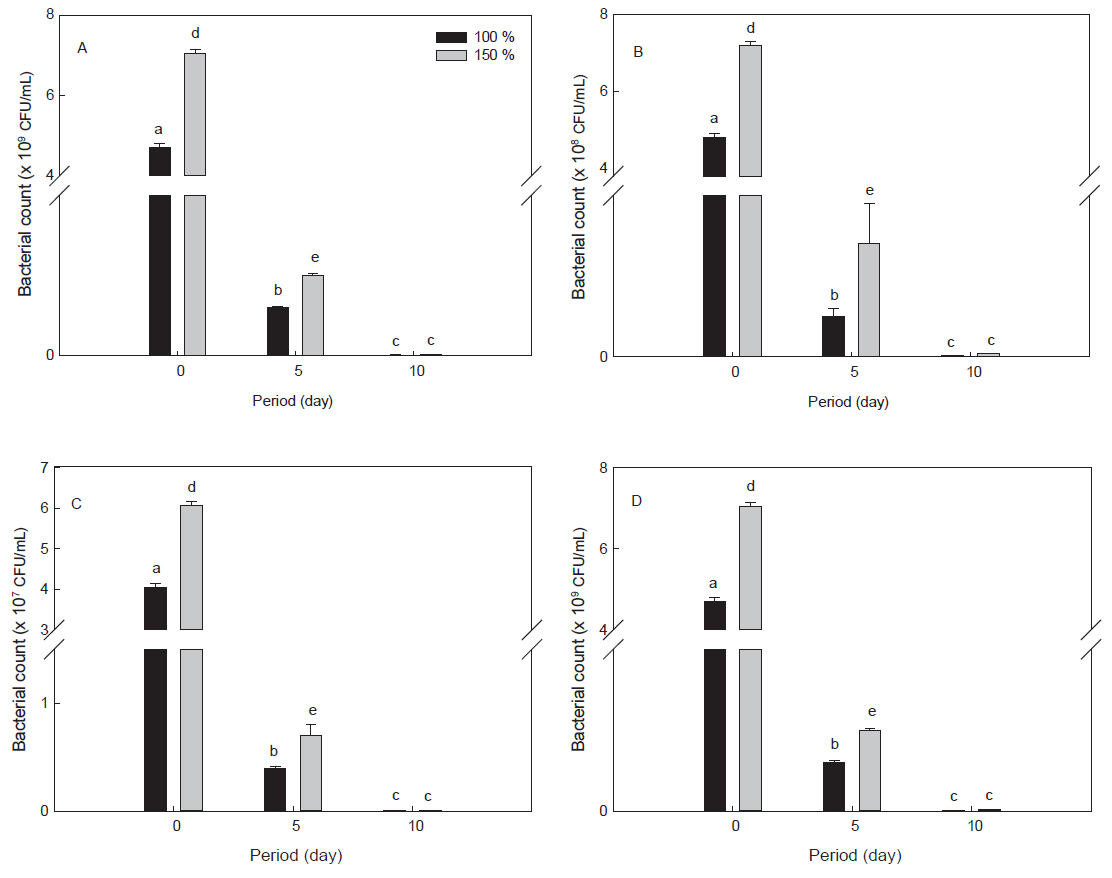
사육실험을 시작하기 전, bio-floc 활성액을 제조한지 5일과 10일 후에 bio-floc 농도 100과 150% 구간에 대하여 미생물 조성을 조사하였다. 각각의 수조에서 채수하여 멸균 생리식염수로 10배씩 단계 희석하고 미생물 종류에 따라 각기 다른 배지에 적하하여 35℃, 48h 배양한 후 세균 집락 수를 조사하였다.
Total bacteria count (TBC)는 1% NaCl을 첨가한 Nutrient Agar (NA, Difco, USA) 배지에 단계 희석한 시료를 적하하여 배양한 후 세균 집락 수를 조사하였다.
Lactobacillus sp., Bacillus sp. 및 Rhodobactor sp. 분리균은 그람 염색 및 세포 형태 등의 형태학적 특성에 따라 순수 배양되었는지 확인한 후, API-test kit (20E & 50CHB & CHL, BioMerieux, Los Angeles, CA, USA)를 통한 확인시험을 실시하여 아래와 같이 각각의 선택배지에 단계 희석한 시료를 적하하여 배양한 후 세균 집락 수를 조사하였다.
Lactobacillus sp. 균은 1% NaCl을 첨가한 MRS (MRS broth; Difco, Detroit, MI, USA) 배지에, Bacillus sp. 균은 1% NaCl을 첨가한 MYP (Mannitol-Egg Yolk Polymyxin; Difco, Detroit, MI, USA) 배지에, Rhodobactor sp. 균은 MB (Malate basal broth; Difco, Detroit, MI, USA) 배지에 배양한 후 각각 세균의 집락 수를 조사하였다.
수온, pH, 용존산소량(DO), 염분은 YSI-85 DO meter (Yellow Springs Instrument, U.S.A.)와 pH meter (Istek, Inc., Korea)를 이용하여 매일 측정하였으며, 사육수를 매주 채수하여 해양환경공정시험방법(국토해양부, 2010)에 따라 화학적 산소요구량(COD), 부유물질(SS), 총질소(TN), 암모니아 질소(NH4+-N) 및 인산염 인(PO4--P)를 분석하였다.
실험에 사용한 대하는 실험에 들어가기 전 전장과 체중을 측정하였으며, 0, 60, 80, 100 및 120, 140% 농도의 bio-floc 사육수에 입식 한 후, 45일과 90일 경과 후, 전장과 체중을 측정하여 다음과 같이 일일 성장량을 구하였다.
일일 성장량(Daily growth gain) = (Wf –Wi)/ day Wf = Final length or weight Wi = Initial length or weight
실험 분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하고, 사후검정으로 Duncan’s multiple range test를 통해 P<0.05일 때 유의성이 있는 것으로 간주하였다.
Bio-floc 시스템에 이용되는 유용 미생물 중 광합성균은 혐기성 미생물로 빈산소 또는 혐기성 조건에서 유기물을 분해하여 양식장 환경수의 수질을 개선하는 기능이 있다(White, 2000). 이전 연구에 따르면, Bacillus sp., Rhodopseudomonas sp. 및 Lactobacillus sp. 균의 농도가 1-4×106 CFU/mL일 때, 새우양식장 수질 개선에 가장 좋은 효과를 나타내었고, 잉어는 성장률의 증가를 보였다고 한다(Luo et al., 2012; Wang, 2011). 따라서, 본 연구에서는, 물론 미생물 균 종마다 적용되는 균의 농도가 다를 수 있지만, 1×106 CFU/mL 농도가 효과적일 것으로 판단하고, 균들이 사육 시스템 내에서 이 농도를 유지할 수 있는 기간이 얼마인가를 알아보기 위하여 시간 경과에 따른 균 수를 측정하였다. Bio-floc 활성액 제조 5일과 10일 후, Bio-floc 농도 100과 150% 구간에 대하여 미생물 균 수를 조사한 결과는 Fig. 1과 같다. Bio-floc 농도 100% 구간은 0일째 총 균수가 4.7±0.1×109 CFU/mL이었으나, 5일 후에는 0.03±0.1×109 CFU/mL로 감소하였고, 10일 후에는 0.001±0.1×109 CFU/mL로 감소하였다(P<0.05). Bio-floc 농도 150% 구간은 0일째 총 균수가 4.8±0.1×109 CFU/mL이었으나, 5일과 10일 후에 각각 0.05±0.1×109 CFU/mL, 0.005±0.1×109 CFU/mL로 감소하였다(P<0.05). Bacillus sp., Lactobacillus sp. 및 Rhodobactor sp. 균 수도 총 균수와 마찬가지로 5일째 상당한 감소를 보였고(P<0.05), 10일째에는 균이 거의 검출되지 않았다(Fig. 1). 이상의 결과로부터 bio-floc 활성액 제조 후 5일 이후 미생물의 농도가 급격히 떨어지는 것을 확인할 수 있었으며(P<0.05), 그 감소폭은 bio-floc 농도 100%보다는 150%구간이 작았다. 따라서, 본 연구에서는 Bacillus sp., Lactobacillus sp. 및 Rhodobactor sp. 균들의 농도를 1×106 CFU/mL 이상으로 유지할수 있는 기간인 5일을 주기로 bio-floc을 조합 및 농도를 조정하여 bio-floc system을 이용한 대하 사육실험을 실시하였다.
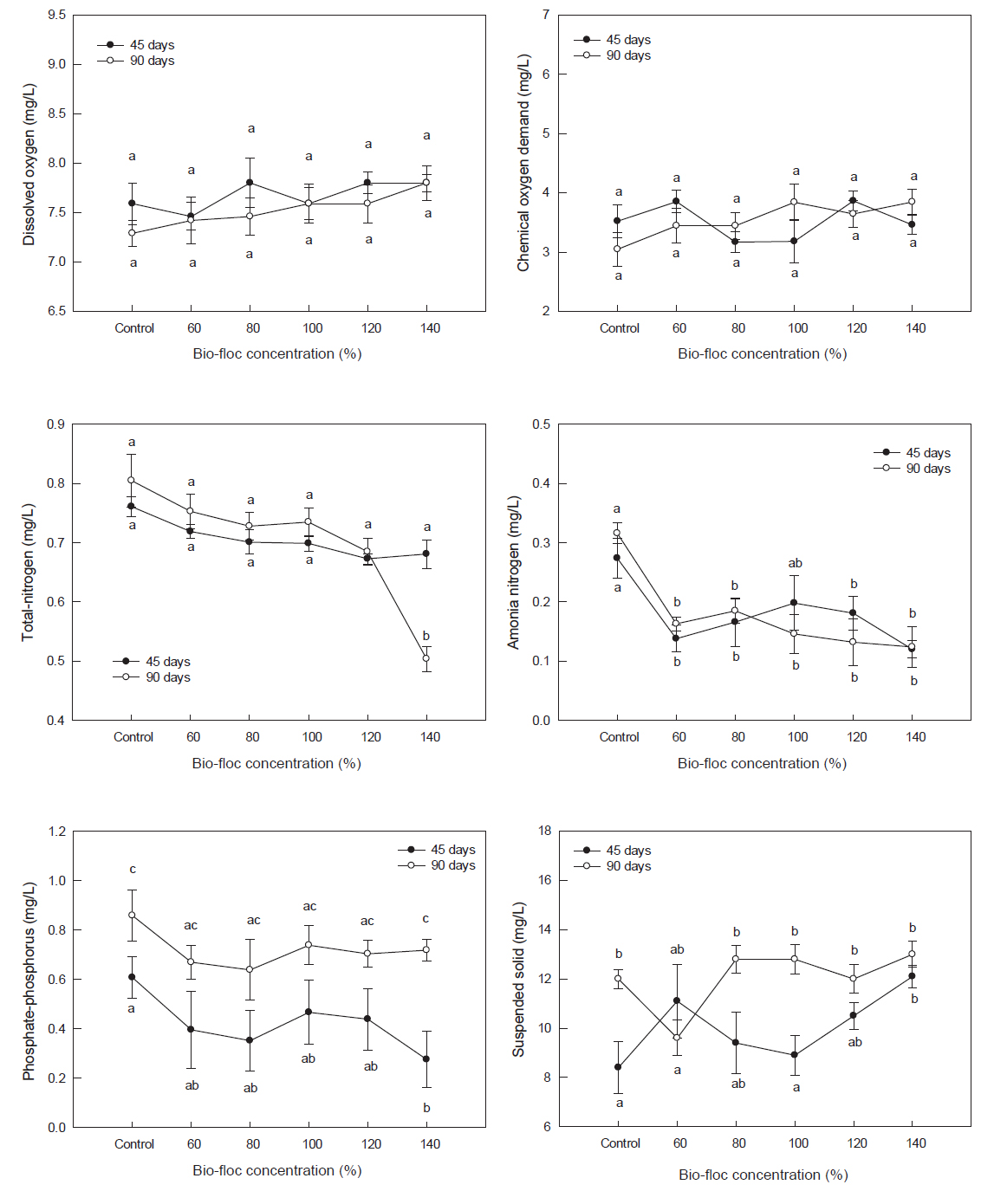
Bio-floc 사육수와 일반 사육수에 대하를 입식하고 45일과 90일 경과 후 사육수 내 수질 변화를 측정한 결과는 Fig. 2와 같다. 용존 산소(DO)와 화학적 산소요구량(COD)은 bio-floc 농도 및 사육일수와 관계없이 유의한 변화를 보이지 않았다. 고밀도 새우 양식에서 사육수 내 암모니아 질소의 축적은 가장 큰 제한요인 중 하나이며(Cho et al., 2010), 얼룩새우, P. monodon의 경우, 치하에 영향을 미치지 않는 총 암모니아(TAN)와 아질산(NO2--N)의 안전 농도는 각각 3.7과 3.8 mg/L이다(Chen and Lei, 1990). 본 연구에서, 총 질소(TN)는 모든 구간에서 0.6-0.7 mg/L 수준으로 bio-floc 농도 120%까지는 유의한 변화가 관찰되지 않았으나, 140% 일 때는 90일 경과 후에 0.5 mg/L 이하로 떨어져 다른 구간보다 유의하게 감소하였다(P<0.05). 암모니아 질소(NH4+-N)는 대조구에 비하여 bio-floc을 첨가한 모든 구간에서 0.1-0.3 mg/L 수준으로 유의하게 낮은 값을 보였다(P<0.05). 인산인(PO4--P)은 사육 45일째, 140% 농도 구간에서 대조구에 비하여 유의하게 감소하였으나(P<0.05), 90일째는 대조구보다 낮은 값이었으나 유의성은 인정되지 않았다(P>0.05). 부유물질(SS)은 대조구간에서는 45일째에 비하여 90일째 값이 유의하게 높았으나(P<0.05), bio-floc을 첨가한 구간에서는 유의한 차이가 관찰되지 않았다(P>0.05) (Fig. 2).
Luo et al. (2012)의 연구에서 광합성 균(Rhodopseudomonas sp.)의 농도를 4×106 CFU/mL 로 유지할 때, 새우 양식수의 아질산(NO2--N), 질산(NO3--N), 암모니아 질소(NH4+-N) 및 인(TP)의 수치가 감소하였다고 보고하였다. 이는 본 연구와도 유사한 결과이나, 본 연구에서 총 질소(TN)는 140% 구간을 제외하고는 유의한 차이가 없었다. 이는 Kim (2014)의 연구에서, bio-floc 첨가 사육수의 암모니아(NH3)와 아질산(NO2)은 감소를 보였으나, 질산(NO3)이 bio-floc을 첨가 사육수에서 높은 수치로 유지된 것에서 원인을 찾을 수 있다. 물론 본 연구에서 아질산(NO2--N)과 질산성 질소(NO3--N)를 구분하여 측정하지 않았지만, 암모니아(NH4+-N) 농도는 감소하였으나 총 질소(TN)의 농도 변화가 없었다는 것은 아질산(NO2--N) 혹은 질산(NO3--N)의 농도 증가를 유추할 수 있다. Avnimelech et al. (2007)의 연구에 따르면 bio-floc 사육수의 질산(NO3--N)의 농도가 높게 유지되는 것은 bio-floc 사육수의 공통적인 특징이며, Kim(2014)은 bio-floc 사육수의 낮은 pH 값과 연관성이 있을 것이라고 고찰하였다. 그러나 본 연구에서는 실험 기간 중 pH의 범위는 평균 7.9-8.1로 비교적 안정적이었고, 이는 본 연구에서 사용한 bio-floc 방법이, 유용미생물의 인위적인 추가 없이 자연적으로 발달한 bio-floc을 이용한 기존의 방법과는 다르기 때문인 것으로 생각된다.
Cho et al. (2010)은 bio-floc을 조성하기 위하여 유용 미생물을 이용하지 않고, 사육수 비교환 방식에서 자가영양(photoautotrophic, autotrophic) 상태의 사육수를 타가영양(heterotrophic) 우점 상태로 전환시키고, 타가영양세균들이 유기물과 결합하여 미생물총(microbial floc, bio-floc)을 형성시킨다(Hopkins et al., 1999)는 점을 착안하여 흰다리 새우, Litopenaeus vannamei를 대상으로 실험을 실시하였다. 또한, Cho et al. (2010)는 이렇게 형성된 미생물총은 유기탄소를 에너지원으로 사용하기 때문에 탄소와 질소 비율(C/N ratio)을 조절하여 암모니아를 효율적으로 제거할 수 있다고 알려져 있듯이, 실험 결과, 평균 비이온화 암모니아 농도가 0.1 mg/L 이하로 새우 생존 및 성장에는 영향을 미치지 않았고, 아질산염 농도 평균이 13.6 mg/L으로 생존과 성장에 심각한 영향을 미치지 않은 것으로 판단하였다. 하지만, Cho et al. (2010)의 수질 분석 값은 본 연구 결과보다 높은 값으로 이는 본 연구에서 주기적인 bio-floc 활성액을 공급한 것과는 달리 사육수 비교환 방식으로 사육했기 때문일 것일 것이다.
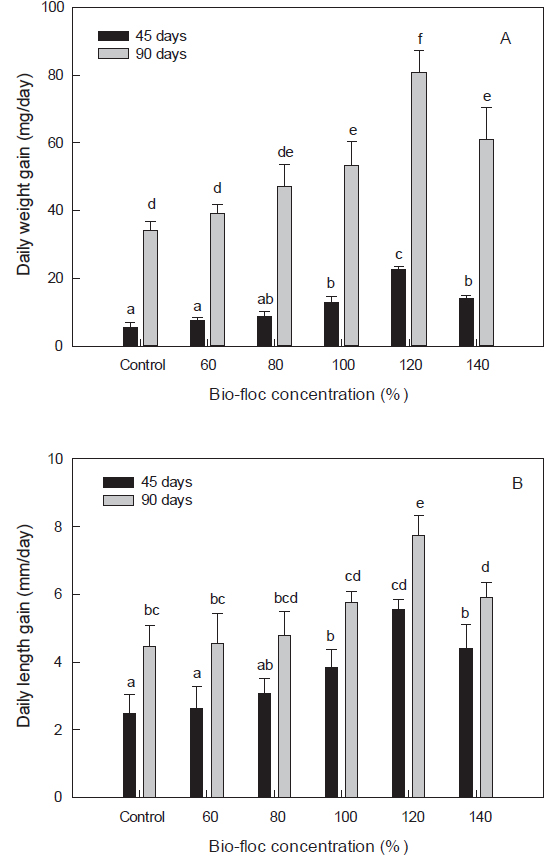
Bio-floc system 사육에 따른 치하의 생존율은 대조구와 비교하여 유의한 차이가 관찰되지 않았으며, 성장률을 조사한 결과 Fig. 3과 같이 나타났다. 체중의 경우, 대조구간은 입식 초기, 5.57±1.5 mg/day에 비하여 입식 후 45일간은 사육환경 적응 등으로 인하여 더딘 성장상태를 보였으나 90일 이후에는 34±2.6 mg/day으로 양호한 성장상태를 보였다. Bio-floc 사육수 농도에 따른 대하의 체중 성장률을 살펴보면, 45일 사육의 경우, bio-floc 농도 100% 이상에서 대조구보다 유의하게 높은 성장을 보였고, 120%에서 22.5±0.9 mg/day로 최대로 성장하였다(P<0.05). 90일 이후에도 100% 이상의 농도에서 유의하게 높은 성장을 보였고, 120%에서 60.7±6.5 mg/day로 최대로 성장하였다. 체장 성장도 체중의 경우와 유사하게 100% 이상의 농도에서 대조구에 비해 유의하게 높은 성장을 보였으며, 120% 구간에서 최고로 높은 성장을 보였다(Fig. 3).
Bio-floc 시스템 사육의 장점은 사료 비용 절감도 있지만, 두드러질 만큼 생산된 새우의 크기가 크다는 것도 있다. 즉, bio-floc에 의한 성장률의 증가는 이전의 연구에서도 보고된 바 있다(Moriarty, 1999; Rengpipat et al., 2000,2003; Wang and Gu, 2010). Wang and Gu (2010)는 Bacillus coagulans로 사육한 white shrimp, Penaeus vannamei의 생존율은 유의한 변화가 없었으나, 일일 체중이 유의하게 증가하였다고 보고하였다. 이러한 성장률 증가의 원인을 연구자들은 bio-floc이 추가적인 먹이공급원이 되었고(Burford and Lorenzen, 2004; Burford et al., 2004), 소화관내의 세균총(bacterial flora)의 변화로 인한 소화 흡수율의 증가에 의한 것으로도 보고 있다(Venkat et al., 2004; Yousefian and Amiri, 2009). Moriary (1996, 1998)는 Bacillus sp. 균이 외분비 효소를 분비한다고 보고하였고, Saeed et al., (2006)는 이러한 외분비 효소가 양식생물의 소화관 내의 소화효소를 활성화하여 사료효율이 증가하였을 것이고, 그 결과로 생존율 및 성장률이 증가하였을 것이라고 하였다. 또한, 본연구에서 이용한 방법처럼, 2종 이상의 유용 미생물을 함께 배양하여 새우를 사육하였을 때, 성장이 좋아진다는 보고도 있다(Gatesoupe, 2002). 이는 유용 미생물들이 유해 미생물을 견제하여 질병의 확산을 방지하며, 면역 기능을 자극함으로써 새우의 건강상태가 좋아졌기 때문일 것이라고 한다(Abidi, 2003; Hai et al., 2009). 뿐만 아니라, 대하는 공식을 하는 특성이 있는데, 수색이 맑을수록 공식률이 높아져 생존율이 낮아지는 결과를 초래한다. 수색은 미생물의 양 및 존재 여부, 유기물의 양과 부유물질(SS) 등에 의해서 달라진다. 본 연구에서는 1×106 CFU/mL 정도의 균이 첨가된 bio-floc 활성액 농도라면 수색유지 기능도 할 수 있어 공식 방지에 따른 생산량에 증대에 효과적일 것이라고 생각한다.
이상의 결과, 시험에 사용한 유용 미생물을 이용하여 인공적으로 만든 bio-floc 활성 수가 사육수 수질 개선효과가 있으며, 대하 치어의 성장에 좋은 효과를 보인 것으로 보아 이 시스템을 대하 사육기술로 활용할 수 있을 것으로 기대한다.