해조류는 연안생태계에서 광합성을 하는 일차생산자로서 지구온난화로 인한 수온 상승과 해양산성화(해수의 CO2 농도 증가), 그리고 인간활동에 따른 부영양화 등에 대한 생리적 반응이 다르므로 환경요인의 변화에 따라 종다양성과 군집구조가 변화된다(Connell and Russell, 2010; Nikinmaa, 2013). 인간의 화석연료 사용량의 증가에 따라 대기 중에 CO2는 지속적으로 증가되고 있으며, 해양은 그 중 약 30%, 즉 시간당 백 만톤(1 million tons) 이상의 CO2 를 흡수하는 것으로 알려져 있으며(Feely et al., 2004; Gao and Zheng, 2010; Connell and Russell, 2010; Xu and Gao, 2012), 해양의 CO2 농도는 현재의 380 ppm에서 2050년에는 970 ppm까지 증가될 것으로 예견하고 있다(Lee et al., 2006). 대부분의 해조류는 해수의 CO2농도가 증가할 때 생장과 생산량이 증가하지만, 조직에 CaCO3을 함유한 유절 및 무절 산호조류는 가입, 생장 및 CaCO3 축적에 부정적인 반응을 보였다(Kuffner et al., 2007; Hall-Spencer et al., 2008; Martin and Gattuso, 2009; Connell and Russell, 2010; Ragazzola et al., 2012).
또한, 최근에 우리나라를 포함한 전 세계 연안에서 빈번하게 일어나는 구멍갈파래류, 염주말류, 그리고 대마디말류와 같은 녹조류 대발생(green tide)은 인간활동으로 인한 부영양 해역이나 교란된 해역에서 주로 관찰된다(Nelson et al., 2003; Hiraoka et al., 2004; Pinedo et al., 2007; Liu et al., 2009; Yabe et al., 2009; Kim et al., 2011; Deng et al., 2012). 녹조 대발생은 해조류 군집구조를 단순화 시키고 종다양성을 위협하고 연안 생태계의 변화를 교란시키는 나쁜 영향을 준다(Carlton, 2000; Taylor et al., 2001; Occhipinti-Ambrogi and Savini, 2003). 녹조류 구멍갈파래(
우리나라 연안에서 구멍갈파래는 암반에 서식하는 대표적인 종으로서 연안생태계의 생산자이며 다양한 해양생물의 먹이장과 생육장으로서 중요한 역할을 하는 것으로 알려져 있지만(Han et al., 2003), 이들의 대발생은 연안생태계 및 관광산업에 나쁜 영향을 주고 있다(Park, 2014). 구멍갈파래류의 대발생의 원인은 인간활동에 의한 연안역의 부영양화로 생각하고 있으나, 해양의 CO2 증가와 부영양화의 상호 작용이 구멍갈파래의 대발생과 관련이 있는지에 대한 연구는 수행되지 않았다. 구멍갈파래는 유주자(zoospore), 배아(germling), 유엽(juvenile)과 성체(adult) 단계의 생활사를 가진다. 중금속과 자외선(UV)에 노출된 구멍갈파래의 생리적 반응에 대한 연구(Han and Choi, 2005; Han et al., 2008)와 다양한 환경 요인(온도, 광도와 영양염 등)에 대한 연구가 수행되었다(Floreto et al. 1994). 구멍갈파래에 대한 선행연구는 대부분 성체단계에서 수행되었으며, 배아와 유엽 단계에 관한 연구는 미흡한 상태이다(Coelho et al., 2000). 하지만, 해조류의 배아와 유엽은 성체에 비해 환경변화에 훨씬 민감하게 반응하므로(Coelho et al., 2000), CO2 농도 증가와 영양염 등의 환경요인에 대한 생활사별 생장 반응을 확인하는 것은 녹조대발생을 이해 및 관리하는데 매우 중요한 정보라고 할 수 있다(Choi et al., 2010; Coelho et al., 2000; Deng et al., 2011; Olischläger et al., 2012). 따라서, 본 연구는 생태학적으로 중요한 역할을 하지만, 녹조대발생의 원인종의 하나인 구멍갈파래의 배아, 유엽과 성체 단계에서의 CO2 증가와 영양염에 대한 반응을 확인하기 위하여 수행되었다.
본 연구를 위한 구멍갈파래는 전남 완도군 정도리(34° 18'N, 126° 41'E)에서 2013년 11월 2일에 채집하였으며, 현장 해수와 함께 플라스틱 샘플병에 담아서 실험실로 운반하였다. 운반된 엽체에 착생한 동·식물과 미세조류를 제거하고 멸균해수와 유화용 붓을 사용하여 수회 세척한 후 실험에 사용하였다.
배아 및 유엽의 생장실험을 위하여, 세척한 성숙한 엽체를 멸균해수가 담긴 플라스틱 바트에 넣어 20℃의 연속광으로 설정된 배양기에서 유주자를 방출 받았다. 유주자액(4 mL)은 슬라이드글라스 조각(2.5×2.5 cm)과 멸균해수가 들어있는 Petri dish (Ø 12 cm)에 주사기로 고르게 접종한 후 유주자가 착생하도록 24시간 실온에 보관하였다(Fig. 1A). 다음 날 배아가 부착된 슬라이드 조각 3개를 배양액 50 mL이 담긴 밀폐된 배양용기에 넣고 다양한 CO2 농도(380, 750 ppm), 영양염(Control, PES)과 조도(50, 100 μmol photons m−2s−1)가 조합된 조건에서 10일간 배양하였고 배양액은 2일 간격으로 전량 교체하였다. 해수의 CO2 농도는 Gas Concentration Controller (CO2 조절 장치)로 조절하였고, 대조구(control)는 멸균해수(Autoclaved seawater)이고 PES는 Provasoli’s의 배양액(Provasoli, 1968)이다. 배양기의 광원은 형광등을 사용하였고 조도는 100 μmol photons m−2s−1이었으며, 50 μmol photons m−2s−1는 배양용기에 검은색 망을 씌워 확보하였으며 디지털조도계(DX-200, TAKEMURA)로 확인하였다. 이때 배양기의 온도(20℃)와 광주기는 12:12 h L:D (Light: Dark)로 일정하게 유지하였다. 배양 10일 후 배아는 광학현미경(BX53F, OLYMPUS, JAPAN)에 부착된 디지털카메라로 촬영하였고 Image J 프로그램으로 길이를 측정하였다.
구멍갈파래 배아는 실내배양에서 유엽으로 생장하였으며, 실험에 사용된 유엽 길이는 4.05±0.20 mm였고 면적은 0.28±0.02 cm2 (mean±SE, n=180)였다(Fig. 1B). 구멍갈파래 유엽의 실내 배양은 배아와 동일한 CO2 농도, 영양염 농도와 조도에서 수행되었다. 마개가 달린 각 배양용기(10 mL)에 유엽 5개와 배양액을 넣고 밀폐시켜 인큐베이터에서 5일 동안 배양하였고 배양액은 2일 간격으로 전량 교체하였다. 배양 개시 5일 후에 유엽을 디지털카메라로 촬영하여 Image J 프로그램에서 길이를 측정한 후, 상대생장률(RGR, relative growth rate)을 아래의 식으로 계산하였다(Ichiki et al., 2000).
RGR (% day−1) = 100 (lnL2 - lnL1)/T2 – T1 L1, 실험 개시 때의 유엽길이; L2는 측정시 유엽길이, T1, T2는 배양 일수
해수의 CO2와 영양염 농도, 그리고 조도가 구멍갈파래 성체의 광합성에 미치는 영향을 파악하기 위하여, 채집한 건강한 엽체를 멸균해수로 수회 세척한 후, cork borer로 원형 디스크(Ø 1 cm)를 만들어 24시간 정치 배양한 후, 탈색되지 않은 디스크를 실험에 사용하였다(Fig. 1C, 1D). 배양기의 광주기(12:12 h LD)와 온도(20℃)는 동일하게 세팅하였고 밀폐된 배양용기에 CO2 농도(380, 750 ppm)와 영양염 농도(Control, PES)가 다른 배양액 50 mL과 원형 디스크 5개씩을 넣은 후, 50과 100 μmol photons m-2s-1의 조도에서 5일 동안 배양하였고 배양액은 2일 간격으로 전량 교체하였다.
성체 디스크의 광합성효율(Fm/Fv)은 배양 개시 전(before)과 배양 5일 후(after)에 15분간 암적응시킨 후에 Phyto-PAM(Walz, Effecltrich, Germany)을 사용하여 측정하였다. Phyto-PAM의 세팅 조도는 8, 16, 32, 64, 90, 120, 210, 295, 350, 435 μmol photons m−2s−1로 설정하여 20초 간격으로 측정하였다. 광합성효율 측정은 아래의 식으로 계산하였다.
Fv/Fm = (Fm-Fo)/Fm Fm = 최대형광효율, Fo = 최소형광효율
형광변수(Fv)는 암적응 후 최대형광과 최소형광의 차이를 나타내며(Jesus et al., 2006), 광양자수율(quantum yield, Fm/Fv)은 광합성 명반응의 반응중심 중 하나인 광계 2 (photosystemII, PSII)의 광화학 반응에 대한 양자수율 또는 양자효율을 의미한다. 측정한 빠른 광반응 곡선은 광양자수율을 바탕으로 전자전달률(electron transport rate, ETR)을 계산하고, 이를 이용해 광합성-조도 곡선을 추정하여 상대적인 광합성 변수(α)를 구할 수 있다(Schreiber et al., 1994).
Ek = ETRmax/α Ek = 광포화계수, ETRmax = 최대전자전달률
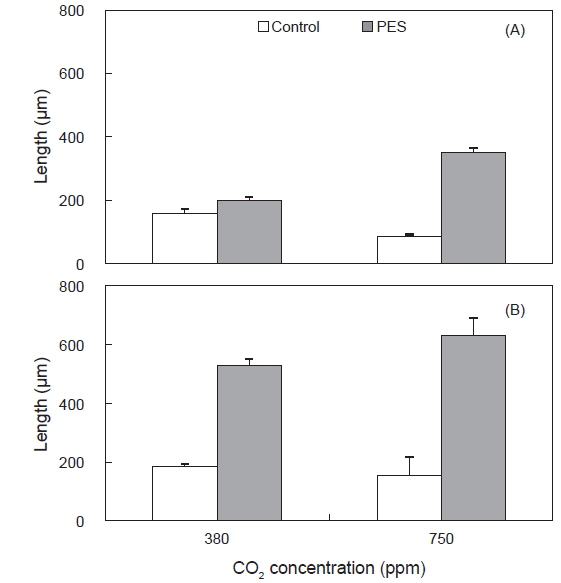
구멍갈파래 유주자가 접종되어 착생시킨 후에 배아의 길이는 24.63±0.57 μm (mean±SE, n=90)였으며, 해수의 CO2농도가 750 ppm인 PES 배양액, 그리고 100 μmol photons m−2s−1에서 635.53±61.45 μm로 최대 생장을 보였으며, 750 ppm의 멸균해수와 50 μmol photons m−2s−1에서 가장 느린 생장을 보였으며, 이때 길이는 79.33±0.07 μm였다(Fig. 2). 낮은 실험 조도인 50 μmol photons m−2s−1에서, CO2농도가 380과 750 ppm 범위에서는 영양염 농도가 증가할수록 생장이 촉진되었다. 또한, 배아는 고조도인 100 μmol photons m−2s−1에서도 750 ppm까지 적당한 영양염 증가(PES) 조건에서 빠른 생장을 보여 조도, 영양염과 CO2농도가 증가할 때 배아는 최대생장을 보였다(Fig. 2).
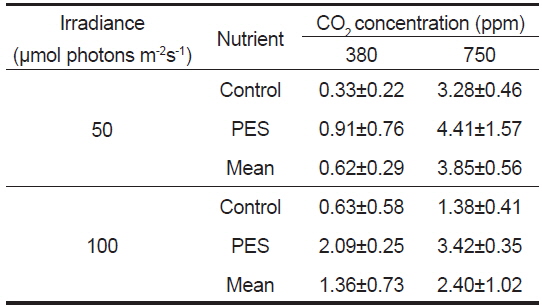
구멍갈파래 유엽의 길이는 배양 개시 전에 4.05±0.09 mm(mean±SE, n=180)였고, 상대생장률은 750 ppm의 PES 배양액, 그리고 50 μmol photons m−2s−1에서 4.41 % day−1로 최대였고, 380 ppm의 멸균해수와 50 μmol photons m−2s−1에서 최소(0.33 % day−1)로 나타났다(Table 1). 유엽의 생장은 380 ppm에 비해 750 ppm에서 50과 100 μmol photons m−2s−1에서 모두 빠른 생장을 보였으며, 최대 생장은 영양염이 풍부한 PES와 750 ppm에서 4.41% day−1로 나타났으며, 멸균해수의 경우에도 CO2농도가 증가한 750 ppm에서 대조구에 비해 높은 생장을 보였다(Table 1).
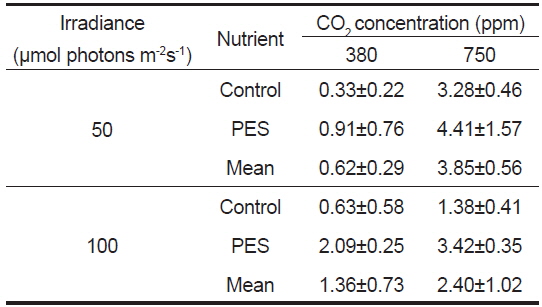
Average relative growth rate (% day?1) of Ulva australis juveniles grown under two CO2, nutrient and irradiance levels. Juveniles grew for 5 days at 20 ℃ and a photoperiod of 12:12 h LD. Values are means ± SE (n=5 replicates)
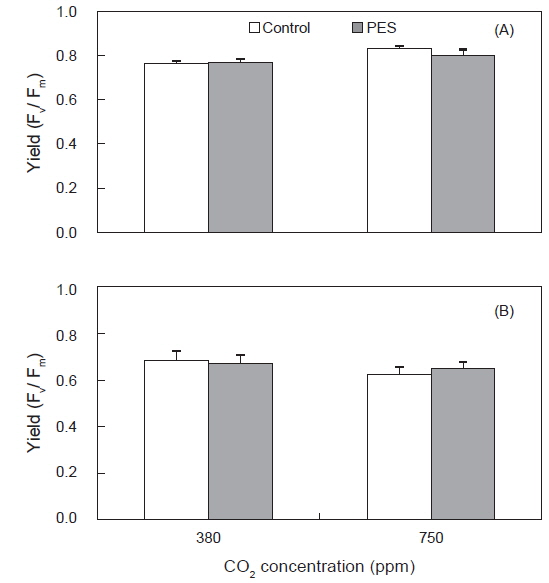
구멍갈파래 성체의 광합성효율(Fm/Fv)은 배양 개시 전에 0.73±0.05였으며, 배양 5일 후에 750 ppm의 멸균해수와 50 μmol photons m−2s−1에서 0.83±0.01로 최대였고 750 ppm의 멸균해수와 100 μmol photons m−2s−1에서 0.63±0.03으로 최소였으며 초기값에 비해 낮았다(Fig. 3). 성체의 광합성 효율은 고조도(100 μmol photons m−2s−1)의 380 ppm에서 평균 0.68, 그리고 750 ppm에서 0.65로서 배양 개시 전(0.73)에 비해 감소하였다. 저조도인 50 μmol photons m−2s−1에서는 배양 개시 전에 비해 모든 실험구에서 높게 나타났고 광합성 효율은 750 ppm에서 380 ppm에 비해 높았다(Fig. 3) 저조도에서 광합성효율은 영양염 농도와 관계없이 해수의 CO2 농도가 380에서 750 ppm으로 증가할 때 정비례로 높아졌다(Fig. 3).
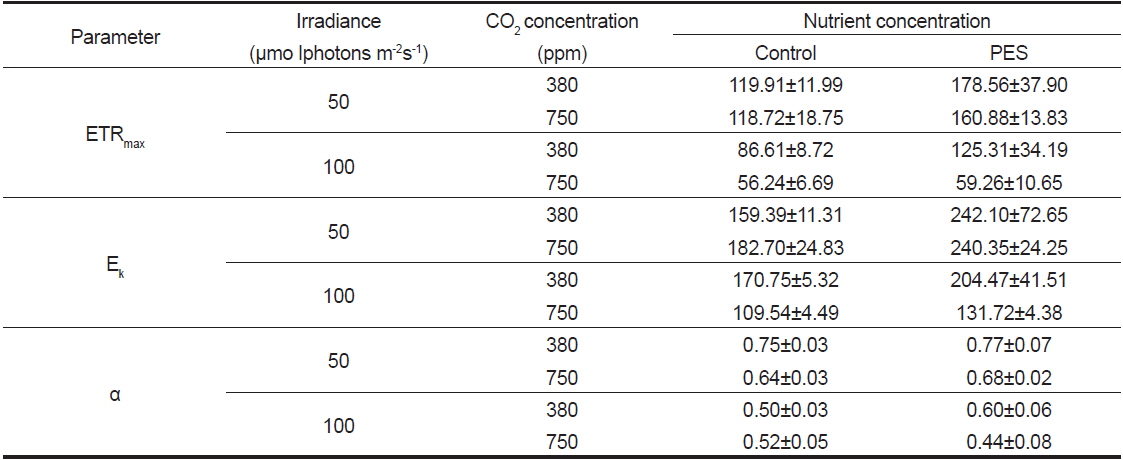
최대전자전달률(ETRmax)은 실험 개시 전에 122.45±3.71였으며, 배양 5일 후 모든 CO2 농도에서 저조도인 50에서 고조도인 100 μmol photons m−2s−1에 비해 모두 높았으며, 380과 750 ppm에서는 PES 배양액에서 최대였다(Table 2). 최소 ETRmax 값은 멸균해수에 CO2 농도가 750 ppm 그리고 고조도인 100 μmol photons m−2s−1에서 나타났다.
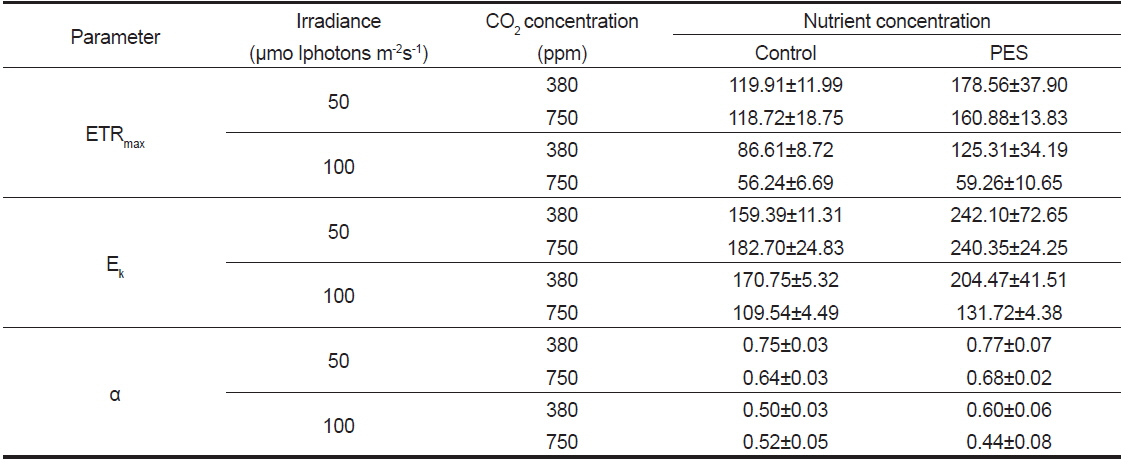
Effects of CO2 concentration and nutrient levels on the photosynthesis parameters of Ulva australis adult discs, which were cultured for 5 days under 50 and 100 μmol photons m?2s?1, 20 ℃, and 12:12 h LD. Values are mean ± SE (n=5 replicates)
광포화계수(Ek)는 실험 개시 전에 185.95±5.63 (n= 5 replicates)이었으며, 배양 5일 후 750 ppm의 PES 배양액과 50 μmol photons m−2s−1에서 240.35±24.25(380 ppm의 PES 배양액과 50 μmol photons m−2s−1에서 242.10±72.65)로서 최대였다(Table 2). Ek값은 일반적으로 50 μmol photons m−2s−1에서 높았으며, 영양염 농도가 낮은 멸균해수와 CO2 농도가 높은 750 ppm에서 낮은 값을 보였다(Table 2).
구멍갈파래 성체의 배양 전 기울기(α) 값은 0.66±0.00 (n=5 replicate)였으며, 5일 후에는 380 ppm의 PES 배양액과 50 μmol photons m−2s−1에서 0.77±0.07로서 최대였고 750 ppm의 PES와 100 μmol photons m−2s−1에서 최소였다(Table 2). 기울기 값은 저조도인 50 μmol photons m−2s−1에서 CO2 농도는 380과 750 ppm에서 높은 값을 보였다.
구멍갈파래 배아의 길이는 배양 10일 후에 50과 100 μmol photons m−2s−1에서 각기 276.21±17.11 μm와 329.83±29.00 μm로 고조도에서 빠른 생장을 보였고, 해수의 CO2농도가 750 ppm, 그리고 고영양염 상태에서도 생장은 촉진되었다. 켈프종인
본 연구에서 구멍갈파래 유엽의 생장과 성체의 광합성은 50과 100 μmol photons m−2s−1에서 증가된 CO2농도와 영양염(PES)에서 촉진되었다. 녹조류인 가시파래(
구멍갈파래 성체의 광합성은 조도와 영양염과 CO2 농도에 따라 다르게 나타났으며, 50에서 100 μmol photons m−2s−1에 비해 높았고, PES 배양액과 750 ppm에서 최대였다. 녹조류
해조류의 생활사에서 현미경적인 단계(예, 유주자, 배아, 접합자, 포자 등)는 무생물적 환경(수온, 건조, 영양염 등)과 생물학적 환경(경쟁, 초식 등)에 매우 민감하게 반응하므로 개체군 증감은 생활사의 초기에 결정되며(Coelho et al., 2000), 환경에 대한 생리적 반응도 생활사 단계에 따라 다른 것으로 알려져 있다(Kim et al., 2011). 예를 들면, 녹조류