해양은 생물자원의 보고로써 지구에 존재하는 생물 종의 약 80% 이상이 서식하는 것으로 추정된다(Census of Marine Life Press Release, 2010). 이처럼 무한한 생물-생태학적 잠재력을 보유하고 있는 해양수산생물자원에 대한 관심은 육상생물자원의 고갈문제로 인한 수요 한계 해결 및 이를 대체할 수 있는 생물자원으로써 높은 관심을 받고 있다. 그로 인하여, 해양수산생명자원은 인류의 식량문제의 해결뿐만 아니라 고부가가치 소재로의 다양한 분야의 적용 및 활용에 있어 그 중요성이 부각되고 있다(Kim et al., 2013a; Lee et al., 2013).
동물계(animal kingdom)에는 척추동물(vertebrate)과 무척추 동물(invertebrate)로 이루어져 있으며, 각각 동물계의 약 3%와 97%를 차지하고 있다(Buchsbaum et al., 2013). 해양무척추동물(marine invertebrate)은 수생환경(aquatic environment)에서 살아가는 다세포동물로, 이들은 해양생태계의 환경변화를 예측할 수 있는 생물지시자(bioindicator)의 역할 뿐만 아니라 이차 생산자로써 중요한 역할을 담당하고 있어 생물학적 다양성 측면에서 매우 높은 가치를 지니는 중요생물 구성원 중 하나이다(Hodkinson and Jackson, 2005; Radjasa et al., 2011).
골(bone)은 우리 몸에서 석회화(mineralization)로 이루어진 대표적인 조직으로, 구조적 기능 및 필수대사과정을 담당한다. 먼저 구조적 기능으로는 척수(bone marrow)나 뇌(brain)처럼 생명현상에 필수적인 조직들을 외부 충격으로부터 보호해주며, 근육이 부착 할 수 있는 지지대의 역할을 하여 근운동(muscular movement)을 할 수 있도록 도와준다. 두번째 기능으로는 필수대사기능으로, 칼슘(calcium)과 인산염(phosphate)의 조절을 통하여 혈액의 항상성(serum homeostasis)을 유지할 수 있도록 도와준다(Hadjidakis and Androulakis, 2006). 이러한 골은 여러 가지 호르몬이나 물리적인 자극에 의해 뼈를 형성하는 조골세포(osteoblast)와 뼈를 흡수하여 제거하는 파골세포(osteoclast)의 상호작용에 의하여 일생 동안 재형성과정(remodeling)을 거친다(Walsh and Gravallese, 2010). 하지만, 뼈의 항상성을 유지하는 두 세포 사이의 균형이 무너지게 되면, 파골세포의 과활성화에 의한 골다공증(osteoporosis)이나 조골세포의 과활성화에 의한 골경화증(osteosclerosis) 같은 문제가 발생하게 된다(Boyle et al., 2003; Dai et al., 2004). 따라서 건강한 뼈 조직을 유지하기 위해서는 이 두 세포들의 생리적 항상성이 매우 중요하다.
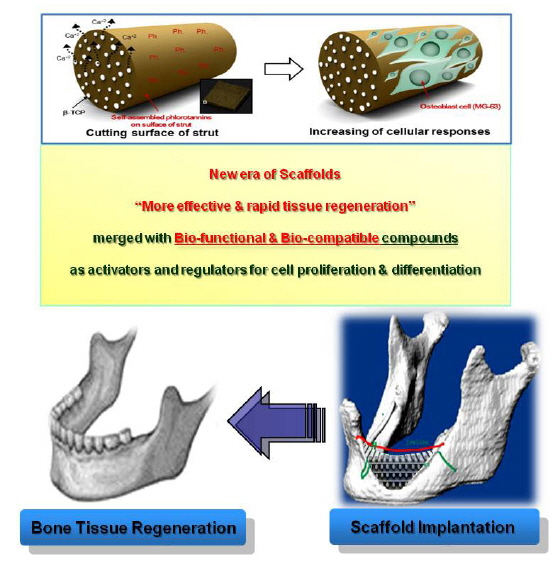
조직공학(tissue engineering)은 질병 및 상처에 의해 조직 및 기관이 더 이상 기능을 못할 경우, 이를 재생과 대체를 통하여 원상태의 기능 유지 및 증진시킬 수 있도록 연구하는 다학제간 연구 분야이다(Ehrenfreund-Kleinman et al., 2005; Rim et al., 2010). 조직공학의 필수요소로는 세포(cell)가 자랄 수 있는 공간을 마련해주는 세포지지체(scaffold)와 세포에게 영양분을 공급하며 부착, 증식 및 분화에 영향을 주는 성장인자(growth factor), 그리고 각 조직 및 기관으로 분화할 수 있는 세포가 포함된다(Dvir et al., 2011). 세포지지체로 사용하는 고분자는 크게 2가지로 나눌 수 있는데, 콜라겐(collagen), 알지네이트(alginate), 키틴(chitin) 및 젤라틴(gelatin)과 같은 천연고분자(natural polymer)와 polycaprolactone (PCL), polylacticacid (PLA) 및 polyglycolide (PGA)와 같은 합성고분자(synthetic polymer)가 있으며, 이들은 각각 사용되거나, 또는 2개 이상의 고분자를 이용하여 세포지지체를 제작한다(Kim and Kim, 2013; Fu et al., 2013). 세포지지체는 인체 내에 사용되어야 하기 때문에 무독성(nontoxic)이어야 하고, 외부충격을 견딜 수 있을 만큼의 적절한 기계적 강도(mechanical property)와 공극률(porosity), 가공성(processability) 그리고 생체적합성(biocompatibility)과 생분해성(biodegradability)이 우수하여야 한다(Yang et al., 2001).
이 논문에서는 해양수산생물 중에서 해양무척추동물을 이용한 골조직재생의 활용 및 적용 가능성에 대하여 알아보고자 한다.
천연자원으로부터 유도되는 다양한 소재들을 이용하여 제작된 의공학용 재료들은 높은 생체적합성과 생분해성 등의 특징들을 가지고 있어 약물전달시스템(drug delivery system), 수술용 봉합사와 임플란트 등의 의료분야에서 널리 이용되고 있다 (Zia et al., 2008) (Fig. 1). 육상생물과 비교하여 수인성 감염 등에 대한 안전성과 높은 생체적합성(bio compatibility)을 가지고 있는 수산생물들은 최근 의공학 소재로써 많은 관심을 받고 있다. 콜라겐의 경우 주로 소나 돼지 등의 육상동물로부터 유래된 피부 및 뼈 등으로부터 얻어지고 있으나, 광우병(bovine spongiform encephalopathy), 전염성 해면상 뇌병증(transmissible spongiform encephalopathy) 및 구제역(foot-and-mouth disease)과 같은 안전성 문제로 인하여 육상동물 유래 콜라겐의 사용을 기피하고 있는 추세이다(Zhang et al., 2007). 이러한 안전성 문제로 인해 생체적합성 소재로서의 이용에 문제점이 대두되고 있어 육상동물 유래 콜라겐의 사용을 기피시하는 등의 문제점을 해결하고자 보다 안전한 해양수산생물자원에 대한 관심이 높아지고 있다.
해양무척추동물들은 해양이라는 특수한 환경에서 온도, pH,
해양무척추동물들의 골격은 연부조직(soft tissue)에 기계적 강도를 통한 지지와 특별한 생리학적 상황에서 요구되는 이온의 비상저장시스템 기능을 한다(Vago, 2008). 이러한 생광물화(biomineralization)는 대부분의 동물이 골격, 껍질 및 이를 구성하는 과정으로, 해양수산생명자원의 골격물질은 일반적으로 탄산칼슘(CaCO3)을 주성분으로 하는 방해석(calcite)이나 아라고나이트(aragonite), 인산칼슘(calcium phosphate) 및 수산화 마그네슘[Mg(OH)2]과 결합된 실리카(SiO2)화합물의 결정형태로 만들어진다(Vago et al., 2002). 생체적합성과 골조직 재생 효능을 보유한 성분을 함유하고 있는 해양무척추동물들 중에서 해면류는 키틴 성분이 풍부하고, 산호와 갑오징어는 탄산칼슘이 풍부하며, 해파리와 전복에는 단백질이 풍부하게 함유되어 있다고 알려져 있다. 이렇게 형성된 골격 및 이들로부터 유래되는 유용물질들은 골조직 재생에 적용될 수 있으며, 실제로도 많은 연구들을 통하여 골조직 재생으로의 활용 및 가능성이 보고되고 있다(Milovac et al., 2014; Wysokowski et al., 2013; Zhang et al., 2014). 또한, 수산생물들은 수생이라는 특수한 환경에 서식하고 있어 많은 생리활성물질과 육상생물로부터 획득하기 힘든 특이한 구조의 생리활성물질들이 해양수산생물자원으로부터 발견되고 있다(Minh et al., 2011). 그 중에서, 해양무척추동물로부터 유래된 해양생리활성물질들은 항산화(Seleghim et al., 2007), 항염증(Thao et al., 2013), 조골세포분화(Nguyen et al., 2014), 항암(Silchenko et al., 2008) 및 항응고(Luo et al., 2013) 등의 다양한 효과를 가지고 있어 약학적인 측면에서의 이용 가능성이 높다.
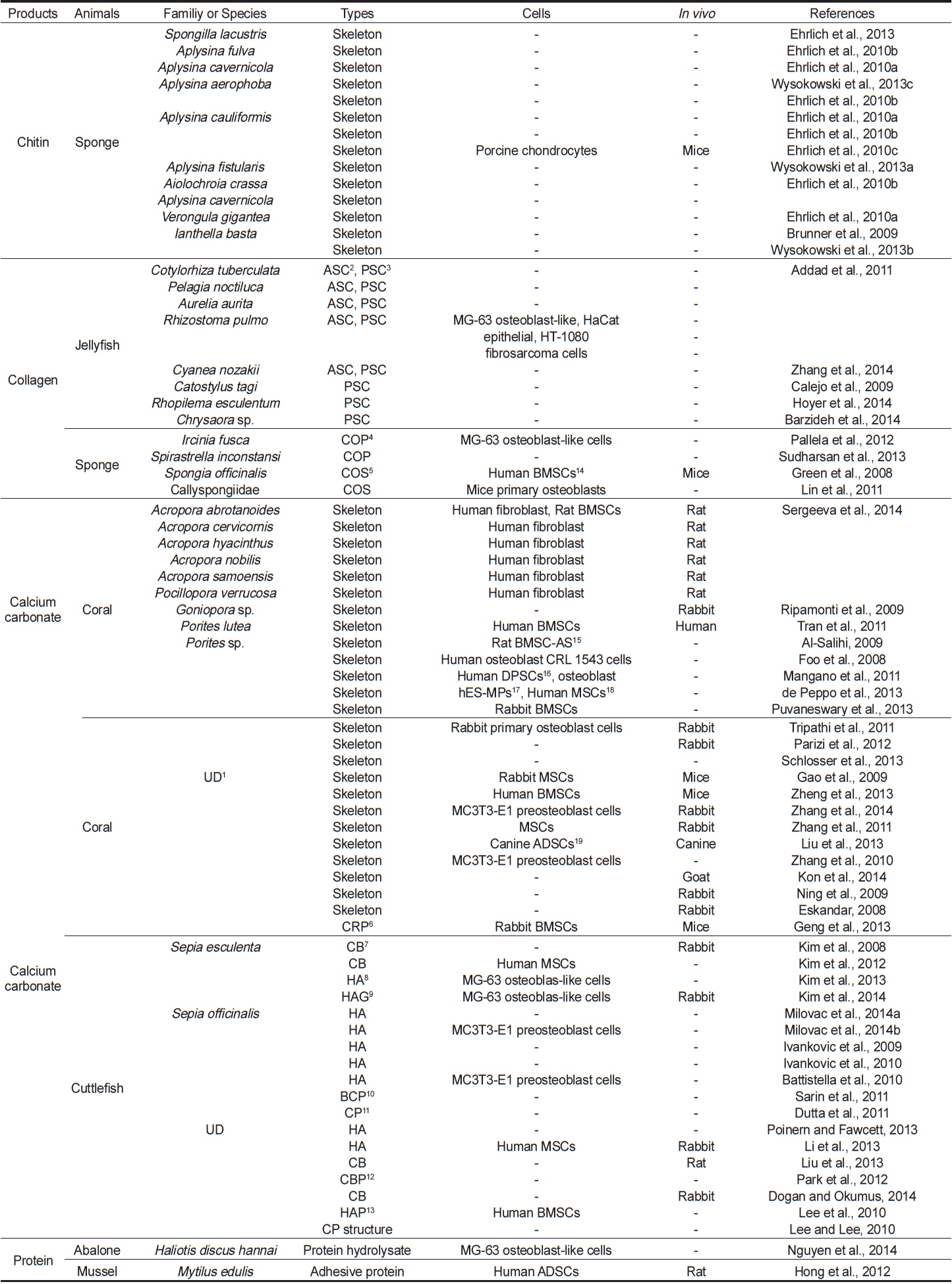
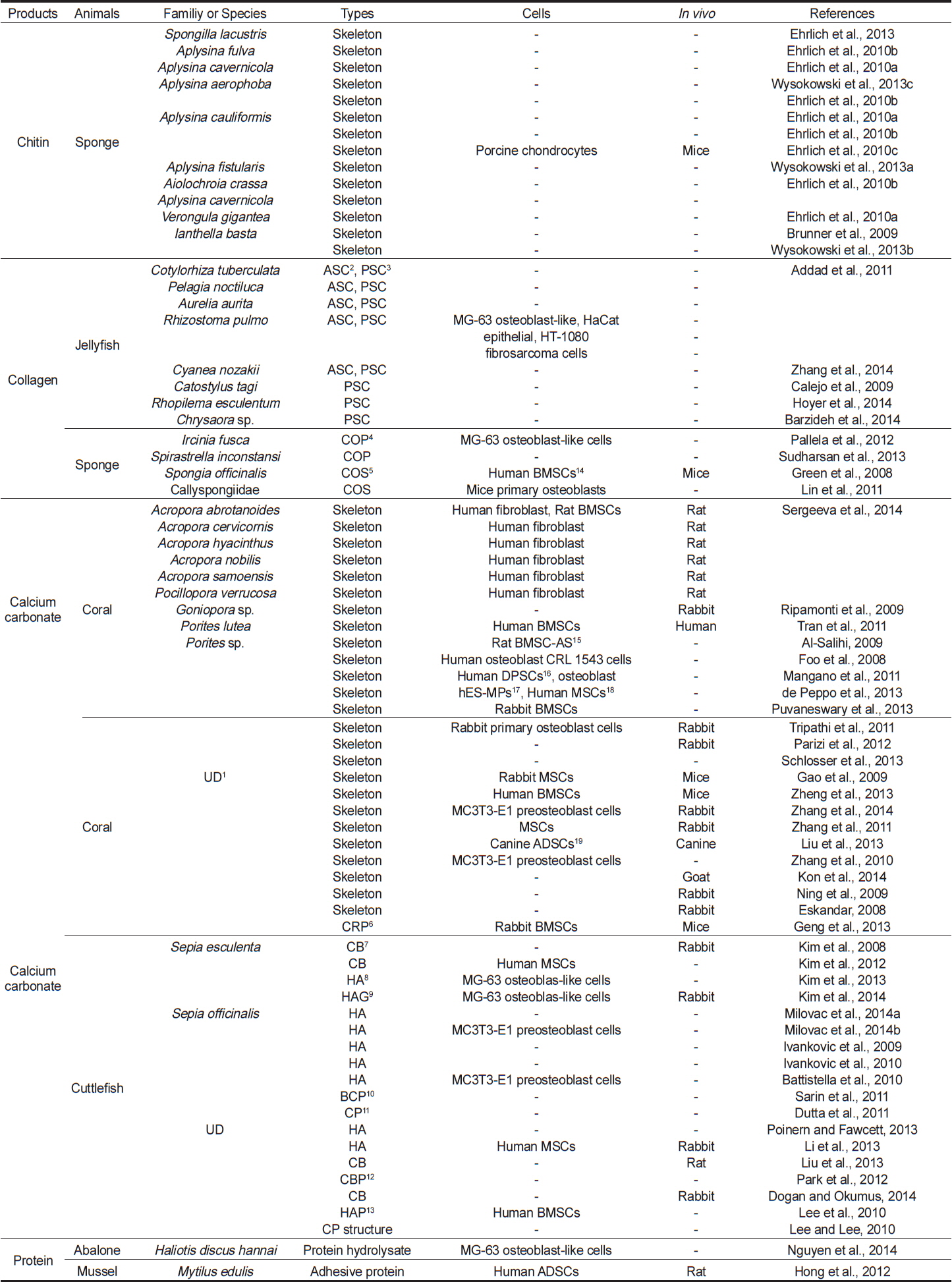
이 논문에서는 이처럼 특수한 수생환경에서 서식하는 해양무척추동물을 대상으로 하여 이들의 골격과 해양무척추동물 유래 유용물질을 이용하여 조직공학으로의 적용 및 가능성에 대한 연구결과들에 대하여 고찰하고자 한다. 또한, 해양무척추동물로부터의 유용물질 및 이를 이용한 골조직재생에 관한 최근 연구들을 Table 1에 제시하였다.
[Table 1.] Natural products derived from marine invertebrates for bone tissue regeneration
Natural products derived from marine invertebrates for bone tissue regeneration
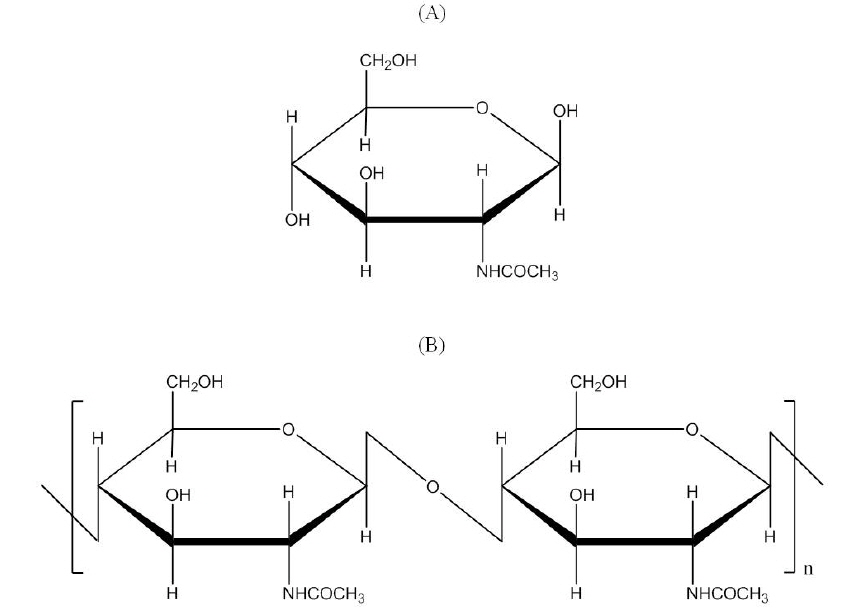
셀룰로오스(cellulose) 다음으로 많이 생산되고 있는 다당류인 키틴은 약 19개의 동물문에서 다른 다당류 및 단백질과의 결합형태로 존재하고, 규조류(diatom)나 균류(fungi)의 세포벽을 이루는 알려져 있는 필수성분이다(Ehrlich et al., 2007). 이러한 키틴은
살아있는 화석이라고도 불리며, 후생동물(metazoans)에 속하는 가장 하등한 다세포생물인 해면(marine sponge)은 약 6억년 전부터 해양에 서식하였으며, 현재까지 알려진 동물 중에서 가장 오래된 동물로 알려져 있다(Pozzolini et al., 2014). 또한, 해면은 다세포의 기원, 조직의 발달, 신호전달경로(signaling pathway), body polarity 및 조직화 체계(coordination system)와 같은 기초연구에 대한 해답을 알려 줄 수 있는 모델로 이용되고 있다(Leys and Hill, 2012). 이들은 물이 순환될 수 있는 여러 개의 관(canal)과 깃세포실(choanocyte chamber)을 보유하고 있으며, 기관을 가지고 있지 않은 매우 단순한 몸의 구조를 가지고 있다(Erwin and Thacker, 2007; Leys and Hill, 2012). 해면동물문(phylum porifera)은 보통해면류(demosponge), 석회해면류(calcarea), 육방해면류(hexactinellida) 및 동골해면류(homoscleromorpha)의 4개의 강(Class)으로 분류할 수 있다(Riesgo et al., 2014). 이중, 보통해면류는 강 중에서 가장 큰 부분을 차지하고 있는 해면동물로서, 다양한 유기성분들로 이루어진 골격을 가지고 있는데, 단백질인 해면질(spongin), 다당류인 키틴과 규질의 골편(siliceous spicule)을 가지고 있다(Kunze et al., 2013). 특히, Verongida 목(Order)을 포함한 모든 보통해면류는 키틴을 기본으로 하는 골격을 보유하고 있다(Kunze et al, 2013). 이러한 특징들을 이용하여 보통 해면류로부터 키틴골격을 획득하여 조직재생에 적용시킨 연구들이 최근 많이 이루어지고 있다.
Ehrlich et al. (2010b; 2010c)은 5종류의 해면(
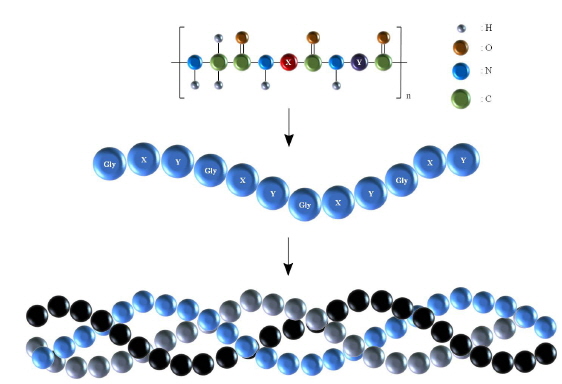
콜라겐은 피부, 뼈, 힘줄 및 연골 같은 조직결합(connective tissue)의 세포외기질(extracellular matrix)을 구성하고 있는 주요 구성성분 중 하나로 동물의 전체 단백질 중 약 30%를 차지하고 있으며, 조직의 기계적 강도와 생리적인 기능유지에 중요한 역할을 한다(Barzideh et al., 2014). 현재까지 알려진 바로는 29개의 콜라겐 형태가 존재한다고 보고되었으며, 구조는 Gly-X-Y의 아미노산 배열의 반복을 통해 형성되는 도메인(domain)으로 이루어진 삼중나선구조(triple helix structure)이며(Fig. 3), 총 아미노산의 약 30%는 glycine으로 구성되어 있고, X와 Y자리에는 주로 proline이나 hydroxyproline이 존재한다(Schegg et al., 2009). 이러한 콜라겐은 생체재료의 이용에 유리한 높은 생체적합성, 낮은 항원성(low antigenicity), 세포부착능력(cell-binding properties) 및 높은 생분해성 등의 특징들을 가지고 있어 생체재료로서 널리 이용이 되고 있다(Jeong et al., 2007; Murphy et al., 2010). 최근에는 안전성 문제가 대두되고있는 육상동물유래 콜라겐보다 안전하다고 알려져 있는 해양수산생명자원유래 콜라겐에 대한 관심이 증대되고 있으며, 콜라겐 추출에 대한 연구 또한 활발히 진행되어지고 있다(Duan et al., 2009; Jongjareonrak et al., 2005; Matrnaroh et al, 2011). 조직재생과 관련하여 해파리(jellyfish) 유래 콜라겐에 대한 연구가 활발하며, 해면 유래 콜라겐에 대한 연구도 점차 증가하고 있는 추세이다.
해파리는 분류학적으로 자포동물문 해파리강(Scyphozoa)에 속하는 무척추동물이다(Lim and Kim, 2014). 해파리는 단백질과 수분이 주성분으로 미량의 당과 칼슘, 인, 요오드 및 비타민 같은 무기질이 풍부하며, 지방 및 콜레스테롤 함량이 적어 천연건강식품으로 오랫동안 이용된 수산생물이다(Ding et al., 2011). 또한 해파리는 몸통의 외피조직과 내피조직의 사이에 다량의 콜라겐을 함유하고 있어(Lim and Kim, 2014), 콜라겐의 추출 및 이를 활용하고자 하는 연구가 많이 이루어지고 있으며, 이로부터 콜라겐의 추출과 가수분해를 통한 항산화(Ding et al., 2011), 항피로효과(Ding et al., 2011), 항고혈압(Zhuang et al., 2012) 및 멜라닌 형성 억제(Zhuang et al., 2012) 등의 다양한 생리활성에 대한 연구가 보고 되었다. 또한, 다양한 생리활성에 대한 연구뿐만 아니라 해파리로부터 획득한 콜라겐을 이용하여 의공학적 소재로 적용 시키기 위한 연구가 활발히 진행되고 있다.
다음은 해파리로부터 추출된 콜라겐에 대한 연구들이다. Addad et al. (2011)은 해파리 2종(
또한, 해면으로부터 콜라겐을 추출하여 이를 이용한 연구들도 보고 되었다. Sudharsan et al. (2013)은
>
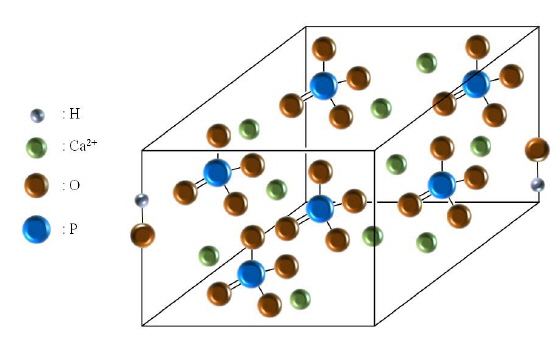
수산화인회석(hydroxyapatite, Ca10(PO4)6(OH)2)
인산칼슘(calcium phosphate)은 골이나 치아 같은 근골격계(musculoskeletal system)의 치료 및 재생에 사용되는 물질이다. 가장 널리 사용되는 인산칼슘 계열로는 수산화인회석, 제삼 인삼칼슘(β-tricalcium phosphate) 및 이 두 가지 생체재료의 혼합을 통하여 만들어지는 생체친화성과 분해성이 우수한 장점을 가지는 이상인삼칼슘(biphasic calcium phosphate)이 있다(Kim et al., 2013c; Sarin et al., 2011). 이중에서, 수산화인회석이 결정구조를 가지기 위한 단위격자를 Fig. 4에 나타내었다. 수산화인회석의 결정구조는 칼슘과 인산염이 수산화이온 주위에 배열이 되고, 이러한 인산염의 네트워크로 인해 생성된 골격의 구조가 결정구조를 형성할 수 있도록 도와준다(White et al., 2007). 이러한, 수산화인회석은 뼈 조직의 약 75%를 구성하는 주요성분으로, 매우 훌륭한 생체친화성, 생체적합성, 골전도성 등의 특징뿐만 아니라 생리활성을 가지고 있어 의공학 분야에서 골 및 타 조직의 복원을 위한 재료로 널리 사용되고 있는 물질이다. 그러나, 수산화인회석으로만 제작 되어진 세포담체는 약한 기계적 강도로 인해 생체재료로 사용하기에는 다소 제한적이며(Kim et al., 2003; Trinkunaite-Felsen et al., 2014), 미세 구조의 복잡한 구조를 제작하기에 어렵다는 단점이 있다(Ma et al., 2003). 수산화인회석은 천연유기물을 기본으로 한 물질 및 무기물로부터 합성되며, 보통 생선뼈, 산호 및 달걀껍질 등의 천연유기물질로부터 합성된 수산화인회석은 Na+, K+, MG2+, Zn2+, F−, Cl− 및 SO42−등과 같이 골 대사와 연관된 여러 가지 생화학적 반응에 영향을 미치는 유익한 원소들을 포함하고 있는 반면, 일반적인 수산화인회석의 합성 방법에 의한 수산화인회석에는 위와 같은 유익한 원소들이 포함되어 있지 않다(Akram et al., 2014). 따라서, 생물로부터 추출된 수산화인회석은 치료 목적을 위한 귀중한 생체적합물질로 사용될 수 있다. 해양무척추동물 중 산호(coral)와 갑오징어(cuttlefish)는 탄산칼슘으로 골격을 형성하며, 이를 이용한 연구가 많이 이루어 지고 있다.
수산생물 중 산호는 군체(colonial organism)를 이루며 살아가는 고착생물로 암초를 형성하는 주요 생물 중 하나이다. 이러한 산호는 산호충강(anthozoa)에 속하는 무척추동물로 약 7,000종 이상이 있으며, 탄산칼슘결정의 일종인 아라고나이트의 형태로 골격을 형성한다(Kon et al., 2014). 형성된 산호골격은 골격자체가 골전도성이 뛰어나거나 골형성 효과를 가지고 있는 것은 아니나 성장인자의 매개와 세포의 부착, 성장, 증식, 확산 및 분화를 도와줄 수 있는 구조와 기공간 연결 및 탄산칼슘의 결정 등의 특징이 인간의 뼈와 형태학적으로 매우 유사하며, 독성이 없고, 비돌연변이 유도물(nonmutagenic)로서, 생체적 합성이 매우 우수하여 다양한 연구를 통하여 골 재생관련 연구의 재료로 사용이 되고 있다(Al-Salihi, 2009; Foo et al., 2008; Gravel et al., 2006). 이러한 산호에서 골조직재생용 세포담체로 주로 사용이 되고 있는 종은
산호는 오래 전부터 골 재생을 위한 물질로 사용 되고 있으며, 많은 연구들을 통하여 조직공학으로써의 가능성이 증명되었다. Al-Salihi (2009), Mangano et al. (2011), Tran et al.(2011) 및 Tripathi et al. (2001)은
또한, 갑오징어는 연체동물에 속하고 뼈는 경조직이며 2가지 영역으로 나뉘는데, 등부분의 두껍고 딱딱한 외벽과 탄산칼슘으로 이루어진 판 사이에 공간을 가지는 얇은 판으로 이루어진 내막으로 되어 있고, 갑오징어가 물에 부유 할 수 있도록 부상조(floating tank)의 역할을 한다(Kim et al., 2012). 갑오징어 뼈의 구성성분은 아라고나이트, 단백질 및 키틴의 무기물 및 유기물로 이루어진 생체적합성물질로, 조직재생 소재로서 잠재력이 풍부하나 주로 가공부산물로 취급하여 이용성이 낮았으나, 최근 갑오징어 뼈가 가지는 특징인 높은 공극률 및 굴곡강도와 내압강도를 가지는 생체적합성으로 인하여 많은 연구를 통해 조직공학으로의 활용방안이 연구되고 있다(Cadman et al., 2010; Milovac et al., 2014). 이러한 갑오징어 뼈는 수열처리(hydrothermal treatment)방법을 이용하여 다공성을 가지는 인산칼슘 세포담체를 제작할 수 있으며, 이렇게 생성된 세포담체는 미세구조가 잘 유지되며, 적절한 공극크기(~ 100 – 200 μm)와 조직재생에서 생물학적 활성들을 지지하기 위한 상호연결성을 가지고 있어 골조직공학으로써의 가능성이 높다(Cadman et al., 2010).
Kim et al. (2008, 2012)은
골재생과 관련하여 Nguyen et al. (2014)은 전복 내장(Abalone intestine)을 가지고 소화 효소를 이용한 가수분해물(hydrolysate)을 제조하여, 이를
>
해양무척추동물 유래 골 조직 재생 소재의 산업적 제품 및 향후 발전 가능성
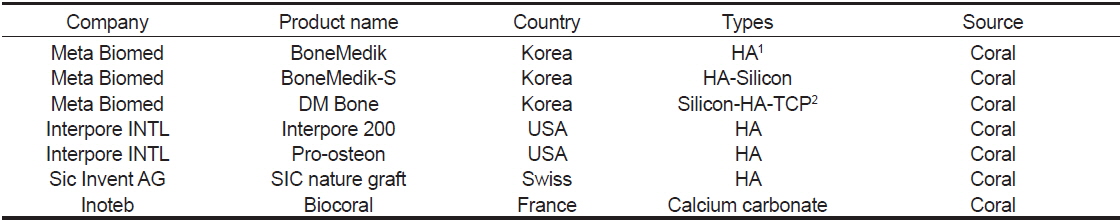
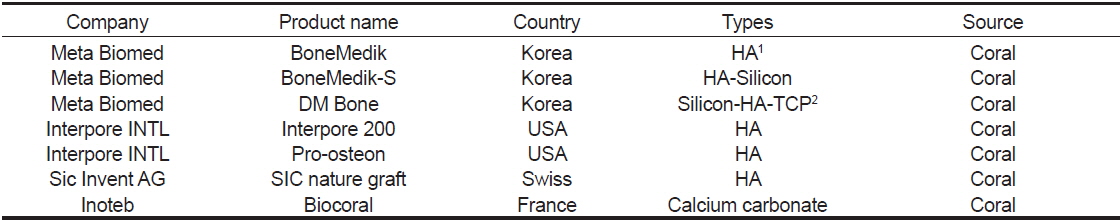
해양무척추동물 유래 골 조직 재생 바이오 메디컬 소재를 이용하여 현재 산업적으로 생산되는 제품은 Table 2에 나타내었다. 국내기업으로는 유일하게 의료용 소재의 연구개발, 생산, 판매 등을 수행할 수 있는 메타바이오메드사에서 해양무척추동물중 산호로부터 유래된 수산화인회석기반의 세포담체를 제작하여 산업화 하였다. 생산되는 제품들을 살펴보면, BoneMedik제품은 천연산호의 탄산칼슘이 수산화인회석으로 전환되는 특징을 이용하여 블록형태와 과립형태의 제품을 통하여 골 대체재 및 손상 치료를 위한 목적으로 제품화 되었으며, BoneMedik-S 제품도 천연산호로부터 유래된 수산화인회석으로 제작되었으며 추가적으로 실리콘을 함유하고 있어 천연산호 기반의 제품들보다 뼈의 성장을 빠르고, 뼈의 강도를 강하게 해주는 제품으로 알려져 있다. 또한, DM Bone제품은 치과용 골 이식재로 사용되는데, 천연산호로부터 유래된 실리콘이 함유되어있는 수산화인회석 60%와 삼인산칼슘 40%가 혼합되어 치조골 및 안면의 골 결손부위의 이식재로 사용이 되고 있다. 외국기업으로는 프랑스의 Inoteb사에서 생산되고 있는 98% 이상의 탄산칼슘으로 구성되어 있는 산호 유래 제품인 Biocoral이 있으며, 수산화인회석 제품인 스위스의 Sic Invent AG사에서 생산되고 있는 산호유래 수산화인회석 제품 SIC nature graft와 Interpore INTL사에서 생산하고 있는 산호유래 수산화인회석 제품인 Interpore 200과 Pro-osteon이 골 재생 및 이식재로 사용되고 있다.
[Table 2.] Clinically available bone substitute products from marine invertebrate
Clinically available bone substitute products from marine invertebrate
조직재생 분야 수요 및 시장 분석 차원에서 봤을 때, 조직재생분야 내에서도 가장 주목 받고 있는 분야는 관절, 골 조직 재생분야이며, 타 장기에 비하여 비교적 많이 상용화가 되어 있는 상황이다. 최근 사회가 고령화됨에 따라 퇴행성 관절을 비롯한 각종 골 대사 관련 질환에 시달리고 있는 환자수를 고려할 때 인공관절 시장규모는 꾸준히 증가할 것으로 예상된다. 골조직 재생은 국내에서는 다른 선진국에 비해 출발이 다소 늦은 편이나, 향후 생명공학이나 실버 산업에 대한 관심이 높아짐에 따라 의료 분야에 적용할 수 있는 생체재료로서의 고부가가치 창출이 가능할 것으로 기대된다. 또한, 육상생물자원의 자원적 한계와 안전성 문제로 인하여, 전 세계적으로 해양수산생물자원으로부터 조골세포를 활성화시킴으로써 근본적인 뼈 조직 생성을 촉 진하는 원천기술 및 소재에 대한 연구 필요성과 중요성이 대두되고 있다. 따라서, 해양수산 자원을 활용한 조골세포 및 골조직 재생 의공학적 활용기술과 원천소재 선점을 위한 연구 및 기술개발이 절실히 필요하다. 이와 관련하여 국내에서는 해양무척추동물을 활용한 골 조직 재생에 대한 기초 및 비임상 관련 연구가 일부 시도된 바 있으나, 기초 연구 수준에서 머물러 있는 실정이며, 의공학적 소재 응용 및 개발은 어뼈로부터 가공한 HA 소재와 국내 유일하게 메타바이오메드사에서 산호로부터 가공한 HA소재 외에는 관련분야 내 해양무척추동물 유래 골 조직 재생에 관한 연구 및 기술 개발은 미비한 상황이다. 그러나, 앞에서 언급한 바와 같이 해양무척추동물 유래 유용소재들의 골 조직 재생으로 적용 가능성은 높다. 이처럼 적용 가능성이 높은 해양무척추동물 유래 골 조직 재생 바이오 메디컬 소재로서의 연구 및 기술개발은 건강기능성 및 의약 신소재 개발을 위한 연계 기술개발과 생물공정 등 산업화 적용을 위한 선행결과로 활용될 수 있다. 아울러, 제약회사 및 기능성 소재 기업과의 연계를 통하여 전문 연구인력을 공급하고 기술이전 등의 산업화 방안의 모색도 가능하며, 국내외 골 조직 재생 소재 시장에서 높은 경쟁력을 확보하고 해양수산생물소재를 활용한 고부가가치화 창출이 가능할 것으로 사료된다.
과학의 발전과 더불어 인류의 평균 수명이 증가하였고 삶의 질 또한 높아지고 있다. 그에 따라 불의의 사고와 노화에 의해 초래되는 조직 및 장기의 손상과 기능의 상실이 증가하고 있지만, 조직 및 장기의 수요에 비해 공급이 부족한 실정이다. 이러한 문제로부터 벗어나고자 천연 및 합성물질을 이용하여 조직 및 장기의 기능을 대체할 수 있도록 도와주는 조직공학이 높은 관심과 더불어 꾸준한 발전을 이루고 있으며, 육상자원의 한계와 안전성의 문제에서 벗어나고자 해양수산생명자원으로의 관심이 높아지고 있다. 따라서, 이 논문에서는 해양수산생명자원중에서 해양무척추동물 유래의 의공학적 유용소재를 이용한 골 조직재생으로 이용 가능한 세포담체의 제작과 활용 및 가능성에 대하여 최근 연구내용들을 살펴보았으며, 키틴 및 콜라겐 골격의 추출을 통한 해면유래 세포담체의 제작, 탄산칼슘을 골격으로 형성하고 있는 산호 및 갑오징어 뼈를 이용한 세포담체의 제작, 그리고 생체적합성과 생분해성의 특징으로 인하여 조직재생에 이용되고 있는 콜라겐을 해파리로부터 추출한 연구들을 바탕으로 의공학적 유용소재로의 활용 및 가능성에 대하여 기술하였다. 해양유래 생물들은 육상생물과 비교하여 월등히 많은 수의 종들이 살고 있음에도 불구하고, 현재까지 우리가 밝혀낸 종들은 10%에도 미치지 않는 극히 소수이며, 아직도 정확히 어느 정도의 생물들이 살아가고 있는지는 추측만 하고 있을 뿐이다. 앞서 기술한 해양생물유래자원에 대한 연구는 아직도 꾸준히 진행 중이며, 많은 연구자들이 해양무척추동물로부터 새로운 구조와 생리활성물질의 발견 및 조직재생으로써의 적용방법에 대하여 연구하고 있다. 따라서, 앞으로도 무궁무진한 가능성을 가지는 해양유래생물들의 발굴을 통하여 골조직재생분야를 포함한 다양한 분야로의 활용 및 적용가능성이 매우 높을 것으로 사료된다.