최근에 구리(Copper)는 양식어망의 부착생물 억제 및 항균활성 능력으로 그 용도가 부각되었지만(Xiuling et al., 2012), 이전부터 오랫동안 선체 도료, 목제 보존제와 양어장의 살충제 및 살조제로 광범위하게 사용되어 연근해 유입이 지속되어 왔다(Tucker, 1985; Clark, 1996). 국내 진해만 해수 중의 구리 농도는 0.31-0.9 μg/L, 퇴적물에서는 25.3-92.3 μg/g으로 조사되었고, 참굴(
과도한 구리 노출에 의한 생물독성 기전에는 여러 가지 모델이 제시되는데, 그 중 하나는 superoxide (O2·−), hydroxyl (OH·) 및 peryoxyl (ROO·)과 같은 활성산소류(ROS, reactive oxygen species)를 과도하게 발생시켜 세포 독성을 유발한다는 것이다(Linde et al., 2005). 세포 내 glutathione (GSH)와 결합하려는 구리의 성질은 세포 내 GSH 고갈 유도로 인한 구리 독성의 또 다른 기전이며 (Maracine and Segner, 1998), glutathione peroxidase (GPx), glutathione reductase (GR)과 같은 GSH-independent antioxidant 활성 및 superoxide dismutase (SOD), catalase (CAT)와 같은 antioxidant enzymes의 조절 능력 또한 구리 독성 기전과 연관되어 있다(Gaetke and Chow, 2003).
GSH는 세포에서 ROS와 직접적으로 반응하여 독성물질의 대사 및 수송 과정에 관여하는 물질로, ROS뿐만 아니라 이들의 대사 산물과도 반응하여 세포의 방어 기작에 다방면으로 작용한다(Dringen et al., 2000). 세포 내에 ROS 발생시, GSH는 주로 GPx에 의해서 glutathione disulfide (GSSG)로 산화되고, GSSG는 GR에 의해서 다시 GSH로 환원되는 redox cycle을 통해 유해물질 포합(conjugation) 과정에 관여하고, glutathione S-transferase (GST)와 같은 효소의 도움을 받아 생체 외로 배설 시킨다. 이러한 생체변환(biotransformation) 과정을 통하여 무독화 혹은 배설되지 못한 ROS는 DNA, RNA 및 단백질을 손상시켜 세포에 심각한 독성을 발휘한다(Liu et al., 2005).
Acetylcholinesterase (AChE)는 척추동물의 신경자극 전달물질로 체내에 흡수된 오염물질에 의해서도 유도되는 효소이기에 해양오염에 대한 조기경보지표로 사용되어 왔다(Kramer, 1994). 특히 유기염소계와 카바마이트계 농약에 의해 활성이 저해되는 것으로 알려져 있으나, 중금속에 오염된 지역의 해양생물에서도 cholinesterase의 저해가 보고된 바 있다(Devi and Fingerman, 1995; Guilhermino et al., 1998; Diamantino et al., 2003). 또한, 구리는 어류의 AChE 활성에 영향을 미쳐 운동신경 및 부교감신경을 자극하여 이상행동을 초래했다는 보고와 함께 AChE는 구리 노출에 따라 유의한 활성 변화를 보여 유용한 biomarker로 활용 가치가 있다는 보고가 있다(Shin et al., 2003; Gioda et al., 2013).
따라서 본 연구는 국내 주요 양식종인 돌돔(
돌돔(
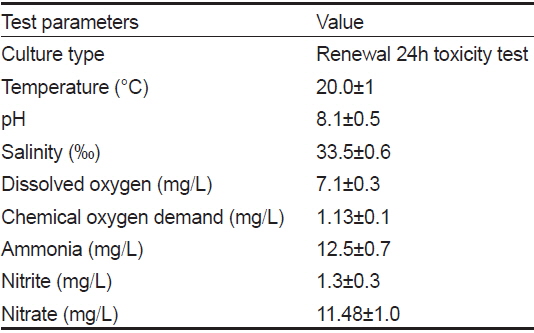
실험은 항온실(20±1℃)에서 유리수조(50×28×31 cm)를 사용하여 1일마다 실험용액을 교환하는 환수식으로 실시하였고, 실험조건은 Table 1과 같다. 실험 용액은 Copper (II) sulfate minimum 99% (CuSO4, Sigma-Aldrich Co. LLC)를 증류수에 용해시켜 stock solution을 만든 후, 여과해수로 희석하여 노출농도가 각각 0, 200 및 400 μg/L이 되도록 설정하였다. 돌돔은 각 농도에 10일 및 20일간 노출시킨 후, heparin-Na (5,000 I.U., 중외제약)을 처리한 주사기를 이용하여 미부 정맥에서 채혈한 후, 간, 아가미, 뇌 및 근육을 적출하였다. 모든 실험은 2회 반복 실시하였다.
[Table 1.] The chemical components of seawater and experimental condition used in the experiments
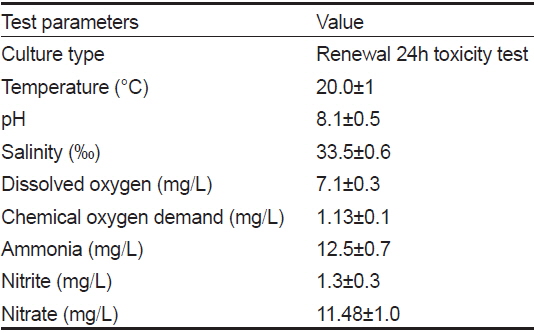
The chemical components of seawater and experimental condition used in the experiments
채혈한 혈액은 1시간 동안 실온에 방치한 후, 4℃에서 6,000 rpm으로 5분간 원심 분리 (MICRO 22R, Hettich, Germany)하여 혈청을 분리하였다. 효소활성 검토를 위해 ALT 및 AST는 Reitma-Frankel법으로, LDH는 LDH 젖산 기질법에 의하여 임상용 kit (Asan Pharm. Co., Ltd.)를 이용하여 분석하였다.
간과 아가미에서는 항산화 효소(GSH, GPx, SOD)를, 뇌와 근육에서 AChE의 활성을 검토하기 위하여 다음과 같이 진행하였다. 적출한 각 기관은 washing buffer (0.1 M KCl, pH 7.4)로 세척 후, homogenizing buffer (0.1 M K2HPO4, 0.15 M KCl, 1 mM DTT, 1 mM EDTA, 1 mM PMSF, pH 7.8)를 이용하여 Teflon-glass homogenizer (099CK4224, Glass-Col, Germany)로 균질화하였다. 조직 균질액을 4℃에서 12,000
GSH 함량은 Richardson and Murphy (1975)의 방법에 의하여 측정하였다. 일정량의 시료에 working solution (0.01 M 5, 5’-dithiobis, 2-nitrobenzoic acid (DTNB), 0.1 M PBS buffer, pH 8.0)을 첨가하여 분광광도계 (Zenyth 200, Anthos Labtec Instruments Gmbh, Austria)를 사용하여 412 nm에서 측정하였다. GSH 함량 계산은 10 nM reduced glutathione standard solution을 사용한 검량선을 이용하였다.
GPx 효소 활성은 Bell et al. (1985)의 변형된 방법으로 측정하였고, H2O2를 기질로, sodium axide를 catalase 억제제로 사용하였다. 시료에 1 mM GSH, 0.1 M NADPH, 0.5 U glutathione reducatase, 1 mM EDTA, 2 mM sodium azide 및 50 mM 인산완충용액(pH 7.4)이 포함된 혼합용액을 가하고 5분간 20℃에서 안정시킨 후, 2.5 mM H2O2를 첨가함과 동시에 반응이 시작되었다. NADPH가 산화되는 비율을 340 nm에서 4분 동안 20초 단위로 측정하였고, 단위는 nmol/ min/ mg protein이다.
SOD 활성은 시료를 0.1M PBS buffer로 희석하여 시판되는 SOD assay kit (WST, Dojindo Labs. Co. Japan)로 450 nm에서 측정하였다. SOD 1 unit은 WST (2-(4-lodophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophynyl)-2H-terazolium, monosodium salt)의 붕괴율을 50% 억제하는 Cu, Zn-SOD의 양이다.
AChE 활성은 Ellman (1961)의 방법을 기초로 하여 변형된 방법으로 측정하였다. 시료를 효소 측정 범위 내로 50 mM TrisHCl buffer (pH 7.5)에 적절히 희석한 후, 1.875 mM DTNB를 혼합하여 기질로 8.25 mM Acethylcolinesterase iodide을 넣은 뒤 즉시 파장 412 nm에서 5분간 측정하였다.
조직의 단백질 함량의 측정은 Bradford (1976) 방법으로 측정하였고, Bovine gamma globulin (Sigma, USA)을 이용하여 표준 검량선을 작성하였다.
실험 분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하고, 사후검정으로 Duncan’s multiple range test를 통해
본 연구에서는 돌돔(
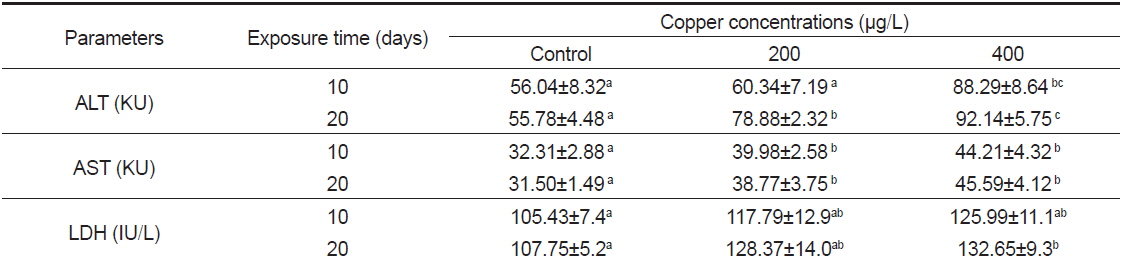
혈액학적 지표들은 중금속 노출 시 빠르게 반응하는데, 이런 변화는 중금속에 노출된 어류의 신장과 간 기능 장애 및 조혈기 손상을 의미하기 때문에 어류에서 혈액학적 연구는 환경의 오염 수준을 감시하는 유용한 수단으로 이용되고 있다(Witters et al., 1990). 본 연구에서, 구리에 노출된 돌돔 혈청의 효소활성 변동은 Table 2에 나타내었다. ALT (KU) 활성은 노출 20일째, 200 μg/L 실험구를 제외하고는 모든 실험구에서 노출 기간과 농도에 의존적으로 대조구에 비하여 유의하게 높은 활성을 보였다(
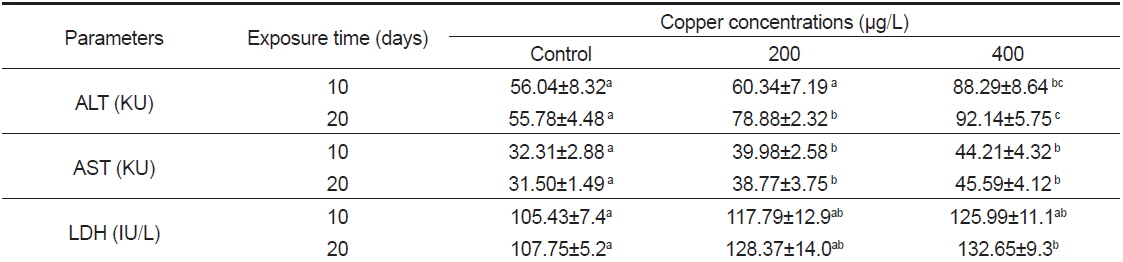
Changes of plasma enzymes parameter of rock bream Oplegnathus fasciatus exposed to Cu for 10 and 20 days.
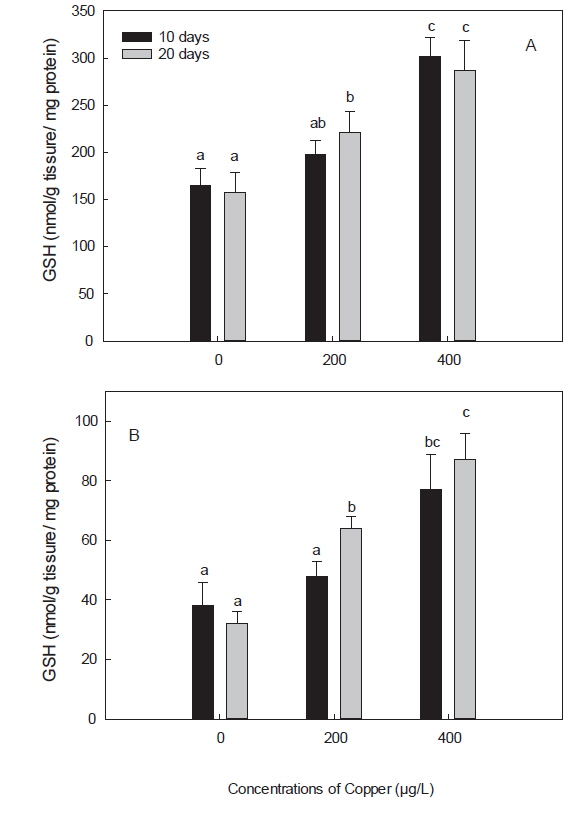
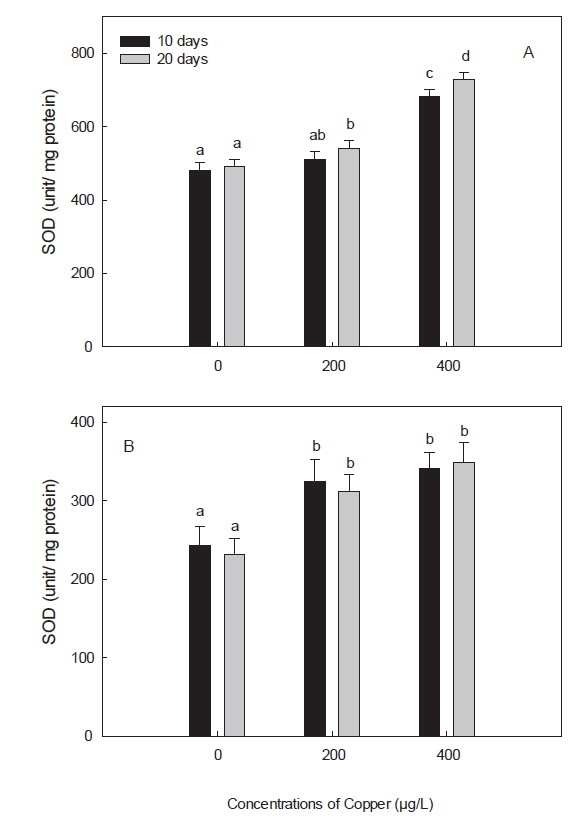
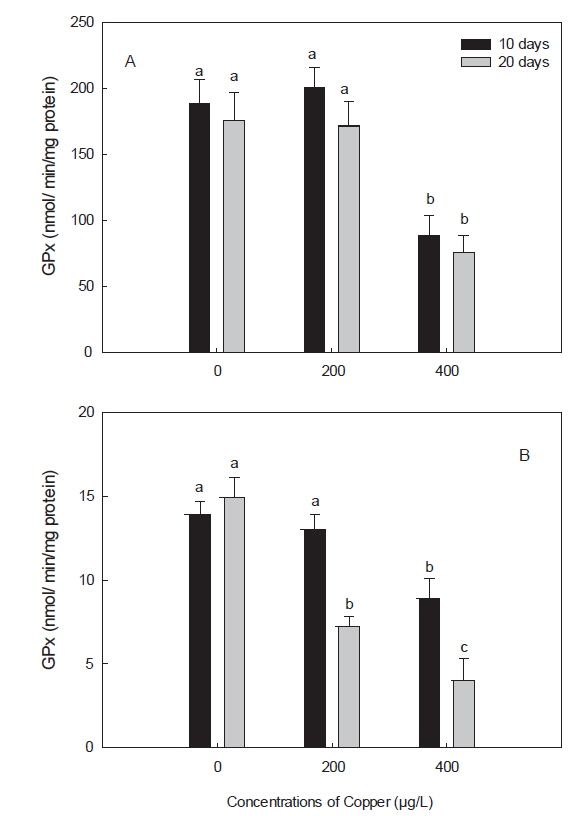
구리 노출에 의한 독성은 oxidative stress를 유발하는 prooxidant와 antioxidant 항상성의 불균형과 연관이 있다(Liu et al., 2005). 어류에서, 구리에 의한 oxidative stress는 무지개 송어와 잉어에서 보고된 바 있다(Niyogi et al., 2006; Gert et al., 2002). 구리에 의한 oxidative stress는 dietary, waterborne 혹은 injection과 같이 노출 경로를 달리 해도 유도됨이 밝혀졌다(Lushchak, 2011). 이와 같이 중금속에 의한 free radical과 oxidative stress 반응은 redox cycling을 중심으로 GSH 및 SOD와 같은 antioxidant defense system에서 대해서 많이 연구되어 왔다(Valavanidis et al., 2006). 본 연구에서는 구리의 산화적 스트레스에 대한 표적 장기로 간과 아가미를 선택하였으며, 그 결과, 아가미의 GSH, SOD 및 GPx, 모두 간에서 보다는 낮은 활성을 보였지만, 구리 노출에 따른 활성 반응양상은 간에서와 유사하였다(Fig.1-3). 또한, 본 연구에서 항산화 효소 활성의 변화가 간에서는 노출 20일차에 유의하게 나타난 것 비해 아가미에서는 노출 10일차에 좀 더 빨리 나타난 것은, waterborne 노출 시, 구리의 주요 축적 장기는 간과 아가미이지만, 주요 흡수 경로가 아가미일뿐만 아니라, 구리로 인한 아가미 점막 손상 때문인 것으로 사료된다(Campbell et al., 1999; Tao et al., 2000; Handy, 2003). 더욱이 Bopp et al. (2008)은 무지개 송어(
GSH는 생체 내 free radical scavenger이자 항산화제로 중금속 노출 시 해독능력을 나타내는 중요한 지표로서, redox reaction을 유지하고, ROS와 외인성 물질에 대해 방어하는 중요한 역할을 한다(White et al., 2003). 본 연구에서는 노출 20일째, 200 μg/L 실험구를 제외하고, 구리에 노출된 모든 실험구의 돌돔의 간과 아가미에서 GSH의 구리 농도에 따른 유의한 증가가 관찰되었다(Fig. 1). 이는 다른 어종인 조피볼락(
구리는, 정확한 메커니즘이 밝혀진 것은 아니나, GSH와 결합하여 보다 안정적인 형태인 GS-Cu(I) 복합체를 형성하는 것으로 알려져 있으며, 높은 농도의 구리 노출 초기에는 GSH가 빠르게 감소한다고 보고된 바 있다(Conners and Ringwood, 2000). 이전 연구에서, 이러한 GSH의 감소는 GSH regenerating system (GSH reductase, GSH synthetase)이 영향을 입었을 가능성을 제시하며, 노출 농도에 따른 변화에 주목하였다(Canesi et al., 1999; Sanchez et al., 2005). 한편, 구리와 GSH의 복합체인 GS-Cu(I)에 의해서는 ROS가 생성되며, 이는 또 SOD 및 cytochrome oxidase와 같은 또 다른 metalloenzymes의 합성을 촉진시킨다고 한다(Freedman et al., 1989).
본 연구에서 보인 구리 노출에 따른 돌돔의 간과 아가미에서의 SOD의 증가도 이와 같은 맥락에서 해석될 수 있을 것이다. 구리에 노출된 돌돔의 간에서는 구리 농도 및 노출 기간에 따른 SOD의 증가가 관찰되었고, 아가미에서는 농도 및 노출기간과는 상관없이 구리에 노출된 모든 실험구에서 유의한 증가를 보였다(Fig. 2). SOD는 CAT, GPx 및 GSH롤 포함하여 중금속에 의해 발생된 ROS에 대한 첫 번째 방어선으로서, superoxide와 hydrogen peroxide를 제거하는 역할을 담당한다(Hayes and McLellan, 1999). Hansen et al. (2006)도 brown trout (
GPx는 H2O2를 분해하여 H2O와 O2로 만드는 효소로, GPx가 활성을 발휘하기 위해서는 GSH를 필요로 하며, H2O2를 분해하는 과정인 redox-cycle에서 antioxidant enzymes으로서의 그 기능을 한다(Winston and Giulio, 1991). 본 연구에서 구리에 노출된 돌돔의 간 및 아가미에서 GPx는 감소하였다(Fig. 3). 이러한 감소는 노출 농도 및 노출 기간에 따라 더욱 가속화 되었는데, 이는 포유류 및 다른 어종에서도 유사한 결과이다(Ossola et al., 1997; Zhang et al., 2000; Ahmad and Santos, 2004; Baeck, 2012). GPx는 GR과 함께 GSH의 산화, 환원 과정에 필요한 항산화 효소로, 구리 노출에 의한 GR의 감소는 oxidized GSH인 GSSG의 축적을 유도한다(Zhang et al., 2005). 본 연구에서, GSH가 증가한 것으로 보아 GR과 마찬가지로 GPx의 감소 또한 GSH의 산화를 감소시켜 환원된(reduced) GSH의 축적을 유도하여 돌돔의 정상적인 redox cycling을 방해하였을 것으로 사료된다.
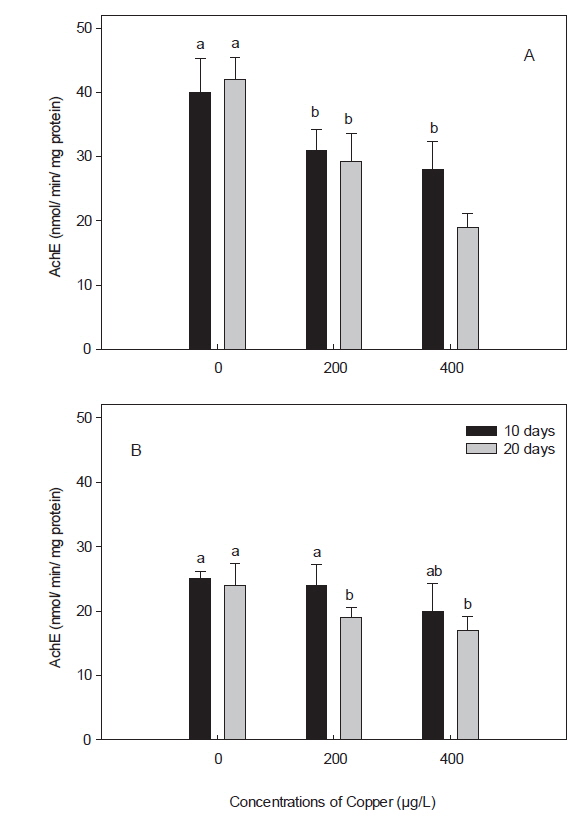
콜린성 섬유 및 혈액 세포에 풍부하게 존재하는 AChE는 중앙 및 말초 신경계에서 중요한 신경전달물질로, 최근 어류에서는 독성물질에 노출되었을 경우 그 활성이 감소되는 것으로 알려져, 신경독성에 대한 biomarker로써 제안된 바 있다(Shin et al., 2003; Modesto and Martinez, 2010). 본 연구에서, 돌돔의 AChE의 활성은 뇌에서는 40±5.2로, 근육의 25±1.2 nmol/min/mg protein보다 약 1.6배 정도 높았다(Fig. 4). 이 활성 수치는 돌돔과 같은 농어목인 참돔(
이상의 논의로부터 만성적 구리 노출에 대한 돌돔의 혈청 효소와 항산화 효소 및 신경전달물질 활성의 변동은 연안 구리 오염에 대한 모니터링의 수단으로 이용될 수 있을 것으로 사료되며, 항산화 효소에 있어서는 돌돔의 간뿐만 아니라 아가미도 해양 모니터링의 재료로써 가치가 있을 것으로 판단된다.