미역(
한편 염증반응은 외부로부터 생체 내로 박테리아나 바이러스와 같은 외부항원이 침입하여 물리화학적 손상을 입었을 때 그 손상에 대해 수복 재생하려는 조직반응을 말한다(Olefsky and Glass, 2010). 면역 세포 중 대식세포는 인체 면역체계에서 중요한 역할을 하는 백혈구로써, 모든 조직에 존재하며 외부의 자극으로 인하여 활성화되어 염증매개물질을 분비하여 염증반응을 유발한다(Albina and Reichner, 1995). 대식세포는 그람 음성균의 세포 외막에 존재하는 lipopolysaccharide (LPS)와 같은 외부의 자극에 의해 염증반응을 조절하는 핵심적인 전사인자를 활성화시켜, nitric oxide (NO), tumor necrosis factor (TNF)-α, interleukin (IL)-1β, IL-6등 여러 가지 염증 매개인자들이 생성되게 된다(Wu et al., 2004; Valledor et al., 2010). 염증매개인자들은 조직 손상의 복구와 보호에 필요한 것이지만(Dinarello, 1998), 이러한 염증반응이 과도하게 일어나게 되면 점막손상을 촉진하고, 암, 천식, 기관지염, 관절염, 파킨스병과 같은 퇴행성 뇌질환등의 각종 질환을 유도하기 때문에 생명현상 유지를 위해 염증반응 조절은 매우 중요하다(Willoughby, 1975). 현재까지 개발되어 이용되고 있는 일부 합성 염증억제제는 간 손상, 위장관 출혈, 성장억제와 같은 부작용 등을 초래하여 사용시 많은 주의와 제한성이 있다. 이에 많은 연구자들은 보다 안전하고 효과적인 천연물 유래의 항염증 물질을 찾는 연구를 계속하고 있다(Kwak and Lee, 2014). 그러므로 폐기되고 있는 미역뿌리의 고부가가치 기능성 소재에 대한 가능성을 알아보고, 새로운 자원으로 활용하기 위한 연구가 필요하다.
따라서 본 연구는 대량 폐기되고 있는 미역 부산물의 재활용 방안으로서, 미역 뿌리 에탄올 추출물이 LPS로 염증을 일으켜 활성화된 RAW 264.7 cells의 NO, IL-6, TNF-α 및 IL-1β 분비에 미치는 영향에 대해 조사하여 항염증 효과를 알아보고 천연항염증제로서 이용 가능성에 대해 구명하고자 하였다.
미역 뿌리는 부산(주)석하에서 제공 받았으며, 담수로 깨끗이 수세하고 동결건조(EyelaFDU-2100, Tokyo Rikakikai Co., Tokyo, Japan)후에 이를 분말화하고 진공 포장하여 -20℃에서 저장하여 두고 실험에 사용하였다.
분쇄한 미역 뿌리 분말에 10배의 95% 에탄올을 가하여 추출한 후 원심분리기(UNION 32R, Hanil Co., Incheon, Korea)로 3,000 rpm에서10분간 원심분리한 후 상층액을 취하였다. 얻어진 잔사는 이와 동일한 방법으로 2회 반복하여 추출하였다. 3회 추출하여 얻어진 상층액을 filter paper (Advantec5A, Toyo Roshi Kaisha, Tokyo, Japan)를 이용하여 여과하였다. 그 상층액을 35℃ water bath에서 rotary evaporator (RE200, Yamato Co., Tokyo, Japan)를 이용하여 감압하여 농축하였다. 농축물은 37℃에서 건조시키고 -20℃에 보관하여 두고 실험에 사용하였다.
마우스의 대식세포주인 RAW 264.7 세포(KCLB40071)는 한국세포주은행에서 분양받아 사용하였으며, DMEM (GIBCO, Grand Island, NY, USA)에 10% inactivated fetal bovine serum(FBS)와 1% penicillin-streptomycin을 첨가한 배지를 배양액으로 37℃, 5% CO2 incubator (MCO-15AC, Sanyo, Osaka, Japan)에서 배양하였다. 실험과정의 모든 세포는 80-90%정도의 밀도로 자랐을 때 계대 배양하였고, 20 passages를 넘기지 않은 세포만 사용하였다.
시료의 세포독성을 평가하기 위해 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay를 실시하였다. RAW 264.7 cell (1×106 cells/mL)를 96-well plate에 분주하고 20시간 전배양 후, 2 μg/mL의 LPS (Sigma, St. Louis, MO, USA)와 추출물(0.1, 1, 10, 50, 100 μg/mL)로 첨가하여 37℃, 5% CO2에서 22시간 배양하였다. 배양 후, 5 mg/mL 농도의 MTT 시약을 첨가하여 2시간 재배양하고 이를 4℃, 2,000 rpm에서 10분간 원심분리하여 상층액을 제거하였다. 그 후, 각 well에 dimethyl sulfoxide (DMSO)를 첨가하고 이를 microplate reader (Mod el 550, Bio-Rad, Richmond, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 세포 증식능은 다음 식에 의해 계산하였다.
Proliferation Index (%)=sample 흡광도/control 흡광도×100
NO의 농도는 배양액 내의 nitrite 농도를 griess 반응을 이용하여 측정하였다. RAW 264.7 세포는 DMEM 배지를 이용하여 2.5×105cells/mL로 조절한 후 24-well plate에 접종하고 37℃, 5% CO2 농도의 incubator에서 20시간 전배양하였다. 배지를 교환 후, RAW 264.7 세포에 2 μg/mL의 LPS와 추출물을(0.1, 1, 10, 50, 100 μg/mL)로 처리하여 24시간 재 배양하였다. 배양액의 상층액을 얻은 후, 동량의 griess 시약(1% sulfanilamide+0.1% naphthylen diamine dihydrochloride, 1 : 1)을 첨가하여 실온에서 10분간 반응시킨 후, microplate reader를 이용하여 540 nm에서 흡광도를 측정하였다. 세포배양액 내 NO의 농도는 sodium nitrite (NaNO2)의 농도별 표준곡선과 비교하여 산출하였다.
>
Pro-inflammatory cytokine 분비량 측정
세포배양액 내의 IL-6, TNF-α 및 IL-1β cytokine의 분비량을 ELISA-kit (BD Bioscience, San Jose, CA, USA)를 이용하여 측정하였다. RAW 264.7 세포는 DMEM 배지를 이용하여 2.5×105 cells/mL로 조절한 후 24-well plate에 접종하고 37℃, 5% CO2 incubator에서 18시간 전배양하였다. 세포에 2 μg/mL의 LPS와 미역 뿌리 ethanol 추출물을 처리하여 12시간 재배양하였다. 먼저, ELISA microplate에 anti-mouse IL-6, TNF-α 및 IL-1β mouse antibody (mAb)를 분주하여 하룻밤 동안 coating시켰다. 이를 0.05% tween 20이 포함된 phosphate buffered saline (PBST)로 세척하고, 10% FBS 용액으로 blocking하였다. PBST로 세척한 뒤, 각 microplate에 배양 상층액을 넣고 실온에서 2시간 반응시켰다. 다시 PBST로 세척한 뒤 희석한 biotinylated anti-mouse IL-6, TNF-α mAb와 streptavidinhorseradish peroxidase conjugate를 첨가하여 실온에서 1시간 반응시켰다. IL-1β의 경우, biotinylated anti-mouse IL-1β detection antibody를 첨가하고 1시간 반응시킨 후, streptavidinhorseradish peroxidase conjugate를 첨가하여 30분 반응시켰다. 그 후, 이를 다시 PBST로 세척한 다음, ο-phenylenediamine(OPD) 용액을 첨가하여 암반응 시키고 microplate reader를 이용하여 490 nm에서 흡광도를 측정하였다.
모든 실험 결과에 대한 통계처리는 SAS program (Statistical analytical system V8.2, SAS Institute Inc., Cary, NC, USA)을 이용하여 ANOVA법으로 분산분석을 실시하였으며, 조사 항목들 간의 유의성 검정은 Duncan의 다중검정법으로
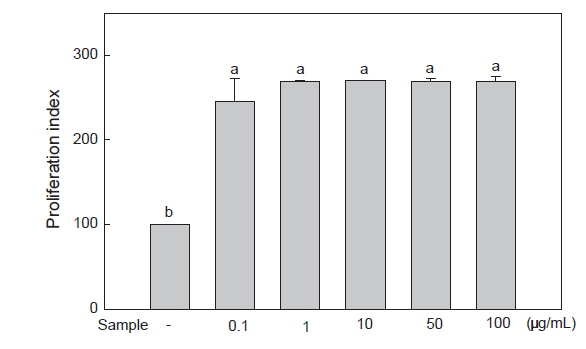
MTT assay를 이용하여 미역 뿌리 에탄올 추출물의 처리 농도에 따른 RAW 264.7 세포의 증식능을 측정하였다. 그 결과, 미역 뿌리 에탄올 추출물을 0.1, 1, 10, 50, 100 μg/mL의 농도로 처리 시 모든 농도에서 무처리구에 비해 세포 증식률이 증가함을 보여 세포 독성이 없음을 확인하였다(Fig. 1). 따라서 미역 뿌리 에탄올 추출물의 NO 및 cytokine 분비 억제 효과가 세포 독성에 의한 효과가 아님을 확인하였다.
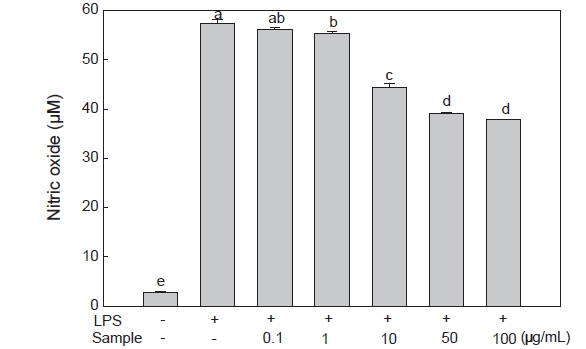
NO는 생체 내에서 NO synthase (NOS)라는 효소에 의해 L-arginine으로부터 생성되는 반응성이 강한 자유라디칼로써 신경전달, 면역반응 및 혈관확장 등의 생리적인 기능 조절에 중요한 역할을 하는 신호전달 물질이다(Weisz et al., 1996; Kim et al., 2012). 하지만 LPS 및 pro-inflammatory cytokine에 의해 다량의 NO가 생성되고, 과발현된 NO는 혈관 투과성을 증가시켜 부종을 일으키고 염증 반응을 촉진하여 조직 손상 및 종양 발생 등에 관여하게 된다(Stuehr et al., 1991). 따라서 미역뿌리 에탄올 추출물이 NO 생성량에 미치는 영향을 알아보기 위 하여 대식세포인 RAW 264.7 세포에 LPS로 염증반응을 유도시키고 미역뿌리 에탄올 추출물을 농도별로(0.1, 1, 10, 50, 100 μg/mL) 처리하여 세포 배양 상층액 내의 NO 양을 측정하였다. 그 결과, LPS에 의해 약 21배 증가된 NO 생성량이 미역뿌리 에탄올 추출물에 의해 LPS 처리 대조군 보다 농도별로 2%, 4%, 22%, 32%, 34% 감소하여 NO 생성량이 유의적으로 감소하는 것으로 나타났으며(
>
미역뿌리 에탄올 추출물에 의한 RAW 264.7 세포의 IL-6 분비 감소 효과
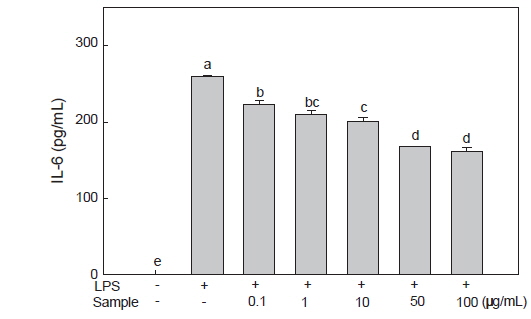
대식세포인 RAW 264.7은 그람 음성 세균의 세포외막에 존재하는 LPS 자극에 의해 IL-6, TNF-α 및 IL-1β와 같은 pro-inflammatory cytokine들의 분비가 촉진된다(Guha and Mackman, 2001). IL-6는 T세포, 단핵구 및 대식세포 등에 의해 생성되고 림프구의 기능을 활성화시키며 생체 내의 조혈작용을 조절하는 급성면역 반응의 유도물질이다(Akira et al.,1990; Shan et al., 2009). 또한 IL-6는 염증을 유발하여 대식세포를 포함한 식세포의 탐식작용과 보체 생산을 증진시키는 기능을 한다(Hur et al., 2013). LPS로 유도된 RAW 264.7 세포에 미역 뿌리 에탄올 추출물을 처리한 후 배양액 내에서의 IL-6의 분비량을 확인한 결과, LPS만 처리한 대조군에서는 259.50 pg/mL의 분비량을 보였으나, 미역 뿌리 에탄올 추출물 처리시 농도별로 각각 222.86, 209.77, 200.61, 167.90, 161.35 pg/mL의 분비량을 보여 농도 의존적으로 IL-6의 분비가 억제됨을 확인하였으며(Fig. 3), 특히 50 및 100 μg/mL의 농도에서는 약 35%와 38%의 감소 효과를 확인하여 미역 뿌리 에탄올 추출물이 RAW 264.7 세포에서 IL-6 발현을 억제하여 염증 억제 효과를 가짐을 확인하였다. Choi et al. (2013)은 미역 에탄올 추출물로부터 분리한 ethyl acetate 분획물의 항염증 효과에서 50 μg/mL의 농도에서는 감소효과가 없었으나 100 μg/mL농도에서는 63%의 염증억제효과를 나타내었다고 보고하여, 미역뿌리 에탄올 추출물이 저농도에서 항염증 효과가 더 큰 것으로 사료된다.
>
미역뿌리 에탄올 추출물에 의한 RAW 264.7 세포의 TNF-α 분비 감소 효과
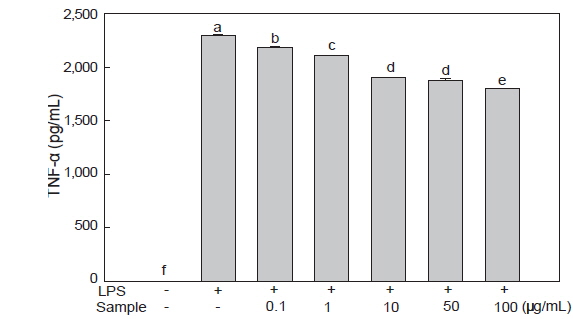
TNF-α는 염증성 매개물질 중 전구 염증 cytokine중 하나로 많은 감염성 혹은 자가면역성 질환에서 강력한 면역 매개 물질로 여겨지고 있는데, 이는 대식세포, 활성화 T세포, 비만세포에서 생산되며 중성구, 림프구, 단핵세포를 활성화시키는 작용을 한다(Kim et al., 2009). 미역뿌리 에탄올 추출물이 염증성 cytokine인 TNF-α의 분비에 미치는 영향을 알아보기 위해 LPS로 염증 반응을 유도한 후, 미역 뿌리 에탄올 추출물을 처리한 배양 상층액을 이용하여 TNF-α 분비량을 ELISA 방법으로 측정하였다. RAW 264.7 세포에서 분비된 TNF-α의 양은 LPS로 세포를 자극시켰을 때에 2,301 pg/mL으로 현저히 증가하였다. 그러나 미역 뿌리 에탄올 추출물을 0.1-100 μg/mL 농도로 처리한 세포에서는 LPS로 세포를 자극시켰을 때와 비교 시, 미역뿌리 에탄올 추출물의 농도에 의존하여 유의적으로 감소하였다(Fig. 4). 특히 100 μg/mL 농도로 처리한 세포에서는 22%의 감소를 보였다. 이는 미역 ethyl acetate 추출물이 100 μg/mL농도에서 TNF-α분비량을 21% 정도 감소시킨 것과 유사한 경향을 보였다(Choi et al., 2013). 이러한 결과는 NO 및 IL-6의 분비 감소 효과보다는 적었지만 미역 뿌리 에탄올 추출물이 RAW 264.7 세포에서 TNF-α의 발현을 억제하여 항염증 기능에 관여하고 있음을 알 수 있다.
>
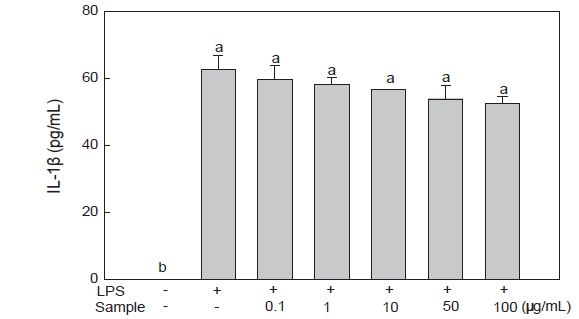
미역뿌리 에탄올 추출물에 의한 RAW 264.7 세포의 IL-1β 분비 감소 효과
IL-6, TNF-α와 함께 대표적인 염증성 cytokine인 IL-1β는 NO 생성의 매개물질로 대식세포, 단핵구, B세포 등에서 분비된다. 또한 국소염증을 발생시키며, T세포의 활성화, B세포의 성숙 및 NK cell을 활성화 시키는 cytokine이다(Lee, 2011). 또한 IL-1β와 TNF-α는 여러 형태의 실험에서 상호상가 효과를 나타낸다는 것이 밝혀졌으며, 급성기 염증반응에서 급격히 증가한다고 알려져 있다(Lee, 2009). LPS로 염증 반응을 유도한 RAW 264.7 세포에 미역 뿌리 에탄올 추출물을 첨가하여 IL-1β 분비량을 측정한 결과, LPS 처리구에서는 62.60 pg/mL로 증가하였으나, 미역 뿌리 에탄올 추출물을 농도별(0.1, 1, 10, 50, 100 μg/mL)로 처리했을 때 유의적인 차이가 없어 큰 효과를 보이지 않았다(Fig. 5).
따라서 미역 뿌리 에탄올 추출물은 LPS에 의한 RAW 264.7 세포의 염증 매개 물질인 NO, IL-6 및 TNF-α 분비를 감소시켜 항염증 효과를 가짐을 확인하여 천연 항염증제로서 이용 가능성이 있는 것으로 확인되었다.