면역은 인체의 주요 방어 기전으로, 외부 물질의 침입이나 감염작용에 대해 다양한 면역세포가 작용하여 인체를 방어하는 기능을 지칭하며(Hancock and Diamond, 2000), 대식세포가 관련된 비특이적 면역반응과, T 및 B cell이 관여하는 특이적 면역반응으로 나뉜다(Seo et al., 2009). 비특이적 면역반응, 즉 자연면역에서 대식세포는 체내 모든 조직에 널리 분포하며, 1차적으로 bacteria나 virus와 같은 감염성 병원체 또는 암세포 및 노화된 정상세포를 탐식작용을 통해 제거함과 동시에 interleukin (IL)-6, IL-1β 및 tumor necrosis factor-α (TNF-α) 등의 cytokine을 분비하며, 항원제시작용을 하여 면역반응을 극대화시키는 매개 역할을 한다(Yu et al., 2012a). 특이적 면역은 적응 면역이라고도 하며, 항원제시세포가 포식 후 제시한 항원 정보를 T cell이 인식하여 일어나는 면역 반응으로, T 및 B cell이 관여한다(Yoon, 2008). 특히 CD4+ T cell은 helper T (Th) 림프구라고도 하며, 방어 면역에서 가장 중요하게 작용하는 세포로 대식세포와 함께 cytokine 분비를 통해 면역반응을 유도한다. 이러한 Th cell은 Th1 및 Th2 cell로 각각 분화되며 서로 다른 면역작용에 관여하게 된다(Mosmann and Coffman, 1989). 그 중 Th1 cell 유도 cytokine은 IL-2, IL-12, interferon-γ (IFN-γ) 및 TNF-α가 있으며, 주로 세포매개성 면역작용을 활성화하고, Th2 cell 유도 cytokine에는 IL-4, IL-5, IL-6, IL-10이 있으며 주로 항체 생성에 의해 매개되는 체액성 면역작용을 활성화한다. 이러한 Th1 및 Th2 cell은 서로 균형을 이룸으로써 면역작용을 조절하게 된다(Liblau et al., 1995; Rengarajan et al., 2000).
최근 경제 성장 및 공업화의 추진, 환경오염, 식생활의 변화 등이 인체 내부의 항상성을 변화시킴에 따라 암, 후천성면역결핍증 등의 면역계 질환이 증가되고 있다(Park et al., 2006a). 이러한 면역계 질환을 치료하기 위해 예로부터 많은 면역 요법이 행해지고 있으나(Fahey and Myers, 1975; Oettgen, 1990; Nikonenko et al., 1996), 임상적 이용에는 여러 문제점을 가지고 있는 실정이다. 대표적 예로 cytokine, lymphokine, growth factor 등을 직접 투여하여 생체 면역계를 조절하는 방법이 있는데(Oldham, 1995), 체내에서 cytokine은 여러 종류가 상호 작용을 통해 서로의 작용을 상승 또는 억제하여 면역작용을 조절하기 때문에, 하나 또는 두가지의 cytokine을 대량 투입하여도 큰 효과를 기대할 수 없고, 독성이 강하며 혈중 적정 농도를 계속해서 유지하기 어려운 단점이 있다. 따라서 체내에서 여러 면역 세포를 자극함으로써 cytokine을 유도하는 보다 안전한 생리활성물질 탐색에 대한 노력이 증가되고 있다(Bergelson, 1995; Han et al., 1998; Kim et al., 2013).
한편, 참치(
따라서 본 연구에서는 수산가공 부산물로 발생하는 참치 자숙액의 기능성 소재로의 이용 가능성을 살펴보고자 참치 자숙액의 마우스 대식세포 및 비장세포에 대한 면역증강 작용을 살펴보았다.
본 실험에서 비장세포 분리 배양을 위해 생후 5주령의 수컷 BALB/c 마우스를 이용하였다. 마우스는 오리엔트바이오(Orient Co., Seongnam, Korea)에서 구입하여 온도 20±2℃, 습도 50±10%, 12시간의 명암주기가 유지되는 동물 사육실에서 1주일간 예비사육한 후 실험에 사용하였다.
본 실험에 사용한 탈염 참치 자숙액은 동원식품연구소에서 제공받은 것으로 31 Brix의 농축액을 4℃에 저장하며 사용하였으며, 고형분 함량은 25.51%이였고, 고형분에 대한 조단백, 조지방, 조회분, 염 함량은 각각 96.2%, 0.2%, 6.8%, 7.2%이였다. 실험 농도 설정을 위해 BCA protein assay kit (Thermo Fisher Scientific Inc., Rockford, IL, USA)를 이용해 bicinchoninic acid (BCA) assay를 실시하여 탈염 참치 자숙액의 단백질 농도를 측정하였으며, 단백질 농도를 기준으로 0.1, 1, 10, 50, 100 μg/mL의 농도로 실험을 진행하였다.
Murine의 대식세포주인 RAW 264.7 세포는 한국세포주은행(KCLB 40071, Seoul, Korea)에서 분양 받아 사용하였으며, Kim et al. (2013)의 방법에 따라 DMEM (GIBCO, Grand Island, NY, USA)에 10% inactivated fetal bovine serum (FBS)과 1% penicillin-streptomycin을 첨가한 배지를 배양액으로 37℃, 5% CO2 조건에서 배양하였다. 비장세포는 Ryu (2014)의 방법을 약간 변형하여 분리하였다. 먼저 세포 유리를 위해 BALB/c 마우스를 마취사 시킨 후, 비장을 무균적으로 적출하였다. 적출한 비장은 RPMI 1640 배지로 세척한 후, tissue grinder로 균질화하여 세포를 유리시켰다. 세포 현탁액을 4℃, 1,800 rpm에서 5분간 원심분리(UNION 32R, Hanil Co., Incheon, Korea)한 후, red blood cell lysis buffer에 10분간 정치시켜 적혈구를 제거하였다. 그 후 10% FBS가 포함된 RPMI 1640 배지를 첨가하여 RAW 264.7 세포와 동일한 조건으로 배양하였다.
참치 자숙액 농축물의 세포독성을 알아보기 위해 Park et al. (2006b)의 방법을 변형하여 MTT assay를 실시하였다. 먼저 RAW 264.7 세포를 1×106 cells/mL의 농도로 96-well plate에 분주하고 20시간 동안 전 배양 후, 시료를 농도별(0.1, 1, 10, 50, 100 μg/mL)로 첨가하여 37℃, 5% CO2 incubator (MCO-15AC, Sanyo, Osaka, Japan)에서 22시간 배양하였다. 또한 비장세포의 경우 1×107 cells/mL의 농도로 96-well plate에 분주하고 시료를 농도별로 첨가한 후 37℃, 5% CO2 incubator에서 70시간 배양하였다. 배양 후, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 시약을 5 mg/mL 농도로 첨가하여 2시간 재 배양하고 이를 4℃, 2,000 rpm에서 10분간 원심분리하여 상층액을 제거하였다. 그 후, 생성된 formazan의 용해를 위해 각 well에 DMSO를 첨가하고 이를 microplate reader (Model 550, Bio-rad, Richmond, CA, USA)로 540 nm에서 흡광도[obtical density (O.D.)]를 측정하였으며, 세포증식능은 다음 식에 의해 계산하였다.
Proliferation Index (%) = sample 흡광도/ control 흡광도×100
참치 자숙액 농축물이 각 세포의 cytokine 분비에 미치는 영향을 살펴보기 위하여 RAW 264.7 세포 및 마우스 비장세포에 시료를 처리하여 배양 상층액의 cytokine 함량을 측정하였다(Seo and Shin, 2012). 먼저 RAW 264.7 세포를 2.5×105 cells/mL로 24-well plate에 접종하고 5% CO2 incubator에서 18시간 동안 전 배양하였다. 마우스 대식세포에 시료를 농도별(0.1, 1, 10, 50, 100 μg/mL)로 처리하여 12시간 재 배양하였다. 비장세포의 경우 2×106 또는 5×106 cells/mL로 48-well plate에 접종하고 시료를 처리하여 72시간 배양하였다. 배양 상층액 내의 cytokine의 분비량은 ELISA kit (Mouse ELISA set, BD Bioscience, San Diego, USA)를 이용하여 측정하였다. ELISA microplate에 capture antibody로 anti-mouse IL-6, TNF-α, IL-10, IFN-γ, IL-4, IL-12 (p70) 및 IL-1β 를 분주하여 4℃에서 하룻밤 동안 coating시키고, 이를 0.05% Tween 20이 포함된 PBST로 세척한 후 10% FBS 용액으로 blocking 하였다. PBST로 세척한 뒤, 각 배양 상층액을 분주하고 실온에서 2시간 반응시켰다. 다시 PBST로 세척한 뒤 희석한 각각의 biotinylated anti-mouse detection antibody와 streptavidin-horseradish peroxidase conjugate를 첨가하여 실온에서 1시간 반응시켰다. IL-1β의 경우, biotinylated anti-mouse IL-1β detection antibody를 첨가하고 1시간 반응 후, streptavidin-horseradish peroxidase conjugate를 첨가하여 30분 반응 시켰다. 그 후, 이를 다시 PBST로 세척한 다음, OPD 용액을 첨가하여 실온에서 30분 동안 암반응 시켰다. 2 N H2SO4로 반응을 종료시킨 후 microplate reader 를 이용하여 490 nm에서 흡광도를 측정하였다.
모든 실험 결과에 대한 유의차 검정은 SAS software (SAS Institute, Inc., Cary, NC, USA)에서 평균값을 분산분석 한 후, Duncan's multiple range test법에 따라
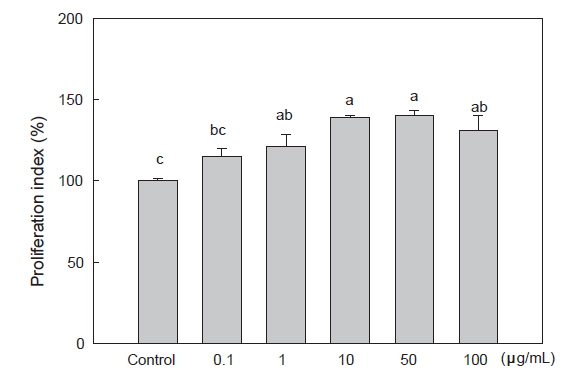
대식세포는 탐식세포라고도하며, 체내 모든 조직에 분포하여 면역계에서 매우 중요한 역할을 담당하는 세포이다. 정상 상태보다 체외의 bacteria나 virus에 의하여 활성화 되었을 때 잠재적 병원체를 제거하는데 더욱 효율적으로 작용하며, 대표적으로 식세포 작용(phagocytosis)과 면역 매개물질(inflammatory mediator)을 분비하고, T cell의 활성화 기능을 한다(Park et al., 2012). 이 외에도 활성화된 대식세포가 분비하는 세포독성 유발 단백질은 암세포, 바이러스 감염세포, 세균 등을 제거하는 기능을 함과 동시에 antigen-presenting cell (APC)로써 세포 표면에 class II MHC protein을 발현함으로써, Th cell과 상호 활성화를 일으킨다(Park, 2008). 따라서 시료의 면역활성능을 측정하는 다수의 연구에서 대식세포의 증식능에 대한 시료의 효과를 측정하고 있다(Kim et al., 2011). 본 연구에서는 MTT assay를 이용하여 참치 자숙액 농축물의 처리 농도에 따른 RAW 264.7 세포의 생존률을 측정하였다. 그 결과(Fig. 1), 참치 자숙액 농축물을 단백질 농도 기준으로 농도별(0.1, 1, 10, 50, 100 μg/mL)로 처리 시 모든 처리 농도에서 무처리구에 비해 세포 증식률이 증가함을 보여 세포 독성을 가지지 않고 대식세포의 증식능을 농도 의존적으로 활성화시키는 것을 확인하였으며, 이는 Kim et al. (2011)의 연구 결과와 동일하였다. 따라서 마우스 대식세포주인 RAW 264.7 cell에 대하여 참치 자숙액 농축물을 단백질 농도 기준으로 100 μg/mL로 처리시까지 세포독성을 가지지 않는 것을 확인하여 이후의 실험에서 단백질 농도 기준으로 100 µg/mL까지 시료를 처리하여 실험을 진행하였다.
>
대식세포 cytokine (IL-6, TNF-α, IL-1β) 분비 변화
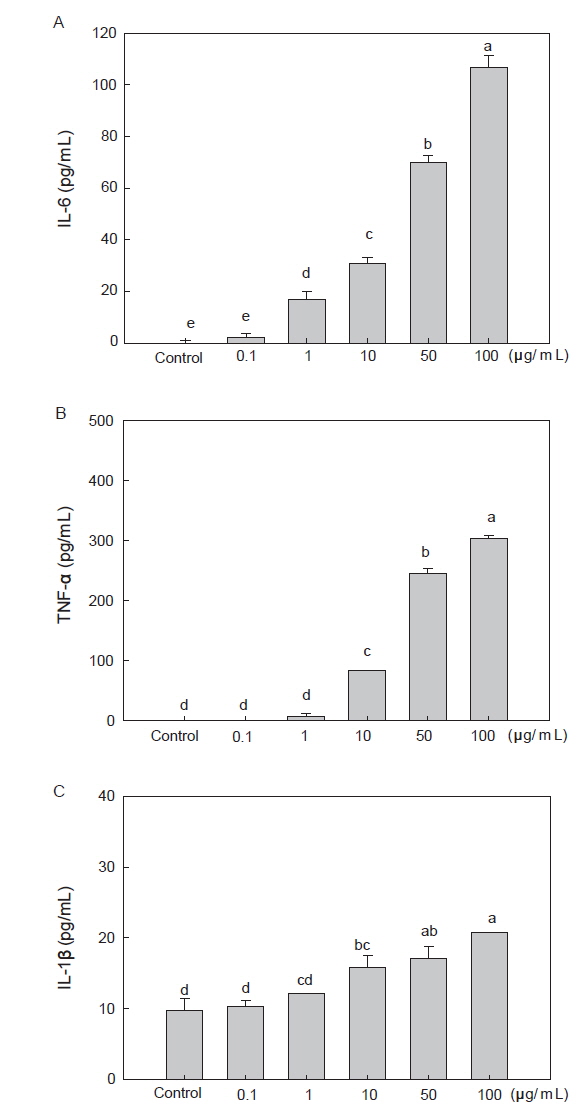
참치 자숙액 농축물이 대식세포를 자극하여 cytokine의 분비에 관여하는지 알아보기 위해 mouse 단핵구 기원의 RAW 264.7 cell line을 이용하여 참치 자숙액 농축물에 의한 cytokine의 분비 변화를 측정하였다. 그 결과, 세가지 cytokine 모두 참치 자숙액 농축물의 첨가에 따라 농도 의존적으로 분비량이 증가하는 것을 확인하였다. IL-6 및 TNF-α의 경우(Fig. 2A, B), 시료를 처리하지 않은 control 세포에서는 분비를 보이지 않았으나 참치 자숙액 농축물의 처리에 의해 농도 의존적인 증가를 보였으며, 특히 100 μg/mL 농도에서는 각각 106.49±4.76 pg/mL, 303.50±4.71 pg/mL로 현저한 증진 효과를 가지는 것으로 나타났다. 다음으로 IL-1β의 경우(Fig. 2C), control에서는 낮은 분비량을 보였으나, 시료를 100 μg/mL 농도로 처리 시 2배 이상의 증진 효과를 보였다. 대식세포로부터 생산되는 염증성 cytokine 중 IL-6는 염증을 유발하여 대식세포를 포함하는 식세포(phagocytes)의 탐식작용 및 보체 생산을 증가시키는 역할을 하며(Inatsu et al., 2009), TNF-α의 경우 대표적인 multi-functional cytokine으로 IL-1β와 함께 작용하여 면역세포들을 염증 부위로 모이게 하고, T 세포의 분화와 증식에 관여하는 역할을 한다(Knutson and Disis, 2005; Weis et al., 2007). 본 연구와 동일하게 시료의 대식세포의 활성화를 통해 면역증진능을 보고한 결과로는 Seo and Shin (2012)의 연구에서 천년초 유래 점질 다당이 대식세포를 자극하여 IL-6 및 TNF-α의 분비를 증가시킨다고 보고한 바 있으며, Cho et al. (2014)은 막걸리에서 분리한 다당이 대식세포의 IL-6 및 TNF-α에 대한 증진 효과를 가짐을 보고한 바 있다. 또한 Kim et al. (2006)은 상황버섯 추출물이 IL-6 및 IL-1β에 대해, Yu et al. (2012b)은 영지버섯 다당이 TNF-α 및 IL-1β에 대해 증진 효과를 가져 대식세포를 활성화시켜 면역 증강 효과를 가진다고 보고하였다. 따라서 본 연구 결과를 통해 참치 자숙액 농축물이 면역반응의 개시단계인 대식세포와 같은 선천면역계(innate immune system)를 직접 활성화시켜 IL-6, TNF-α 및 IL-1β와 같은 cytokine의 생산을 증가시키는 것을 확인하였다.
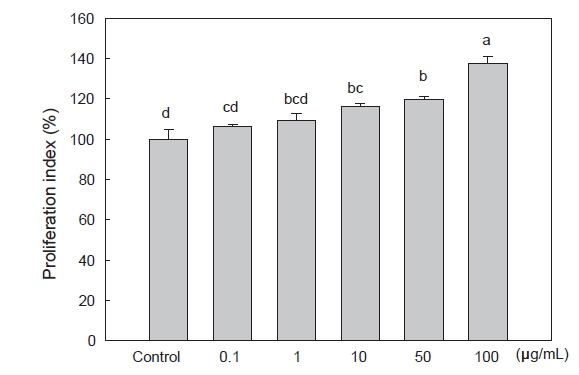
비장은 혈액으로부터 항원을 수집하고, T 및 B cell의 성숙과 항원으로부터 자극을 받은 후 이들의 분열 및 분화가 이루어지는 주요 림프기관으로 비장 세포의 증식은 면역 시스템 활성화에 매우 중요한 의미를 가진다(Seo and Shin, 2012). 본 연구에서 마우스 비장세포의 증식능에 대한 참치 자숙액 농축물의 효과를 살펴보기위해 참치 자숙액 농축물을 단백질 농도 기준으로 농도별(0.1, 1, 10, 50, 100 μg/mL)로 처리한 후 MTT assay를 통하여 증식능을 관찰하였다. 그 결과(Fig. 3), 100 μg/mL의 농도까지 세포독성을 가지지 않고 농도 의존적으로 유의적인 증가를 보여 면역 활성능을 가지는 것을 확인하였다. Choi et al.(2008)은 장미무당버섯에서 분리한 조다당류가 비장세포의 수를 대조군에 비해 약 2배 증가시켰으며, Jin (1996)은 잣나무버섯의 lepidan이 비장세포를 약 10배 증가시켜 면역증진능을 가지는 것으로 보고한 바 있다. 본 연구에서 참치 자숙액 농축물이 비장세포를 자극하여 증식능을 증가시킴을 확인하였으며, 또한 100 μg/mL 농도까지 세포 독성을 가지지 않는 것을 확인하여, 이후의 참치 자숙액 농축물의 처리에 따른 비장세포 Th1 및 Th2 cytokine의 분비 변화에 대해서는 단백질 농도 기준으로 100 μg/mL 농도까지 실험을 진행하였다.
>
비장세포의 Th1 cytokine (IFN-γ, TNF-α, IL-2, IL-12) 분비 변화
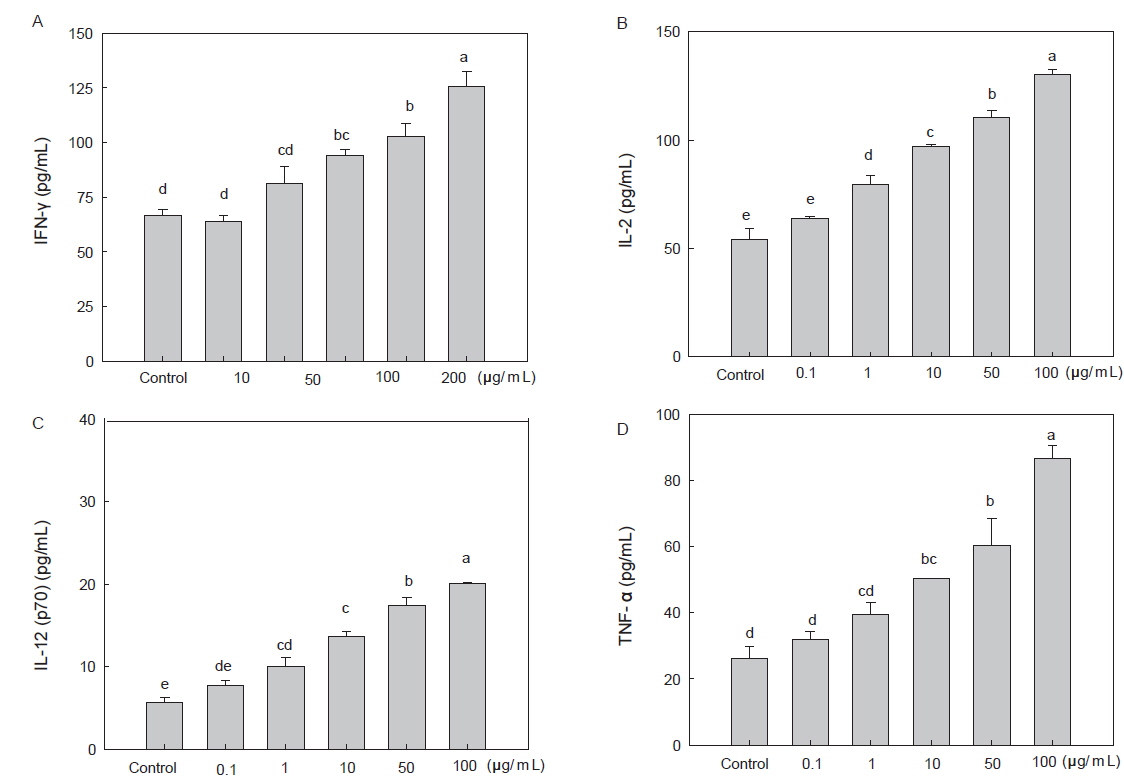
IFN-γ, TNF-α, IL-2 및 IL-12는 초기염증반응에서 세포 간 신호전달을 수행함으로써 면역반응에서 중요한 역할을 담당하며(Barnes and Liew, 1995; Ryu, 2010), 따라서 많은 식품의 면역작용을 살펴보는 연구에서 면역증진능을 나타내는 지표로 활발히 이용되고 있다(Brubaker et al., 1996), 따라서 본 연구에서 참지 자숙액 농축물이 세포수준에서 면역증강 효과를 가지는지를 판단하기 위하여 마우스 비장세포의 helper T 세포가 분비하는 Th1 cytokine인 IFN-γ, TNF-α, IL-2 및 IL-12의 분비량을 ELISA assay kit로 측정하였다. 참치 자숙액 농축물을 농도별로 비장세포에 처리한 결과, IFN-γ, TNF-α, IL-2 및 IL-12(p70)의 cytokine대해 농도 의존적 증가를 보였다. IFN-γ의 경우(Fig. 4A), control구에서 66.68±2.90 pg/mL의 분비량을 보였으나, 100 μg/mL으로 처리하였을 때 125.62±6.79 pg/mL으로 약 1.8배의 분비 증가를 보임을 확인하였다. IFN-γ는 Th1에서 생성되는 전염증성 사이토카인의 일종으로, 거의 모든 세포를 표적기관으로 하여 분비되며, 대식세포에 대하여 강력한 활성화 기능을 가진다(Sypek et al., 1993). 또한 다양한 antigen presenting cells (APCs)에서 MHC class I 과 II의 발현을 유도하고, NK 및 T cell의 분화를 촉진시키며 호중구와 혈관내피세포를 활성화시킨다(Lee et al., 2013). 이외에도 IL-4 및 IL-10을 억제하는 기능을 가짐으로써 체내의 Th1 세포 우세 반응인 type-1 response와 Th2 세포 우세 반응인 type-2 response간의 세포면역 항상성 유지여부를 판단하는 주요한 척도로 이용되고 있다(Pisa et al., 1992). 다음으로 IL-2 및 IL-12 (p70)의 경우(Fig. 4B, C), control에 비해 100 μg/mL으로 처리 시 각각 2.4 및 3.5배의 증진 효과를 보였다. IL-2는 활성화된 T 세포에서 분비되며, 주로 세포분열을 증진시켜 T cell growth factor로 작용하는 cytokine으로(Grabstein et al., 1994; Howard et al., 1994), IL-2의 증가 효과를 통해 T 림프구의 증가를 확인할 수 있는 지표가 된다(Ryu et al., 2010). 또한 IL-12는 p35와 p40의 소단위가 하나의 이황화 결합으로 결합된 헤테로이합체 단백질(p70)로 대식세포와 수지상세포 및 Th1 cell에서 분비되는 사이토카인이며, NK 및 T cell을 자극하여 IFN-γ의 분비를 증가시키는 역할을 하여 종양의 성장이나 전이를 억제하는 기능을 한다(Waldner and Neurath, 2009). 다음으로 TNF-α의 경우(Fig. 4D), 100 μg/mL의 농도에서 약 3.3배의 분비 증가 효과를 보여 참치 자숙액 농축물의 비장세포의 TNF-α 분비 증진능이 매우 우수함을 확인하였다. 이러한 TNF-α는 전신성 염증과 급성 반응을 조절하는 cytokine으로 활성화된 대식세포 이외에도, CD4+ T cell이나 natural killer (NK) cell에서도 생성되어 면역세포를 조절하는 주요 cytokine이며, 특히 T cell과 상호 작용하여 T cell의 활성과 성숙을 조절한다(Beutler et al., 1985;Carswell et al., 1975; Ryu, 2014). 이들 Th1 cytokine의 분비는 주로 자연면역에 의해 활성화 되며(Seo et al., 2013), 그 중 특히 IFN-γ, TNF-α 및 IL-2는 T cell의 성장인자로, 특히 TNF-α는 대식세포와 같은 백혈구를 유도해 급성염증반응과 적응면역반응의 주요 연결체로 작용하여 자연면역과 적응면역의 매개반응을 조절하는 것으로 알려져 있다(Asadulah et al., 2003). 위 결과에 따라서 참치 자숙액이 비장세포의 Th1 cytokine의 분비를 증가시키는 효과를 가짐을 확인하였다. 이와 같은 결과로 Ha et al. (2006)은 BALB/c 마우스 비장세포에 동충하초물 추출물을 처리한 경우 IFN-γ, TNF-α 및 IL-2와 같은 Th1 cytokine과 동시에 IL-10에 대해서도 증진 효과를 가진다고 보고하였고, Choi et al. (2010)은 노루궁뎅이 자실체의 조다당류가 비장세포의 TNF-α 및 IL-2에 증진 효과가 있다고 보고하였다. 또한 Seo et al. (2013)은 발효꾸지뽕 열매 추출물이 마우스 비장세포의 IL-2 및 IL-4에 대하여 증진 효과가 있다고 보고하였으며, Kim et al. (2012)은 동충하초 추출물을 마우스에 투여하였을 때, 비장세포에서 IFN-γ, TNF-α, IL-2 및 IL-12의 분비가 증가됨을 보고하였고, Cha et al. (2011)은 신령버섯의 조다당류를 투여한 생쥐의 비장세포에서 TNF-α, IL-2가 현저히 증가함을 확인하여 면역 증진 효과를 보고하였다. 따라서 본 연구에서도 이러한 Th1 cytokine에 대하여 현저한 증진 효과를 가져 참치 자숙액이 세포성면역력을 증진시키는 것을 확인하였다.
>
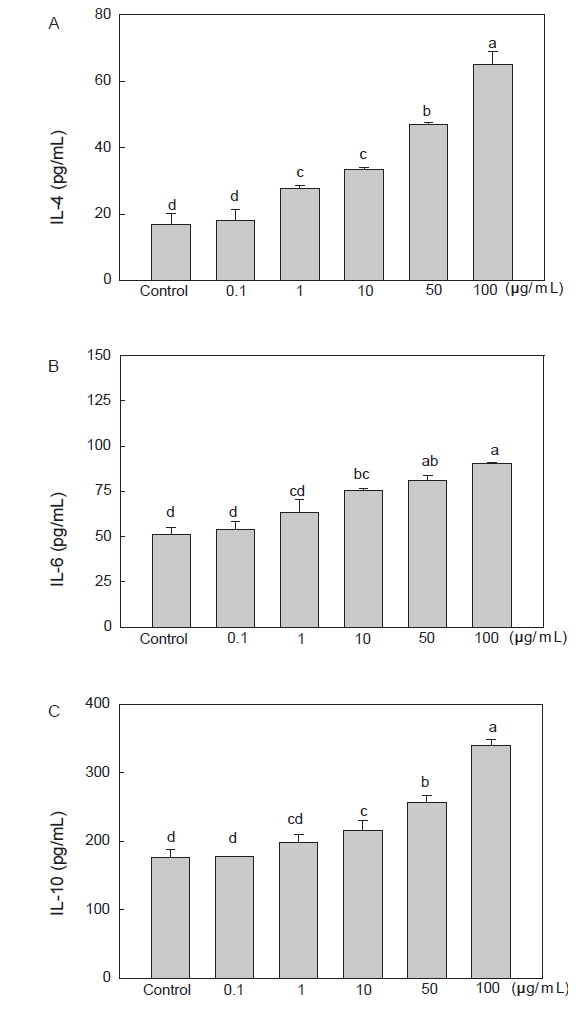
비장세포의 Th2 cytokine (IL-4, IL-6, IL-10) 분비 변화
Th2 cell은 항체에 의한 체액성 면역에 주로 작용하며, Th1 cell의 작용을 억제하는 기능을 한다. 이러한 작용을 하는 Th2 cytokine에는 IL-4, IL-6, IL-10이 있으며, 면역계는 이러한 Th1/Th2 cell의 균형에 의해 항상성을 가지며 유지된다(Seo et al., 2013). 따라서 본 연구에서는 참치 자숙액 농축물의 면역조절작용 메커니즘을 이해하기 위해, Th2 cytokine의 분비에 미치는 영향을 알아보았다. 그 결과(Fig. 5), 모든 cytokine이 참치자숙액 농축물의 첨가 농도 의존적으로 증가하는 경향을 보였다. 먼저 IL-4의 경우(Fig. 5A), control구 17.01±3.19 pg/mL에 비해, 시료를 100 μg/mL으로 처리 시 64.91±3.99 pg/mL으로 약 3.81배의 증진 효과를 보였으며, IL-6의 경우(Fig. 5B) 1.7배, IL-10의 경우(Fig. 5C) 1.9배의 증진 효과를 가짐을 확인하였다. 본 연구에서 살펴본 Th2 cytokine 중 IL-4는 T 및 B cell과 NK cell, 단핵구, 대식세포, 호중구, 호산구, 혈관내피세포, 섬유아세포를 표적세포로 하여 Th2 cell의 분화와 증식을 유도함과 동시에 CD4+ T cell의 발현을 증가시키는 cytokine이며(Seo et al., 2013), IL-6은 T cell 및 대식세포에서 분비되는 cytokine으로, 외부 침입인자에 의한 인체 감염 시 감염에 의한 숙주의 면역반응을 촉진하여 손상된 조직을 복구하는 기능을 하는 것으로 알려져 있으며. B cell의 성장인자로 작용한다(Cho et al., 2014; Ha et al., 2006). 마지막으로 IL-10은 단핵구, 대식세포, T 및 B cell, NK cell, mast cell을 표적세포로 하며 특히 T cell과 대식세포에 직접적으로 작용하여 세포의 활성화를 억제하는 항염증성 cytokine (anti-inflammatory cytokine)으로 (Lee et al., 2013), 주로 면역반응을 진정시켜 면역계에 대한 억제 기능을 담당하는 억제성 cytokine의 역할을 하며(Sohn et al., 2012), 위의 결과로 부터 참치 자숙액이 IL-4 및 IL-6의 분비를 증가시킴으로써 T 및 B cell로 일어나는 세포성 및 체액성 면역반응을 활성화 시키고, IL-10의 분비를 증가시켜 과도하게 일어나는 면역 반응에 대한 억제 및 조절 효과를 가짐으로써 면역 작용을 조절하는 데 탁월한 효과가 있는 것으로 사료된다. 이와 동일한 결과로, Kim et al. (2012)은 동충하초 추출물을 마우스에 투여하였을 때, 비장세포에서 IL-10의 분비가 증가됨을 보고하였고, Seo et al. (2013)은 흑마늘 추출물이 마우스 비장세포에서 IL-4 및 IL-6의 생성을 유도하여 B cell의 성장을 유도하고 T cell의 활성을 조절함으로써 면역 증진 작용을 가진다고 보고하였다. 위의 결과를 종합해 볼 때, 참치 자숙액이 대식세포를 자극하여 선천면역계를 활성화시킴과 동시에 비장세포의 helper T cell에 의한 적응면역반응을 활성화시켜 Th1/Th2 cell의 균형조절에 의해 일어나는 면역 작용을 증진시키는 것으로 사료되며, 따라서 본 연구 결과를 기초로 이용률이 저조했던 참치가공 부산물인 자숙액을 이용하여 다양한 건강 기능성 제품 개발이 가능할 것으로 사료된다.